例談中學化學中的對角線規則
郝劍
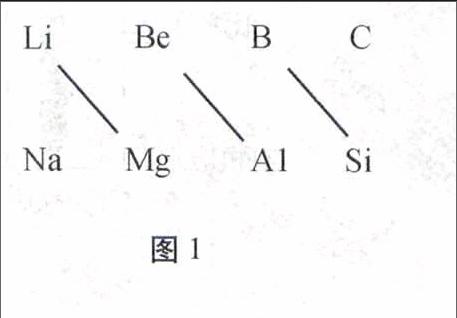
研究周期表中元素性質變化規律,不難發現在周期表二、三周期的ⅠA~ⅣA族中,左上方和右下方的兩種元素性質十分相似,這種現象特稱其為對角線規則。對角線規則是中學階段最重要的規則之一。對于此類問題只要抓住“相對應”物質的特殊性質,就可以很好的解決問題。
例1根據對角線規則,下列物質的性質不具有相似性的是()。
A.硼和硅B.鈹和鋁
C.鋰和鎂D.鋰和鋁
分析在周期表中,某元素的性質和它左上方或右下方的另一元素性質相似性,稱對角線規則。這種規則,屬于經驗規則,尚無統一理論解釋。這種相似性特別明顯地存在于如圖1所示三對元素之間。
圖1
答案:D。
小結周期表中僅有圖1所示三組元素符合對角線規則。
例2在周期表中,同一主族元素的化學性質相似。目前也發現有些元素的化學性質和它在周期表中左上方或右下方的另一主族元素性質相似,這稱為對角線規則。據此請回答:
(1)鋰在空氣中燃燒除生成外,也生成微量的(均填化學式)。
(2)下列對鋰或鎂的性質的推斷不合理的有(填代號)
A.兩者在自然界中均無游離態
B.LiOH易溶于水,受熱不分解
C.Li遇濃硫酸不“鈍化”
D.Mg可以在二氧化碳中燃燒
E.碳酸鎂可以受熱分解生成氧化鎂
F.Li2SO4能溶于水
(3)受到對角線規則的啟發,根據NaH的存在,有人提議可將其中反氫元素放在ⅦA族,你認為其理由是;由此推知,根據其最高正價與最低負價的絕對值相等,則也可將反氫元素放在周期表中的族。
分析空氣中除氧氣外,還有大量的氮氣。由于鋰和鎂處在對角線上,根據對角線規則,結合鎂的化學性質,不難判斷出(1)為Li2O和Li3N;對于(2)由于鎂很活潑,故此,Li和Mg在自然界中一定無游離態存在;根據Mg(OH)2難溶于水,那么,可推斷LiOH也不溶于水;依次可順推出C、D、E、F都正確。(3)VIIA元素的特征和NaH比較,可得出主要是由于H顯-1價的性質而做出的判斷;而最高正價與最低負價的絕對值相等,只有ⅣA族。
答案:(1)Li2OLi3N;(2)B;(3)H顯 -1價 ⅣA族
小結鋰與鎂相似性表現在:
(1)鋰、鎂在氧氣中燃燒都生成正常氧化物,而其它堿金屬生成過氧化物或超氧化物;
(2)都能與N2直接化合生成氮化物(Li3N、Mg3N2);
(3)氫氧化物均為中等強度的堿,在水中溶解度不大。加熱時可分別分解為Li2O和MgO。其他堿金屬氫氧化物均為強堿,且加熱至熔融也不分解。
(4) 碳酸鹽在受熱時, 均能分解成相應的氧化物( Li2O、MgO)。
例3(1)鈹的性質類似于鋁,下列有關鈹性質的推斷正確的是()。
A.鈹能與冷水反應
B. 氫氧化鈹能與強酸、強堿溶液反應
C.氧化鈹的化學式為Be2O3
D.氧化鈹只溶于強酸溶液,不溶于強堿溶液
(2)鈹的最高價氧化物的水化物屬于兩性化合物(提示:鈹酸的化學式為H2BeO2),證明這一結論的有關離子方程式為:。
(3)若已知反應
Be2C+4H2O2Be(OH)2↓+CH4↑
則Al4C3與水反應的化學方程式為:。
分析(1)根據題目信息,“鈹的性質類似于鋁”,易知A、D錯,B對。對于C由于鈹在第ⅡA族,最高正價為+2價,因此,氧化鈹的化學式為BeO。(2)所謂兩性即既與強酸反應生成鹽和水,又與遇強堿反應成鹽和水,據此可寫出其離子方程式。(3)觀察給的化學方程式不難看出,是形成了Be的氫氧化物,C的氫化物。
答案:(1)B;
(2)Be(OH)2+2H+Be2++2H2O
Be(OH)2+2OH-BeO22-+2H2O
(3)Al4C3+12H2O4Al(OH)3↓+3CH4↑
小結鈹與鋁的相似性有:
(1) 單質均為活潑金屬;
(2) 單質均為兩性金屬, 既能溶于酸也能溶于強堿,一般得都到氫氣。(如硝酸例外)
(3) 單質都能被冷的濃硝酸鈍化;
(4) 氯化物均為共價化合物;在鹵化鋁中,除AlF3是離子化合物外,其余都是共價化合物。
(5) 氧化物的熔點、硬度都很大;如Al2O3因硬度大、熔點高而俗稱剛玉。
(6)氫氧化物的顏色均為白色固體,難溶于水,呈兩性。
Be(OH)2 + 2 H+Be2+ + 2 H2O
Be(OH)2+2OH-Be(OH)2-4
此外,硼與硅也有許多相似性。例如,兩者單質的硬度很大,都能和強堿作用產生氫氣,含氧酸為不溶于水的固體酸、氫化物的穩定性差,易自燃等。
(收稿日期:2017-02-15)endprint

