亞油酸氧化誘導大豆分離蛋白氧化對其結構的影響
陳曦,汪娟,孫為正
(華南理工大學 食品科學與工程學院,廣東 廣州,510641)
亞油酸氧化誘導大豆分離蛋白氧化對其結構的影響
陳曦,汪娟,孫為正*
(華南理工大學 食品科學與工程學院,廣東 廣州,510641)
利用脂肪氧合酶催化不同底物濃度亞油酸氧化大豆分離蛋白,通過測定氧化后大豆分離蛋白的羰基值、巰基、表面疏水性、內源熒光以及凝膠電泳等指標,對氧化修飾后大豆分離蛋白的結構進行分析,并通過分析氧化后大豆分離蛋白在不同溶劑中溶解性能表征其分子間相互作用力。結果表明,隨體系中亞油酸濃度的增加,大豆分離蛋白羰基含量增加56.3%,總巰基和游離巰基含量降低,表面疏水性呈先增大后減小趨勢,內源熒光強度降低,發生先紅移后藍移現象,大豆分離蛋白粒徑先減小后增大,主要分布于5~40 nm之間,蛋白質氧化過程發生去折疊和重聚集,蛋白質交聯中存在非二硫鍵共價鍵生成。
蛋白質氧化;大豆分離蛋白;分子結構;亞油酸氧化
大豆分離蛋白(SPI)是重要的植物蛋白質之一,富含多種氨基酸,其營養價值可與優質的動物性蛋白質相媲美[1]。大豆分離蛋白被廣泛應用于脂質豐富的食品中,是大豆制品的主要成分之一,能夠有效提高該類食品的質量品質。在酶促和非酶促條件下不飽和脂肪酸容易發生氧化,脂質過氧化反應產生自由基以及過氧化物,可與食品中蛋白質發生反應,引起蛋白質的氧化[2]。大豆中富含脂肪氧合酶(EC1.13.11.12,Lipoxygenase,LOX),可直接作用于含1,4-順,順-戊二烯結構的多不飽和脂肪酸;亞油酸(順,順-9,12-十八(碳)二烯酸)是大豆中主要的多不飽和脂肪酸之一。亞油酸在脂肪氧合酶的催化下可產生大量活性氧自由基和具活性的次生氧化產物,從而引起大豆蛋白氧化[3]。食品工業中大豆經低溫脫脂后仍然會有脂質殘留,且脂肪氧合酶未完全失活,脂肪氧合酶可造成殘留脂質氧化,從而對大豆蛋白相關產品的質量品質產生不利影響[1]。
針對大豆分離蛋白的氧化,陳楠楠等研究了烷過氧自由基(ROO·)和丙二醛對大豆分離蛋白結構的影響[3-4]。吳偉等也分別研究了烷過氧自由基、丙二醛和丙烯醛對大豆分離蛋白的影響[5-7]。結果表明,大豆分離蛋白經過氧化后結構發生顯著變化,并且伴隨蛋白質聚集體或蛋白質共價交聯物的產生。不飽和脂肪酸的過氧化反應是一個較為復雜的過程,通常可產生多種具有誘導蛋白質氧化的活性氧自由基等,脂肪氧合酶催化氧化亞油酸可產生相對復雜的活性氧自由基體系。黃友如等對脂肪氧合酶誘導亞油酸對大豆分離蛋白氧化進行了研究,結果表明,氧化可誘導大豆分離蛋白發生聚集[1,8-10]。由于體系復雜,其氧化分子機制仍不清晰。本文以脂肪氧合酶催化氧化多不飽和脂肪酸亞油酸模擬氧化大豆分離蛋白,表征氧化后大豆分離蛋白的結構,探究油脂氧化對大豆分離蛋白氧化的影響機制。
1 材料和方法
1.1材料與試劑
低溫脫脂大豆粕,山東;亞油酸,Aladdin;脂肪氧合酶,Sigma;其他化學試劑均為分析純。
pHS-25數顯pH計,瑞士梅特勒-托利多公司;CS150NX超速離心機,日本HITACI公司;SP-721可見分光光度計,上海精密儀器儀表有限公司;F-7000熒光分光光度計,日本日立公司;Nano ZS納米粒度分布儀,英國Malvern公司。
1.2實驗方法
1.2.1 大豆分離蛋白的制備
參考CHEN等[3]的方法并略加改進,將低溫脫脂豆粕粉碎后與去離子水按1∶15(g∶mL)混合后,使用2 mol/L NaOH調節pH值至7.5。浸提2 h后在4 ℃、8 000 g下離心20 min,取上清液用2 mol/L HCl調pH值至4.5。靜置后在4 ℃、8 000 g下離心10 min,所得沉淀進行復溶,使用2 mol/L NaOH調pH值至7.0,然后在4 ℃下透析72 h,經冷凍干燥后即得大豆分離蛋白。
1.2.2 氧化大豆分離蛋白的制備
底物亞油酸(LA)溶液配制:取1.5 g亞油酸于燒杯中,依次加入1 mL 5 mmol/L NaOH溶液,10 mL 0.2 mol/L的硼酸緩沖液(pH 9.0)和2滴Tween 20,搖勻后使用0.2 mol/L的硼酸緩沖液(pH 9.0)進行定容(50 mL),LA最終濃度為0.107 mol/L。
配制5%的SPI溶液,用2 mol/L NaOH調pH值至9.0。分別稱100 g溶液置于5組編號為1~5的錐形瓶中,每組加酶液10 mL,并分別加入0、3、5、7、9 mL底物亞油酸溶液,振蕩混勻,在25 ℃搖床中培養6 h后取出,迅速冷卻至0 ℃,用2 mol/L HCl調pH值至4.5,在4 ℃、5 000 g下離心30 min,取出沉淀物,按沉淀物∶乙醇∶正己烷=1 g∶4 mL∶2 mL的比例浸提約30 min,抽濾,將濾餅醇洗,并90 ℃滅酶約30 min。最后復溶,經冷凍干燥得到氧化大豆分離蛋白SPI-1至SPI-5。
1.2.3 大豆蛋白羰基含量的測定
參考WU等[6]的方法(2,4-二硝基苯肼比色法)測定大豆分離蛋白經氧化后的羰基含量,消光系數為22 000 mol/(L·cm),計算每毫克大豆分離蛋白羰基含量。
1.2.4 大豆蛋白巰基的測定
參考WU等[6]的測定方法。取3 mL的蛋白質溶液(4 mg/mL),加入3 mL 0.1 mol/L、pH 8.0含有1 mmol/L乙二胺四乙酸和1%十二烷基硫酸鈉的磷酸鹽緩沖液,室溫下磁力攪拌2 h后8 000 g離心20 min。取上清液測定總巰基和游離巰基的含量。
1.2.5 大豆蛋白表面疏水性的測定
采用ANS熒光探針法[11],用0.01mol/L的磷酸鹽緩沖液(pH 7.0)稀釋至蛋白濃度為0.005~0.5 mg/mL不等;熒光分光光度計激發波長365 nm、發射波長484 nm(狹縫均為5 nm)。
1.2.6 大豆蛋白內源熒光的測定
參考CHEN等[4]的測定方法,將大豆蛋白分散于0.01 mol/L pH 7.0的磷酸鹽緩沖液中,磁力攪拌2 h后在 4 ℃、10 000 g下離心30 min,采用雙縮脲法測定上清液中蛋白濃度,通過稀釋使得上清液中蛋白質濃度達到0.1 mg/mL。采用熒光分光光度計在激發波長295 nm條件下得到300~400 nm之間的發射光譜,以pH 7.0、0.01 mol/L的磷酸鹽緩沖液為空白。
1.2.7 粒徑
將SPI-1~5溶解于0.01 mol/L pH 7.0的磷酸鹽緩沖液中,稀釋到適當濃度(2 mg/mL),用納米粒度分析儀測定氧化后大豆分離蛋白的粒徑分布。
1.2.8 溶解度
參考CHEN等[3]的測定方法,將SPI-1~5分別分散在下列溶劑中:(a)磷酸鹽緩沖液(PBS);(b)1%十二烷基硫酸鈉(SDS)+PBS;(c)8 mol/L尿素+ 1%SDS+PBS;(d)20 mmol/L二硫蘇糖醇(DTT)+8 mol/L尿素 +1%SDS+PBS。在25 ℃靜置10 h后,將樣品在25 ℃、10 000 g下離心10 min,取上清液,用BCA法分析上清液中蛋白質濃度,在d組的上清液中加碘乙酰胺溶液進行稀釋,來消除DTT對BCA蛋白測定的影響。上清液的蛋白質含量與初始蛋白質含量的比值即為蛋白質溶解度。
1.2.9 SDS-聚丙烯酰胺凝膠電泳(SDS-PAGE)分析
SDS-PAGE參照LAEMMLI的方法[12]。分離膠質量分數為12%,濃縮膠質量分數為5%,電泳前將已和樣品緩沖液混合的樣品煮沸5 min,并在4 ℃、10 000 g下離心5 min,取15 μL上清液進樣,凝膠電泳在恒流下進行,濃縮膠中電流為20 mA,進入分離膠后增至40 mA。
2 結果與分析
2.1氧化大豆分離蛋白羰基含量、總巰基和游離巰基含量

圖1 大豆分離蛋白羰基含量變化圖Fig.1 Carbonyl group content of modified SPI
羰基含量是被廣泛用來衡量蛋白質氧化程度的重要指標之一[13],如圖1所示,SPI-1的羰基含量為4.17 nmol/mg蛋白,這與HUANG[8]的4.31 nmol/mg蛋白接近。隨著底物亞油酸的濃度升高,羰基含量上升了56.3%,表明大豆分離蛋白發生了顯著的氧化。亞油酸的過氧化產生活性氧自由基和氫過氧化物等,自由基反應活性強,能直接引起大豆分離蛋白氧化,引起蛋白質主肽鏈的斷裂而羰基化;自由基可與側鏈基團形成氫過氧化合物,其在一定條件下生成具活性的羰基化合物,從而與蛋白質側鏈發生共價交聯,引起羰基化[14],導致大豆分離蛋白結構發生變化。
半胱氨酸殘基很容易受到攻擊,引起巰基含量的變化,其是表征蛋白質氧化的重要指標之一,圖2和圖3分別為游離巰基和總巰基的變化情況。由圖2可知,隨著底物濃度的增加,大豆分離蛋白的游離巰基從SPI-1的3.79 nmol/mg減小到SPI-5的2.38 nmol/mg。由圖3可知,總巰基也有下降趨勢,其中SPI-4、SPI-5總巰基值下降尤為明顯。半胱氨酸是容易受到氧化攻擊的一種氨基酸,氧化會使半胱氨酸的氧化還原狀態發生改變,影響蛋白質巰基和二硫鍵之間的交互反應平衡常數,進一步改變巰基及二硫鍵的含量以及分布情況[15]。EATON研究表明,蛋白質的巰基氧化有可逆與不可逆2種,可逆氧化會生成二硫鍵和次磺酸,不可逆氧化則主要生成磺酸和亞磺酸[16]。隨底物濃度增加,總巰基含量減小幅度分別為0.326、0.445、2.254、1.806 nmoL/mg,游離巰基含量減小幅度分別為0.495、0.271、0.206、0.437 nmoL/mg,由此可以看出,在低底物濃度時,游離巰基變化量稍大,說明氧化過程中有巰基向二硫鍵轉化,但是當底物濃度增加,總巰基變化量顯著增大,說明這個氧化階段中有非二硫鍵形式的化合物生成,這與WU等研究結果中對應指標都下降的結論相一致[7]。
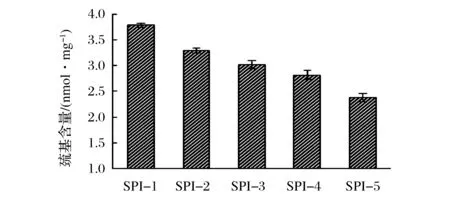
圖2 大豆分離蛋白游離巰基含量變化圖Fig.2 Free sulphydryl content of modified SPI
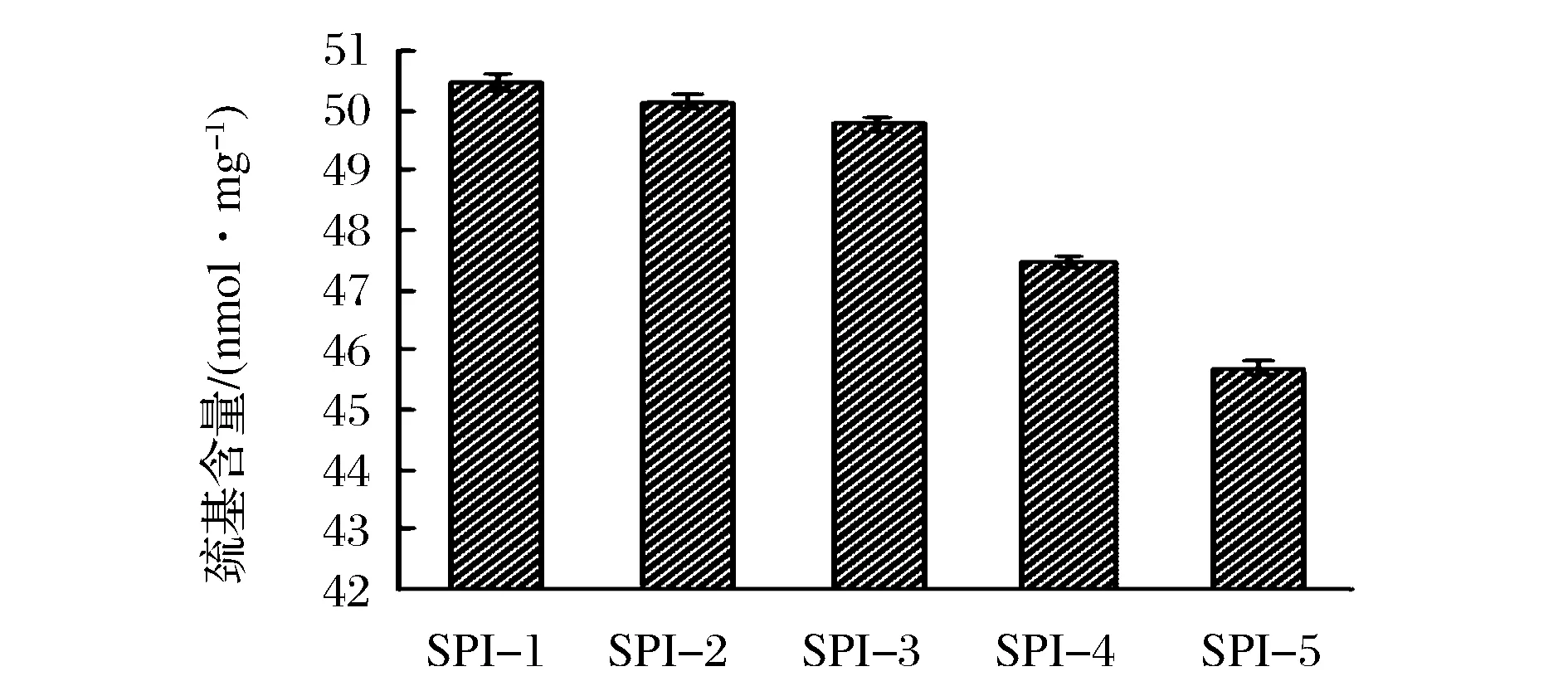
圖3 大豆分離蛋白總巰基含量變化圖Fig.3 Total sulphydryl content of modified SPI
2.2氧化大豆分離蛋白表面疏水性、內源熒光
疏水相互作用力是維持蛋白質三級結構的重要分子作用力之一[17]。表面疏水性的變化如圖4所示,隨著底物亞油酸濃度增加,大豆蛋白的表面疏水性呈現先增大后減小的趨勢。HUANG等發現大豆蛋白氧化后表面疏水性會增加[8],而WU等研究結果表明氧化會使大豆蛋白表面疏水性降低[7]。蛋白質氧化過程中球蛋白表面氨基酸先被氧化,疏水性基團變為親水性基團,并且通過氫鍵和范德華力進入球蛋白內部,自由基進一步氧化球蛋白內部氨基酸殘基,造成蛋白質去折疊,疏水基團暴露,引起蛋白質表面疏水性升高。隨著氧化進行,暴露的疏水性基團可以通過疏水相互作用力引起聚集,表面疏水性降低。該結果說明氧化大豆分離蛋白的去折疊和聚集體形成的過程中結構發生了變化[18]。
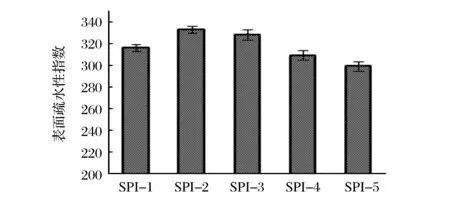
圖4 大豆分離蛋白表面疏水性變化圖Fig.4 Surfacehydrophobicity of modified SPI
圖5為氧化大豆分離蛋白內源熒光的變化圖。

圖5 大豆分離蛋白內源熒光變化圖Fig.5 Fluorescent emission spectra of modified SPI
隨著底物亞油酸濃度的升高,大豆分離蛋白的內源熒光強度持續降低,最大吸收波長λmax先略微增大后又減小,分別發生紅移和藍移。內源熒光表征了大豆分離蛋白中色氨酸殘基的氧化程度以及它所處微環境的變化。色氨酸具有低單電子氧化勢能,極易被自由基通過奪氫反應而轉化為不穩定的色氨酸自由基,進而氧化為過氧自由基,轉化為犬尿氨酸,使內源熒光強度下降[11,19]。紅移說明在蛋白質去折疊的過程中色氨酸殘基逐漸暴露在外部環境中,而隨著反應進一步進行,蛋白質的聚集可能使分子中的色氨酸殘基回到分子中的非極性環境,從而導致其最大吸收波長λmax發生藍移。本文蛋白質最大吸收波長變化與表面疏水性的分析結果相一致,再次證明氧化過程中大豆分離蛋白結構發生了去折疊和重新聚集的復雜變化。
2.3氧化大豆分離蛋白的粒徑分布
底物亞油酸的誘導氧化,使蛋白質的結構發生改變,粒徑也隨之改變,由圖6可以看出,當底物濃度增加,大豆分離蛋白的粒徑先減小,SPI-3粒徑達到最小,當濃度繼續增加,粒徑增大,最大氧化程度的SPI-5粒徑略大于對照組SPI-1,粒徑上述變化趨勢的原因可能是在氧化初始階段,大豆分離蛋白去折疊分子展開,平均粒徑減小,隨著氧化程度加深,暴露的表面疏水性基團發生相互作用,導致大豆分離蛋白聚集體的形成,使平均粒徑增大。這與表面疏水性(圖4)和內源熒光(圖5)變化相一致。
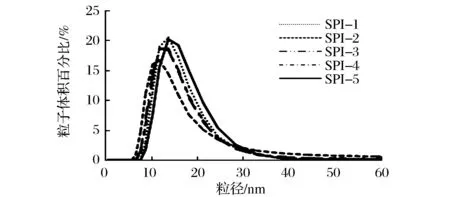
圖6 大豆分離蛋白的粒徑變化圖Fig.6 Particle size distribution change of modified SPI
2.4氧化大豆分離蛋白分子間相互作用力分析
通過添加不同的試劑規避分子間作用力,通過溶解度的變化來分析大豆分離蛋白氧化后分子間作用力變化。由圖7可以看出,相比4種溶劑,PBS中蛋白質的溶解度明顯低于其他3種溶劑,當依次加入SDS、尿素、DTT,溶解度都有一定程度增加。在PBS中,隨著底物濃度增加,溶解度降低,表明大豆分離蛋白結構發生了變化,影響其溶解度。添加SDS和尿素后,溶解度有很大提高,SDS和尿素能夠破壞氫鍵和疏水鍵等非共價鍵,同時,對比在PBS溶劑和含PBS、SDS、尿素溶劑中溶解度增加量,分別為27.77%、33.39%、39.43%、36.83%、36.48%,說明在氧化初期,大豆分離蛋白非共價的分子相互作用力較強。當溶劑中繼續添加強還原劑DTT,溶解度進一步增大,氧化程度高的增加越明顯,DTT能夠裂解二硫鍵,說明氧化過程有二硫鍵生成,CHEN等[3]的研究也得出在丙二醛誘導大豆分離蛋白氧化過程中生成二硫鍵。但是在底物濃度較高時,仍然有不溶物,說明此過程生成了非二硫鍵形式的共價化合物,這與巰基變化結果相一致。
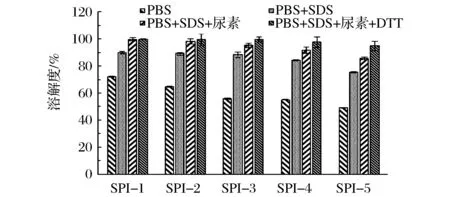
圖7 大豆分離蛋白在不同溶劑中溶解度Fig.7 Solublity of modified SPI in four types of solution
2.5氧化大豆分離蛋白的SDS-PAGE分析
由電泳圖8可知,空白組大豆分離蛋白SPI-1的電泳條帶是β-伴大豆球蛋白和大豆球蛋白亞基的特征條帶,隨著氧化程度加深,有大分子聚集物產生。β-伴大豆球蛋白亞基α’和β條帶變模糊,在A、B亞基條帶變淺,說明在氧化過程中7S、11S受到攻擊,可能脂質與蛋白質結合,或者是大豆分離蛋白亞基之間的共價交聯,并且隨著蛋白質氧化加深,在聚集過程中形成了可溶性的聚集體[10]。
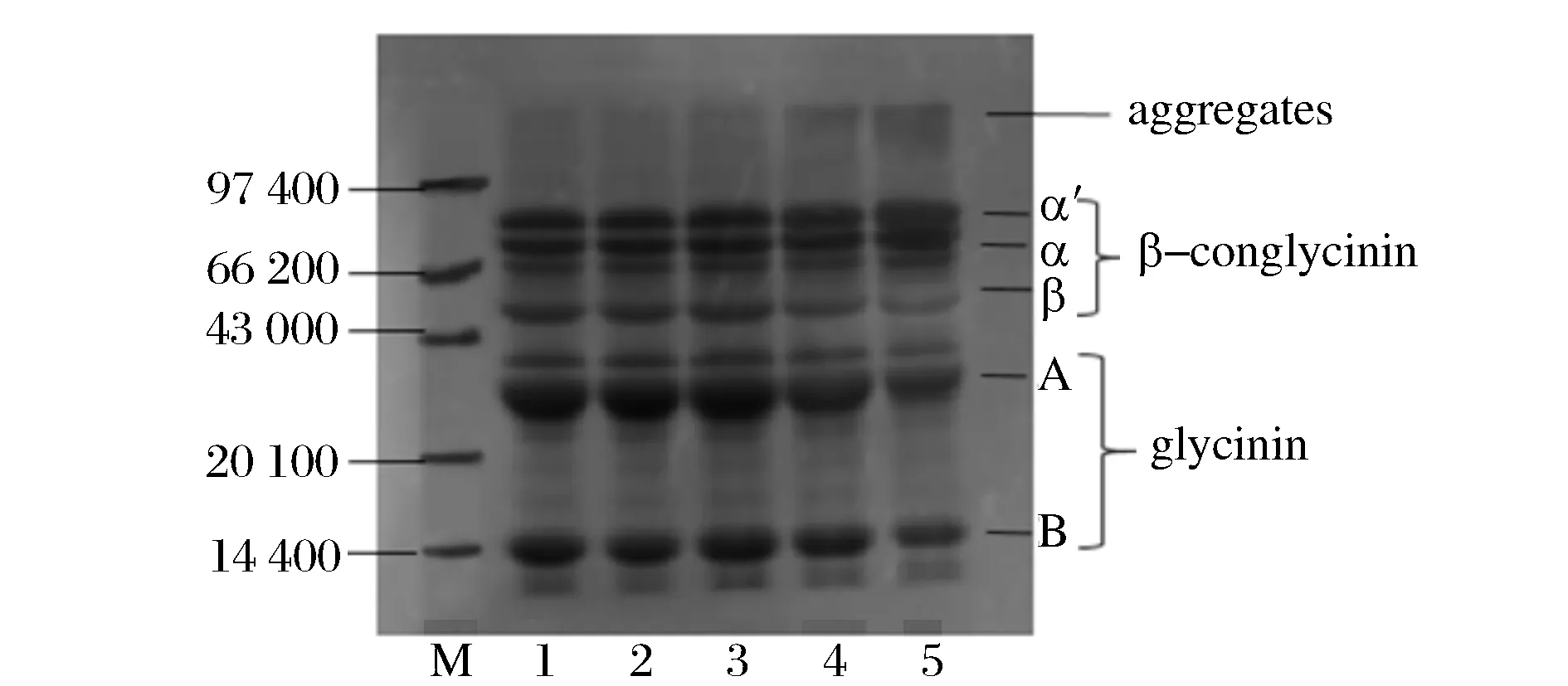
圖8 大豆分離蛋白的SDS-PAGE(M為標準蛋白,1-5分別對應SPI-1~5)Fig.8 SDS-PAGE analyses of modified SPI
3 結論
亞油酸氧化引起大豆分離蛋白氧化,進而引起蛋白結構改變,隨著氧化程度加深,蛋白質表面疏水性呈現先增大后減小趨勢,內源熒光發生先發生小幅紅移,后發生藍移現象,蛋白粒徑先減小后增大,上述變化表明蛋白質氧化過程中先發生去折疊后聚集。大豆分離蛋白在不同溶劑中溶解度變化和凝膠電泳圖譜表明蛋白質分子結構發生了改變,氧化過程中形成了以非二硫鍵形式的共價鍵鍵合的蛋白聚集體。
[1] 黃友如,華欲飛,裘愛泳.脂質氧化誘導的大豆蛋白質聚集機理的研究[J].中國糧油學報,2006(1):80-87.
[2] CHAMULITRAT W,MASON R P.Lipid peroxyl radical intermediates in the peroxidation of polyunsaturated fatty acids by lipoxygenase.Direct electron spin resonance investigations[J].J Biol Chem,1989,264(35):20 968-20 973.
[3] CHEN N,ZHAO Q,SUN W,et al.Effects of malondialdehyde modification on theinvitrodigestibility of soy protein isolate[J].Journal of Agricultural and Food Chemistry,2013,61(49):12 139-12 145.
[4] CHEN N,ZHAO M,SUN W,et al.Effect of oxidation on the emulsifying properties of soy protein isolate[J].Food Research International,2013,52(1):26-32.
[5] WU W,HUA Y,LIN Q.Effects of oxidative modification on thermal aggregation and gel properties of soy protein by malondialdehyde[J].J Food Sci Technol,2014,51(3):485-493.
[6] WU W,WU X,HUA Y.Structural modification of soy protein by the lipid peroxidation product acrolein[J].LWT-Food Science and Technology,2010,43(1):133-140.
[7] WU W,ZHANG C,KONG X,et al.Oxidative modification of soy protein by peroxyl radicals[J].Food Chemistry,2009,116(1):295-301.
[8] HUANG Y,HUA Y,QIU A.Soybean protein aggregation induced by lipoxygenase catalyzed linoleic acid oxidation[J].Food Research International,2006,39(2):240-249.
[9] WU W,HOU L,ZHANG C M,et al.Structural modification of soy protein by 13-hydroperoxyoctadecadienoic acid.[J].European Food Research and Technology,2009,229(5):771-778.
[10] 黃友如.脂肪氧合酶催化亞油酸誘導大豆蛋白聚集機理[D].無錫:江南大學,2006.
[11] 吳偉,鄧克權,華欲飛,等.脫脂豆粕預處理對大豆球蛋白結構的影響[J].中國糧油學報,2015,30(5):19-23.
[12] LAEMMLI U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227(5 259):680-685.
[13] 蔡勇建,葉建芬,吳曉娟,等.米糠貯藏時間對米糠蛋白功能性質影響[J].糧食與油脂,2015(6):31-34.
[14] SIMAT T J,STEINHART H.Oxidation of free tryptophan and tryptophan residues in peptides and proteins[J].J Agric Food Chem,1998,46(2):490-498.
[15] TSUMURA K,SAITO T,KUGIMIYA W,et al.Selective proteolysis of the glycinin and β-conglycinin fractions in a soy protein isolate by pepsin and papain with controlled pH and temperature.[J].Food Sci Biotechnol,2004,(69):363-367.
[16] EATON P.Protein thiol oxidation in health and disease:techniques for measuring disulfides and related modifications in complex protein mixtures[J].Free Radic Biol Med,2006,40(11):1 889-1 899.
[17] 王玲,朱秀清,李佳棟,等.低溫冷凍條件對大豆分離蛋白分散液表面疏水性及二硫鍵的影響[J].食品科學,2014,35(7):28-32.
[18] 吳偉,林親錄,華欲飛.脂質氫過氧化物氧化修飾對大豆蛋白去折疊和復折疊性質的影響[J].中國糧油學報,2011,26(7):17-21.
[19] STADTMAN E R,LEVINE R L.Protein oxidation[J].Annals of the New York Academy of Sciences,2000,899(1):191-208.
Effectofproteinoxidationinducedbylinoleicacidoxidationonthestructureofsoyproteinisolate
CHEN Xi,WANG Juan,SUN Wei-zheng*
(School of Food Science and Engineering,South China University of Technology,Guangzhou 510641,China)
Soy protein isolate (SPI) oxidation was induced by lipoxygenase-catalyzed linoleic acid. Protein carbonyl content, sulfhydryl content, surface hydrophobicity, intrinsic fluorescence, and gel electrophoresis were tested to evaluate the effect of protein oxidation of SPI. The solubility of SPI in different solvents was also analyzed to elaborate the inter- and intra-molecular interactions. Results indicated that with the increase of linoleic acid substrate, carbonyl value significantly increased, total sulfhydryl and free sulfhydryl group content decreased, surface hydrophobicity increased and then decreased, intrinsic fluorescence decreased, red shift of SPI was first observed and then blue shifted, the particle size of SPI decreased and then increased and was in the range 5-40 nm. The SPI oxidation caused protein unfolding and aggregation, and non-disulfide covalent bond generated.
protein oxidation; soy protein isolate; molecular structure; linoleic acid oxidation
碩士研究生(孫為正教授為通訊作者,E-mail:fewzhsun@scut.edu.cn)。
“廣東特支計劃”科技創新青年拔尖人才項目(2014TQ01N538);廣州市珠江科技新星專項(201610010105);中央高校基本科研業務費項目(2015ZM155)
2017-02-07,改回日期:2017-03-10
10.13995/j.cnki.11-1802/ts.013994

