殼聚糖改性對磁性Fe3O4吸附去除Pb(Ⅱ)和Cd(Ⅱ)的影響研究*
商 娟 趙 軍
(1.河海大學文天學院土木工程系,安徽 馬鞍山 243000; 2.同濟大學環境科學與工程學院,長江水環境教育部重點實驗室,上海 200092)
殼聚糖改性對磁性Fe3O4吸附去除Pb(Ⅱ)和Cd(Ⅱ)的影響研究*
商 娟1趙 軍2#
(1.河海大學文天學院土木工程系,安徽 馬鞍山 243000; 2.同濟大學環境科學與工程學院,長江水環境教育部重點實驗室,上海 200092)
利用殼聚糖改性磁性Fe3O4以提高其對重金屬Pb(Ⅱ)和Cd(Ⅱ)的吸附性能,考察了改性前后磁性Fe3O4對Pb(Ⅱ)、Cd(Ⅱ)的吸附等溫線及吸附動力學過程。結果表明,經殼聚糖改性后,殼聚糖-磁性Fe3O4比表面積大幅增加,由原來的76.12m2/g增加到142.67m2/g;殼聚糖-磁性Fe3O4對Pb(Ⅱ)、Cd(Ⅱ)的吸附性能優于磁性Fe3O4;當pH為2.0~7.0時,提高pH有助于促進兩種磁性材料對Pb(Ⅱ)和Cd(Ⅱ)的吸附量;兩種磁性材料對Pb(Ⅱ)和Cd(Ⅱ)的吸附符合準二級動力學模型,吸附過程屬于吸熱過程;重復吸附—脫附循環再生5次后,殼聚糖-磁性Fe3O4對Pb(Ⅱ)、Cd(Ⅱ)的去除率仍在80%以上,磁性Fe3O4對Pb(Ⅱ)、Cd(Ⅱ)的去除率在75%以上,兩種磁性材料再生性能較好。
Fe3O4磁性材料 吸附 殼聚糖 重金屬
Abstract: In this paper,the chitosan was employed to modify the surface structure of synthesized magnetic Fe3O4in order to enhance its adsorption capacity towards heavy metals Pb(Ⅱ) and Cd(Ⅱ). The adsorption isotherms and adsorption kinetics of magnetic Fe3O4and chitosan-magnetic Fe3O4for Pb(Ⅱ) and Cd(Ⅱ) was investigated and compared. The results showed that the surface area of magnetic Fe3O4increased from 76.12 m2/g to 142.67 m2/g after chitosan modification. The adsorption properties of chitosan-magnetic Fe3O4on Pb(Ⅱ) and Cd(Ⅱ) were better than those of magnetic Fe3O4. When pH ranged 2.0-7.0,increasing pH would promote the adsorption quantity of two magnetic materials on Pb(Ⅱ) and Cd(Ⅱ). The adsorption of Pb(Ⅱ) and Cd(Ⅱ) by two magnetic materials conformed to the quasi two order kinetic model,and the adsorption process belonged to endothermic process. After regeneration for 5 times,Pb(Ⅱ) and Cd(Ⅱ) removal rate of chitosan-magnetic Fe3O4was still more than 80%,and that of magnetic Fe3O4was more than 75%,showing the better regeneration performance of two magnetic materials.
Keywords: Fe3O4; magnetic material; adsorption; chitosan; heavy metals
磁性材料具有經濟高效、易于回收、吸附性能好、容易分離和再生等優點,可用于去除環境中的重金屬[1-3]。ZHANG等[4]將Fe2+和H2O2置于十二烷基硫酸鈉溶液中,在3種溫度下焙燒得到分離較好的磁性Fe3O4;ZHONG等[5]以乙二醇為反應溶劑、尿素為水解劑,在195 ℃下制得磁性Fe3O4。上述制得的磁性Fe3O4對于重金屬的吸附容量較低,在處理重金屬含量較高的工業廢水時所需成本較高,因此需要在其表面進行改性,提高其對重金屬的吸附容量。
殼聚糖是一種由幾丁質在堿性條件下發生脫乙酰作用產生的天然多糖,具有較好的親水性、無毒性及可生物降解性[6-7]。殼聚糖分子有較多的氨基和羥基,能較方便地負載在磁性材料表面,且能通過這些基團固定重金屬。LIU等[8]將殼聚糖負載在納米零價鐵表面并用其處理電鍍廢水,對電鍍廢水中Cu(Ⅱ)、Cd(Ⅱ)、Pb(Ⅱ)的去除率均達89%以上。然而納米零價鐵容易被氧化,釋放到水溶液中易發生氧化還原反應。因此,本研究在磁性Fe3O4上引入殼聚糖分子制得殼聚糖-磁性Fe3O4,分析兩種磁性材料對于重金屬Pb(Ⅱ)、Cd(Ⅱ)的吸附情況。
1 材料與方法
1.1 試 劑
FeCl3·6H2O、尿素、乙醇、乙二醇、四丁基溴化銨和殼聚糖均為分析純;Pb(NO3)2、Cd(NO3)2、濃鹽酸、醋酸、纖維素、NaNO3和氫氧化鈉均為普通市售產品,純度能滿足試驗要求。試驗中使用的水均為去離子水。
1.2 磁性Fe3O4的制備
分別稱取1.2 g FeCl3·6H2O、2.7 g尿素和7.2 g四丁基溴化銨,置于裝有180 mL乙二醇的圓底燒瓶中,在200 ℃下磁力攪拌均勻,溶解60 min。待圓底燒瓶溫度冷卻至室溫后靜置15 min,棄上清液,收集燒瓶中的沉淀。經乙醇清洗3次后再用去離子水清洗4次,最后置于60 ℃恒溫烘箱中干燥,制得磁性Fe3O4,收集備用。
1.3 殼聚糖-磁性Fe3O4的制備
稱取2.0 g殼聚糖并溶解于100 mL質量分數為1%的醋酸溶液中,待完全溶解后加入1.0 g纖維素粉末,在磁力攪拌器上攪拌2 h使其溶解均勻。將1.0 g制得的磁性Fe3O4加入到醋酸混合液中,逐滴加入2 mol/L的氫氧化鈉溶液10 mL,不斷攪拌,經過24 h硬化后得到殼聚糖-磁性Fe3O4,用去離子水清洗4次,60 ℃下烘干、備用。
1.4 材料表征
采用掃描電子顯微鏡(SEM)和透射電子顯微鏡(TEM)觀察法觀察磁性Fe3O4及殼聚糖-磁性Fe3O4的表面形態結構;采用傅立葉變換紅外光譜(FTIR)法對兩種材料進行結構表征分析;利用N2吸附脫附曲線BET法測定兩種材料的比表面積;采用元素分析儀法對兩種材料中的元素進行定量分析;利用Zeta電位儀法測定兩種材料的等電點。
1.5 吸附試驗
1.5.1 pH的影響
分別以磁性Fe3O4及殼聚糖-磁性Fe3O4為吸附劑處理含Pb(Ⅱ)、Cd(Ⅱ)的溶液,具體方法如下:取0.05 g吸附劑分別加入到50 mL初始質量濃度均為50.0 mg/L的Pb(Ⅱ)、Cd(Ⅱ)標準溶液中,用0.1 mol/L的鹽酸和氫氧化鈉調節溶液pH為2.0、3.0、4.0、5.0、6.0、7.0。為接近環境條件,利用NaNO3將溶液的離子強度調節為0.01 mol/L。室溫下吸附反應12 h,吸附結束后磁選分離吸附劑,測定吸附劑對Pb(Ⅱ)、Cd(Ⅱ)的吸附量。
1.5.2 等溫吸附試驗
向150 mL錐形瓶中分別加入50 mL不同初始質量濃度(0.5、1.0、5.0、10.0、20.0、30.0、40.0、50.0、60.0 mg/L)的Pb(Ⅱ)、Cd(Ⅱ)標準溶液,加入0.05 g吸附劑進行混合。參考1.5.1節調節溶液pH為5.0,離子強度為0.01 mol/L。將錐形瓶封口并轉移到恒溫振蕩箱中開始吸附試驗,控制恒溫振蕩箱溫度分別為25、35、45 ℃。設定吸附時間為12 h,吸附結束后磁選分離吸附劑,測定吸附劑對Pb(Ⅱ)、Cd(Ⅱ)的吸附量。
1.5.3 動力學分析
向150 mL錐形瓶中分別加入50 mL初始質量濃度均為50.0 mg/L的Pb(Ⅱ)、Cd(Ⅱ)標準溶液,加入0.05 g吸附劑進行混合。參考1.5.1節調節溶液pH為5.0,離子強度為0.01 mol/L,在常溫下進行吸附試驗,吸附時間為0、30、60、120、180、240、360、480、600 min時取樣,磁選分離吸附劑后測定上清液中Pb(Ⅱ)、Cd(Ⅱ)的濃度,根據上清液中Pb(Ⅱ)、Cd(Ⅱ)剩余濃度與初始濃度的比值(c/c0)隨時間的變化,繪制吸附動力學曲線。
1.5.4 循環再生試驗
向150 mL錐形瓶中分別加入50 mL初始質量濃度均為50.0 mg/L的Pb(Ⅱ)、Cd(Ⅱ)標準溶液,加入0.05 g吸附劑進行混合。參考1.5.1節調節溶液pH為5.0,離子強度為0.01 mol/L,達到吸附平衡后,磁選分離吸附劑,用去離子水將吸附劑清洗3次去除表面殘留的重金屬溶液,然后在70 ℃的恒溫烘箱中烘干,將烘干后的吸附劑加入到50 mL 0.1 mol/L的氫氧化鈉溶液中,超聲30 min使顆粒分散均勻,放置于恒溫振蕩箱中30 ℃振蕩12 h進行解吸。重復上述吸附—脫附循環再生操作5次,試驗中設置兩組平行試驗,結果取平均值。
2 結果與討論
2.1 材料表征結果
兩種磁性材料的SEM圖見圖1。由圖1可以看出,磁性Fe3O4顆粒表面較為粗糙,覆有大量非晶體狀微球,可見大量納米顆粒構成了磁性Fe3O4表面的粗糙結構[9]。與磁性Fe3O4相比,殼聚糖-磁性Fe3O4表面更加致密,說明殼聚糖成功地負載在磁性Fe3O4表面。

圖1 兩種磁性材料的SEM圖Fig.1 SEM profiles of two magnetic materials

圖2 兩種磁性材料的TEM圖Fig.2 TEM profiles of two magnetic materials
由磁性Fe3O4及殼聚糖-磁性Fe3O4的TEM圖(見圖2)可以看出,兩種磁性材料皆為不規則、無定形態,由一個黑色中心和透明邊緣組成。中心黑色區域為磁核,邊緣外殼較為松散。另外,從TEM圖可以推測出磁性Fe3O4及殼聚糖-磁性Fe3O4尺寸較小,總體為20~50 nm。
為分析對比磁性Fe3O4及殼聚糖-磁性Fe3O4的表面官能團和化學鍵,本研究采用FTIR對兩種磁性材料的表面結構進行表征,結果如圖3所示。由圖3可見,磁性Fe3O4及殼聚糖-磁性Fe3O4均在3 500 cm-1附近出現—OH伸縮振動峰,在1 630 cm-1處出現O—H伸縮振動峰,在560 cm-1處出現Fe—O的伸縮振動峰。經殼聚糖改性后,在3 500 cm-1附近的吸收峰變強,且在1 421 cm-1處出現C—H的伸縮振動吸收峰,說明殼聚糖成功負載在Fe3O4表面。此外,改性后560 cm-1處的Fe—O吸收峰也稍有變強,說明殼聚糖可能通過與Fe元素結合而負載在磁性Fe3O4表面上。

圖3 磁性Fe3O4及殼聚糖-磁性Fe3O4的FTIR譜圖Fig.3 FTIR spectra of magnetic Fe3O4 and chitosan- magnetic Fe3O4
測得磁性Fe3O4及殼聚糖-磁性Fe3O4的比表面積分別為76.12、142.67 m2/g。可見,經殼聚糖改性后磁性Fe3O4比表面積大幅增加,有助于提高其對重金屬的吸附容量。由元素分析結果(見表1)可知,經殼聚糖改性后,磁性Fe3O4表面C、N元素質量分數明顯增加。Zeta電位測定結果表明,磁性Fe3O4的等電點為3.5~4.0,殼聚糖-磁性Fe3O4的等電點升高到4.5~5.0,這是由于帶正電的殼聚糖負載在Fe3O4表面所致。

表1 磁性Fe3O4及殼聚糖-磁性Fe3O4中各元素質量分數

圖4 不同pH下兩種磁性材料對Pb(Ⅱ)、Cd(Ⅱ)的吸附量變化Fig.4 Change of Pb(Ⅱ) and Cd(Ⅱ) adsorption quantity of two magnetic materials with different pH

圖5 磁性Fe3O4對Pb(Ⅱ)、Cd(Ⅱ)的吸附等溫線Fig.5 Adsorption isotherms of magnetic Fe3O4 on Pb(Ⅱ) and Cd(Ⅱ)
2.2 pH對吸附的影響
不同pH條件下,磁性Fe3O4及殼聚糖-磁性Fe3O4對Pb(Ⅱ)、Cd(Ⅱ)的吸附量變化見圖4。
由圖4可見,當pH較低時,磁性Fe3O4及殼聚糖-磁性Fe3O4對Pb(Ⅱ)、Cd(Ⅱ)的吸附量相差不大,隨著pH增加至中性,二者對Pb(Ⅱ)、Cd(Ⅱ)的吸附量均明顯增加,其中殼聚糖-磁性Fe3O4吸附量增幅更加明顯。當pH為7.0時,磁性Fe3O4及殼聚糖-磁性Fe3O4對Pb(Ⅱ)的吸附量分別為32.32、50.00 mg/g,對Cd(Ⅱ)的吸附量分別為26.78、42.58 mg/g。可見,經殼聚糖改性后磁性Fe3O4對重金屬離子的吸附性能大幅提高,這是由于改性后的殼聚糖-磁性Fe3O4表面具有更多的羥基和氨基,能固定更多的重金屬。此外,兩種磁性材料對Pb(Ⅱ)的吸附量均比Cd(Ⅱ)高,說明其對Pb(Ⅱ)的親和力比Cd(Ⅱ)強,可能與Cd(Ⅱ)的水合離子半徑大于Pb(Ⅱ)有關[10],因此Cd(Ⅱ)較難經過材料表面空隙擴散至材料內部而被固定下來。
2.3 等溫吸附試驗結果
磁性Fe3O4及殼聚糖-磁性Fe3O4對Pb(Ⅱ)、Cd(Ⅱ)的吸附等溫線分別見圖5、圖6。
由圖5、圖6可見,磁性Fe3O4及殼聚糖-磁性Fe3O4對Pb(Ⅱ)、Cd(Ⅱ)的吸附特性相似。在相同溫度下,隨著Pb(Ⅱ)、Cd(Ⅱ)初始濃度的增加,兩種磁性材料對Pb(Ⅱ)、Cd(Ⅱ)的吸附量均呈增加趨勢,且高溫條件下吸附量增加更為明顯。當重金屬初始質量濃度≤10 mg/L時,溫度對兩種磁性材料吸附性能幾乎沒有影響。當重金屬初始質量濃度>10 mg/L時,溫度的影響逐漸明顯,表現出隨著溫度的升高,兩種磁性材料對Pb(Ⅱ)、Cd(Ⅱ)的吸附量均呈增加趨勢,說明此吸附過程為吸熱過程,重金屬濃度越高,溫度對吸附量的影響越明顯。
2.4 吸附動力學試驗結果
磁性Fe3O4及殼聚糖-磁性Fe3O4對Pb(Ⅱ)、Cd(Ⅱ)的吸附動力學曲線如圖7所示。由圖7(a)可見,利用磁性Fe3O4及殼聚糖-磁性Fe3O4吸附處理Pb(Ⅱ)時,c/c0在吸附初期迅速下降,隨著吸附時間的延長,c/c0的下降速率逐漸放緩,最終在480 min時基本達到吸附平衡。這是因為兩種磁性材料的表面均為多孔結構,溶液中的Pb(Ⅱ)很容易擴散至磁性材料表面,當表層吸附位點達飽和后,Pb(Ⅱ)向內層擴散的阻力增加,吸附去除速率逐漸降低[11]。由圖7(b)可見,兩種磁性材料對Cd(Ⅱ)的去除情況與Pb(Ⅱ)相似,但達到吸附平衡所需時間較長,這是由于兩種磁性材料對Cd(Ⅱ)的親和力比Pb(Ⅱ)弱,導致吸附去除速率較慢。
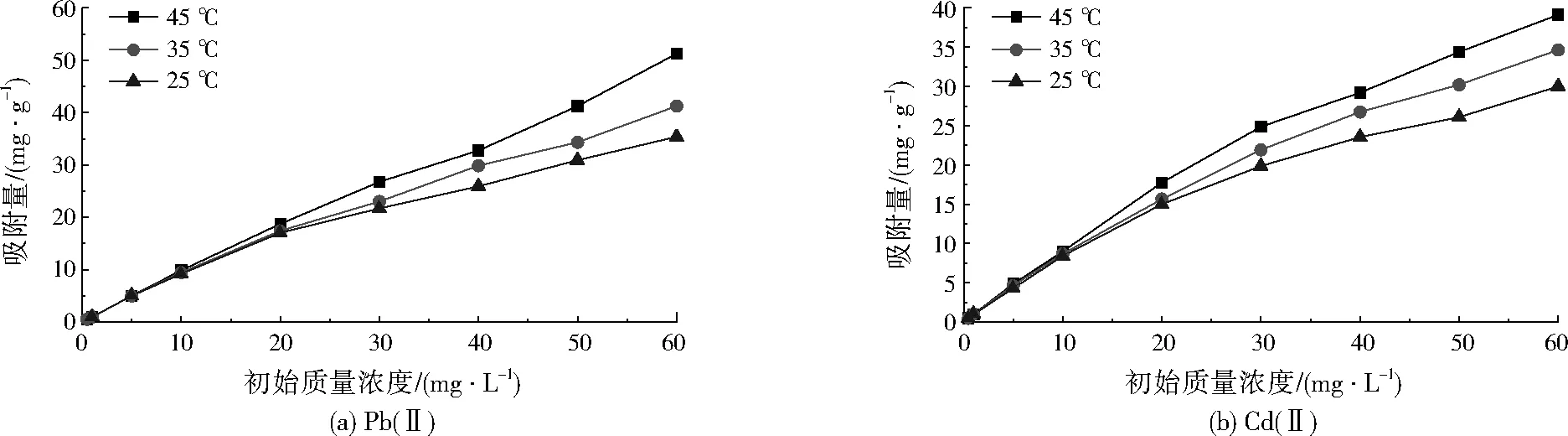
圖6 殼聚糖-磁性Fe3O4對Pb(Ⅱ)、Cd(Ⅱ)的吸附等溫線Fig.6 Adsorption isotherms of chitosan-magnetic Fe3O4 on Pb(Ⅱ) and Cd(Ⅱ)
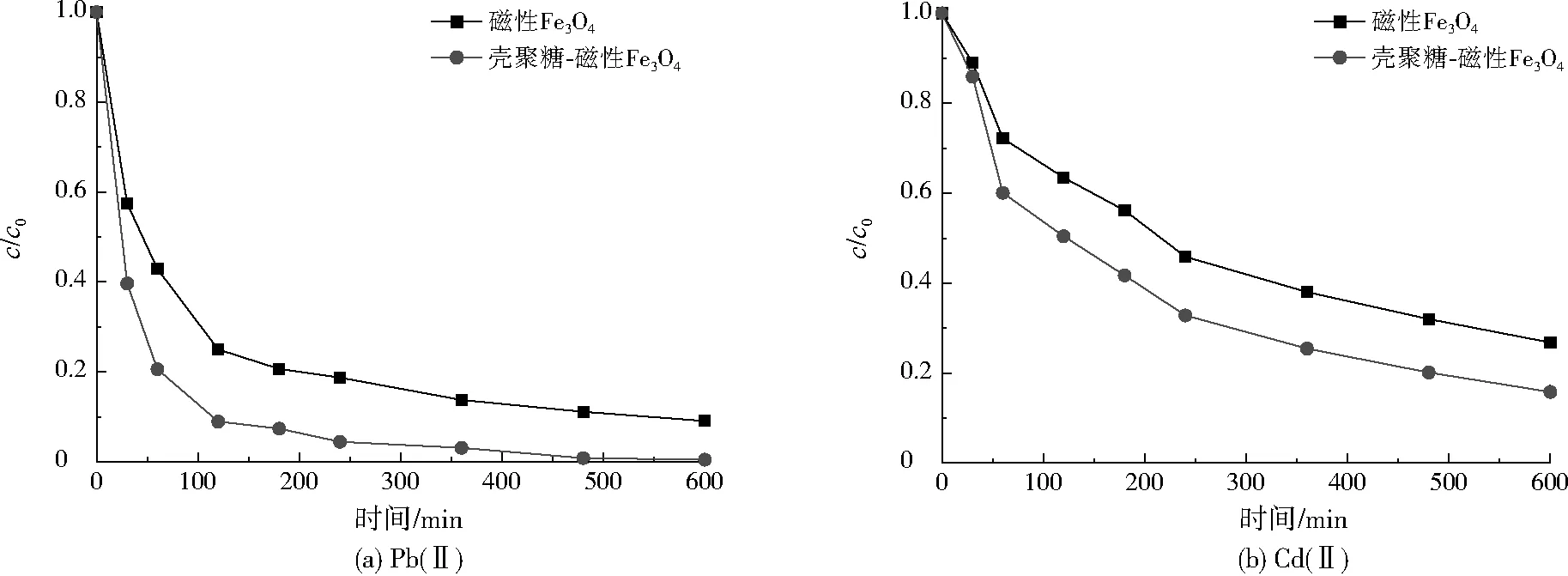
圖7 兩種磁性材料對Pb(Ⅱ)、Cd(Ⅱ)的吸附動力學曲線Fig.7 Adsorption kinetic curves of two magnetic materials on Pb(Ⅱ) and Cd(Ⅱ)
本研究采用準二級動力學模型[12]對兩種磁性材料吸附Pb(Ⅱ)、Cd(Ⅱ)的過程進行分析,得到平衡吸附量的擬合值(Qe,cal,mg/g),并將其與平衡吸附量的試驗值(Qe,exp,mg/g)進行對比,結果見表2。由表2可見,Qe,cal與Qe,exp比較接近,且準二級動力學模型對吸附數據擬合的相關系數R2均在0.99以上,說明準二級動力學模型可以較好的描述兩種磁性材料對Pb(Ⅱ)和Cd(Ⅱ)的吸附動力學過程。
2.5 吸附—脫附循環再生試驗結果
由于本研究合成的磁性Fe3O4及殼聚糖-磁性Fe3O4均具有較好的磁響應性能,故能在循環再生試驗中快速分離回收。由圖8可見,隨著吸附—脫附循環再生次數的增加,兩種磁性材料對Pb(Ⅱ)、Cd(Ⅱ)的吸附去除率逐漸降低。對循環再生5次的殼聚糖-磁性Fe3O4進行元素分析,測得C、H、N元素的質量分數分別為12.91%、3.19%、1.92%,與循環再生前差別不大,說明殼聚糖在循環過程中較為穩定,未發生明顯脫落。此外,殼聚糖-磁性Fe3O4對重金屬吸附性能的下降趨勢與磁性Fe3O4總體一致,說明可能是循環過程中吸附劑有部分損失,或再生過程并未解吸完全導致磁性材料表面的活性吸附位點降低,造成吸附性能下降。

表2 兩種磁性材料對Pb(Ⅱ)、Cd(Ⅱ)的平衡吸附量
在5次循環再生過程中,殼聚糖-磁性Fe3O4對Pb(Ⅱ)、Cd(Ⅱ)的去除率均高于磁性Fe3O4,5次循環再生后,殼聚糖-磁性Fe3O4對Pb(Ⅱ)、Cd(Ⅱ)的去除率分別為87.5%、82.3%,磁性Fe3O4對Pb(Ⅱ)、Cd(Ⅱ)的去除率分別為76.8%、78.2%,說明本研究合成的殼聚糖-磁性Fe3O4具有較好的再生性能。
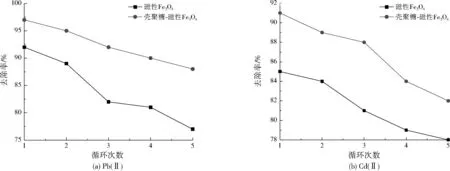
圖8 循環再生過程中兩種磁性材料對Pb(Ⅱ)、Cd(Ⅱ)的去除率Fig.8 Removal rate of Pb(Ⅱ) and Cd(Ⅱ) by two magnetic materials after regeneration
3 結 論
(1) 殼聚糖改性可大幅提高磁性Fe3O4的比表面積,殼聚糖-磁性Fe3O4的比表面積由原來的76.12 m2/g增加到了142.67 m2/g。
(2) 當pH為2.0~7.0時,提高pH有助于促進兩種磁性材料對Pb(Ⅱ)和Cd(Ⅱ)的吸附量。當pH為7.0時,磁性Fe3O4及殼聚糖-磁性Fe3O4對Pb(Ⅱ)的吸附量分別為32.32、50.00 mg/g,對Cd(Ⅱ)的吸附量分別為26.78、42.58 mg/g。
(3) 磁性Fe3O4及殼聚糖-磁性Fe3O4對Pb(Ⅱ)、Cd(Ⅱ)的吸附符合準二級動力學模型。
(4) 當重金屬初始質量濃度≤10 mg/L時,溫度對兩種磁性材料吸附性能幾乎沒有影響。當重金屬初始質量濃度>10 mg/L時,溫度的影響逐漸明顯,表現出隨著溫度的升高,兩種磁性材料對Pb(Ⅱ)、Cd(Ⅱ)的吸附量總體呈增加趨勢,說明吸附過程為吸熱過程。
(5) 兩種磁性材料具有較好的再生性能,重復吸附—脫附循環再生5次后,殼聚糖-磁性Fe3O4對Pb(Ⅱ)、Cd(Ⅱ)的去除率仍在80%以上,磁性Fe3O4對Pb(Ⅱ)、Cd(Ⅱ)的去除率在75%以上。
[1] 艾翠玲,雷英杰,張國春,等.納米鐵氧化物吸附處理重金屬廢水的研究進展[J].化工環保,2015,35(6):593-598.
[2] 杜雪巖,路翠萍,馬應霞,等.磁性微/納米材料處理水溶液中金屬離子研究進展[J].材料導報,2013,27(12):66-70.
[3] 楊梖,白雪,顧海鑫.磁性吸附材料的制備及其在污水處理中的應用[J].環境工程,2015,33(4):25-29.
[4] ZHANG Chang,YU Zhigang,ZENG Guangming,et al.Phase transformation of crystalline iron oxides and their adsorption abilities for Pb and Cd[J].Chemical Engineering Journal,2016,284:247-259.
[5] ZHONG Liangshu,HU Jinsong,LIANG Hanpu,et al.Self-assembled 3D flowerlike iron oxide nanostructures and their application in water treatment[J].Advanced Materials,2006,18(18):2426-2431.
[6] 吳永娟,羅鳴,閆俊英,等.磁性介孔γ-Fe2O3制備及其處理含Cr(Ⅵ)廢水的應用[J].工業水處理,2014,34(1):15-17.
[7] PAULA I P S,DIANA M,CéSAR L,et al.Thermal and magnetic properties of chitosan-iron oxide nanoparticles[J].Carbohydrate Polymers,2016,149:382-390.
[8] LIU Tingyi,YANG Xi,WANG Zhongliang,et al.Enhanced chitosan beads-supported Fe0-nanoparticles for removal of heavy metals from electroplating wastewater in permeable reactive barriers[J].Water Research,2013,47(17):6691-6700.
[9] MAO Dan,YAO Jianxi,LAI Xiaoyong,et al.Hierarchically mesoporous hematite microspheres and their enhanced formaldehyde-sensing properties[J].Small,2011,7(5):578-582.
[10] 李文文,李夢蕊,趙廣超.磁性竹基炭對Pb2+、Cd2+與Cu2+的吸附機理研究[J].環境科學學報,2014,34(4):938-943.
[11] ZENG Guangming,LIU Yuanyuan,LIN Tang,et al.Enhancement of Cd(Ⅱ) adsorption by polyacrylic acid modified magnetic mesoporous carbon[J].Chemical Engineering Journal,2015,259:153-160.
[12] 賈志剛,彭寬寬,許立信,等.磁性介孔錳鐵復合氧化物對Cr(Ⅵ)的吸附性能研究[J].環境工程學報,2012,6(1):157-162.
EffectofchitosanmodificationonPb(Ⅱ)andCd(Ⅱ)adsorptionbymagneticFe3O4
SHANGJuan1,ZHAOJun2.
(1.DepartmentofCivilEngineering,HohaiUniversityWentianCollege,MaanshanAnhui243000;2.KeyLaboratoryofYangtzeRiverWaterEnvironment,MinistryofEducation,SchoolofEnvironmentalScienceandEngineering,TongjiUniversity,Shanghai200092)
10.15985/j.cnki.1001-3865.2017.07.011
2016-12-27)
商 娟,女,1986年生,碩士,講師,研究方向為水污染控制。#
。
*安徽省高校自然科學研究重點項目(No.KJ2016A622)。

