異源表達irrE轉基因煙草的耐鹽耐旱性
趙雷霖,范鑫,聶星,梁成真,張銳,孫國清,孟志剛,林敏,王遠,郭三堆
?
異源表達轉基因煙草的耐鹽耐旱性
趙雷霖,范鑫,聶星,梁成真,張銳,孫國清,孟志剛,林敏,王遠,郭三堆
(中國農業科學院生物技術研究所,北京 100081)
IrrE是從耐輻射異常球菌中發現的全局調控蛋白,主要通過修復強輻射等逆境條件下DNA損傷,提高耐輻射異常球菌對極端逆境環境的抗性。研究按植物密碼子優化的后導入煙草對轉基因煙草耐逆能力的提高,為棉花等作物耐逆育種研究打下基礎。按照植物密碼子優化細菌并合成基因;通過酶切連接法構建植物表達載體;通過葉盤法轉化煙草并PCR驗證獲得陽性轉基因再生苗;通過實時熒光定量PCR(qRT-PCR)分析轉基因株系中的表達量;通過蛋白免疫印跡法(Western blot)檢測IrrE編碼蛋白;通過NaCl和甘露醇模擬鹽處理和干旱處理分析純和轉基因株系的耐鹽耐旱性,通過測定抗逆相關生理指標鑒定其對植物耐逆的貢獻。按照植物密碼子對進行改造,共優化了241個密碼子;構建了高效植物表達載體GBI-IE;利用除草劑草甘膦作為篩選劑獲得轉基因再生幼苗,并通過PCR驗證共獲得15個獨立的轉基因株系;通過qRT-PCR分析從中選取兩個表達量最高的株系GO1和GO2進行后續的抗逆性分析;Western blot驗證IrrE編碼蛋白在GO1和GO2中能正確翻譯。轉基因煙草耐鹽耐旱性分析:種子萌發試驗表明,正常1/2 MS培養基上,轉基因株系GO1和GO2發芽率和非轉基因野生型對照之間沒有明顯的差異。然而250 mmol·L-1NaCl培養基上GO1和GO2萌發率分別為78.8%和90.0%,野生型僅為10.3%,分別提高了68.5%和79.7%。類似地,300 mmol·L-1甘露醇條件下,野生型的萌發率為39.7%,轉基因株系GO1和GO2分別提高了42.9%和50.8%;正常萌發的種子移栽到250 mmol·L-1NaCl和300 mmol·L-1甘露醇條件12 d后,轉基因株系根長、側根數以及鮮重等生理指標顯著高于野生型對照;溫室中正常生長30 d的苗期煙草在250 mmol·L-1NaCl處理下,轉基因煙草SOD、CAT活性比野生型對照分別提高了48.80%和88.55%,而MDA含量比野生型對照降低了61.61%,脅迫響應基因、、、在GO1和GO2轉基因株系中表達量均顯著高于非轉基因野生型。和鹽處理結果類似,300 mmol·L-1甘露醇的處理下,轉基因煙草的耐旱生理生化指標均優于非轉基因對照。煙草中異源表達耐輻射異常球菌可以顯著提高耐鹽耐旱性;其多效性耐非生物脅迫能力的提高表明其可作為植物耐逆基因工程的優良基因源。
密碼子優化;;轉基因煙草;耐旱耐鹽
0 引言
【研究意義】干旱和鹽堿是制約作物發展的重要環境因素,非生物逆境脅迫下作物生長緩慢[1]、黃化早衰[2-3]、產量降低[4],對農業生產造成嚴重的損害。植物自身可通過受體蛋白感知干旱、鹽、溫度等逆境信號[5],通過激素和信號轉導基因傳遞,從而激活抗逆信號,實現對逆境的適應。目前,盡管大量的逆境相關基因被克隆和報道,然而可用于極端環境下作物遺傳改良的報道仍然非常少。蘇云金芽孢桿菌基因在棉花抗棉鈴蟲中的成功應用[6],為利用外源微生物基因改良作物抗蟲等農藝性狀提供了重要的參考。然而,異源表達微生物基因提高植物抗非生物脅迫的報道仍然非常的少,是否存在類似Bt蛋白提高植物抗蟲效果的優良基因有待深入研究。【前人研究進展】耐輻射異常球菌()是一類可生存于極端環境的微生物,對電離輻射、紫外線、干旱、絲裂霉素C等均具有抗性[7-8]。Udupa等[9]從耐輻射異常球菌302菌株中分離得到了41株電離輻射敏感菌株,這些敏感菌株被劃分成irrA至irrP的16個亞群,每個亞群均含有與電離輻射抗性相關基因的差異突變;Earl等[10]鑒定出irrE亞群中的唯一菌株IRS24,此菌株不僅對電離輻射抗性低而且對紫外輻射及絲裂霉素C都敏感,研究發現導致這些抗性減弱是由于突變所致,位于耐輻射異常球菌的1號染色體,編號為DR_0167,全長987 bp,編碼328個氨基酸,大小為35 kD。IrrE蛋白是由3個結構域構成的獨特組合:一個類鋅肽結構域,一個HTH(螺旋-轉角-螺旋)結構域和一個類GAF結構域[11]。Lu等[12-13]通過分析突變株與野生型菌株受到輻射前后的蛋白組差異,發現存在時,31種蛋白表達量顯著上調,除RecA與PprA參與DNA損傷修復[14-15],其他蛋白涉及了轉錄調控、能量代謝和應激反應等6個不同通路[12]。2014年,Ludanyi等[16]通過體內和體外實驗證明IrrE是一種金屬蛋白酶,可以與DdrO(DNA損傷誘導基因的負調節因子)相互作用[17],使其降解并促進DNA損傷誘導基因的表達,進而提高耐輻射異常球菌的輻射、干旱等抗性。此外,樂東海等[18]將轉入大腸桿菌,轉化菌株的抗氧化性顯著提高;在枯草芽胞桿菌中表達,也能增強細胞的抗氧化與紫外輻射能力[19],PAN等[20]將此基因轉入大腸桿菌,IrrE蛋白顯著提高大腸桿菌細胞對鹽、氧化、滲透和熱等多種非生物脅迫的耐受性,同時驗證了該基因提高油菜耐鹽能力的作用。上述研究結果說明對生物耐逆性提高具有顯著的生物學功能。【本研究切入點】IrrE對耐輻射異常球菌的干旱和輻射等抗性具有重要作用,且相關研究表明異源表達可顯著提高宿主的抗逆性[21]。然而,按照植物密碼子優化后導入植物,對植物抗逆性的提高目前仍沒有報道。研究優化的轉基因煙草的耐鹽耐旱性,進一步了解在植物中的抗逆功能。【擬解決的關鍵問題】將優化的轉入煙草,鑒定轉基因煙草的耐鹽耐旱性,并分析轉基因植物的生理生化變化,以期獲得改造后的耐輻射異常球菌可顯著提高轉基因植物耐旱耐鹽性,為植物耐逆基因工程提供優良基因源。
1 材料與方法
試驗于2016年在中國農業科學院生物技術研究所完成。
1.1 試驗材料
序列來源于中國農業科學院生物技術研究所林敏研究員課題組,基因合成由上海生工生物工程有限公司完成,中間載體pUC-19、植物表達載體pBI-121、農桿菌GV3101感受態、煙草種子NC89均由生物技術研究所郭三堆研究員課題組保存。質粒小提試劑盒購于GenStar公司,d Ⅲ、RⅠ等內切酶購于NEB公司,膠回收試劑盒購于Omega公司,植物DNA提取試劑盒購于天根公司,植物RNA提取試劑盒購于原平皓公司,反轉錄試劑盒和實時熒光定量PCR(qRT-PCR)試劑盒均購于全式金公司,高保真DNA聚合酶、In-Fusion HD Cloning Kit購于TaKaRa公司,常規試劑購于拜爾迪公司,引物(表1)由上海生工生物工程公司合成。Western blot用一抗由中國農業科學院生物技術研究所陸偉老師提供,其他試劑均購于康為試劑公司。
1.2 植物表達載體的構建
為了轉基因株系易于篩選,對pBI-121載體進行改造,利用[22]替換抗性標記基因,獲得植物表達載體GBI。編碼序列長987 bp,進行密碼子優化并將基因內部的Ⅰ、Ⅰ、d Ⅲ、RⅠ和HⅠ酶切位點鈍化,在ORF兩端加上Ⅰ和Ⅰ酶切位點,連接于中間載體上,獲得中間載體pUC-irrE,載體表達盒的一端用d Ⅲ酶切后,插入linker-02,鈍化d Ⅲ位點,插入RⅠ位點,用coRⅠ單酶切的方式切下表達盒片段,連接到GBI上,獲得植物高效表達載體GBI-IE。
1.3 轉化煙草及陽性植株鑒定
將GBI-IE載體轉化農桿菌GV3101感受態,葉盤法轉化煙草,使用草甘膦篩選培養4—5周后,愈傷組織開始分化,待再生苗長至3—4片葉子時轉接到生根培養基,幼苗長至10 cm左右開蓋,PCR鑒定陽性轉基因植株后,煉苗1—2 d,移栽至培養盆于溫室培養。
1.4 實時熒光定量PCR(qRT-PCR)分析
取幼苗自頂部向下第3葉,利用植物RNA提取試劑盒(TIANGEN,DP432)提取材料總RNA,反轉錄獲得cDNA,利用KOD SYBR qPCR MIX(TOYOBO,QKD-201)進行實時熒光定量PCR檢測,應用BIO-RAD Mini Opticon熒光定量分析儀進行qRT-PCR反應和分析。煙草作為內參基因。按照2-ΔΔCt法計算目的基因的相對表達量[23]。
1.5 Western blot檢測
利用RIPA裂解液提取煙草葉片總蛋白,煮沸變性后,稀釋5倍取30 μL進行SDS-PAGE電泳,濃縮膠電壓為80 V,待溴酚藍指示劑遷移至分離膠、分子量標準各條帶略有分開后,換電壓至120 V,待溴酚藍遷移至距離凝膠底部0.5 cm時結束電泳;轉膜,100 mA(約40 V)穩流轉100 min;5% BSA封閉1 h;一抗按照1﹕5 000倍稀釋,4℃孵育過夜,TBST洗膜3次;二抗按照1﹕5 000比例稀釋,孵育1 h,TBST洗膜4次,曝光[24]。
1.6 轉基因煙草的耐鹽耐旱性分析
取適量野生型和轉基因煙草種子于無菌2 mL離心管中,75%酒精消毒30 s,無菌水洗一次,15% NaClO 25℃消毒30 min,無菌水洗5—6遍,點播于含有250 mmol·L-1NaCl和300 mmol·L-1甘露醇的1/2 MS培養基上,黑暗1 d后,28℃光照培養,每隔24 h統計發芽率;正常萌發的種子移栽到250 mmol·L-1NaCl和300 mmol·L-1甘露醇條件12 d后,統計根長、側根數和鮮重,每個株系取10株;煙草于溫室培養30 d后,250 mmol·L-1NaCl和300 mmol·L-1甘露醇處理,24 h后取材料檢測和相關脅迫響應因子的表達量,一周后采集照片并測定SOD、CAT活性和MDA含量,每個株系取6株。

表1 引物信息
2 結果
2.1 密碼子優化
來自于耐輻射異常球菌,基因全長987 bp,編碼329個氨基酸,在轉入植物之前,與植物基因組比對,其中有241個氨基酸的密碼子使用的是非植物偏愛密碼子,占比達到73.25%。理論上來說,若不對其進行密碼子優化,直接導入植物,會造成基因表達量低甚至不表達[25]。因此,按植物密碼子對其進行了優化,旨在讓在植物中正確翻譯并高效表達。共優化290個堿基,涉及241個密碼子,編碼蛋白氨基酸序列和改造前完全相同(圖1)。
2.2 irrE植物表達載體構建和陽性轉基因煙草分子鑒定
棉花遺傳轉化費時費力,為提高轉基因苗陽性率,首先將載體pBI-121卡拉霉素抗性標記基因替換成為草甘膦抗性基因。將與Cozk、Kozak和ployA等元件連接后克隆到GBI載體上,構建植物表達載體GBI-IE(圖2-A)。葉盤法轉化煙草(圖2-B),使用100 mg·L-1草甘膦篩選和PCR檢測,共獲得15個獨立的轉基因陽性株系(圖2-C)。根據qRT-PCR檢測結果,選擇2個表達量最高的轉基因株系,并命名為GO1和GO2進行耐鹽耐旱試驗(圖2-D),為確定在轉基因煙草中蛋白正常翻譯,進一步利用Western blot檢測轉基因煙草GO1和GO2中目標蛋白的表達(圖2-E),轉基因煙草在35 kD處清晰地檢測到IrrE蛋白表達,而野生型非轉基因對照完全沒有條帶,說明GO1和GO2中IrrE編碼蛋白正確的翻譯。
2.3 逆境條件下irrE轉基因煙草萌發率
在正常1/2 MS培養基上,轉基因株系GO1和GO2發芽率和野生型對照之間沒有明顯差異(圖3-A和圖3-B);而250 mmol·L-1NaCl培養基中,GO1和GO2萌發率分別為78.8%和90.0%,野生型僅為10.3%(圖3-C);300 mmol·L-1甘露醇條件下,與野生型對照相比,轉基因株系GO1和GO2萌發率分別提高了42.9%和50.8%(圖3-D)。
2.4 irrE轉基因煙草耐鹽和耐旱性
正常萌發的種子移栽到正常培養基12 d后,轉基因GO1和GO2與對照組生長基本一致,根長(圖4-A和圖4-B)、側根數(圖4-C)和鮮重(圖4-D)無顯著差異;而移栽到含250 mmol·L-1NaCl培養基上,與對照相比,轉基因GO1和GO2的平均根長提高46.9%和53.3%,平均側根數提高3和3.34倍,平均鮮重提高2.29和2.31倍;移栽到300 mmol·L-1甘露醇培養基上,轉基因GO1和GO2的平均根長增加46.1%和58.4%,平均側根數增加2.29和2倍,平均鮮重增加3和3.33倍。
將正常萌發的GO1、GO2和野生型煙草移栽至溫室中培養30 d后,進行鹽和干旱處理。與野生型相比,轉基因煙草無論耐旱還是耐鹽害能力均明顯提高(圖5-A)。
正常生長條件下,GO1、GO2與野生型SOD(圖5-B)、CAT活性(圖5-C)和MDA含量(圖5-D)無明顯差異;250 mmol·L-1NaCl處理后,野生型煙草的SOD活性為79.08 U·g-1FW,轉基因GO1和GO2的SOD活性分別為122.07和175.84 U·g-1FW,野生型煙草的CAT活性為84.00 U·g-1FW,轉基因煙草GO1和GO2的CAT活性分別為123.74和127.81 U·g-1FW;野生型煙草的MDA含量為74.13 nmol·g-1FW,轉基因煙草GO1和GO2的MDA含量分別為28.70和28.16 nmol·g-1FW;干旱處理后,轉基因煙草GO1和GO2的SOD活性比野生型分別提升了56.27和74.58 U·g-1FW,CAT活性提升了26.65和41.55 U·g-1FW,MDA含量降低了24.73和27.83 nmol·g-1FW。

圖1 棉花偏好性密碼子優化前后irrE編碼區核苷酸(A)和編碼蛋白氨基酸(B)序列比較
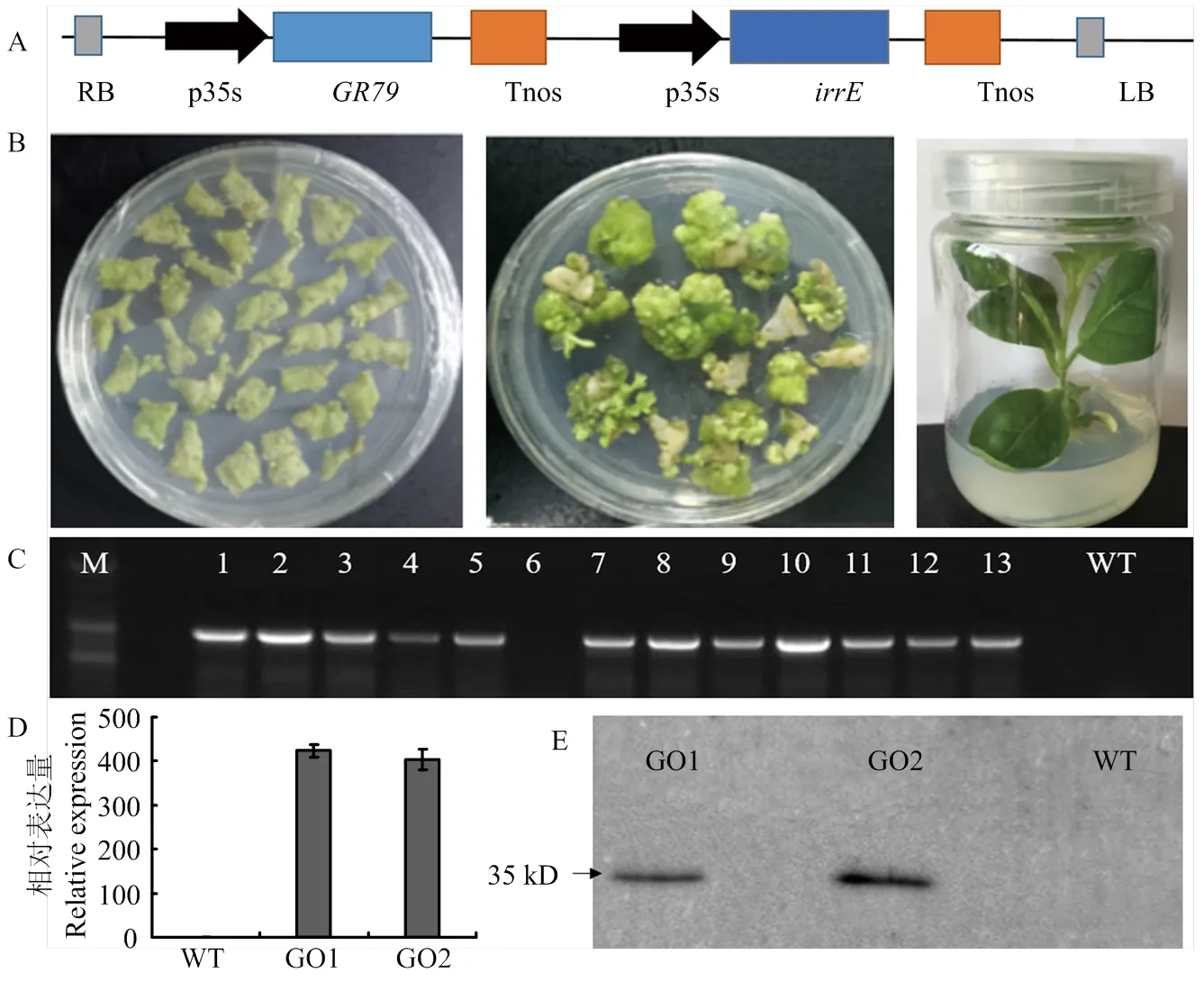
A:載體圖譜;B:轉基因再生株系的獲得;C:T0代陽性植株PCR鑒定,M:DNA Marker,CK:野生型對照,1—13:轉基因株系;D:GO1和GO2中irrE的表達量檢測;E:蛋白免疫印跡檢測IrrE蛋白
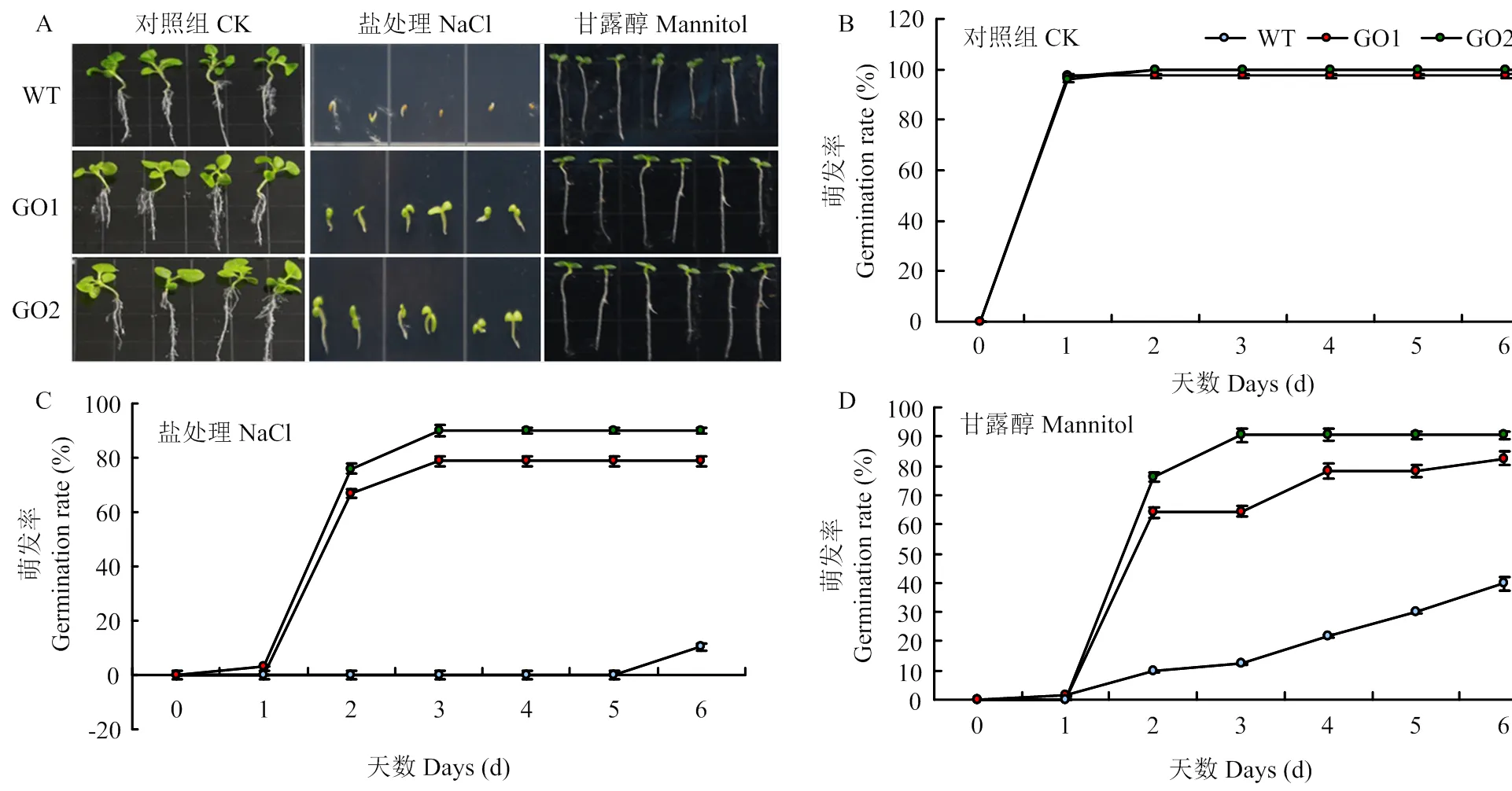
A:野生型和GO1、GO2在不同培養基上第8天的萌發情況;B:野生型和GO1、GO2在1/2 MS培養基上的萌發率;C:野生型和GO1、GO2在含有250 mmol·L-1 NaCl培養基上的萌發率;D:野生型和GO1、GO2在含有300 mmol·L-1甘露醇培養基上的萌發率
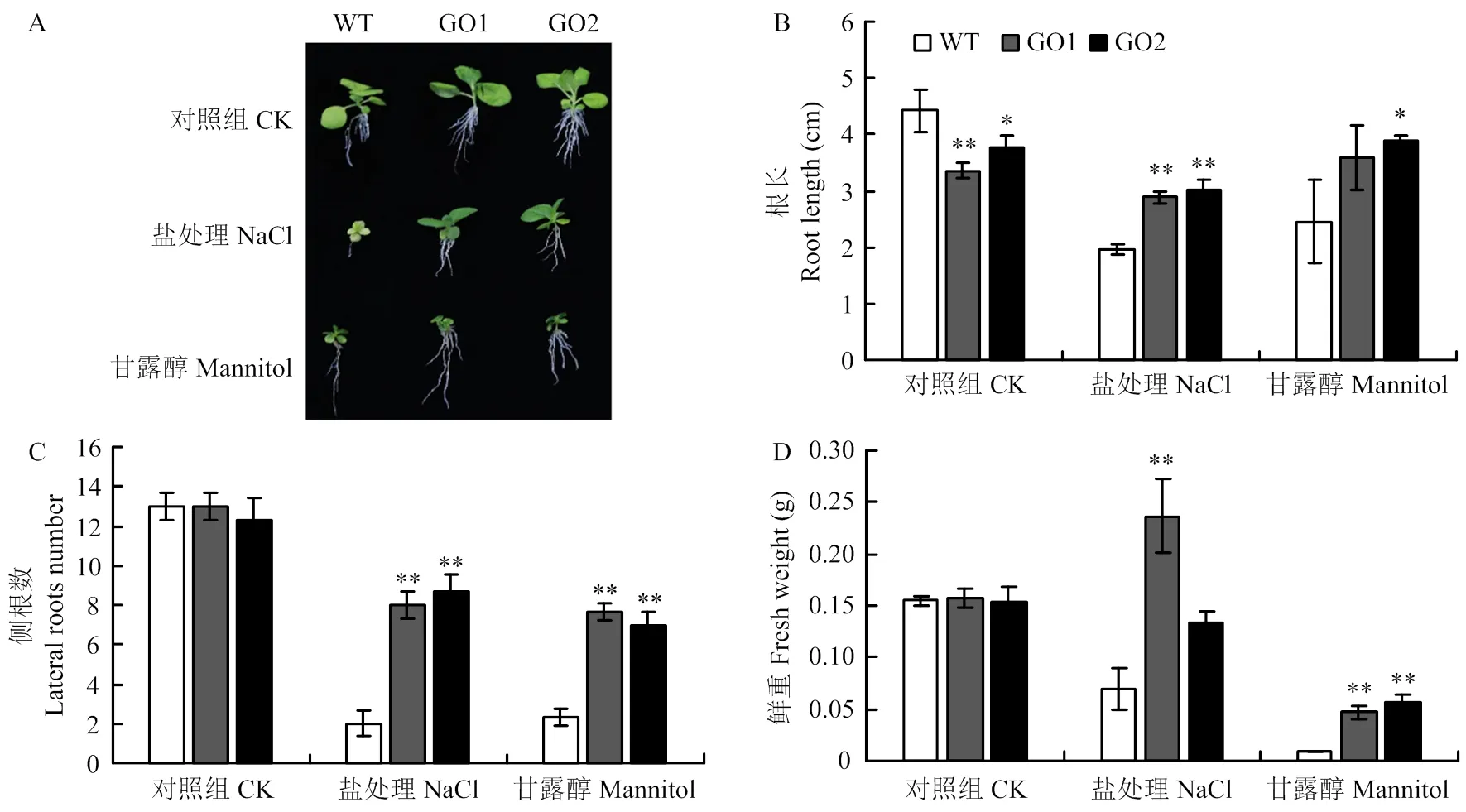
A:250 mmol·L-1NaCl和300 mmol·L-1甘露醇條件12 d后野生型和轉基因GO1和GO2的煙草;B:根長;C:側根數;D:鮮重
A: After treatment of 250 mmol·L-1NaCl and 300 mmol·L-1mannitol for 12 days, WT and GO1, GO2; B: Root length; C: Lateral roots number; D: Fresh weight
“*”和“**”分別表示在<0.05 和<0.01水平上差異顯著。下同
“* ” and “**” indicate significant difference at<0.05 and<0.01 level, respectively. The same as below
圖4 轉基因株系和野生型根長、側根數和鮮重比較
Fig. 4 Comparison of root length, lateral roots number and fresh weight of transgenic lines and WT
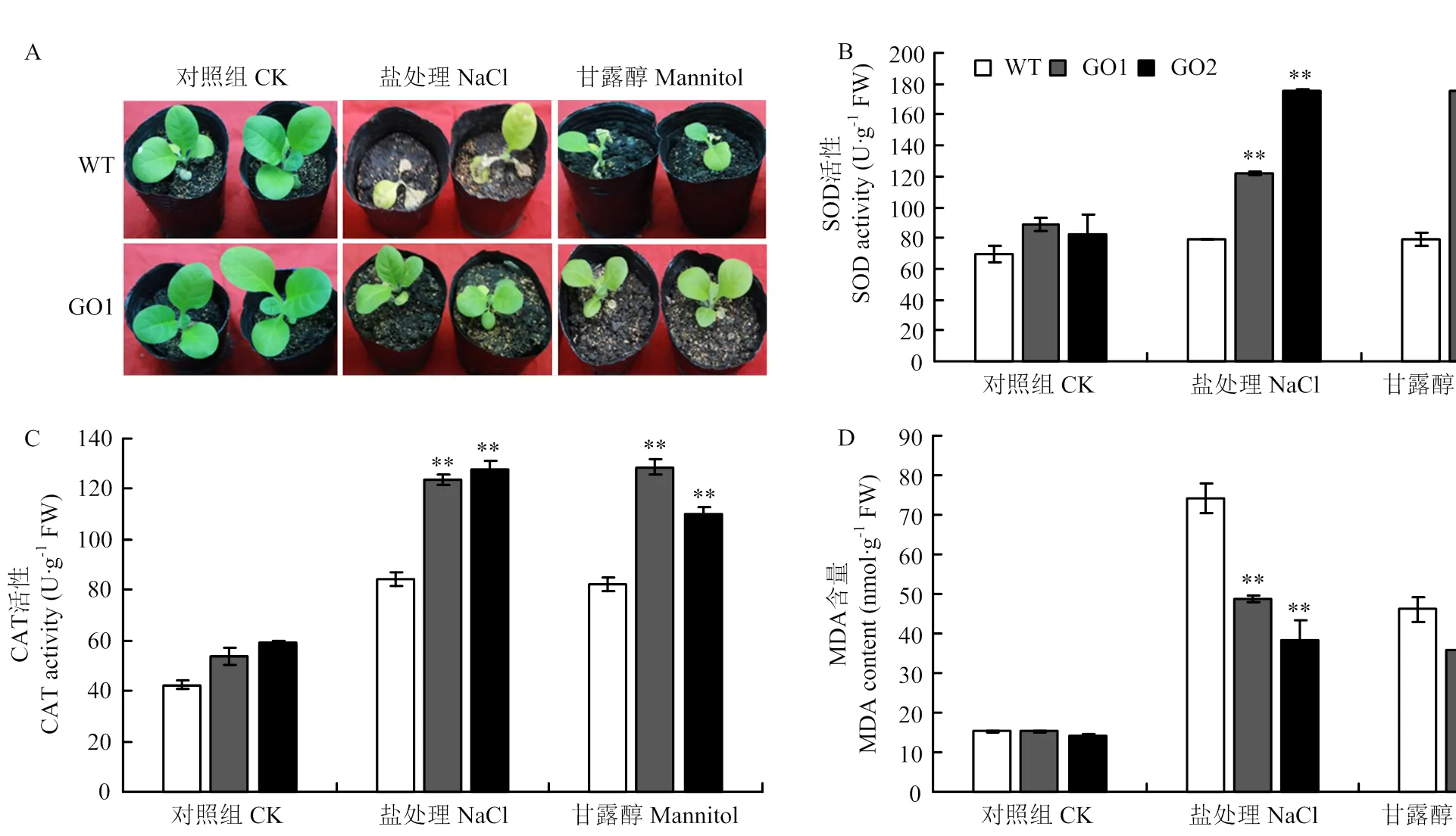
A:正常生長條件和脅迫處理的表型(野生型和GO1株系),鹽處理:250 mmol·L-1 NaCl,干旱處理:300 mmol·L-1甘露醇;B:SOD活性;C:CAT活性;D:MDA含量
2.5 轉基因株系中逆境應答基因表達
qRT-PCR分析表明,250 mmol·L-1NaCl和300 mmol·L-1甘露醇處理下,脅迫應答因子NtABF2(ABRE binding factor)[26]、Ntzfp(osmotic stress-induced zinc-finger protein)[27]、NtCDPK2(calcium dependent protein kinase)[28]以及水通道蛋白NtLEA5[29]等編碼基因表達量均顯著上調(圖6)。在正常生長條件下,野生型和轉基因GO1、GO2表達量基本一致,然而鹽處理后轉基因煙草植株的表達量比野生型提高了2倍,干旱處理后提高了1倍;、、無論正常生長條件下還是鹽脅迫和甘露醇處理下,轉基因植株的表達量均顯著高于野生型。
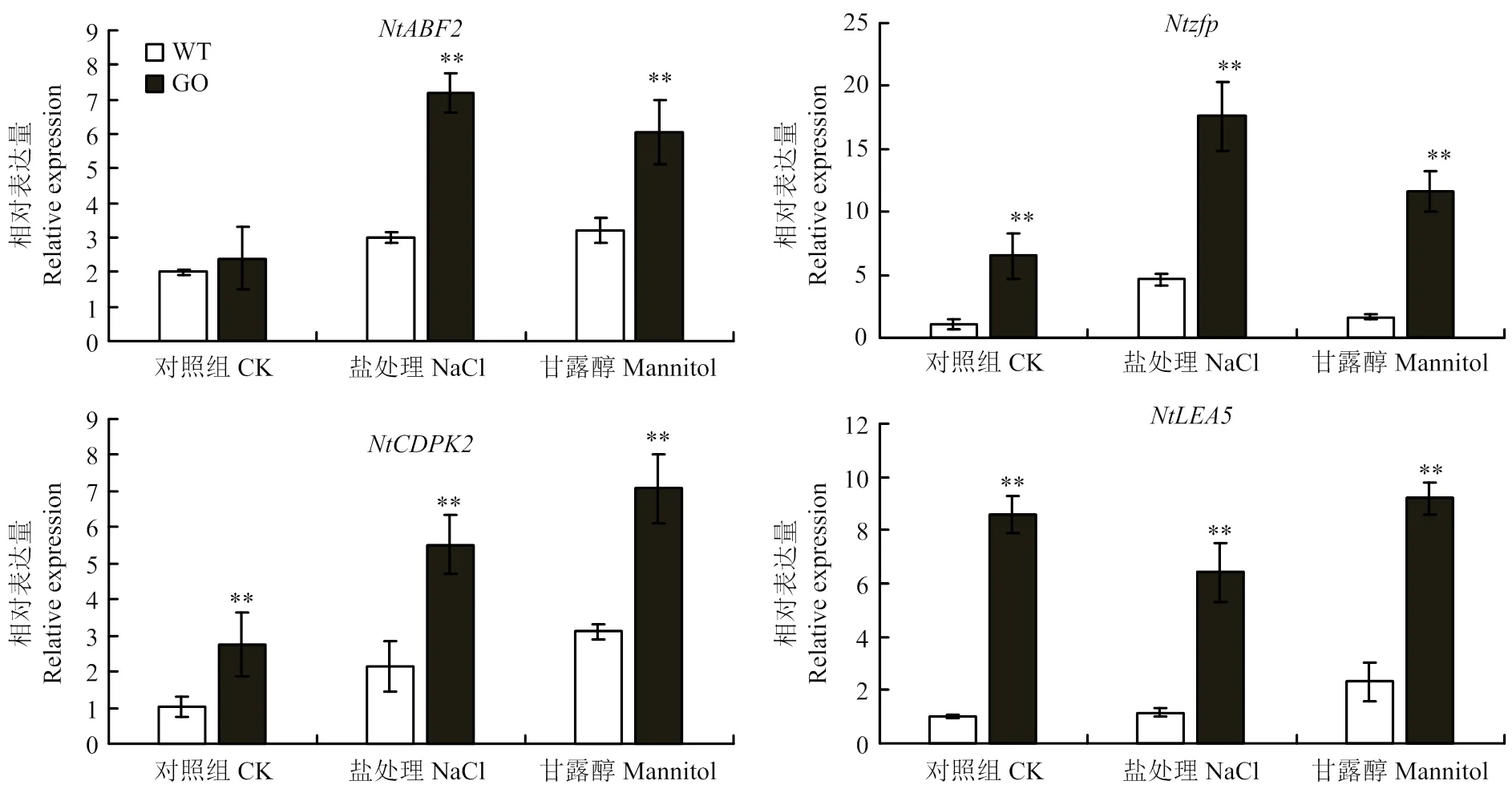
圖6 鹽和干旱處理下WT和irrE轉基因煙草脅迫響應相關基因的表達分析
3 討論
植物對逆境的耐受性是一個復雜的性狀,目前已經發現植物中有100多個基因參與逆境響應[30],為了提高作物對干旱、鹽堿和低溫等的耐受性,很多研究者將與逆境響應轉錄因子、滲透保護物質生物合成相關的基因等轉入植物,一定程度上提高了植物的耐逆能力[31-33]。然而人為干預植物逆境響應或調節基因表達,往往對植物的生長發育產生不同程度的影響,進而影響其產量和品質。利用蘇云金芽孢桿菌提高棉花抗棉鈴蟲能力的成功,為植物耐逆基因工程提供了新的思路。利用改造的微生物耐逆關鍵基因改良植物耐逆性是否會取得同樣的成功?目前,僅有零星利用微生物基因改良植物耐逆性的報道[34-35]。本研究中來源于耐輻射異常球菌,其表達受到輻射和干旱的強烈誘導[13],推測其編碼蛋白與DNA修復密切相關。PAN等[20]在大腸桿菌和油菜中表達,鹽耐受性均顯著提高,臨界鹽濃度350 mmol·L-1處理6周,轉基因油菜生長狀況良好,而野生型在鹽處理2周后死亡。本研究對進行植物密碼子優化,通過融合多個表達增強序列,利用葉盤法轉化煙草,轉錄水平和翻譯水平檢測均證明在轉基因煙草中表達。正常條件下,轉基因煙草與野生型長勢基本一致,說明導入不干擾轉基因植株的生長。然而,250 mmol·L-1NaCl和300 mmol·L-1甘露醇脅迫下,轉基因煙草對高鹽和干旱的耐受性均明顯高于野生型,說明可以提高植物耐鹽和耐旱能力。此外,前期預實驗證明,野生型煙草在臨界鹽濃度200 mmol·L-1NaCl處理2周后即全部死亡,說明按照植物密碼子優化的導入煙草后,可使轉基因煙草獲得比臨界鹽濃度更高的耐鹽性。
植物在逆境脅迫下,體內會產生大量的超氧根陰離子和過氧化氫,SOD可以清除超氧根陰離子,CAT清除過氧化氫,減少對細胞的傷害;MDA是生物體內膜脂過氧化的產物,反映了膜脂過氧化的程度,其值越高,細胞膜受傷害程度越深;這3個指標是反應植物細胞受傷害程度的重要指標[36-37]。通過對轉基因煙草SOD、CAT酶活性和MDA含量進行測定,發現正常生長條件三者含量(活性)水平和野生型之間沒有顯著差異,而干旱和鹽逆境下SOD、CAT酶活性顯著提高,MDA含量顯著降低,這一結果說明轉基因煙草的抗氧化能力顯著高于野生型,膜脂過氧化程度低于野生型,從而提高轉基因植物在逆境下的成活率,與奉斌等的研究結果一致[38]。其中,CAT活性比非轉基因煙草平均提高48.80%,SOD活性比非轉基因煙草平均提高88.55%,而轉細菌的油菜中CAT表達量比非轉基因油菜平均提高約40%,SOD表達量比非轉基因油菜平均提高約70%,說明轉優化的植物中的SOD和CAT表達量均高于轉細菌植物,優化的可使轉基因植物的清除活性氧能力更強。
耐逆基因的表達對植物耐逆性具有直接的指示作用。董仕波等[39]研究表明,可以通過提高Na+/H+轉運蛋白AtNHX1的表達,進而提高轉基因擬南芥的鹽脅迫耐受性。而在本研究中,實時熒光定量PCR結果證明轉基因煙草中,ABRE結合因子NtABF2、逆境誘導鋅指蛋白Ntzfp、鈣依賴蛋白激酶NtCDPK2、水通道蛋白NtLEA5表達量在鹽和干旱脅迫的條件下均顯著高于野生型,這些不同類型逆境響應基因的表達升高也暗示可能通過激活植物多種逆境響應提高植物的抗旱和耐鹽性。另外,本研究發現異源表達轉基因煙草種子萌發率在甘露醇和鹽逆境下顯著高于非轉基因對照。萌發率和成苗率往往存在直接的正相關,對于很多作物而言,干旱和鹽堿條件下,尤其是東部沿海鹽堿地和西北次生鹽堿地,種子萌發和成苗對于后期的產量具有決定性的作用。轉基因煙草逆境下萌發率的提高暗示對于鹽堿地作物改良具有較好的應用前景。
4 結論
根據植物密碼子優化耐輻射異常球菌并轉化模式植物煙草,轉基因煙草無論耐旱還是耐鹽能力均顯著提高,表現為在逆境條件下種子萌發率升高、苗期存活率提高、清除活性氧能力增強和多類逆境響應基因表達激活。推測可通過多種脅迫響應途徑正調控植物的耐鹽耐旱性。
中國農業科學院生物技術研究所林敏研究員提供了;周正富老師提供了相關資料并在研究過程中給予了幫助;陸偉老師提供了IrrE蛋白一抗。在此一并表示感謝!
[1] Li Z G, Duan X Q, Xiong M, Zhou Z H. Methylglyoxal as a novel signal molecule induces the salt tolerance of wheat by regulating the glyoxalase system, the antioxidant system, and osmolytes., 2017, 254(5): 1995-2006.
[2] Nakashima K, Yamaguchishinozaki K, Shinozaki K. The transcriptional regulatory network in the drought response and its crosstalk in abiotic stress responses including drought, cold, and heat., 2014, 5: Article 170.
[3] Liang C, Meng Z, Meng Z, Malik W, Yan R, Lwin K M, Lin F, Wang Y, Sun G, Zhou T, ZHU T, LI J Y, JIN S X, GUO S D. GhABF2, a bZIP transcription factor, confers drought and salinity tolerance in cotton (L.)., 2016, 6: 35040.
[4] Yu L H, Wu S J, Peng Y S, Liu R N, Chen X, Zhao P, Xu P, Zhu J B, Jiao G L, Pei Y, Xiang C B.EDT1/HDG11 improves drought and salt tolerance in cotton and poplar and increases cotton yield in the field., 2015, 14(1): 72.
[5] Yu T F, Xu Z S, Guo J K, Wang Y X, Abernathy B, Fu J D, Chen X, Zhou Y B, Chen M, Ye X G, Ma Y Z. Improved drought tolerance in wheat plants overexpressing a synthetic bacterial cold shock protein gene SeCspA., 2017, 7: 44050.
[6] 張銳, 王遠, 孟志剛, 孫國清, 郭三堆. 國產轉基因抗蟲棉研究回顧與展望. 中國農業科技導報, 2007, 9(4): 32-42.
Zhang R, Wang Y, Meng Z G, Sun G Q, Guo S D. Review and prospect of domestic transgenic insect-resistant cotton research., 2007, 9(4): 32-42. (in Chinese)
[7] Agapov A A, Kulbachinskiy A V. Mechanisms of stress resistance and gene regulation in the radioresistant bacterium deinococcus radiodurans., 2015, 80(10): 1201.
[8] Mattimore V, Udupa K S, Berne G A, Battista J R. Genetic characterization of forty ionizing radiation-sensitive strains of: linkage information from transformation., 1995, 177(18): 5232-5237.
[9] Udupa K S, O’Cain P A, Mattimore V, Battista J R. Novel ionizing radiation-sensitive mutants of., 1994, 176(24): 7439.
[10] Earl A M, Mohundro M M, Mian I S, Battista J R. The IrrE protein ofR1 is a novel regulator of recA expression., 2002, 184(22): 6216.
[11] Vujici?-Zagar A, Dulermo R, Le Gorrec M, Vannier F, Servant P, Sommer S, de Groot A, Serre L. Crystal structure of the IrrE protein, a central regulator of DNA damage repair in deinococcaceae., 2009, 386(3): 704-716.
[12] Lu H, Gao G, Xu G, Fan L, Yin L, Shen B, Hua Y.PprI switches on DNA damage response and cellular survival networks after radiation damage., 2009, 8(3): 481.
[13] Bauermeister A, Bentchikou E, Moeller R, Rettberg P. Roles of PprA, IrrE, and RecA in the resistance of, to germicidal and environmentally relevant UV radiation., 2009, 191(12): 913-918.
[14] Randi L, Perrone A, Maturi M, Dal Piaz F, Camerani M, Hochkoeppler A. The DnaE polymerase fromfeatures RecA-dependent DNA polymerase activity., 2016, 36(6): e00419.
[15] Alice D, Philippe G, Johnny L, Sophie Q C, Jean A, Suzanne S, Claire B T, Pascale S. PprA protein is involved in chromosome segregation via its physical and functional interaction with DNA gyrase in irradiatedbacteria., 2016, 1(1): e00036-15.
[16] Ludanyi M, Blanchard L, Dulermo R, Brandelet G, Bellanger L, Pignol D, Lemaire D, Groot A. Radiation response in: IrrE is a metalloprotease that cleaves repressor protein DdrO., 2014, 94(2): 434-449.
[17] Devigne A, Ithurbide S, Bouthier T C, Passot F, Mathieu M, Sommer S, Servant P. DdrO is an essential protein that regulates the radiation desiccation response and the apoptotic-like cell death in the radioresistantbacterium., 2015, 96(5): 1069-1084.
[18] 樂東海, 高冠軍, 華躍進. 耐輻射球菌在大腸桿菌中表達增強細胞抗氧化能力的研究. 微生物學報, 2004, 44(3): 324-327.
Le D H, Gao G J, Hua Y J.improved antioxidant capacity in., 2004, 44(3): 324-327. (in Chinese)
[19] 高加旺, 謝水波, 唐振平, 劉迎久, 劉金香, 唐東山. 奇球菌基因增強枯草芽孢桿菌細胞抗性的研究. 南華大學學報(自然科學版), 2010, 24(1): 78-82.
Gao J W, Xie S B, Tang Z P, Liu Y J, Liu J X, Tang D S.improvedcell resistance, 2010, 24(1): 78-82. (in Chinese)
[20] Pan J, Wang J, Zhou Z F, Yan Y L, Zhang W, Lu W, Ping S W, Dai Q L, Yuan M L, Feng B, HOU X G, ZHANG Y, MA R Q, LIU T T, FENG L, WANG L, CHEN M, Lin M. IrrE, a global regulator of extreme radiation resistance in, enhances salt tolerance inand., 2009, 4(2): e4422.
[21] 陳震, 周正富, 張維, 陳明, 宋淵, 林敏. 耐輻射異常球菌全局調控蛋白IrrE的研究進展. 生物技術進展, 2013, 3(3): 179-184.
CHEN Z, ZHOU Z F, ZHANG W, CHEN M, SONG Y, LIN M. Research progress of the global regulator IrrE in., 2013, 3(3): 179-184. (in Chinese)
[22] Guo B F, Guo Y, Hong H L, Jin L G, Zhang L J, Chang R Z, Lu W, Lin M,Qiu L J. Co-expression ofand glyphosate acetyltransferasegenes conferring high tolerance to glyphosate in soybean., 2015, 6: 847.
[23] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method., 2001, 25(4): 402-408.
[24] Kang C C, Yamauchi K A, Vlassakis J, Sinkala E, Duncombe T A, Herr A E. Single cell-resolution western blotting., 2016, 11(8): 1508.
[25] Perlak F J, Fuchs R L, Dean D A, Mcpherson S L, Fischhoff D A. Modification of the coding sequence enhances plant expression of insect control protein genes., 1991, 88(8): 3324-3328.
[26] Kim S, Kang J Y, Cho D I, Park J H, Kim S Y. ABF2, an ABRE-binding bZIP factor, is an essential component of glucose signaling and its overexpression affects multiple stress tolerance., 2004, 40(1): 75.
[27] Str?her E, Wang X J, Roloff N, Klein P, Husemann A, Dietz K J. Redox-dependent regulation of the stress-induced zinc-finger protein SAP12 in., 2009, 2(2): 357-367.
[28] Estelle M H, Catherine W M C, Michael G, Jeffrey F H, Jung H C, Nigel H, J?rg K, Sheng L, Hugh G N, Michael R S, Martine T, Kay W S, Zhu J K, ALICE C H. TheCDPK-SnRK superfamily of protein kinases., 2003, 132(2): 666-680.
[29] Salleh F M, Evans K, Goodall B, Machin H, Mowla S B, Mur L A, Runions J, Theodoulou F L, Foyer C H, Rogers H J. A novel function for a redox-related LEA protein () in root development and biotic stress responses., 2012, 35(2): 418-429.
[30] Seki M, Narusaka M, Abe H, Kasuga M, Yamaguchi- Shinozaki K, Carninci P, Hayashizaki Y, Shinozaki K. Monitoring the expression pattern of 1300 Arabidopsis genes under drought and cold stresses by using a full-length cDNA microarray., 2001, 13(1): 61.
[31] Kasuga M, Liu Q, Miura S, Yamaguchi-Shinozaki K, Shinozaki K. Improving plant drought, salt, and freezing tolerance by gene transfer of a single stress-inducible transcription factor., 1999, 17(3): 287.
[32] Zheng X, Chen B, Lu G, Han B. Overexpression of a NAC transcription factor enhances rice drought and salt tolerance., 2009, 379(4): 985-989.
[33] Yan H, Jia H, Chen X, Hao L, An H, Guo X. The cotton WRKY transcription factor GhWRKY17 functions in drought and salt stress in transgenicthrough ABA signalling and the modulation of reactive oxygen species production., 2014, 55(12): 2060.
[34] Holmstr?m K O, Somersalo S, Mandal A, Palva T E, Welin B. Improved tolerance to salinity and low temperature in transgenic tobacco producing glycine betaine., 2000, 51(343): 177-185.
[35] Castiglioni P, Warner D, Bensen R J, Anstrom D C, Harrison J, Stoecker M, Abad M, Kumar G, Salvador S, D'Ordine R, Navarro S, BACK S, FERNANDES M, TARGOLLI J, DASGUPTA S, BONIN C, LUETHY M H, HEARD J E. Bacterial RNA chaperones confer abiotic stress tolerance in plants and improved grain yield in maize under water-limited conditions., 2008, 147(2): 446.
[36] 尹永強, 胡建斌, 鄧明軍. 植物葉片抗氧化系統及其對逆境脅迫的響應研究進展. 中國農學通報, 2007, 23(1): 105-110.
Yin Y Q, Hu J B, Deng M J. Plant leaf antioxidant system and its response to stress response, 2007, 23(1): 105-110. (in chinese)
[37] Gill S S, Tuteja N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants., 2010, 48(12): 909.
[38] 奉斌, 代其林, 劉婷婷, 田霞, 龔元亞, 孫英坤, 王勁. NaCl脅迫對轉基因煙草抗氧化酶活性的影響. 吉林農業(學術版), 2010(6): 63-64.
Feng B, Dai Q L, Liu T T, Tian X, Gong Y Y, Sun Y K, Wang J. The influence of antioxidant enzyme activity intransgenic tobacco under NaCl treatment., 2010(6): 63-64. (in chinese)
[39] 童仕波, 文國琴, 林敏, 楊毅, 李樹峰. 轉耐輻射球菌基因提高擬南芥鹽脅迫耐受性的表型分析. 中國農業科技導報, 2010, 12(4): 90-94.
Tong S B, Wen G Q, Lin M, Yang Y, Li S F. Expression of irrE incan enhance salt tolerance of., 2010, 12(4): 90-94. (in chinese)
(責任編輯 李莉,岳梅)
Salt and Drought Tolerance in Heterologous-expression ofTransgenic Tobacco
ZHAO leilin, FAN xin, NIE xing, LIANG chengzhen, ZHANG Rui, SUN guoqing, MENG zhigang, LIN Min, WANG Yuan, GUO sandui
(Biotechnology Research Institute, Chinese Academy of Agricultural Sciences, Beijing 100081)
IrrE is a protein found in, and it process the transcription regulating function mainly through repairing DNA damage in conditions of strong radiations and other adverse environments. It is of great significance to study the tolerance of optimizedagainst drought and salt in transgenic plants and to lay a theoretical basis of crops resistance breeding.The bacteriacodons were optimized with the plant preferences and the gene was synthesized. efficient plant expression vector was constructed by using the method of enzyme digestion and connection. Leaf disc method was used for transforming tobacco, and the positive regenerated seedlings were screened with PCR. the expression level ofin transgenic strain was analyzed. the IrrE protein was tested using Western blot. pure transgenic generations were recruited and treated with the mannitol and NaCl treatments, which simulated drought and salt conditions. physiological tests were conducted to determine drought and salt tolerance.Thewas modified according to plant codes, and 241 codes were optimized. the efficient plant expression vector GBI-IE was constructed. the regenerated seedlings were screened by herbicide glyphosate, and 15 independent transgenic strains were obtained using PCR, and two highest expression lines, GO1 and GO2, were used for subsequent analysis of tolerance under adverse environmental conditions. Western blot proved that protein IrrE encoded in GO1 and GO2 could be translated correctly. Salt and drought tolerance of transgenic tobacco was analyzed. Germinating experiments displayed that there was no obvious difference between transgenic lines (GO1 and GO2) and non-GMO wild type (WT) in terms of germination rate in 1/2 MS culture medium, however, in medium containing 250 mmol·L-1NaCl, germination rate of GO1 and GO2 was 78.8% and 90.0%, respectively, while the one of the WT was 10.3%, increased by 68.5% and 79.7%, respectively. Similarly, germination rate of WT was 39.7% in medium containing 300 mmol·L-1mannitol, the rate of GO1 and GO2 increased by 42.9% and 50.8%, respectively. Normally germinated seedlings were transplanted into 250 mmol·L-1NaCl and 300 mmol·L-1mannitol environment for 12 days, and root length, lateral roots number and fresh weight of those two transgenic lines were markedly higher than the ones of WT. Tobacco seedlings of 30 days normal growth in the greenhouse were treated with 250 mmol·L-1NaCl of which transgenic tobacco SOD and CAT activity was more 48.80% and 88.55% than WT, respectively, and the MDA content was less 61.61% than WT, In addition, the expression level of drought responsive gene in GO1 and GO2, like,,,, was significantly higher than WT. Similarly, the changes of physiological and biochemical indexes in transgenetic lines in 300 mmol·L-1mannitol treatment were higher than the ones in WT.Expression offromremarkably improved the tolerance of tobacco to drought and salt stresses in which the pleiotropy could be beneficial gene resource of gene engineering about resistance to stress in plant.
codon optimization;; transgenic tobacco; drought and salt tolerance
2017-03-30;接受日期:2017-05-03
國家轉基因生物新品種培育科技重大專項(2016ZX08005-004)、國家“863”計劃(2013AA102601-2)
趙雷霖,Tel:010-82106129;E-mail:happy_lin92@163.com。通信作者王遠,E-mail:wangyuan07@caas.cn。通信作者郭三堆,E-mail:guosandui@caas.cn

