低強度脈沖超聲對不同鈦表面骨髓間充干細胞成骨分化的影響
宋巖 吳高義 王菁 陳磊 杜曉媛 邢曉濤 鄒姣姣 朱國雄
基礎醫學研究
低強度脈沖超聲對不同鈦表面骨髓間充干細胞成骨分化的影響
宋巖 吳高義 王菁 陳磊 杜曉媛 邢曉濤 鄒姣姣 朱國雄
目的觀察低強度脈沖超聲(LIPUS)對大鼠骨髓間充質干細胞(BMSCs)在鈦片表面成骨分化的影響。方法將體外培養的BMSCs分別接種于光滑鈦表面和大顆粒噴砂酸蝕(SLA)鈦表面,進行礦化誘導并實施超聲干預和假刺激。于礦化誘導后3、7 d進行堿性磷酸酶(ALP)定量檢測,14 d進行ALP染色觀察;礦化誘導21 d后行茜素紅染色;于礦化誘導14、21 d檢測成骨相關基因及蛋白表達。結果礦化誘導后3、7 d超聲組ALP活性較對照組高(P<0.05),14 d超聲組與對照組相比鈦片表面ALP染色明顯深染;茜素紅染色顯示,21 d后超聲組的染色更明顯且形成更多的礦化結節;超聲組的成骨相關蛋白成骨轉錄因子2、骨形成蛋白、骨橋蛋白表達增高;RT-PCR檢測到成骨相關基因、ALP、成骨轉錄因子2、骨形成蛋白、骨橋蛋白、骨鈣素、Ⅰ型膠原蛋白均有不同程度表達增高(P<0.05)。結論LIPUS可以促進光滑及SLA鈦表面BMSCs的成骨分化。
低強度脈沖超聲(LIPUS); 骨髓間充質干細胞(BMSCs); 成骨分化; 鈦表面
隨著口腔種植技術的發展,越來越多的焦點集中于如何縮短種植體的骨結合周期以及擴大種植修復的適應證[1-2]。低強度脈沖超聲(LIPUS)是一種安全、無創的治療手段,依靠超聲波能量作用于組織,能有效起到促進組織再生修復的效果[3]。骨髓間充質干細胞(BMSCs)是具有多向分化潛能的干細胞,其在種植體骨結合方面扮演著重要角色[4-5]。本研究旨在探討LIPUS作用于鈦表面生長的BMSCs,觀察其對BMSCs在鈦表面骨向分化的影響以及不同鈦表面BMSCs對超聲作用的生物學行為的差異。
1 材料與方法
1.1 主要材料和儀器
Wistar大鼠(山東大學實驗動物中心),鈦片(西北有色金屬研究所),低糖DMEM、DMEM/F12(Gibco,美國),胎牛血清(Hyclone,美國),抗壞血酸(a7631)、β甘油磷酸鈉(g9422)、地塞米松(D4902,sigma, 美國),Runx2一抗(CST,#12556),BMP2一抗(ab6285)、Osteopontin一抗(ab91655,Abcam,英國),堿性磷酸酶測定試劑盒(A059-2,南京建成),堿性磷酸酶(碧云天),茜素紅(索萊寶),超聲治療儀(Cosmogamma US13),掃描電鏡(S-4800,日立,日本),體式顯微鏡(SMZ745T,尼康,日本),酶標儀(Thermo scientific,美國)等。
1.2 試驗方法
1.2.1 BMSCs提取和原代培養 選用70~80 g左右wistar大鼠,過量水合氯醛處死,取其股骨并剔除肌肉組織,減去兩側骨骺,PBS沖洗骨髓腔,加入10%血清和1%雙抗的低糖DMEM培養基,放入37 ℃、5%CO2的培養箱中培養,3 d換液1 次,10 d左右傳代。
1.2.2 BMSCs成骨誘導 配制含0.1 μmol/L地塞米松、10 mmol/L β-甘油磷酸鈉、50 mg/L抗壞血酸的成骨誘導劑,加入含10%血清和1%雙抗的DMEM/F12培養基。取P3代細胞以2×104/ml的密度接種細胞,接種2 d后加入成骨誘導培養基,3 d換液1 次。
1.2.3 鈦試件的制備和觀察 將鈦片切割成10 mm×10 mm×1.0 mm和20 mm×20 mm×1.0 mm的樣本,20 mm×20 mm×1.0 mm試件用于RT-PCR和Western blot實驗,其他實驗使用10 mm×10 mm×1.0 mm試件,光滑鈦表面試件使用碳化硅砂紙逐級拋光至1 500目。用丙酮、無水乙醇、去離子水超聲清洗 10 min,干燥。大顆粒噴砂酸蝕鈦表面在以上處理后,使用筆式噴砂機和250 μm粒度氧化鋁對鈦試件噴砂,清洗后置入酸蝕液(180 ml/L HCl:490 ml/L H2SO4=1∶1)中,80 ℃下酸蝕30 min,清洗,干燥。掃描電鏡觀察鈦表面。
1.2.4 LIPUS處理 將試件分為4 組(n=5),光滑鈦表面組(FLAT組)、光滑鈦表面超聲組(Flat/LIPUS組)、大顆粒噴砂鈦表面組(SLA組)、大顆粒噴砂鈦超聲組(SLA/LIPUS組)在成骨誘導后行超聲刺激或假刺激。超聲強度:100 mW/cm2,頻率:1.0 MHz,空占比:10%,作用時間:10 min/d。
1.2.5 堿性磷酸酶(ALP)活性檢測 P3代細胞以2×104/ml的密度接種于鈦試件,成骨誘導后超聲干預,誘導3、7 d后吸取培養液,離心后取上清加入檢測試劑,酶標儀520 nm檢測吸光度A值,根據計算公式計算ALP活性(金氏單位/100 ml)=(測定A值-空白A值)/(標準A值-空白A值)×酚標準品濃度(0.02 mg/ml)×100 ml×樣品測定前稀釋倍數。
1.2.6 ALP染色 細胞培養和超聲處理同前,14 d終止培養,PBS清洗后4%多聚甲醛固定,根據說明書加入染色液,避光孵育1 h,蒸餾水洗滌,體式顯微鏡觀察。
1.2.7 茜素紅染色 細胞培養和超聲處理同前,21 d終止培養,PBS清洗后4%多聚甲醛固定,加入0.1%茜素紅溶液,37 ℃孵育3 h,清洗后置于體式顯微鏡觀察。
1.2.8 Western blot 細胞培養和超聲處理同前,分別于14 d和21 d終止培養后提取總蛋白,測定蛋白濃度后加入上樣緩沖液,配制SDS-PAGE,上樣后電泳,電泳完畢將蛋白轉至PVDF膜,脫脂奶粉封閉1 h,4 ℃孵育一抗過夜,孵育二抗1 h,顯色,拍照。
1.2.9 RT-PCR 細胞培養和超聲處理同前,分別于14 d和21 d終止培養,使用Trizol法提取RNA,測量RNA濃度,反轉錄后進行PCR反應,反應溫度為95 ℃,40 個周期,反應結束數據導入Graph Pad Prism 5。引物見表 1。

表 1 引物序列列表
1.3 統計學方法
采用SPSS 16.0軟件對數據進行統計學分析,組間比較進行方差齊性檢驗,然后進行方差分析,以P<0.05為差異具有統計學意義。
2 結 果
2.1 BMSCs形態學觀察
骨髓間充質干細胞在原代早期呈鳥嘴形和短梭形為主(圖 1A),在細胞增殖后細胞逐漸呈長梭形并呈旋渦狀生長。在傳代后細胞形態逐漸穩定,細胞均一性高,背景干凈(圖 1B)。
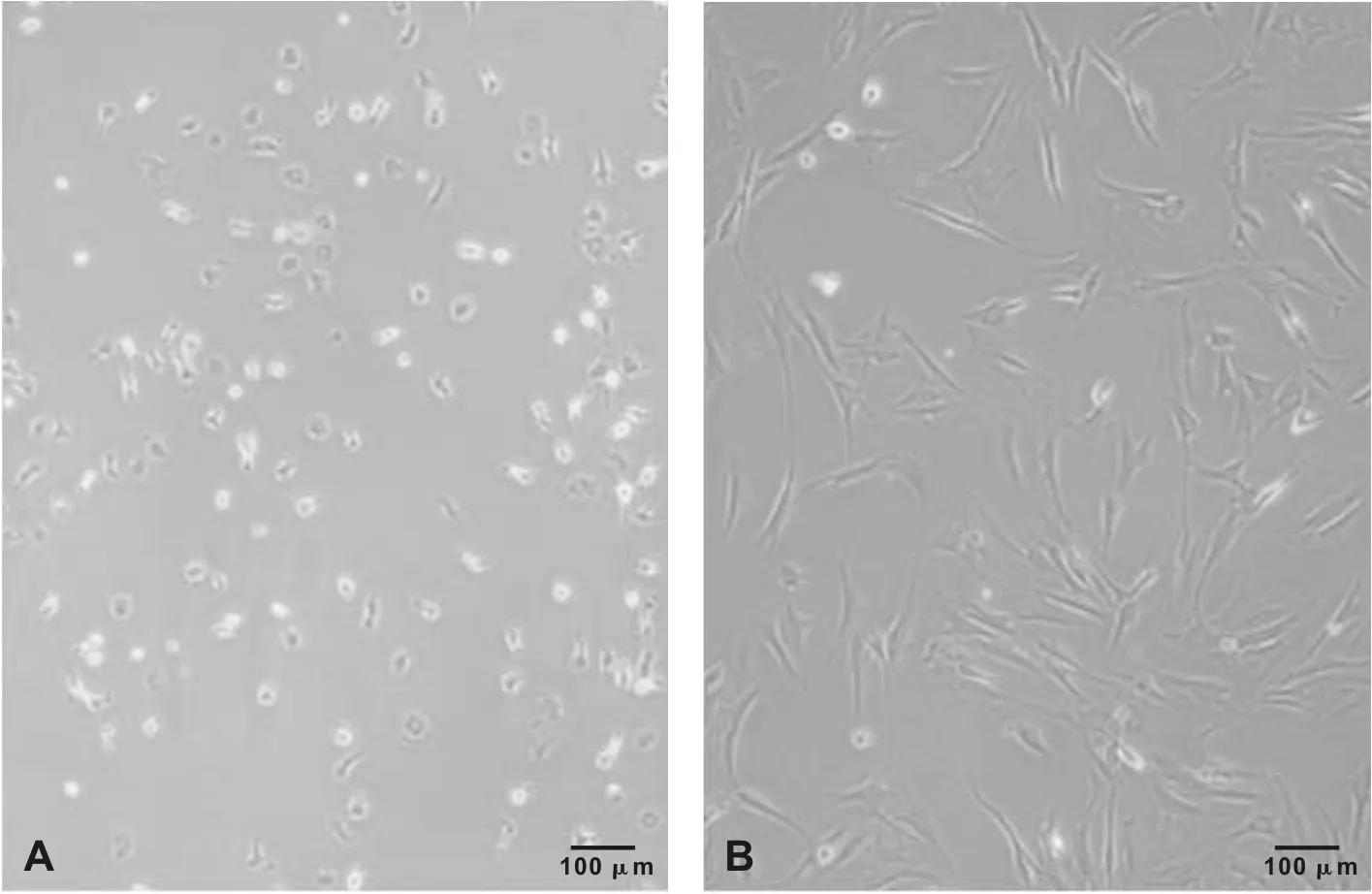
A: 原代BMSCs; B: 第3代BMSCs
2.2 鈦試件SEM觀察
光滑鈦表面在掃描電鏡下觀察表面呈微米級溝紋結構(圖 2A),大顆粒噴砂鈦表面表面呈大小不等的微孔結構(圖 2B)。
2.3 ALP活性檢測
在成骨誘導3 d和7 d,培養液上清行ALP活性檢測,在誘導3 d時SLA/LIPUS組中活性升高趨勢明顯(P<0.01)。在誘導7 d時超聲組ALP活性較對照組均有明顯升高(P<0.05)(圖 3)。

A: 光滑鈦表面; B: 大顆粒噴砂酸蝕(SLA)鈦表面
圖 2 鈦試件表面特征(SEM)
A: Flat surface; B: SLA treated surface
Fig 2 The surface characteristics of titanium specimens (SEM)
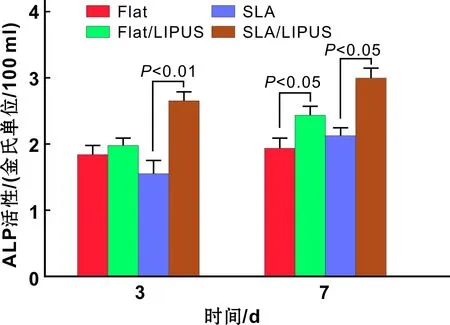
圖 3 ALP定量檢測
2.4 ALP染色觀察
成骨誘導2 周后ALP染色,在經過超聲處理后,實驗組較對照組均有更深的染色(圖 4)。
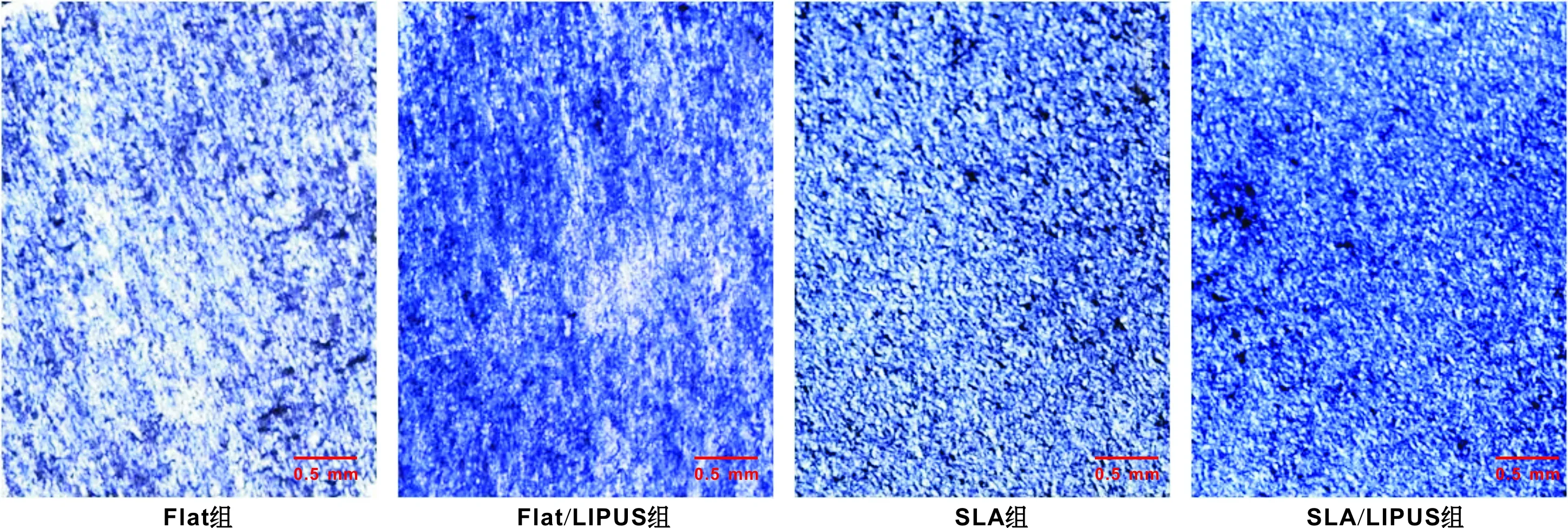
圖 4 成骨誘導2 周ALP染色
2.5 茜素紅染色
成骨誘導3 周后茜素紅染色,Flat/LIPUS組較Flat組的染色更深,出現更多的礦化結節(圖 5)。在SLA/LIPUS組的茜素紅染色較SLA組顏色更深。
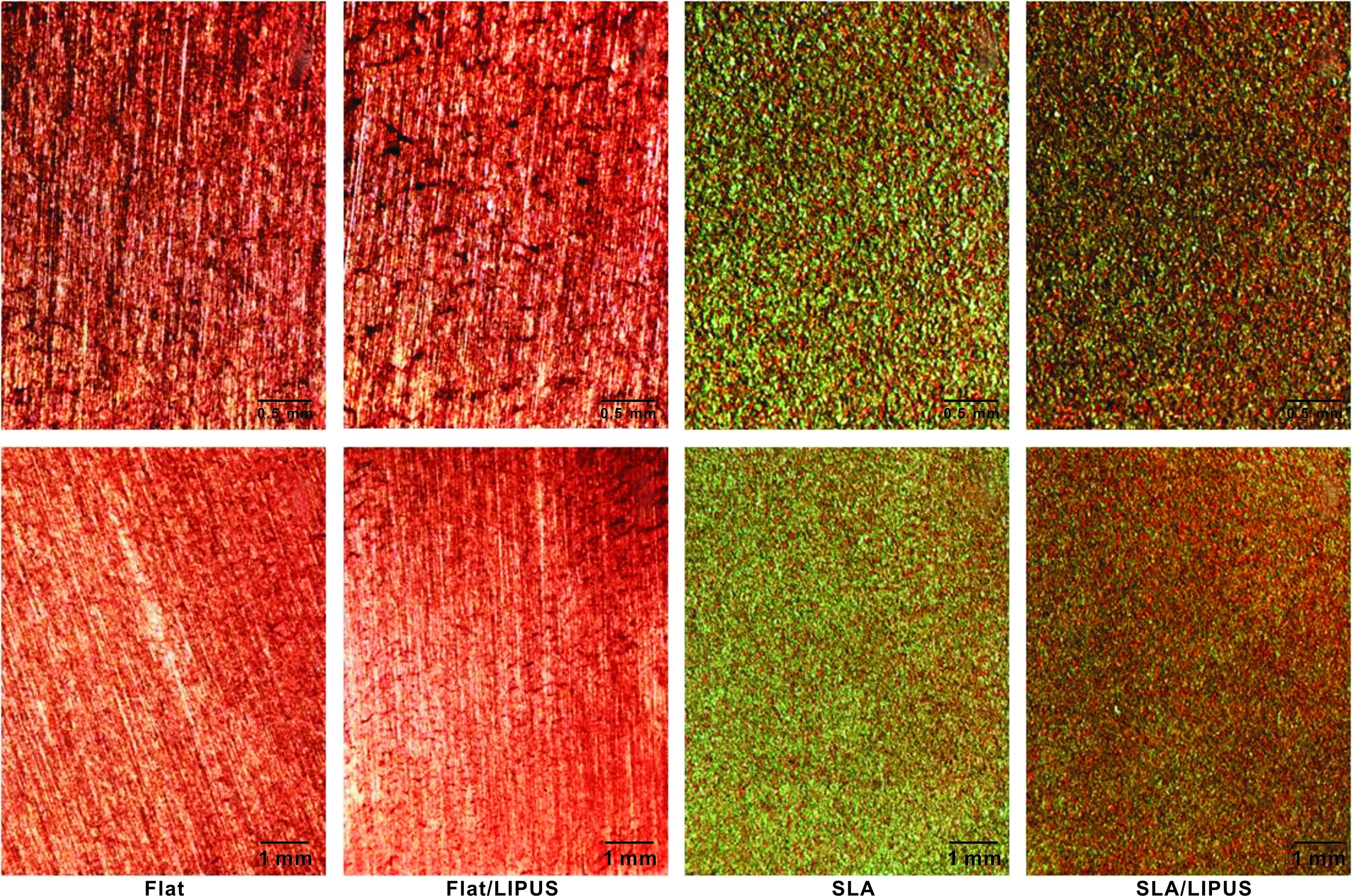
圖 5 成骨誘導3 周茜素紅染色
2.6 Western Blot結果
分別于成骨誘導2 周和3 周提取總蛋白進行western blot檢測,OPN、BMP2、Runx2的實驗組較對照組均有明顯變化(圖 6)。
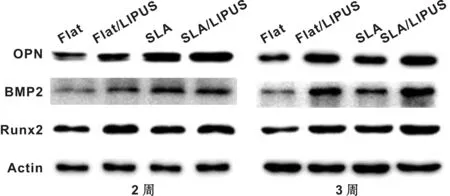
圖 6 成骨誘導2 周和3 周western blot結果
Fig 6 Results of western blot after osteogenic induction for 2 and 3 weeks
2.7 RT-PCR結果
ALP基因在成骨誘導2 周時,LIPUS組較對照組表達增高(P<0.05),顯示在誘導3 周時,FLAT/LIPUS組較FLAT組基因表達降低(P<0.05)。OCN基因在誘導2 周和3 周時LIPUS組較對照組增高(P<0.05),FLAT/LIPUS組在誘導3 周時尤為明顯(P<0.01)。OPN基因在誘導2周和3周時LIPUS組較對照組增高(P<0.05),FLAT/LIPUS組在誘導3 周時OPN增高明顯(P<0.01)。在誘導2 周和3 周后BMP2基因表達LIPUS組較對照組增高(P<0.05),在成骨誘導2 周時,LIPUS組Runx2表達高于對照組(P<0.05),誘導3 周時FLAT/LIPUS組基因表達較Flat組表達升高(P<0.05)。Col-1基因在成骨誘導2 周和3 周時,LIPUS組較對照組明顯增高,尤其FLAT/LIPUS組較Flat組升高更為明顯。LIPUS組較對照組Col-1基因表達明顯升高(P<0.01)(圖 7)。
3 討 論
超聲是一種安全、無創的治療方法,大量的動物和臨床研究研究表明頻率為0.5~1.5 MHz,強度為30~200 mW/m2的超聲干預會促進骨組織的愈合、骨沉積和生長[6-7]。以往的研究發現,超聲刺激能上調間BMSCs中成骨標志物和骨基質蛋白的表達,增加成骨細胞的形成。鈦具有良好的生物相容性和良好的機械性能,被廣泛應用于種植體的制造,機械拋光表面和大顆粒噴砂酸蝕表面是目前應用廣泛的鈦表面。Liu等[8]在新西蘭兔植入植體后使用超聲干預,結果顯示超聲縮短了骨結合出現的時間并形成更成熟的骨組織。Wu等[9]在放射性骨髓炎犬模型上植入植體并行超聲刺激后發現了類似的結果。Ganzorig等[10]在細胞實驗中發現,超聲放射可以增加不同金屬材料上成骨前體細胞ALP的分泌。
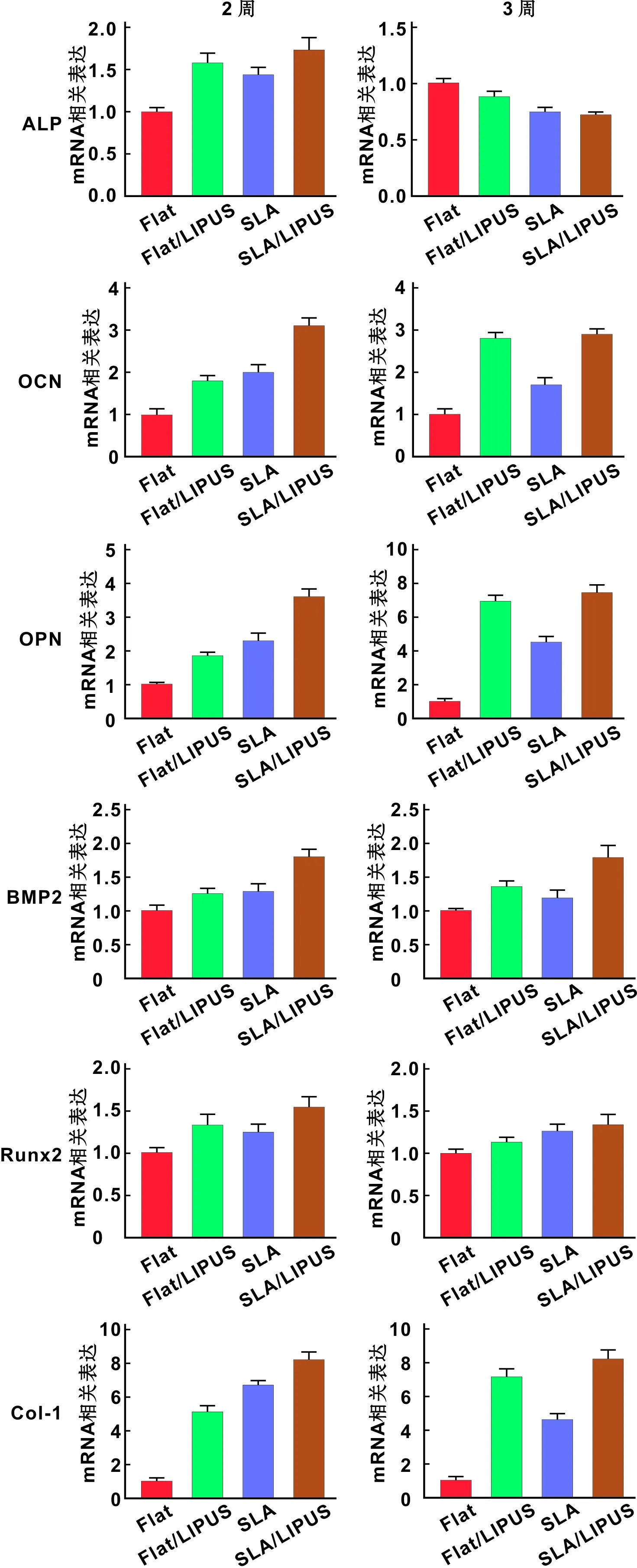
圖 7 成骨誘導2 周和3 周成骨相關基因的表達
Fig 7 Expression of osteogenic related genes after osteogenic induction for 2 and 3 weeks
本實驗中使用超聲對鈦表面上生長的BMSCs進行干預,觀察其對成骨分化的影響。ALP在細胞成為前成骨細胞和成骨細胞時出現,ALP活性被作為成骨細胞分化的標記[11]。本實驗對ALP活性以及ALP基因的表達進行檢測,并進行染色觀察,發現超聲組ALP活性相比于參照組有明顯增高。但在21 d時,RT-PCR顯示超聲組較對照組表達呈降低趨勢,因為ALP是成骨早期的代表標記,在骨成熟礦化期,由于基質中骨鈣素等與羥磷灰石沉積相關的基因表達增加,ALP活性下降。所以猜測實驗組的成骨成熟ALP下降。在21 d的茜素紅染色實驗證實了這一猜想,超聲組茜素紅深染且出現更多的礦化結節,而細胞礦化是新生骨生成的重要標志。
OCN和OPN作為非膠原蛋白是成熟成骨細胞的標志,OCN分泌到細胞外基質中與鈣磷離子結合形成羥基磷灰石,OPN蛋白在細胞黏附和礦化中起重要作用[12-13],在RT-PCR檢測中,超聲組OCN和OPN表達增強,在21 d時,超聲組OCN和OPN表達增強趨勢尤為明顯。在Western blot檢測中OPN蛋白的表達與RT-PCR的結果相吻合。BMP-2屬于TGF-β超家族,可以通過激活BMP/Smad信號通路引起下游Runx2的表達[14]。研究中超聲組BMP-2和RUNx2表達均成上升趨勢,尤其Runx2在14 d時表達增強趨勢明顯,而21 d時較14 d時趨勢下降但仍然高于對照組。Col-1在成骨細胞表型的發展和平衡中起重要作用,它可以促進種植體與骨組織的整合,其含量反映了骨成熟程度,在RT-PCR檢測顯示超聲組Col-1表達較對照組升高明顯。
在本實驗中選用2 種鈦表面,LIPUS對2 種鈦表面促進成骨方面未見明顯差異,但SLA表面相比于光滑鈦表面,早期礦化及成骨相關指標均高。研究表明鈦材表面的微結構可以增加成骨相關因子的分泌并增加成骨相關蛋白和基因的表達[15-17]。本實驗結果與之前研究結果相同,而SLA組在超聲刺激下成骨相關因素的增長率普遍比光滑鈦表面高,我們認為是SLA鈦表面的微結構增加了材料表面積,從而增加了對超聲刺激能量的吸收。
通過LIPUS對鈦表面生長的BMSCs的早期和后期礦化的影響,發現LIPUS可以促進BMSCs在鈦表面的成骨分化,縮短分化時間,為LIPUS應用于種植治療領域,縮短治療時間,提高不良種植病例的種植成功率提供基礎理論。
[1] Adell R, Eriksson B, Lekholm U, et al. Long-term follow-up study of osseointegrated implants in the treatment of totally edentulous jaws[J]. Int J Oral Maxillofac Implants, 1990, 5(4): 347-359.
[2] Gapski R, Wang HL, Mascarenhas P. Critical review of immediate implant loading[J].Clin Oral Implants Res, 2003, 14(5): 515-527.
[3] Claes L, Willie B. The enhancement of bone regeneration by ultrasound[J]. Prog Biophys Mol Biol, 2007, 93(1-3): 384-398.
[4] Gerstenfeld LC, Cullinane DM, Barnes GL, et al. Fracture healing as a post-natal developmental process: Molecular, spatial, and temporal aspects of its regulation[J]. J Cell Biochem, 2003, 88(5): 873-884.
[5] Colnot C, Huang S. Analyzing the cellular contribution of bone marrow to fracture healing using bone marrow transplantation in mice[J]. Biochem Biophy Res Commun, 2006, 350(3): 557-561.
[6] Sena K, Leven RM, Mazhar K, et al. Early gene response to low-intensity pulsed ultrasound in rat osteoblastic cells[J]. Ultrasound Med Biol, 2005, 31(5): 703-708.
[7] Hadjiargyrou M, McLeod K, Ryaby JP, et al. Enhancement of fracture healing by low intensity ultrasound[J]. Clin Orthop Relat Res, 1998, (355 Suppl): S216-229.
[8] Liu Q, Liu X, Liu B, et al. The effect of low-intensity pulsed ultrasound on the osseointegration of titanium dental implants[J]. Br J Oral Maxillofac Surg, 2012, 50(3): 244-250.
[9] Wu G, Chen L, Zhu G, et al. Low-intensity ultrasound accelerates mandibular implant bone integration in dogs with mandibular osteoradionecrosis[J].J Surg Res, 2013, 182(1): 55-61.
[10]Ganzorig K, Kuroda S, Maeda Y, et al. Low-intensity pulsed ultrasound enhances bone formation around miniscrew implants[J]. Arch Oral Biol, 2015, 60(6): 902-910.
[11]Hoemann CD, El-Gabalawy H, McKee MD.Invitroosteogenesis assays: Influence of the primary cell source on alkaline phosphatase activity and mineralization[J]. Pathol-biol(Paris), 2009, 57(4): 318-323.
[12]Huang J, Wang X, Zhang TL, et al. Alterations of ovariectomized rat bone and impact of non-collagenous proteins on mineralization[J]. Joint Bone Spine, 2009, 76(2): 176-183.
[13]Reichert JC, Quent VM, Burke LJ, et al. Mineralized human primary osteoblast matrices as a model system to analyse interactions of prostate cancer cells with the bone microenvironment[J]. Biomaterials, 2010, 31(31): 7928-7936.
[14]Karlsson L, Lindahl P, Heath JK, et al. Abnormal gastrointestinal development in PDGF-A and PDGFR-(alpha) deficient mice implicates a novel mesenchymal structure with putative instructive properties in villus morphogenesis[J].Development, 2000, 127(16): 3457-3466.
[15]Kieswetter K, Schwartz Z, Hummert TW, et al. Surface roughness modulates the local production of growth factors and cytokines by osteoblast-like MG-63 cells[J]. J Biomed Mater Res, 1996, 32(1): 55-63.
[16]Raines AL, Olivares-Navarrete R, Wieland M, et al. Regulation of angiogenesis during osseointegration by titanium surface microstructure and energy[J]. Biomaterials, 2010, 31(18): 4909-4917.
[17]劉智勇, 穆亞星, 楊海歐, 等. 成骨細胞在激光立體成形多孔鈦表面的附著、增殖及ALP活性[J]. 實用口腔醫學雜志, 2015, 31(5): 603-606.
TheeffectsoflowintensitypulsedultrasoundontheosteogeneticdifferentiationofBMSCsontitaniumwithdifferentsurfacetopography
SONGYan1,WUGaoyi2,WANGJing2,CHENLei2,DUXiaoyuan3,XINGXiaotao1,ZOUJiaojiao1,ZHUGuoxiong2.
1. 250000,JinzhouMedicalUniversityPostgraduateCultureBaseinGeneralHospitalofJinanMilitaryCommand,China; 2.DepartmentofStomatology,JinanGeneralMilitaryHospital; 3.DepartmentofPathology,TheFirstAffiliatedHospitalofJinzhouMedicalUniversity
Objective: To observe the effects of low intensity pulsed ultrasound(LIPUS) on the osteogenic differentiation of rat bone marrow mesenchymal stem cells(BMSCs)on titanium surface.MethodsBMSCs from Wistar rat bone marrow were respectively cultured on the flat titanium surface and the large grain blast acid etched(SLA) titanium surface, and induced by mineralization medium. Then, the cells were interfered by LIPUS and a control condition. Alkaline phosphatase(ALP) were quantitative determinated after 3 and 7 d mineralization induction respectively, ALP staining were observed after 14 d induction. Alizarin red staining were observed after 21 d mineralization induction. Osteogenic related protein and gene expressions were detected after mineralization induction.ResultsALP in culture medium of LIPUS group was higher than that of the control group after 3 d and 7 d mineralization induction(P<0.05). LIPUS group showed stronger ALP staining and alizarin staining, and more mineralized nodules than control group. The expression of osteogenic related proteins, including Runx2, BMP2, OPN in LIPUS group increased. Osteogenic related genes expression, including ALP, Runx2, BMP2, OPN, OCN and Col-1 of the LIPUS group increased.ConclusionThe osteogenic differentiation of BMSCs on the flat titanium surface or SLA titanium surface can be promoted by LIPUS.
LowintensityPulseultrasound(LIPUS);Bonemarrowmesenchymalstemcells(BMSCs);Osteogeneticdifferentiation;Titaniumsurface
國家自然科學基金(編號: 61471384, 81400573); 全軍衛生孵育計劃(編號: 15QNP019); 山東省科技發展計劃(編號: 2014GSF118101); 濟南市青年科技明星計劃(編號: 2013032)
250000, 錦州醫科大學濟南軍區總醫院研究生培養基地(宋巖 邢曉濤 鄒姣姣); 濟南軍區總醫院口腔科(吳高義 王菁 陳磊 朱國雄); 錦州醫科大學附屬第一醫院病理科(杜曉媛)
朱國雄 E-mail: jnjqzgx@163.com
R329.28
A
10.3969/j.issn.1001-3733.2017.04.001
(收稿: 2016-12-21 修回: 2017-01-13)

