生物材料的3D打印研究進展
, , , 鈺方
(上海理工大學 材料科學與工程學院,上海 200093)
生物材料的3D打印研究進展
朱敏,黃婷,杜曉宇,朱鈺方
(上海理工大學 材料科學與工程學院,上海200093)
在生物醫(yī)藥領域,通過對生物材料或活細胞進行3D打印,可構(gòu)建復雜生物三維結(jié)構(gòu)如個性化植入體、可再生人工骨、體外細胞三維結(jié)構(gòu)體、人工器官等,因而基于生物3D打印在個性化定制及復雜結(jié)構(gòu)調(diào)控制造上的獨特優(yōu)勢,綜述了生物3D打印技術(shù)的基本工藝、應用領域與研究進展.重點針對3D打印生物材料這一研究熱點,全面討論了噴墨打印和注射擠出打印兩種路徑,分析總結(jié)了3D打印相關生物材料并應用于體外模型、醫(yī)療器械和植入體的制造以及可降解組織支架、細胞三維結(jié)構(gòu)體的構(gòu)建,最后對該技術(shù)未來發(fā)展趨勢和研究重點提出展望.
生物材料;3D打印; 生物醫(yī)學應用; 研究進展
1 生物3D打印技術(shù)概述
3D打印技術(shù)(three-dimensional printing,3DP),又名快速成型、實體自由成型、增材制造等,是基于離散-堆積原理,在計算機輔助下通過層層堆積形成三維實體的有別于傳統(tǒng)減材制造的先進制造方法[1-2].因高精度、個性化制造及復雜形狀構(gòu)建上的獨特顯著優(yōu)勢,3D打印滲入了各行各業(yè)并引領創(chuàng)新,引發(fā)全球制造業(yè)產(chǎn)生革命性變革[3-6].
在生物醫(yī)藥領域,3D打印技術(shù)通過對生物材料或活細胞進行3D打印,可構(gòu)建復雜生物三維結(jié)構(gòu)如個性化植入體、可再生人工骨、體外細胞三維結(jié)構(gòu)體、人工器官等[7-9].以3D打印技術(shù)為基礎的組織工程支架和器官打印技術(shù)的發(fā)展[6]是目前3D打印技術(shù)研究的最前沿領域,也是3D打印技術(shù)中最具活力和發(fā)展前景的方向之一.當前以組織器官修復與重建為目的,國際上開發(fā)了各種生物3D打印技術(shù),包括用于組織工程支架構(gòu)建的熔融擠出技術(shù)、基于噴墨技術(shù)的細胞打印、細胞和細菌的激光直寫以及T細胞和細菌的微接觸印刷等[6-10].
生物3D打印涵蓋的內(nèi)容十分廣泛[11],根據(jù)打印材料的不同可將其劃分為4個層次的應用:
a. 個性化體外模型制造.材料為無需生物相容性和降解性的工程材料,主要為手術(shù)規(guī)劃、假肢設計、測試標準等制造體外的模型[12-13].
b. 個性化植入體制造材料.為具有良好生物相容性且不易降解的生物材料,如鈦合金[14]、聚氨酯類聚合物[15-16]等,用于制造人工假肢植入物、組織缺損部位支撐和替代,以及整形外科.
c. 可降解組織工程支架制造.針對組織工程應用,要求材料既具有良好的生物相容性又有匹配的降解性能,避免自體或異體組織移植中的問題.以支架模擬細胞外基質(zhì),相應細胞在支架上經(jīng)體外培養(yǎng)后植入體內(nèi),誘導組織再生與修復[17-18].
d. 細胞三維結(jié)構(gòu)體的人工構(gòu)建.材料為活細胞及其外基質(zhì)材料,如肝細胞-明膠、干細胞-膠原等,用于構(gòu)建三維細胞結(jié)構(gòu)體、體外三維細胞模型及組織或器官胚體等[19-22].
這4個層次的生物3D打印對生物醫(yī)學領域的基礎研究、藥物篩選和臨床應用都具有重要的促進作用.
通常,生物3D打印的實施包含3個步驟:(影像)數(shù)據(jù)獲取與三維模型設計、打印墨水(材料和細胞)選擇和組織構(gòu)架的3D打印工藝.
1.1(影像)數(shù)據(jù)獲取與三維模型設計
為實現(xiàn)打印組織或器官最終的功能性及復雜結(jié)構(gòu)的精確復制,在打印之前采用醫(yī)學影像檢查方法收集組織結(jié)構(gòu)和組成信息以構(gòu)建打印模型是至關重要的.最常見的兩種影像學手段是CT(計算機X射線斷層成像)和MRI(磁共振成像).牙科領域為獲得圖像數(shù)據(jù)還會使用錐形束計算機斷層掃描(CBCT).這3種技術(shù)均可獲得二維截面的解剖信息,通過專業(yè)軟件對系列截面的三維重構(gòu)建模即可得3D打印機接受的STL格式圖形文件,繼而最終制造出生物產(chǎn)品三維實體[23].
近十多年來,歐美等發(fā)達國家科研機構(gòu)對于醫(yī)學圖像三維重建技術(shù)的研究相當活躍,其技術(shù)水平正從后處理向?qū)崟r跟蹤和交互處理發(fā)展,并且已經(jīng)將超級計算機、光纖高速網(wǎng)、高性能工作站和虛擬現(xiàn)實結(jié)合起來,代表著這一技術(shù)領域未來的發(fā)展方向.在市場應用領域,如表1所示,目前已有多個較為成熟的商品化三維醫(yī)學影像處理系統(tǒng).

表1 常見商品化三維醫(yī)學影像處理與分析系統(tǒng)[24]Tab.1 Common 3D medical image analysis and processing systems
1.2生物材料打印墨水的選擇
基于生物應用指向的3D打印技術(shù),其打印材料組成與其他領域3D打印材料相比具有更多特殊要求.例如,高溫燒結(jié)、有機溶劑、紫外輻照和交聯(lián)劑等條件在生物3D打印過程中往往須盡量避免[25].具體來說,根據(jù)應用目的須考慮以下要求:
a. 可打印性.材料的黏度、流變和凝膠化等性能直接影響到3D打印的可操作性,決定打印制品的空間和時間分辨率[26].
b. 生物相容性.包含生物安全性和生物功能性.材料不僅要求很低的毒性及不引起機體的任何不良反應,而且也要求材料在特定的應用中激發(fā)機體的相應功能[27].
c. 降解性.包括材料的降解速度可控性、與組織再生速度的匹配性、降解產(chǎn)物安全性、材料的溶脹和收縮特性等[28].
d. 結(jié)構(gòu)與機械性能.3D打印的材料往往具有支撐細胞和組織三維結(jié)構(gòu)的作用.針對特定的組織類型,從皮膚、肌肉、軟骨到硬骨,材料打印后須具有不同的力學強度和微結(jié)構(gòu),尤其是材料的孔隙[29].
e. 仿生學特性.材料仿生學特性有利于刺激細胞響應.在生物材料中摻入生物活性組分可對內(nèi)源或外源細胞的粘附、遷移、增殖及功能表達產(chǎn)生積極作用[30-31].另外,材料表面性質(zhì)如化學基團的修飾、粗糙度、親疏水性、微納米結(jié)構(gòu)等直接影響到細胞的鋪展形狀、分化過程、運動、取向、細胞骨架的組裝,甚至是細胞內(nèi)部的相關信號通路[32].
1.3生物材料3D打印工藝
用于生物材料,包括材料/細胞復合體材料的3D打印技術(shù)手段主要有兩種類型:噴墨生物打印和注射式生物打印.兩者在打印產(chǎn)品的表面分辨率、細胞存活率以及生物活性材料選用等方面具有不同特點[7],其工作原理和技術(shù)方法如圖1所示.
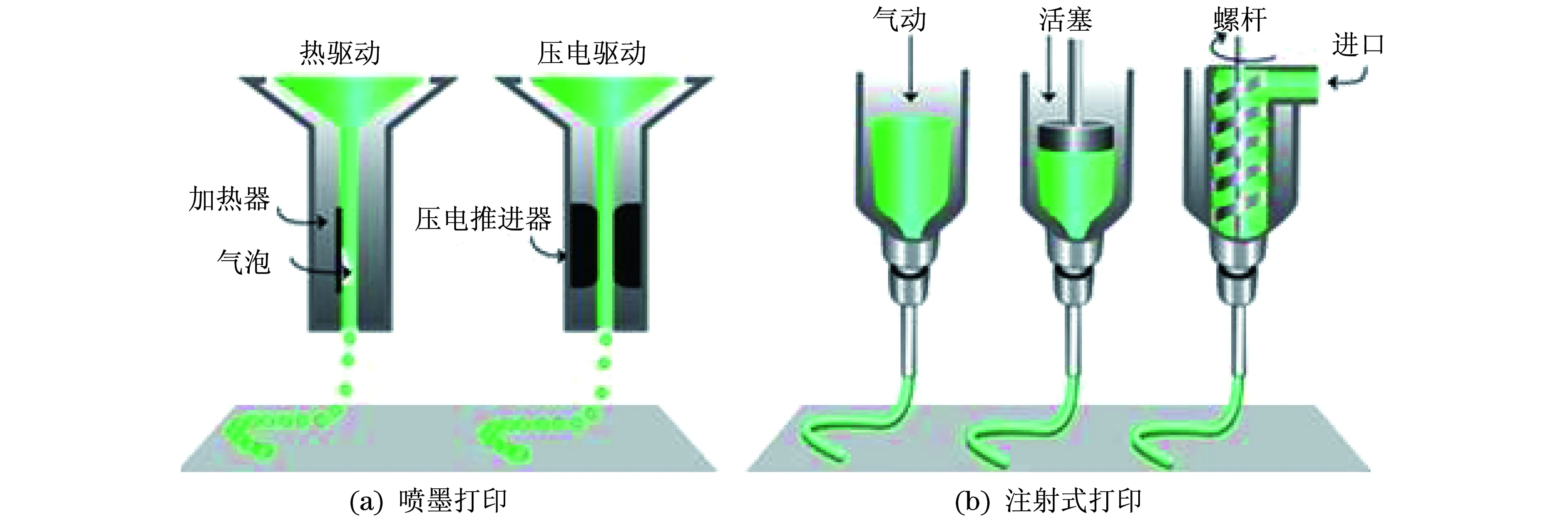
圖1 “生物墨水”的3D打印技術(shù)方法 [7]Fig.1 Two strategies of 3D-printing “Bioinks”
噴墨式3D打印機是目前生物3D打印領域最常見的打印機類型,可實現(xiàn)連續(xù)和按需噴射.實際上,3D噴墨打印機是從傳統(tǒng)的2D打印機發(fā)展而來,其原理差別不大,只是利用生物材料替代打印墨水,利用一個可升降的平臺替代紙張,是低成本和經(jīng)濟性的3D打印機.目前,多個研究團隊正致力于研究開發(fā)能夠?qū)崿F(xiàn)高分辨率和高精確度的含細胞液滴的3D打印,打印液滴體積可控制在1~300 pl,每秒噴射速度可在1~10 000滴范圍內(nèi)調(diào)節(jié),可以準確地打印成寬約50 μm的圖案[33-35].
目前,噴墨式3D打印機擠出墨水的方式有熱驅(qū)動和聲驅(qū)動兩種.熱驅(qū)動式打印噴頭通過局部電阻加熱產(chǎn)生氣泡,擠壓噴頭內(nèi)液體獲得液滴[36].這種熱泡擠壓打印噴頭盡管使用范圍較廣,打印速度較快,但是其在液滴方向、均勻性和尺寸控制上表現(xiàn)得不盡如人意,且噴射過程中產(chǎn)生的熱應力、噴頭堵塞、細胞裸露等問題往往對打印產(chǎn)生不利影響.為克服以上問題,可通過壓電器件的逆壓電效應造成材料變形,使噴頭內(nèi)液體體積和壓力發(fā)生變化而擠出液體.聲驅(qū)動打印噴頭以聲波配合超聲場來噴射液滴,擠壓出的液滴大小和擠壓速度可由超聲強度、時間、脈沖等參數(shù)實現(xiàn)控制[37].噴墨式3D打印在擠出墨水時產(chǎn)生的剪切力容易對細胞造成損傷,而且要求擠出的材料必須是液態(tài)的形式,極大地限制其應用[38].因此,提高噴墨式3D打印細胞存活率及優(yōu)化打印工藝仍然面臨挑戰(zhàn).
與噴墨式生物3D打印相比,注射式生物3D打印直接采用壓縮空氣或通過壓縮空氣直線電動機推動的活塞將注射筒中的材料連續(xù)擠出,對于黏度較大的“生物墨水”的打印優(yōu)勢更為明顯[33].目前已有文獻報道的注射式3D打印材料種類相當豐富,黏度范圍30~6×107mP·s,可同時涵蓋打印所需的高強度支撐材料和低黏度含活細胞材料[39-43].注射式的噴頭設計可處理高濃度的細胞懸浮液,具有構(gòu)建高細胞濃度的組織和器官的潛能[44].含多種細胞的細胞團在被擠出沉積后得到的細胞團聚體,在一定程度上具有了類似細胞外基質(zhì)材料的力學性能和功能,因而可作為自組裝的單元在粘彈性能驅(qū)動下發(fā)生融合和自組裝,形成3D結(jié)構(gòu)[45].這種細胞團自組裝打印技術(shù)對器官打印時內(nèi)部血管網(wǎng)絡的構(gòu)建具有獨到之處[46].
2 生物3D打印的應用領域
2.1診斷與手術(shù)規(guī)劃
近年來,醫(yī)學方面的3D打印技術(shù)發(fā)展主要在于繼續(xù)發(fā)展醫(yī)療成像技術(shù)、開發(fā)虛擬外科手術(shù)規(guī)劃工具、生產(chǎn)針對特殊患者的器械以及可以直接植入人體的金屬植入物等. 3D打印的模型提供直觀的、可觸摸的信息,有效地提高診斷和手術(shù)水平,便于醫(yī)生與患者之間的溝通,避免了可能的醫(yī)患矛盾.國內(nèi)外臨床醫(yī)學領域已有多例借助3D打印技術(shù)進行術(shù)前規(guī)劃和模擬的事例.例如2015年,美國心血管外科醫(yī)生通過3D打印精細還原一例“完全型肺靜脈畸形引流”的心臟模型,成功實施一個細節(jié)清晰、過程復雜的矯正手術(shù).
3D打印還可制作精準貼合的術(shù)中導航模板,主要應用在顱頸交界、上頸椎、上胸椎、脊柱側(cè)彎、腫瘤等手術(shù)上[12].臨床上因為這些區(qū)域較復雜,手術(shù)風險、難度大,通過3D打印導航模板來指導手術(shù)會大大增加其安全性[47-48].例如華山醫(yī)院利用3D打印手部手術(shù)導板實現(xiàn)輔助舟狀骨骨折精確經(jīng)皮內(nèi)固定手術(shù).
2.2個性化體外模型制造
牙冠、內(nèi)冠固定橋金屬修復體以及可摘局部義齒的金屬支架等,其形狀精細、復雜,要求精度誤差要控制在微米級.傳統(tǒng)的金屬修復體制作工序復雜,需要數(shù)次模型的澆筑、復制,尤其是蠟型的制作只能依賴于技工手工完成,效率和精度低[49].為解決上述問題,近年來出現(xiàn)了口腔金屬修復體蠟型直接3D打印成形的方法.目前,加拿大Cynovad公司用于義齒修復體數(shù)據(jù)采集和蠟型制作的Pro50數(shù)字制造系統(tǒng)、美國Solidscape公司preXacto系列以及3D Systems公司ProJet系列三維蠟型打印機就是其中的佼佼者.用陶瓷材料替代金屬進行3D打印制作口腔修復體是該領域的主流趨勢,也是21世紀牙科修復的發(fā)展方向[50].3D打印陶瓷修復體所采用的陶瓷材料除目前臨床常用的IPS Empress鑄造陶瓷和氧化鋁陶瓷外,氧化鋯結(jié)構(gòu)陶瓷材料因強度高、韌性好而被廣泛研究.例如Ebert等[51]利用噴射噴頭進行了氧化鋯牙冠的直接噴墨打印成形,打印的成品陶瓷件的咬合面細節(jié)清晰,壁厚可小至100 μm,強度可高達1 200 MPa.當采用多噴頭打印,還可以成形具有空腔結(jié)構(gòu)的整個牙冠和支架.
基于3D打印技術(shù)的假肢制造也為截肢者和醫(yī)生帶來了全新的高度定制化.例如,Bespoke公司采用3D打印技術(shù)設計制造假肢,通過對患者“健康”的腿和他們目前假肢的掃描,并進行掃描數(shù)據(jù)建模以確定肢體能夠保持身體對稱,從而打印出與患者的身體和生活方式充分吻合并迎合審美的假肢[52].
2.3個性化植入體制造
目前,國內(nèi)外已有報道開始臨床使用的3D打印植入體仍多應用于硬組織和關節(jié)替代或修復.通常骨內(nèi)植入物剛度過高會產(chǎn)生應力遮擋,自體骨與原松質(zhì)骨得不到合適的力學刺激,從而引起植入物的松動;而剛度過低又會使植入物斷裂,欠缺力學強度.利用3D打印技術(shù)能通過不同人的骨模量來制造個體化植入物,各種生物力學均與人體相近,因而具有廣闊的應用前景和傳統(tǒng)技術(shù)不可比擬的優(yōu)勢[48].更具體地來說,3D打印的人工骨在組成、形狀、結(jié)構(gòu)等方面可控,與病灶或缺損能夠準確匹配,產(chǎn)生與人體組織相似的生物學特性,有效避免了并發(fā)癥的出現(xiàn),如植入物的沉降、塌陷甚至臨近組織的退變[53].3D打印的人工骨可以制作豐富多變的孔隙結(jié)構(gòu),使得打印骨與自體骨通過孔隙牢固結(jié)合,大大縮短康復時間.北京三院的劉忠軍等率先嘗試了在頸椎、脊柱原發(fā)惡性腫瘤患者體內(nèi)直接植入3D打印的人工椎體和人工骨骼,取得了不錯的效果[54].該團隊在2016年成功為一名骨科脊索瘤患者切除五節(jié)段脊椎腫瘤,并利用世界首個3D打印多節(jié)段胸腰椎植入物完成長達19 cm大跨度椎體重建手術(shù).
從材料上來說,金屬鈦、生物陶瓷及其復合材料,尤其是功能性梯度材料都可以3D打印制作骨植入物.3D打印通過對多種材料的組合,對構(gòu)成的局域要素(如組分的組成和分布、微結(jié)構(gòu)、孔隙率、物性參數(shù))的控制,乃至在多個特定方向上材料功能及特性的(準)連續(xù)性變化,可充分滿足工件各部位不同的特性要求[25].例如,常見牙種植體要求由生物金屬(Ti或不銹鋼)和生物陶瓷(HA)組成,體部即下端100%金屬,臺部即上端100%陶瓷,而兩者之間沿種植體垂直方向具有連續(xù)的梯度成分變化[55].3D打印個體化的鋼板、鋼釘?shù)葍?nèi)固定物一直被設想,但由于工藝和技術(shù)上極大的困難目前仍未見報道.
除骨內(nèi)或關節(jié)植入體外,美國密歇根大學于2013年運用3D打印技術(shù)制造了用于治療氣管支氣管軟化癥的夾板,成功挽救3名嬰幼兒的生命.該夾板采用可隨時間變形的PCL材料,能夠被人體吸收并再生出相關組織和細胞[56].如圖2所示,圖(a)是病患在夾板植入前的氣管最小密度投影成像;圖(b)表示計算機復制設計為病患量身定制的夾板模型(紅色);圖(c)和圖(d)則是三維打印的氣管夾板;圖(e)和圖(f)是在病患左主支氣管軟化段處手術(shù)植入打印的氣管夾板;圖(g)顯示了夾板植入手術(shù)后1年的氣管擴張情況.

圖2 三維打印氣道夾板 [56]Fig.2 3D printing of airway clamp
2.4再生醫(yī)學
傳統(tǒng)組織再生和損傷修復的方法包括了自體移植、異體移植與人工合成產(chǎn)品的替代3條途徑[57].然而,來源有限、免疫排斥、生物相容性差等問題極大地限制了這些方法的應用,難以真正達到修復或長期替代的效果.組織工程技術(shù)適時出現(xiàn),給組織再生與修復帶來新的生機.常見基于生物材料支架的組織工程方法原理是,在體外要首先制作模仿組織器官形狀結(jié)構(gòu)的多孔支架,然后再結(jié)合種子細胞形成復合物植入體內(nèi)進一步增殖、分化[58].其中,多孔組織工程支架的制作是至關重要的一步.
組織工程用支架是一種多孔隙三維結(jié)構(gòu)體,它要求有合適的孔隙尺寸和高連通的孔道結(jié)構(gòu),以提供細胞足夠和連續(xù)的生長通道,同時也保證了水分、無機鹽、營養(yǎng)物質(zhì)和排泄廢物的流通.很多已經(jīng)發(fā)展的支架制備方法有溶液澆注/顆粒濾取法、氣體發(fā)泡法、纖維編織法等,但這些方法的共同問題是難以對支架孔隙的形狀、大小、連接形態(tài)、空間分布等進行有效的精確控制,不能滿足組織工程對支架的復雜結(jié)構(gòu)要求,不能使不同細胞在支架的空間結(jié)構(gòu)中準確定位等[59-60].3D打印技術(shù)的高度靈活性和可定制性恰好能夠解決上述問題,并且在材料打印同時可將各種生長因子、蛋白質(zhì)乃至細胞混合至支架結(jié)構(gòu)中.因此,3D打印在組織工程技術(shù)尤其是組織工程用支架構(gòu)建上體現(xiàn)出無可比擬的優(yōu)勢[61].
目前,3D打印技術(shù)應用于組織工程再生/修復的組織包含骨、軟骨、神經(jīng)、肌肉、血管等,并且已經(jīng)取得了較為理想的研究成果,對臨床應用展現(xiàn)出極大的潛力.
2.4.1骨修復
骨組織修復支架的3D打印是目前研究深入、發(fā)表成果最多的生物3D打印應用,不同結(jié)構(gòu)與組成的骨修復支架被打印出來.例如,Castilho等[62]通過擠出式3D打印制備了孔徑在100~1 000 μm范圍內(nèi)可精確調(diào)控的TCP/HA復合陶瓷支架,準確度可達96.5%.Serra等[63]采用PLA/磷酸鈣的有機無機復合材料,以擠出3D打印方式制備了四方和雙層交錯結(jié)構(gòu)的多孔支架,研究結(jié)果表明結(jié)構(gòu)上細微的差異就能導致迥異的生物力學性能.Almeida等[64]按照同樣的打印參數(shù)分別3D打印了PLA和殼聚糖支架,在植入家兔體內(nèi)后考察了兩者的免疫應答與炎癥反應情況,結(jié)果與支架的組成和結(jié)構(gòu)均息息相關.Jakus等[65]采用擠出式3D打印制備含有90%HA和10%PCL或PLGA的彈性人工骨,彈性應變達32%~67%,彈性模量4~11 MPa可調(diào);植入老鼠體內(nèi)35天后的生物相容性良好,8周內(nèi)新骨生成,體內(nèi)實驗沒有顯示負面的免疫反應,血管生成并與周圍組織很好地結(jié)合.Tumbleston等[66]在Science發(fā)表封面文章,介紹了一種革命性的3D打印技術(shù)——連續(xù)液面生產(chǎn)技術(shù),這項技術(shù)成千倍地提高了傳統(tǒng)3D打印的速度和精度,因而對復雜且細節(jié)豐富的組織修復支架的打印具有巨大的優(yōu)勢.
2.4.2軟骨修復
軟骨組織的自我再生和愈合能力有限,結(jié)合支架材料、干細胞和相關因子的組織工程技術(shù)是目前最具潛力的軟骨缺損修復手段[67].Lee等[68]通過混合打印技術(shù),以PEG作為支撐材料,能夠打印具有復雜外形的軟骨修復支架特殊結(jié)構(gòu),如碗狀、倒金字塔狀等,因而可直接用于耳朵、鼻子等軟骨組成器官的修復.另外,軟骨細胞、脂肪細胞同時與材料進行打印后,體外培養(yǎng)顯示出良好的存活率以及成軟骨和成脂肪性能.
用于打印軟骨修復支架的生物材料目前常為海藻酸鹽、殼聚糖、透明質(zhì)酸等生物相容的水凝膠[69-70],但是水凝膠材料缺乏較高的機械強度,真正實現(xiàn)應用具有一定的困難.Hutmacher等[59]結(jié)合熔體靜電紡絲和3D打印技術(shù),制備出了超細纖維網(wǎng)絡增強的蛋白聚糖水凝膠,具有與人類膝關節(jié)軟骨類似的強度和韌性.這種增強水凝膠可以很好地支持人類軟骨細胞的生長和軟骨三維組織的形成,因而有望用于乳房組織和心臟瓣膜組織的重建.Hung等[72]合成了水溶性PU彈性納米粒子并與透明質(zhì)酸混合打印多孔支架,而且還可在支架打印過程中添加生物活性分子或替代小分子藥物.該支架可實現(xiàn)活性分子的持續(xù)可控釋放,誘導MSCs細胞向成軟骨方向分化并抑制新生軟骨過度生長,能有效地修復兔子關節(jié)軟骨缺損.
2.4.3神經(jīng)修復
運用組織工程手段進行神經(jīng)再生的過程中,仿生支架的結(jié)構(gòu)和組成可構(gòu)建出具有不同動態(tài)功能的細胞微環(huán)境,從而影響到體內(nèi)神經(jīng)干細胞(NSCs)的命運[73].通過3D打印技術(shù)靈活打印不同結(jié)構(gòu)支架,可模擬細胞外基質(zhì)并滿足神經(jīng)再生和修復的支架結(jié)構(gòu)要求[73].Wüst等[74]通過不同3D打印路徑在長方體支架中分別構(gòu)造出了L,T,S,U和X形通道,系統(tǒng)研究了各種通道曲線上的材料聚集情況、神經(jīng)干細胞在不同形狀的凹槽和通道內(nèi)具有的遷移、增殖和分化特性,為闡明神經(jīng)修復機制提供技術(shù)基礎.Wong等[75]研究了支架內(nèi)部結(jié)構(gòu)對大腦皮質(zhì)損傷修復的影響,如圖3所示.以聚己內(nèi)酯為材料,3D打印了內(nèi)部含有縱向微溝單向通道及水平與垂直方向正交叉通道的圓柱體支架(圖3(a)~(i)).結(jié)果表明,兩種支架分別植入大鼠的大腦皮質(zhì)缺損部位,如圖3(j)中4周后組織再生情況和圖3(k)中蘇木精-伊紅染色照片顯示,正交叉形支架中向內(nèi)生長的組織總量與星形細胞的滲透率均明顯增高.

圖3 3D打印含內(nèi)部通道支架用于大腦皮質(zhì)損傷修復[75]Fig.3 Scaffolds with channels and microgrooves manufactured by 3D printing technique for brain cortex regeneration
另外,3D打印定制硅膠導板可應用于幫助受損的復雜神經(jīng)再生其感覺和運動功能.通過3D打印設計定制導板,賦予導板物理和化學誘導因素(包括溝槽設計和生物化學組份的添加),已成功應用于老鼠的坐骨神經(jīng)結(jié)構(gòu)缺損修復,促進了其運動和感覺神經(jīng)的再生[76].
2.4.4心血管修復
3D打印技術(shù)在心血管研究和應用方面具有重要價值.目前在組織工程心肌、組織工程心臟瓣膜、組織工程大血管及血管網(wǎng)的構(gòu)建上都已有突破性進展,3D打印方案也逐漸完善,其應用已從實驗室研究走向臨床應用.
心肌組織:Petrochenko等[77]采用激光燒結(jié)3D打印技術(shù),使用生物可降解脲烷和丙酸鹽基材料打印出心肌組織材料,材料表現(xiàn)出良好的可塑性、彈性及生物活性,有利于骨髓干細胞生長.Pati等[78]采用液滴材料,3D打印出質(zhì)地與大腦脂肪類似的網(wǎng)狀細胞外基質(zhì),打印的液滴大小約與5個心肌細胞相當,因此打印出的組織結(jié)構(gòu)整體性和精細度大大提高.
血管:構(gòu)建大血管與毛細血管也是組織工程中的重要方面[79].大血管可提供管腔結(jié)構(gòu),血液通過官腔結(jié)構(gòu)運輸至靶器官[80].毛細血管的構(gòu)建能改善血液微循環(huán),更好地實現(xiàn)血細胞的功能[81].Lee等[80]以水凝膠、膠原和臍帶靜脈血內(nèi)皮細胞為材料,3D打印出直徑為1 mm、長5 mm、具有血管動力學特性和功能的微血管床模型.研究結(jié)果表明臍帶靜脈血內(nèi)皮細胞可自然生長和增殖,并形成血管分支結(jié)構(gòu),實現(xiàn)小血管微循環(huán)、靶器官的血液供應等功能.Miller等[82]利用可去除的糖玻璃為原料進行3D打印纖維網(wǎng)絡支架,可用于進行血管內(nèi)皮細胞的灌注以形成血管網(wǎng)絡,如圖4所示.由圖4(a)和(b)可見,3D打印的糖玻璃纖維支架具有可控的網(wǎng)絡結(jié)構(gòu),各打印纖維相交處易融合形成連通交聯(lián).圖4(c)和(d)顯示了活細胞灌注至纖維支架中之后的發(fā)展情況,紅色表示沿空管腔分布的血管內(nèi)細胞,綠色表示支架網(wǎng)格之間灌注的成纖維細胞.Zhao等[83]以3D打印技術(shù)構(gòu)建具有內(nèi)連接通道的生物降解聚合物骨架結(jié)構(gòu),再將脂肪干細胞引入骨架結(jié)構(gòu),誘導脂肪干細胞分化成為內(nèi)皮細胞和平滑肌細胞,從而形成血管.
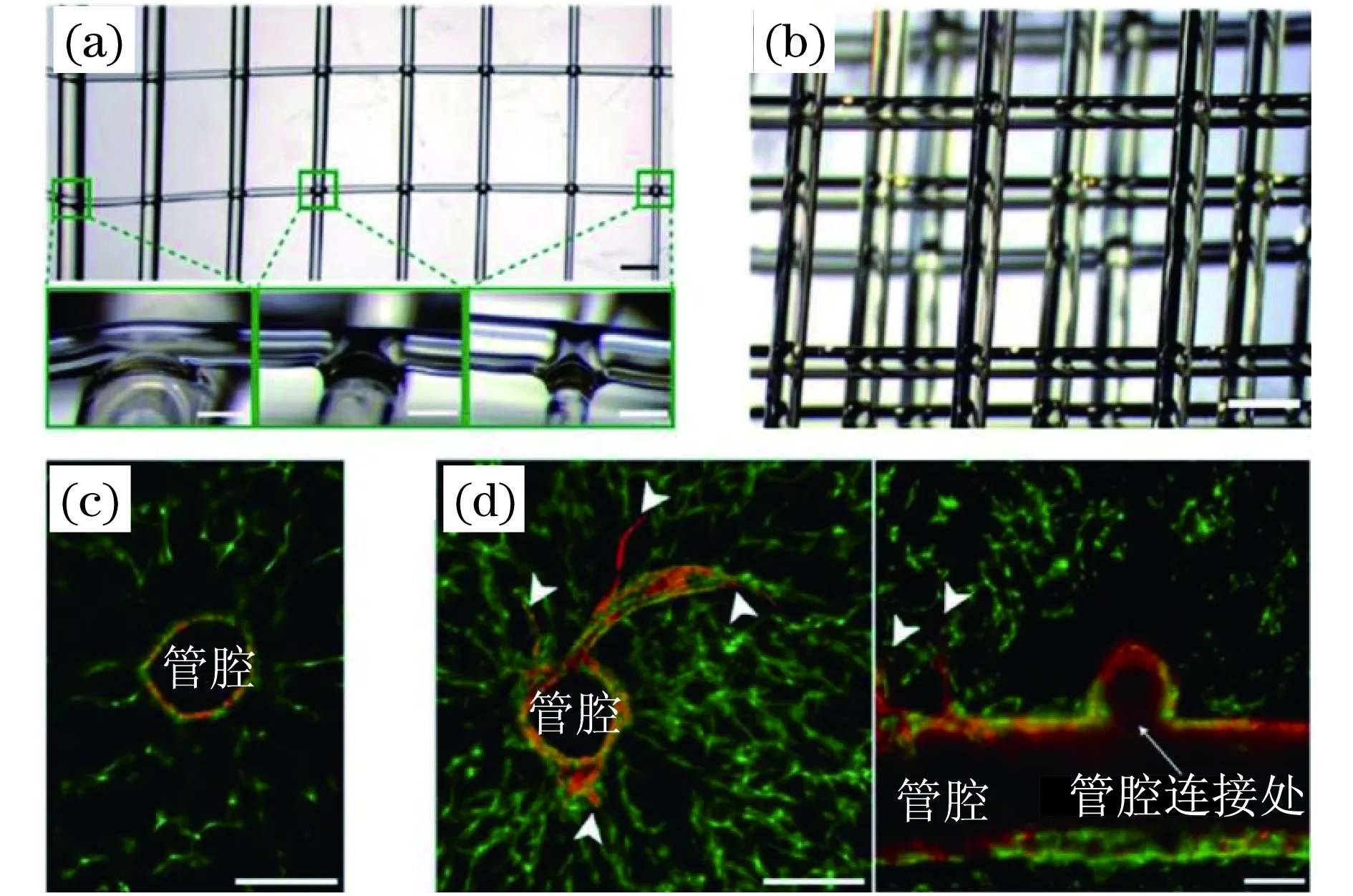
圖4 3D打印的糖玻璃支架用于血管內(nèi)皮細胞灌注成型三維組織[82]Fig.4 3D printed vascular networks for endothelialization and perfusable engineered extravascular tissues
多樣化心臟瓣膜:Lueders等[84]以心臟半月瓣為模型研究了其在3D打印中的熱力學、材料學特性及移植細胞的功能,發(fā)現(xiàn)3D打印構(gòu)建心臟瓣膜的主要影響因素取決于瓣膜骨架材料和種子細胞種類.其中,瓣膜骨架材料的韌性、耐久度等達到長期的心臟瓣膜活動時具備的功能結(jié)構(gòu).因此,與3D打印血管結(jié)構(gòu)相比,心臟瓣膜的3D打印在材料和打印方式上均有較高要求.
2.5個性化藥物緩釋裝置
為克服傳統(tǒng)藥劑效率低下、副作用大、作用時間短等缺陷,緩釋型給藥系統(tǒng)近年來受到廣泛關注.緩釋藥物系統(tǒng)指的是通過一定方法控制藥物釋放的時間、速度和位置,改善藥物在體內(nèi)的釋放、吸收和分布代謝的過程,從而達到延長藥物作用、減少藥物不良反應的一類藥劑[85].美國麻省理工學院基于3D打印技術(shù),提出了一種層層鋪粉、噴墨粘結(jié)的3D打印藥片制劑的方法獲得可控緩釋藥物的系統(tǒng)[86].由于3D打印成形的高度靈活性,噴墨過程及參數(shù)可以隨意控制,不同組成和類型的材料可以通過不同噴頭打印,因此可以很容易地控制局部材料組成、微觀結(jié)構(gòu)和表面特性,從而精確控制藥物釋放行為.目前常見的3D打印緩釋藥片有多層片、多腔室、核殼結(jié)構(gòu)、包裹結(jié)構(gòu)等類型[87-88],藥劑偏差量小于1%[89].
植入式的藥物緩釋系統(tǒng)進一步改善單純口服緩釋片劑不能靶向給藥的缺點,能做到通過手術(shù)植入或注射等手段直接導入病灶部位,從而實現(xiàn)定位給藥,植入局部藥物濃度高,而進入血液的藥物濃度低,減少用藥次數(shù)和用藥量.目前,3D打印可降解材料制作植入式藥物制劑是主要方向.Huang等[90]采用聚乳酸3D打印了慶大霉素的植入式藥劑,聚乳酸的不斷降解使包藏的藥物得以逐步完全釋放.與傳統(tǒng)的溶劑澆注壓制法相比,3D打印制劑的初始爆發(fā)釋放量低,緩釋過程中維持釋放濃度更平穩(wěn).Wu等[91]3D打印了具有多層結(jié)構(gòu)的載藥聚乳酸植入式支架,植入家兔體內(nèi)的藥物釋放研究表明,各層結(jié)構(gòu)中的藥物可以分階段控制釋放,極大地避免了全身用藥導致的毒性.朱鈺方研究團隊[23,92-94]通過材料表面化學改性,利用3D打印有機無機復合支架,在實現(xiàn)骨修復支架構(gòu)建的同時,獲得了抗生素、DNA、地塞米松、DMOG、阿霉素等多類型多尺寸藥物分子的局部緩釋和控制釋放.
2.6腫瘤治療
3D打印技術(shù)目前對腫瘤診斷和治療的意義主要在于體外腫瘤三維模型的構(gòu)建.早在2003年,Cho等報道,乳腺癌細胞在3D環(huán)境中通過合適的誘導因子添加可恢復到良性細胞的狀態(tài),而這是在2D平面培養(yǎng)中無法實現(xiàn)的[95].因此,構(gòu)建3D體外腫瘤模型對于腫瘤診療的研究具有重要的意義.Zhao等[96]運用自主開發(fā)的細胞3D打印技術(shù),在世界上首次構(gòu)建出由明膠、藻酸鹽和纖維素組成的Hela細胞的體外三維腫瘤模型.與2D培養(yǎng)相比,3D模型具有與腫瘤生理環(huán)境更相似的特征,腫瘤細胞在其中表現(xiàn)出較高的擴散效率,更高的蛋白表達和對抗腫瘤藥物更好的抗性,從而便于研究腫瘤的發(fā)展、侵襲、轉(zhuǎn)移和治療.Huang等[97]采用3D打印技術(shù)制備了仿生支架,深入研究了良性細胞和不同腫瘤細胞在支架中的遷移情況,并通過打印不同粗細的血管網(wǎng)絡研究腫瘤細胞在抗癌轉(zhuǎn)移藥物作用下的運動行為和分布.
另外,眾多研究人員開始采用3D打印技術(shù)精確設計仿生組織藥物病理作用模型,可以使人們在短時間內(nèi)大規(guī)模高通量篩選新型高效藥物[24],更重要的是,3D打印的病理模型具有極高的可重復性,對新型藥物或者藥物輸送系統(tǒng)的篩選測試也就具有了可靠性.近來,Gou等通過3D打印設計了一款肝組織結(jié)構(gòu)藥物解毒模型,受到全世界關注[98].
3 結(jié)束語
生物材料3D打印具有個性化、精準化生物醫(yī)學應用,越來越受到重視.目前,生物材料3D打印研究已經(jīng)在醫(yī)療與手術(shù)設計模型、手術(shù)導板、體外醫(yī)療器械,及非降解永久植入物等方面取得重要進展,并已經(jīng)開展臨床應用.但是,生物材料3D打印更為優(yōu)勢的應用,應該向可降解組織工程支架、3D打印體外仿生三維生物結(jié)構(gòu)體、器官及器官再生等領域發(fā)展.個性化可降解的組織工程支架將為包括骨/軟骨組織、皮膚組織等修復提供新的途徑;生物3D打印體外仿生生物結(jié)構(gòu)體的研發(fā)對短時間大規(guī)模高通量的新藥篩選具有重大價值;生物3D打印器官再生如能實現(xiàn),對器官移植具有深遠意義.另外,由于3D打印機的局限,目前合適的3D打印生物材料有限,質(zhì)量也有待于進一步提高.因此,3D打印生物材料問題的解決才能助力生物材料3D打印技術(shù)的臨床應用,從而造福人類.
[1] PELTOLA S M,MELCHELS F P W,GRIJPMA D W,et al.A review of rapid prototyping techniques for tissue engineering purposes[J].Annals of Medicine,2008,40(4):268-280.
[2] JANG J,YI H G,CHO D W.3D printed tissue models:present and future[J].ACS Biomaterials Science & Engineering,2016,2(10):1722-1731.
[3] 潘周嫻,陳適,劉巍,等.醫(yī)學三維打印材料分類及應用介紹[J].基礎醫(yī)學與臨床,2015,35(5):702-706.
[4] 王雪瑩.3D打印技術(shù)與產(chǎn)業(yè)的發(fā)展及前景分析[J].中國高新技術(shù)企業(yè),2012(9):3-5.
[5] 黃健,姜山.3D打印技術(shù)將掀起“第三次工業(yè)革命”[J].新材料產(chǎn)業(yè),2013(1):62-67.
[6] 周長春,王科峰,謝鵬飛,等.生物三維打印技術(shù)的研究現(xiàn)狀及發(fā)展趨勢[J].科技與企業(yè),2014(13):381-382.
[7] MURPHY S V,ATALA A.3D bioprinting of tissues and organs[J].Nature Biotechnology,2014,32(8):773-785.
[8] CALVERT P.Printing cells[J].Science,2007,318(5848):208-209.
[9] DERBY B.Printing and prototyping of tissues and scaffolds[J].Science,2012,338(6109):921-926.
[10] SEARS N A,SESHADRI D R,DHAVALIKAR P S,et al.A review of three-dimensional printing in tissue engineering[J].Tissue Engineering Part B:Reviews,2016,22(4):298-310.
[11] 顧奇,郝捷,陸陽杰,等.生物三維打印的研究進展[J].中國科學:生命科學,2015,45(5):439-449.
[12] KAWAGUCHI Y,NAKANO M,YASUDA T,et al.Development of a new technique for pedicle screw and Magerl screw insertion using a 3-dimensional image guide[J].Spine,2012,37(23):1983-1988.
[13] 黃軒,李鳳寧,張帆,等.三維打印個體化導航模板在枕骨髁螺釘固定技術(shù)中的應用研究[J].中國脊柱脊髓雜志,2014,24(5):440-446.
[14] XIONG Y Y,QIAN C,SUN J.Fabrication of porous titanium implants by three-dimensional printing and sintering at different temperatures[J].Dental Materials Journal,2012,31(5):815-820.
[15] CHEN Q Y,MANGADLAO J D,WALLAT J,et al.3D printing biocompatible polyurethane/poly(lactic acid)/graphene oxide nanocomposites:anisotropic properties[J].ACS Applied Materials & Interfaces,2017,9(4):4015-4023.
[17] INZANA J A,OLVERA D,FULLER S M,et al.3D printing of composite calcium phosphate and collagen scaffolds for bone regeneration[J].Biomaterials,2014,35(13):4026-4034.
[18] PEI P,QI X,DU X Y,et al.Three-dimensional printing of tricalcium silicate/mesoporous bioactive glass cement scaffolds for bone regeneration[J].Journal of Materials Chemistry B,2016,4(46):7452-7463.
[19] KIM Y B,LEE H,KIM G H.Strategy to achieve highly porous/biocompatible macroscale cell blocks,using a collagen/genipin-bioink and an optimal 3D printing process[J].ACS Applied Materials & Interfaces,2016,8(47):32230-32240.
[20] GAETANI R,FEYEN D A M,VERHAGE V,et al.Epicardial application of cardiac progenitor cells in a 3D-printed gelatin/hyaluronic acid patch preserves cardiac function after myocardial infarction[J].Biomaterials,2015,61:339-348.
[21] CHOI Y,PATI F,DAS S,et al.Development of novel silk fibroin-gelatin bioink for 3d cell printing technology[J].Tissue Engineering Part A,2014,20:S116.
[22] BILLIET T,GEVAERT E,DE SCHRYVER T,et al.The 3D printing of gelatin methacrylamide cell-laden tissue-engineered constructs with high cell viability[J].Biomaterials,2014,35(1):49-62.
[23] ZHANG J H,ZHAO S C,ZHU Y F,et al.Three-dimensional printing of strontium-containing mesoporous bioactive glass scaffolds for bone regeneration[J].Acta Biomaterialia,2014,10(5):2269-2281.
[24] 周長春,王科峰,肖占文,等.3D打印技術(shù)在生物醫(yī)學工程中的研究及應用[J].科技創(chuàng)新與應用,2014(21):41-42.
[25] GUVENDIREN M,MOLDE J,SOARES R M D,et al.Designing biomaterials for 3D printing[J].ACS Biomaterials Science & Engineering,2016,2(10):1679-1693.
[26] JOSE R R,BROWN J E,POLIDO K E,et al.Polyol-silk bioink formulations as two-part room-temperature curable materials for 3D printing[J].ACS Biomaterials Science & Engineering,2015,1(9):780-788.
[27] NI S Y,LI X H,YANG P A,et al.Enhanced apatite-forming ability and antibacterial activity of porous anodic alumina embedded with CaO-SiO2-Ag2O bioactive materials[J].Materials Science and Engineering C,2016,58:700-708.
[28] SHAO H F,HE Y,FU J Z,et al.3D printing magnesium-doped wollastonite/β-TCP bioceramics scaffolds with high strength and adjustable degradation[J].Journal of the European Ceramic Society,2016,36(6):1495-1503.
[29] PEI P,WEI D X,ZHU M,et al.The effect of calcium sulfate incorporation on physiochemical and biological properties of 3D-printed mesoporous calcium silicate cement scaffolds[J].Microporous and Mesoporous Materials,2017,241:11-20.
[30] ZHU W,XU C,MA B P,et al.Three-dimensional printed scaffolds with gelatin and platelets enhanceinvitropreosteoblast growth behavior and the sustained-release effect of growth factors[J].Chinese Medical Journal,2016,129(21):2576-2581.
[31] STERNER E,MASUKO S,LI G Y,et al.Fibroblast growth factor-based signaling through synthetic heparan sulfate blocks copolymers studied using high cell density three-dimensional cell printing[J].Journal of Biological Chemistry,2014,289(14):9754-9765.
[32] PAGE H,FLOOD P,REYNAUD E G.Three-dimensional tissue cultures:current trends and beyond[J].Cell and Tissue Research,2013,352(1):123-131.
[33] DERBY B.Inkjet printing of functional and structural materials:fluid property requirements,feature stability,and resolution[J].Annual Review of Materials Research,2010,40(1):395-414.
[34] DEMIRCI U,MONTESANO G.Single cell epitaxy by acoustic picolitre droplets[J].Lab on a Chip,2007,7(9):1139-1145.
[35] NAKAMURA M,KOBAYASHI A,TAKAGI F,et al.Biocompatible inkjet printing technique for designed seeding of individual living cells[J].Tissue Engineering,2005,11(11/12):1658-1666.
[36] KADOR K E,GROGAN S P,DORTHé E W,et al.Control of retinal ganglion cell positioning and neurite growth:combining 3D printing with radial electrospun scaffolds[J].Tissue Engineering Part A,2016,22(3/4):286-294.
[37] FANG Y,FRAMPTON J P,RAGHAVAN S,et al.Rapid generation of multiplexed cell cocultures using acoustic droplet ejection followed by aqueous two-phase exclusion patterning[J].Tissue Engineering Part C:Methods,2012,18(9):647-657.
[38] CHENG E,YU H R,AHMADI A,et al.Investigation of the hydrodynamic response of cells in drop on demand piezoelectric inkjet nozzles[J].Biofabrication,2016,8(1):015008.
[39] FERRIS C J,GILMORE K J,BEIRNE S,et al.Bio-ink for on-demand printing of living cells[J].Biomaterials Science,2013,1(2):224-230.
[40] HEO E Y,KO N R,BAE M S,et al.Novel 3D printed alginate-BFP1 hybrid scaffolds for enhanced bone regeneration[J].Journal of Industrial and Engineering Chemistry,2017,45:61-67.
[41] WANG Q,XIA Q Q,WU Y,et al.3D-printed atsttrin-incorporated alginate/hydroxyapatite scaffold promotes bone defect regeneration with TNF/TNFR signaling involvement[J].Advanced Healthcare Materials,2015,4(11):1701-1708.
[42] JEON H,KANG K,PARK S A,et al.Generation of multilayered 3D structures of HepG2 cells using a bio-printing technique[J].Gut and Liver,2017,11(1):121-128.
[43] JANG J,PARK H J,KIM S W,et al.3D printed complex tissue construct using stem cell-laden decellularized extracellular matrix bioinks for cardiac repair[J].Biomaterials,2017,112:264-274.
[44] XU T,KINCAID H,ATALA A,et al.High-throughput production of single-cell microparticles using an inkjet printing technology[J].Journal of Manufacturing Science and Engineering,2008,130(2):021017.
[45] LI S J,XIONG Z,WANG X H,et al.Direct fabrication of a hybrid cell/hydrogel construct by a double-nozzle assembling technology[J].Journal of Bioactive and Compatible Polymers,2009,24(3):249-265.
[46] ZHAO Y,LI Y,MAO S S,et al.The influence of printing parameters on cell survival rate and printability in microextrusion-based 3D cell printing technology[J].Biofabrication,2015,7(4):045002.
[47] AHMED R,MENEZES A H.Management of operative complications related to occipitocervical instrumentation[J].Neurosurgery,2013,72(2S):ons214.
[48] 禤天航,曹正霖,王剛.三維打印技術(shù)在脊柱外科的研究與應用[J].海南醫(yī)學,2015,26(12):1807-1809.
[49] 石靜,鐘玉敏.組織工程中3D生物打印技術(shù)的應用[J].中國組織工程研究,2014,18(2):271-276.
[50] SUN J,ZHANG F Q.The application of rapid prototyping in prosthodontics[J].Journal of Prosthodontics:Implant,Esthetic,and Reconstructive Dentistry,2012,21(8):641-644.
[51] EBERT J,?ZKOL E,ZEICHNER A,et al.Direct inkjet printing of dental prostheses made of zirconia[J].Journal of Dental Research,2009,88(7):673-676.
[52] Emma,INDEX.3D打印定制假肢[J].設計,2013,(12):24.
[53] ZHU M,ZHAO S C,XIN C,et al.3D-printed dimethyloxallyl glycine delivery scaffolds to improve angiogenesis and osteogenesis[J].Biomaterials Science,2015,3(8):1236-1244.
[54] 朱建平.3D打印骨骼進入臨床觀察階段[J].健康博覽,2013(8):9.
[55] CARRADA,PERRIN-SCHMITT F,LE Q V,et al.Nanoporous hydroxyapatite/sodium titanate bilayer on titanium implants for improved osteointegration[J].Dental Materials,2017,33(3):321-332.
[56] MORRISON R J,HOLLISTER S J,NIEDNER M F,et al.Mitigation of tracheobronchomalacia with 3D-printed personalized medical devices in pediatric patients[J].Science Translational Medicine,2015,7(285):285ra64.
[57] WEI G B,MA P X.Structure and properties of nano-hydroxyapatite/polymer composite scaffolds for bone tissue engineering[J].Biomaterials,2004,25(19):4749-4757.
[58] LANGER R,VACANTI J P.Tissue engineering[J].Science,1993,260(5110):920-926.
[59] HUTMACHER D W.Scaffolds in tissue engineering bone and cartilage[J].Biomaterials,2000,21(24):2529-2543.
[60] 趙瑾,袁曉燕,姚康德.組織工程多孔支架制備技術(shù)進展[J].化工進展,2002,21(9):644-648.
[61] RICHARDS D J,TAN Y,JIA J,et al.3D printing for tissue engineering[J].Israel Journal of Chemistry,2013,53(9/10):805-814.
[62] CASTILHO M,MOSEKE C,EWALD A,et al.Direct 3D powder printing of biphasic calcium phosphate scaffolds for substitution of complex bone defects[J].Biofabrication,2014,6(1):015006.
[63] SERRA T,MATEOS-TIMONEDA M A,PLANELL J A,et al.3D printed PLA-based scaffolds:a versatile tool in regenerative medicine[J].Organogenesis,2013,9(4):239-244.
[64] ALMEIDA C R,SERRA T,OLIVEIRA M I,et al.Impact of 3-D printed PLA and chitosan-based scaffolds on human monocyte/macrophage responses:unraveling the effect of 3-D structures on inflammation[J].Acta Biomaterialia,2014,10(2):613-622.
[65] JAKUS A E,RUTZ A L,JORDAN S W,et al.Hyperelastic “bone”:a highly versatile,growth factor-free,osteoregenerative,scalable,and surgically friendly biomaterial[J].Science Translational Medicine,2016,8(358):358ral127.
[66] TUMBLESTON J R,SHIRVANYANTS D,ERMOSHKIN N,et al.Continuous liquid interface production of 3D objects[J].Science,2015,347(6228):1349-1352.
[67] VISSCHER D O,BOS E J,PEETERS M,et al.Cartilage tissue engineering:preventing tissue scaffold contraction using a 3D-printed polymeric cage[J].Tissue Engineering Part C:Methods,2016,22(6):573-584.
[68] LEE J S,HONG J M,JUNG J W,et al.3D printing of composite tissue with complex shape applied to ear regeneration[J].Biofabrication,2014,6(2):024103.
[69] YOU F,WU X,CHEN X B.3D printing of porous alginate/gelatin hydrogel scaffolds and their mechanical property characterization[J].International Journal of Polymeric Materials and Polymeric Biomaterials,2017,66(6):299-306.
[70] KIRCHMAJER D M,GORKIN III R,PANHUIS M I H.An overview of the suitability of hydrogel-forming polymers for extrusion-based 3D-printing[J].Journal of Materials Chemistry B,2015,3(20):4105-4117.
[71] VISSER J,MELCHELS F P W,JEON J E,et al.Reinforcement of hydrogels using three-dimensionally printed microfibres[J].Nature Communications,2015,6:6933.
[72] HUNG K C,TSENG C S,DAI L G,et al.Water-based polyurethane 3D printed scaffolds with controlled release function for customized cartilage tissue engineering[J].Biomaterials,2016,83:156-168.
[73] 符鋒,李曉紅,張賽.三維打印技術(shù)在神經(jīng)修復中的應用[J].中國醫(yī)藥指南,2016,11(1):138-141.
[74] WüST S,MüLLER R,HOFMANN S.3D Bioprinting of complex channels-Effects of material,orientation,geometry,and cell embedding[J].Journal of Biomedical Materials Research Part A,2015,103(8):2558-2570.
[75] WONG D Y,KREBSBACH P H,HOLLISTER S J.Brain cortex regeneration affected by scaffold architectures[J].Journal of Neurosurgery,2008,109(4):715-722.
[76] CHANG C C,BOLAND E D,WILLIAMS S K,et al.Direct-write bioprinting three-dimensional biohybrid systems for future regenerative therapies[J].Journal of Biomedical Materials Research Part B:Applied Biomaterials,2011,98B(1):160-170.
[77] PETROCHENKO P E,TORGERSEN J,GRUBER P,et al.Laser 3D printing with sub-microscale resolution of porous elastomeric scaffolds for supporting human bone stem cells[J].Advanced Healthcare Materials,2015,4(5):739-747.
[78] PATI F,JANG J,HA D H,et al.Printing three-dimensional tissue analogues with decellularized extracellular matrix bioink[J].Nature Communications,2014,5:3935.
[79] 王璐,胡為杰,聶昊,等.3D打印與組織工程心肌、心臟瓣膜、大血管及血管網(wǎng)的構(gòu)建[J].中國組織工程研究,2015,19(43):7029-7034.
[80] LEE V K,KIM D Y,NGO H,et al.Creating perfused functional vascular channels using 3D bio-printing technology[J].Biomaterials,2014,35(28):8092-8102.
[81] CHRISTENSEN K,XU C X,CHAI W X,et al.Freeform inkjet printing of cellular structures with bifurcations[J].Biotechnology and Bioengineering,2015,112(5):1047-1055.
[82] MILLER J S,STEVENS K R,YANG M T,et al.Rapid casting of patterned vascular networks for perfusable engineered three-dimensional tissues[J].Nature Materials,2012,11(9):768-774.
[83] ZHAO X R,LIU L B,WANG J Y,et al.Invitrovascularization of a combined system based on a 3D printing technique[J].Journal of Tissue Engineering and Regenerative Medicine,2016,10(10):833-842.
[84] LUEDERS C,JASTRAM B,HETZER R,et al.Rapid manufacturing techniques for the tissue engineering of human heart valves[J].European Journal of Cardio-Thoracic Surgery,2014,46(4):593-601.
[85] ZHU M,ZHANG J H,TAO C L,et al.Design of mesoporous bioactive glass/hydroxyapatite composites for controllable co-delivery of chemotherapeutic drugs and proteins[J].Materials Letters,2014,115:194-197.
[86] GOOLE J,AMIGHI K.3D printing in pharmaceutics:a new tool for designing customized drug delivery systems[J].International Journal of Pharmaceutics,2016,499(1/2):376-394.
[87] KHALED S A,BURLEY J C,ALEXANDER M R,et al.3D printing of tablets containing multiple drugs with defined release profiles[J].International Journal of Pharmaceutics,2015,494(2):643-650.
[88] KHALED S A,BURLEY J C,ALEXANDER M R,et al.3D printing of five-in-one dose combination polypill with defined immediate and sustained release profiles[J].Journal of Controlled Release,2015,217:308-314.
[89] LEE K J,KANG A,DELFINO J J,et al.Evaluation of critical formulation factors in the development of a rapidly dispersing captopril oral dosage form[J].Drug Development and Industrial Pharmacy,2003,29(9):967-979.
[90] HUANG Y Y,CHUNG T W.Microencapsulation of gentamicin in biodegradable PLA and/or PLA/PEG copolymer[J].Journal of Microencapsulation,2001,18(4):457-465.
[91] WU W G,ZHENG Q X,GUO X D,et al.The controlled-releasing drug implant based on the three dimensional printing technology:fabrication and properties of drug releasinginvivo[J].Journal of Wuhan University of Technology-Materials Science Edition,2009,24(6):977-981.
[92] ZHU M,LI K,ZHU Y F,et al.3D-printed hierarchical scaffold for localized isoniazid/rifampin drug delivery and osteoarticular tuberculosis therapy[J].Acta Biomaterialia,2015,16:145-155.
[93] ZHAO S C,ZHU M,ZHANG J H,et al.Three dimensionally printed mesoporous bioactive glass and poly(3-hydroxybutyrate-co-3-hydroxyhexanoate) composite scaffolds for bone regeneration[J].Journal of Materials Chemistry B,2014,2(36):6106-6118.
[94] ZHANG J H,ZHAO S C,ZHU M,et al.3D-printed magnetic Fe3O4/MBG/PCL composite scaffolds with multifunctionality of bone regeneration,local anticancer drug delivery and hyperthermia[J].Journal of Materials Chemistry B,2014,2(43):7583-7595.
[95] CHO H S,MASON K,RAMYAR K X,et al.Structure of the extracellular region of HER2 alone and in complex with the Herceptin Fab[J].Nature,2003,421(6924):756-760.
[96] ZHAO Y,YAO R,OUYANG L L,et al.Three-dimensional printing of Hela cells for cervical tumor modelinvitro[J].Biofabrication,2014,6(3):035001.
[97] HUANG T Q,QU X,LIU J,et al.3D printing of biomimetic microstructures for cancer cell migration[J].Biomedical Microdevices,2014,16(1):127-132.
[98] GOU M L,QU X,ZHU W,et al.Bio-inspired detoxification using 3D-printed hydrogel nanocomposites[J].Nature Communications,2014,5:3774.
Progressofthe3DPrintingTechnologyforBiomaterials
ZHU Min,HUANGTing,DUXiaoyu,ZHUYufang
(SchoolofMaterialsandEngineering,UniversityofShanghaiforScienceandTechnology,Shanghai200093,China)
In biomedical fields,the 3D printing of either biomaterials or living cells is capable to construct complex 3D bio-structures,such as customized implants,engineered bone grafts,ex vivo 3D cellular aggregates and artificial organs,etc.Therefore,considering its remarkable superiorities over the individual fabrication and complex structure building,the paper affords a meaningful review of the basis technological process,application areas and developments of 3D bio-printing.The discussions based on the 3D printing of biomaterials were then presented according to current research hotspots,including the two strategies of inkjet printing and dispensing printing techniques.Its applications in manufacturing medical models,devices and implants with biomaterials were focused.In addition,tissue engineering scaffolds and three-dimensional cell aggregates fabricated via 3D bio-printing were summarized.The outlooks about the future 3D bio-printing technique were put forward.
biomaterial; 3Dprinting;biomedicalapplications;progress
1007-6735(2017)05-0473-11
10.13255/j.cnki.jusst.2017.05.011
2017-05-05
上海理工大學科技發(fā)展基金資助項目(2016KJFZ011,2017KJFZ010)
朱 敏(1985-),女,副研究員.研究方向:生物材料.E-mail:mzhu@usst.edu.cn
朱鈺方(1976-),男,教授.研究方向:生物材料.E-mail:yfzhu@usst.edu.cn
TP391.7;R318.1
A
(編輯:丁紅藝)

