化學反應與能量變化知識點解讀
■北京市十一學校 滕明俊(博士)
化學反應與能量變化知識點解讀
■北京市十一學校 滕明俊(博士)
編者注:本期文章的作者主要為北京市十一學校的中青年骨干教師,他們寫的文章將知識講解得清楚明白,解題的思路與方法巧妙實用,對同學們開拓知識面和提高應試能力很有幫助。希望同學們讀后收獲滿滿。另外,特別感謝滕明俊老師及其同事為組織編寫本期稿件所做的努力。
化學反應與能量變化知識是高考考查的重點,要順利解答相關方面的題目,最重要的是對基本概念(燃燒熱、中和熱、熱化學方程式等)和基本原理(蓋斯定律)的理解和應用。
一、對基本概念的理解
1.反應熱能量變化的本質為化學鍵的斷裂和形成。反應熱=反應物舊鍵斷裂所吸收的能量-生成物新鍵生成所釋放的能量。反應熱小于零是放熱反應,大于零是吸熱反應。反應是放熱還是吸熱,這與反應條件(比如是否需要加熱)沒有必然聯系。需要加熱才能進行的反應不一定是吸熱反應,例如,鋁熱反應2Al+Fe2O3══Al2O3+2Fe需要在加熱條件下引發,但是該反應是劇烈的放熱反應。
2.燃燒熱的定義:1mol純凈物在25℃,101kPa的條件下完全燃燒生成穩定產物所放出的能量。定義中有幾點需要特別注意:①量:可燃物為1mol,但不限制生成物的量;②反應的條件:25℃、101kPa;③產物:完全燃燒后的穩定產物。比如1molC燃燒生成CO所放出的熱量,不能夠稱之為碳的燃燒熱,因為CO不是完全燃燒后的穩定產物,CO2才是穩定產物。
3.中和熱的定義:酸與堿發生中和反應生成1 molH2O時所釋放的熱量稱為中和熱。定義中需要注意的地方是:①量:生成物(H2O)為1mol,但不限制反應物的量,如果生成物不是1mol水,則能量變化不能稱之為中和熱;②放熱反應;③在稀溶液中,強酸和強堿的中和熱約為57.3kJ·mol-1,而對于強酸和弱堿,或是強堿和弱酸的反應,其中和熱的數值小于57.3kJ·mol-1,因為弱酸或弱堿的電離是一個吸熱的過程。
例1判斷以下說法正確的是( )。
A.合成氨需要在高溫高壓下進行:N2+3H2══2NH3,所以該反應是吸熱反應
B.1molH2完全燃燒生成1mol水蒸氣所放出熱量稱之為氫氣的燃燒熱
C.燃燒熱和中和熱都是化學反應時放出的熱量,故它們對應的ΔH<0
D.在25℃,101kPa下,1mol磷燃燒生成三氧化二磷所放出的熱量為磷的燃燒熱
解析:選項A,反應條件與反應吸熱、放熱沒有必然的聯系,合成氨雖然需要在高溫條件下進行,但是該反應是放熱反應,A項錯誤。
選項B,根據定義,H2的燃燒熱為1molH2完全燃燒生成液態水H2O(l)所放出的熱量,而非水蒸氣,故B項錯誤。
D選項,磷燃燒的穩定產物為五氧化二氯,而不是三氧化二磷,故D項錯誤。
燃燒和中和過程都是放熱過程,所以ΔH<0,C選項正確。
答案:C
【舉一反三】
已知:①2H2(g)+O2(g)══2H2O(l)ΔH1=-571.6kJ·mol-1
求氫氣的燃燒熱。
解析:在25℃,101kPa的條件下,H2的穩定燃燒產物H2O以液態形式存在,而非氣態,所以②ΔH=-241.8kJ·mol-1的熱量變化不是反應熱。
因為燃燒熱規定是1mol可燃物參與反應,根據①式,H2的燃燒熱應為-285.8kJ·mol-1。
答案:ΔH=-285.8kJ·mol-1。
二、熱化學反應方程式的書寫與正誤判斷
熱化學反應方程式包含了物質變化和能量變化兩部分的信息,表1總結了它與普通化學方程式的區別。

表1
判斷熱化學方程式正誤和書寫熱化學方程式的注意事項:
(1)觀察方程式是否已經配平;
(2)看是否注明物質的聚集狀態,以及狀態是否正確;
(3)看是否注明能量變化ΔH,①ΔH的符號(放熱為“-”,吸熱為“+”),②數值,③單位(kJ·mol-1),是否符合實際情況;
(4)分析各物質的計量數是否符合要求(燃燒熱——可燃物的計量數為1,中和熱——H2O的計量數為1)。
例2下列熱化學方程式正確的是(ΔH的絕對值均正確)( )。
A.表示S的燃燒熱的熱化學反應方程式是2S(s)+3O2(g)══2SO3(s) ΔH=-630kJ·mol-1
B.乙醇的燃燒:C2H5OH+3O2→2CO2+3H2O ΔH=-1369kJ·mol-1
C.已 知NaOH(aq)+HCl(aq)══NaCl(aq)+H2O ΔH=-57.3kJ·mol-1,則反應 3NaOH(aq)+H3PO4(aq)══Na3PO4(aq)+H2O(l) ΔH=-57.3×3=-171.9kJ·mol-1
D.碳的燃燒:C(s)+O2(g)══CO2(g)ΔH=-393.5kJ·mol-1
解析:A選項,燃燒熱應該是1mol純凈物在25℃,101kPa的條件下完全燃燒生成穩定產物所放出的能量。A選項中S的化學計量數應該是1而不是2。
B選項,沒有標明聚集狀態,且方程式中應該用“=”而不是“→”。
C選項,H3PO4是中強酸,其電離的過程吸熱,所以H3PO4與NaOH的反應熱的數值應該小于57.3×3=171.9kJ·mol-1。
答案:D
【舉一反三】
火箭推進器常以氣態聯氨(N2H4)為燃料,液態過氧化氫為助燃劑。反應過程中生成的氣體可參與大氣循環。測得當反應過程中有1mol水蒸氣生成時,放出161kJ的熱量。試寫出反應過程中的熱化學方程式:___。
答案:N2H4(g)+2H2O2(l)══N2(g)+4H2O(g) ΔH=-644kJ·mol-1
三、蓋斯定律及其應用(見表2)

表2
例3半水煤氣是工業合成氨的原料氣,其主要成分為H2、CO、CO2、N2和H2O(g)。半水煤氣經過下列步驟轉化為合成氨的原料。
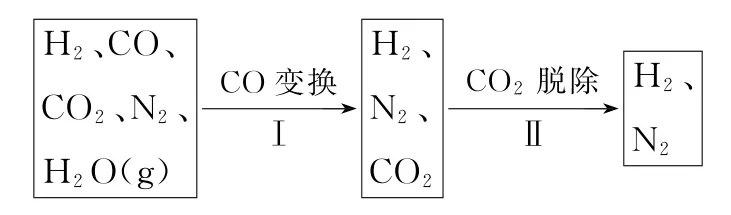
步驟Ⅰ,CO變換反應的能量變化如圖1所示。
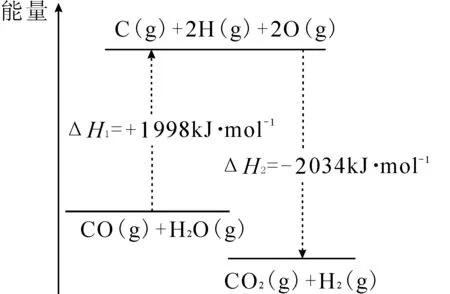
圖1
則CO變換反應的熱化學方程式是____。
解析:根據題意,先寫出CO變換反應的目標方程式:
CO(g)+H2O(g)══CO2(g)+H2(g) ΔH
根據圖中的能量變化圖,可以寫出已知方程式:
①CO(g)+H2O(g)══C(s)+2H(g)+2O(g) ΔH1
②C(s)+2H(g)+2O(g)══CO2(g)+H2(g) ΔH2
觀察發現,①+②進行方程式疊加可以消除中間產物[C(s)+2H(g)+2O(g)],得到目標方程式,所以ΔH=ΔH1+ΔH2=+1998 kJ·mol-1+(-2034kJ·mol-1)=-36kJ·mol-1。
答案:CO(g)+H2O(g)══CO2(g)+H2(g) ΔH=-36kJ·mol-1
【舉一反三】
根據下列熱化學方程式分析,C(s)的燃燒熱ΔH等于( )。
①C(s)+H2O(l)══CO(g)+H2(g)ΔH1=+175.3kJ·mol-1
②2CO(g)+O2(g)══2CO2(g) ΔH2=-566.0kJ·mol-1
③2H2(g)+O2(g)══2H2O(l) ΔH3=-571.6kJ·mol-1
A.ΔH1+ΔH2-ΔH3
B.2ΔH1+ΔH2+ΔH3

解析:首先寫出C(s)的燃燒熱的熱化學方程式(目標方程式):
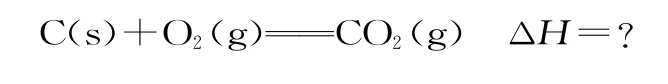
根據各物質在以上方程式中的位置,觀察已知的三個方程式,發現不用調整反應方向,僅需要調整計量數。為把中間產物CO和H2消去,對②和③進行計量數調整,都分別乘以,可以得到目標方程式,所以
答案:D
(責任編輯 謝啟剛)
《中學生數理化》高考理化版發稿計劃
(雙月化學專刊)
2018年2月號
有機化學:有機化合物的分類及命名,官能團的識別,有機物的結構,同系物與同分異構體,同分異構體種數的判斷及書寫,有機物的燃燒規律,有機物分子式、結構式的確定,烴和鹵代烴,烴的含氧衍生物,高分子化合物,有機合成與推斷。
2018年4月號
化學實驗:化學實驗的基本方法和技能,常見儀器的使用,化學實驗基本操作及安全,常見氣體的實驗室制法,物質的檢驗、分離與提純,物質的鑒別,阿伏加德羅常數的應用,物質的量,氣體摩爾體積,溶質的質量分數、物質的量濃度及其相關計算,無機物和有機物的制備,實驗探究(反應原理、物質組成、物質性質的探究),實驗方案的設計、評價或改進方案。
2018年6月號(提前于4月底出版)
物質結構 元素周期律:元素、核素、同位素的含義,微粒的組成、結構和性質,化學鍵、離子化合物與共價化合物,元素周期表及其應用,元素周期律及其應用。
物質結構與性質:原子結構與性質,化學鍵與分子結構,晶體結構與性質。
2018年8月號(提前于4月底出版)
高考熱點專題:化學與生活、科技、環境,科學應考,審題要領,選擇題解題技巧,填空題答題規范,等等。

