三招教你巧學『難溶電解質的溶解平衡』
■山東省濟南市章丘第一中學高二(5)班 韓美玉
三招教你巧學『難溶電解質的溶解平衡』
■山東省濟南市章丘第一中學高二(5)班 韓美玉
我在學習中發現,難溶電解質的溶解平衡是大家學習的難點,這部分知識主要包括溶解平衡和沉淀反應的應用,如何更好地理解和掌握溶解平衡,我教大家三招。
第一招:辯證思維看溶解
溶解度的概念是:一定溫度下,在100g溶劑里,某物質達到飽和時所溶解的質量。一般如下界定物質的溶解性(以20℃為準):
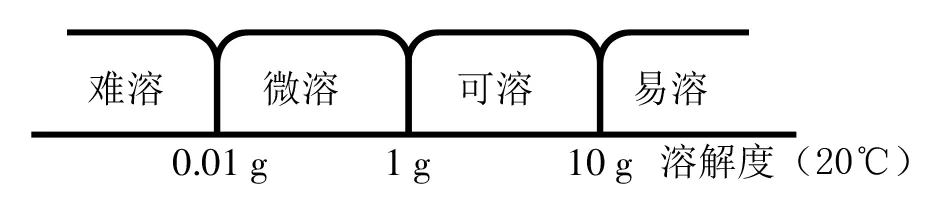
故此,絕對不溶的物質是不存在的,用辯證思想理解也就是:溶解是絕對的,而不溶是相對的,即存在著“變數”。
例1下列說法中正確的是( )。
A.不溶于水的物質在乙醇中也不溶解
B.絕對不溶解的物質是可以存在的,只是太少而已
C.某離子被沉淀完全是指該離子在溶液中的濃度為1.0×10-5mol·L-1以下
D.某物質的溶解性如果為難溶,即說明該物質不溶于水
分析:從上述敘述可知C項正確。
第二招:巧用對比會遷移
易溶物質的溶解平衡和難溶電解質的溶解平衡的對比(見表1):

表1
例2在溶液中存在Mg(OH)2的溶解平衡)。加入NH4Cl濃溶液,使Mg(OH)2溶解,你能從平衡移動的角度加以解釋嗎?
分析:①加入NH4Cl時,直接結合OH-,使c(OH-)減小,平衡右移,從而使Mg(OH)2溶解;②水解,產生的H+中和OH-,使c(OH-)減小,平衡右移,從而使Mg(OH)2溶解。
第三招:兩個方面看應用
沉淀反應的應用如何理解為好?我建議同學們從以下兩個方面理解較好。
1.根據有關離子濃度的乘積(Qc)和溶度積(Ksp)的大小比較進行理解。
(1)Qc>Ksp,溶液過飽和,析出沉淀,直至溶液達到新的平衡。所以為了使沉淀生成,可以通過加沉淀劑使Qc>Ksp,析出沉淀;為了使沉淀析出較完全,可以增加有關離子的濃度使Qc增大而達到目的。
(2)Qc<Ksp,溶液未飽和,無沉淀析出,沉淀向溶解的方向進行。因此使沉淀溶解的方法是把構成晶體離子的濃度減小,使之滿足Qc<Ksp。常用方法是:在難溶飽和電解質溶液中加入含有能與原離子反應的適當試劑使之與組成沉淀的一種或兩種離子結晶為新的離子化合物,此化合物更難溶,從而使原沉淀溶解,實際是轉化為一種新的沉淀。
(3)Qc=Ksp,沉淀和溶解達到平衡,溶液為飽和溶液。
2.利用平衡移動原理——勒夏特列原理來理解。
溶解平衡也是平衡的一種,所以適用于化學平衡移動的主要原理——勒夏特列原理,對解答沉淀反應的應用同樣適用。沉淀的生成、溶解和轉化主要是通過改變有關離子的濃度而破壞舊平衡,從而建立新的平衡。
除上述方法外,同學們還可以通過上網、討論和查閱有關資料,共同探究,對本節知識進行理解和應用。
(責任編輯 謝啟剛)

