毛竹筍竹快速生長期可溶性糖質量分數與PeTPS1/PeSnRK1基因表達分析
李丹丹,許馨露,翟建云,孫建飛,曹友志,高 巖,張汝民
(1.浙江農林大學 林業與生物技術學院,浙江 杭州311300;2.浙江農林大學 省部共建亞熱帶森林培育國家重點實驗室培育基地,浙江 杭州311300)
毛竹筍竹快速生長期可溶性糖質量分數與PeTPS1/PeSnRK1基因表達分析
李丹丹1,許馨露1,翟建云1,孫建飛1,曹友志2,高 巖1,張汝民1
(1.浙江農林大學 林業與生物技術學院,浙江 杭州311300;2.浙江農林大學 省部共建亞熱帶森林培育國家重點實驗室培育基地,浙江 杭州311300)
為探討毛竹Phyllostachys edulis筍竹快速生長期可溶性糖質量分數變化與PeTPS1和PeSnRK1基因的表達情況,明確它們與毛竹快速生長的關系,采用實時熒光定量聚合酶鏈式反應(qRT-PCR)分析技術對筍竹快速生長期不同時間(黃昏后0,4和8 h)和不同部位(筍竹上部、中部、下部和竹篼)PeTPS1和PeSnRK1基因表達量進行分析,并采用試劑盒法測定糖質量分數。結果表明:筍竹莖稈上部可溶性糖質量分數變化不顯著;黃昏后8 h中部葡萄糖、果糖、蔗糖質量分數與黃昏時相比分別下降了2.2倍、1.4倍和1.6倍;營養儲存器官竹蔸中黃昏后8 h葡萄糖、果糖、蔗糖、海藻糖質量分數與黃昏時相比分別下降了1.6倍、1.3倍、1.4倍和1.3倍。筍竹中部黃昏后8 h PeTPS1基因的表達量為下部的4.8倍;黃昏后8 h竹蔸中PeSnRK1基因表達量均顯著高于其他部位,為黃昏時的1.7倍。隨黃昏時間變化毛竹快速生長過程中不同部位碳水化合物質量分數及其相關調控基因不斷變化,可溶性糖不斷消耗以供應筍竹快速生長部位的生長,同時PeTPS1基因被上調合成海藻糖以保證充足的碳源,而PeSnRK1基因則呈現出與PeTPS1基因表達相反的變化趨勢。推測T6P/SnRK1信號共同調節黑暗中筍竹快速生長,在毛竹快速生長這一關鍵生理過程中具有重要作用。研究成果為進一步明確毛竹速生生長機制以及指導其他樹木的速生和育種具有重要意義。圖4表1參35
植物學;毛竹;糖;PeTPS1;PeSnRK1;快速生長
碳水化合物是光合作用的最終產物,不僅為植物體的生長發育和生理代謝提供能量,同時也作為信號分子在物質運輸、滲透調節、抵抗脅迫、基因表達等方面起重要作用[1]。櫻桃番茄Lycopersicum esculentum var.cerasiforme果實在發育成熟過程中,蔗糖被不斷分解,而葡萄糖和果糖逐漸積累[2]。對溫州蜜柑Citrus unshiu研究發現[3],蜜柑果實成熟過程中可食組織中糖不斷增加,而果糖激酶活性不斷下降。擬南芥Arabidopsis thaliana中編碼淀粉降解相關基因的表達受光照時間和生物鐘調控,持續黑暗條件下,碳水化合物水平、轉錄水平和蛋白質水平相互協調,糖促進擬南芥下胚軸伸長[4-5]。海藻糖可以誘導光合器官中調控碳水化合物合成酶的激活[6],高濃度海藻糖抑制擬南芥根中碳水化合物分配,抑制根的伸長[7];逆境條件下植物體內海藻糖含量增加以抵抗脅迫[8]。WINGLER等[9]發現海藻糖通過調節糖調控基因的表達影響擬南芥幼苗的生長代謝。海藻糖磷酸合成酶(trehalose-6-phosphate synthase,TPS1)作為一種信號來調控海藻糖-6-磷酸(T6P)的合成,T6P通過磷酸海藻糖磷酸酶(TPP)轉化為海藻糖,從而促進植物的生長發育[10]。 對水稻 Oryza sativa[11], 煙草 Nicotiana tabacum[12]和小麥 Triticum aestivum[13]等植物幼苗研究發現:植物體通過調控TPS1基因的表達來增加體內海藻糖質量分數,從而提高其抗逆性。植物蔗糖非發酵-1-型相關蛋白激酶1(sucrose non-fermenting-1(SNF1)-related kinase 1,SnRK1)是植物中糖信號調控的一種關鍵激酶,廣泛參與植物的細胞周期調控、生長發育、病蟲害防御、激素信號傳導和非生物脅迫等各種信號的應答反應[14]。能量匱乏條件下,擬南芥SNF1相關蛋白激酶催化亞基KIN10和KIN11促進合成代謝基因的表達,抑制分解代謝基因的表達以響應脅迫[15]。反義表達SnRK1馬鈴薯Solanum tuberosum葉片喪失蔗糖合成酶的轉錄功能[16];對水稻和擬南芥研究發現:SnRK1活性的高低嚴重影響著脅迫誘導型基因的表達,從而增強植物抗逆性[17]。植物中可溶性糖和SnRK1一同作為生物發育的糖信號調控物質,與糖信號途徑相互作用。能量缺乏時,SnRK1抑制植物體生長,T6P通過抑制SnRK1的表達來調控基因的表達,保證植物在營養缺乏逆境條件下能夠存活生長[18]。ZHANG等[19]研究發現,微摩爾濃度的T6P就可以抑制擬南芥幼苗及其他植物幼嫩組織SnRK1活性。葡萄糖和蔗糖可以緩解高濃度海藻糖對植物生長的抑制作用,蔗糖和海藻糖在糖感受調控基因的表達中有相似的作用,海藻糖能代替蔗糖,調控碳水化合物的代謝[20]。蔗糖調控基因SnRK1與海藻糖相互作用,調控植物碳代謝、基因表達,為植物的生長發育及其代謝提供保證[21]。毛竹Phyllostachys edulis是重要的經濟資源、造園材料,關于毛竹的研究目前主要集中在莖稈解剖結構[22]、不同生長期莖稈色素含量[23]、快速生長期水勢變化[24]、基因組學及快速生長期節間伸長相關蛋白的表達[25-26]等方面,尚未有關于毛竹快速高生長過程中糖代謝的研究。本研究以快速生長期毛竹筍竹為實驗材料,分析毛竹中可溶性糖質量分數及PeSnRK1,PeTPS1基因的表達情況,研究其表達差異性,以期探索毛竹生長過程中糖調控基因如何調控碳水化合物來指導幼筍的快速生長,為毛竹及其他樹種的快速生長機制的闡述提供新的理論依據。
1 材料與方法
1.1 試驗地概況
供試材料毛竹采自浙江農林大學毛竹示范基地, 地理位置為 29°56′~30°23′N, 118°51′~119°52′E,屬中亞熱帶季風氣候區,四季分明,溫暖濕潤,年平均氣溫為16.4℃,氣候特點為春多雨,夏濕熱,秋氣爽,冬干冷,年平均降水量為1 628.6 mm,年平均日照時數1 847.3 h。森林覆蓋率為76.5%。
1.2 材料
2015年4月,在浙江農林大學毛竹試驗基地挑選生長健壯的2 m高毛竹筍竹,以18:00為黃昏時,分別于黃昏后0,4,8 h取材。選取3株生長健壯的筍竹3株·次-1,從基部將其伐倒,挖出竹蔸,將地上部分平均分成3段,各段取中間1節記為上部、中部、下部,并對竹蔸中間位置進行取樣,將樣品迅速放進液氮中冷凍,存于-80℃備用。
1.3 可溶性糖測定
葡萄糖、果糖和蔗糖質量分數測定:稱取0.5 g筍竹于研缽中研磨,加蒸餾水8.0 mL,80℃恒溫水浴30 min,冷卻,定容10.0 mL。離心(3 000 g,5 min),上清液為可溶性糖提取液。葡萄糖、果糖和蔗糖質量分數采用可溶性糖試劑盒(南京建成科技有限公司)測定。重復5次·樣品-1。
海藻糖質量分數測定:參考蘇州科銘生物技術有限公司海藻糖試劑盒,加入5.0 mL提取液,稱取0.5 g筍竹于研缽中冰浴研磨,室溫靜置45 min,常溫下8 000 g離心10 min,取上清。取60 μL樣本和240.0 μL工作液至EP管中,95℃水浴10 min,自然冷卻至室溫后,取200.0 μL至96孔板中,620 nm波長下測定吸光度D(λ)值。重復5次·樣品-1。
1.4 毛竹筍竹總RNA的分離純化以及cDNA合成
稱取0.5 g筍竹,使用改進Trizol法進行總核糖核酸(RNA)提取。使用分光光度計檢測樣品RNA的純度,并用瓊脂糖電泳檢測RNA的完整性。以上述RNA為模板,冰上配置10.0 μL實時熒光定量聚合酶鏈式反應(qRT-PCR)體系:包括5×Prime Script RT Master Mix 2.0 μL,總 RNA 500 ng,加去RNA酶的水(RNase Free H2O)至總體積10.0 μL。置于PCR儀中,37℃孵育15 min,85℃加熱5 s。反轉錄得到的cDNA存于-20℃用于實時熒光定量分析。
1.5 筍竹PeTPS1及PeSnRK1基因全長cDNA克隆
根據毛竹基因組數據庫中PeTPS1和PeSnRK1基因序列設計基因全長及定量引物,選擇毛竹PeNTB基因作為熒光定量的內參基因,引物設計使用Primer 5.0軟件,并由上海生工合成以此設計特異性引物(表1),擴增這2個基因的系列片段。擴增程序為:94℃ 5 min;94℃ 30 s,60℃ 30 s,72℃ 30 s,共35個循環;72℃10 min。質量分數為1.0%的瓊脂糖凝膠電泳分離PCR擴增產物。回收純化目的條帶,連接到pMD19-T載體上并轉化至大腸埃希菌Escherichia coli(DH5α),菌落PCR鑒定陽性克隆后提取質粒,送往上海生工生物工程服務有限公司測序。

表1 本研究所用的引物名稱Table 1 PCR primers used in this study
1.6 PeTPS1及PeSnRK1反轉錄產物的基因表達分析
采用 TaKaRa公司 SYBR Premix Ex TaqTM(perfect real time)試劑盒,20.0 μL 反應體系中包含 10.0 μL SYBR Premix Ex TaqTM,0.8 μL正向引物,0.8 μL反向引物,2.0 μL反轉錄cDNA模版,6.4 μL滅菌蒸餾水。反應于Bio-Rad CFX manager 3.1 PCR儀上進行,以內參為對照,平行反應做5次·樣品-1。采用兩步法擴增標準程序:95℃預變性3 min,95℃10 s,60℃30 s,39次循環。反應完成后,得到含所有樣品的記錄點曲線,得出循環閾值(Ct值)。
1.7 數據處理
所得初始數據均經軟件進行整理,熒光定量數據按照公式計算:相對表達量=2-ΔΔCt[27],使用內參基因校正拷貝數,利用Origin 9.0軟件進行統計分析和作圖。
2 結果與分析
2.1 毛竹筍竹快速生長過程中可溶性糖質量分數變化
筍竹可溶性糖質量分數變化分析表明,黃昏后0 h到8 h,筍竹中部、下部和竹蔸蔗糖質量分數隨黃昏時間的增加均呈現逐漸下降的趨勢,其中黃昏后4 h,中部、下部和竹蔸蔗糖質量分數極顯著下降(P<0.01);黃昏后8 h蔗糖消耗量極顯著高于黃昏時(P<0.01);上部各時間蔗糖質量分數變化無顯著差異(圖1A)。黃昏后筍竹果糖與蔗糖質量分數變化相似,黃昏時,筍竹中部、下部和竹蔸果糖質量分數最高,夜間整體呈現逐漸下降的趨勢;黃昏時竹蔸中果糖質量分數最高,為上部的1.6倍,上部隨黃昏時間增加果糖質量分數變化不顯著(圖1B)。葡萄糖質量分數變化如圖1C所示,筍竹上部葡萄糖質量分數呈逐漸上升的趨勢,黃昏后8 h達到最大值,此時葡萄糖質量分數為黃昏時1.2倍,中部、下部、竹蔸葡萄糖質量分數隨時間變化均呈現極顯著下降的趨勢(P<0.01),黃昏時葡萄糖質量分數分別為黃昏后8 h的2.2倍、1.4倍和1.6倍。毛竹筍竹快速生長期海藻糖質量分數變化見圖1D。黃昏時,竹蔸海藻糖質量分數為1.45 mg·g-1,分別為下部、中部、上部的1.3倍、1.2倍和2.0倍;黃昏后4 h,筍竹下部、中部海藻糖質量分數極顯著升高(P<0.01),均高于上部;筍竹下部海藻糖質量分數呈現先上升再下降的的趨勢,在黃昏后4 h達到最大值。
上述結果表明:毛竹筍竹各部位中蔗糖、果糖、葡萄糖、海藻糖質量分數變化在不同時間內具有相似的表達模式。夜間筍竹中部和下部處于快速生長期,需要消耗大量碳水化合物,上部基本不生長,可溶性糖質量分數變化不顯著;竹蔸是筍竹快速生長期能量的暫存和周轉的重要部位,可溶性糖質量分數一直較高。
2.2 筍竹PeTPS1及PeSnRK1基因cDNA全長克隆及驗證
以確定純度和完整度較好的毛竹總RNA的反轉錄產物cDNA為模板,用普通PCR擴增筍竹PeTPS1及PeSnRK1基因全長,對擴增產物進行質量分數為1%瓊脂糖凝膠電泳檢測(圖2),條帶清晰且單一,獲得與預期片段大小一致、長度分別為1 440 bp和1 476 bp擴增產物。

圖1 毛竹不同部位可溶性糖變化Figure 1 Changes of bamboo shoots soluble sugar mass fraction in different parts of Phyllostachys edulis

圖2 毛竹PeTPS1及PeSnRK1基因cDNA擴增電泳圖Figure 2 Electrophoresis map of Phyllostachys edulis PeTPS1 and PeSnRK1 amplification on 1%agarose gel
2.3 毛竹筍竹快速生長過程中PeTPS1基因表達模式
黃昏后筍竹PeTPS1表達量變化如圖3所示。筍竹竹蔸與其他部位相比PeTPS1表達豐度較高,中部和上部PeTPS1表達豐度次之,下部表達量最低。黃昏后4 h筍竹竹蔸PeTPS1表達量達到極顯著水平(P<0.05),分別是下部、中部和上部的9.0倍、2.4倍和2.5倍。下部PeTPS1表達量在整個夜間隨時間變化被不同程度下調,黃昏時PeTPS1表達量較高,分別為4 h和8 h的3.2倍;中部和上部PeTPS1基因具有相同的表達模式,黃昏時表達豐度較低,黃昏后8 h轉錄水平達到高峰。上述結果表明:竹蔸在毛竹快速生長階段為其他部位提供碳源,筍竹下部已完成初生生長,海藻糖需求量小,PeTPS1基因表達量低。
2.4 毛竹筍竹快速生長過程中PeSnRK1基因表達模式
快速生長的毛竹筍竹PeSnRK1基因表達情況如圖4所示。從基部到頂部不同節間PeSnRK1表達量呈先下降再上升的趨勢,竹蔸表達豐度最高。上部和中部具有相同的表達模式,黃昏后4 h PeSnRK1表達量下降,黃昏后8 h又呈現上升的趨勢。下部和竹蔸PeSnRK1基因轉錄水平變化相同,黃昏后4 h PeSnRK1基因表達量顯著上升,轉錄水平達到高峰;黃昏后8 h PeSnRK1基因表達量又迅速下降,黃昏后4 h竹蔸種PeSnRK1基因表達量分別是下部、中部和上部的1.3倍、5.2倍和2.8倍。上述結果表明:黑暗條件下,快速生長期的毛竹筍竹中竹蔸和下部已停止生長或生長緩慢,PeSnRK1表達量較高,中部處于快速生長期,PeSnRK1表達豐度相對較低,上部生長速度不明顯。
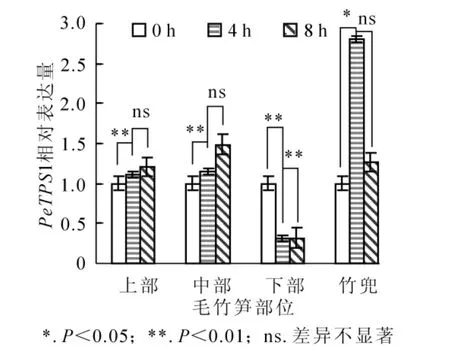
圖3 筍竹PeTPS1基因在不同部位的定量分析Figure 3 Change of bamboo shoots PeTPS1 relative expression in different parts of Phyllostachys edulis
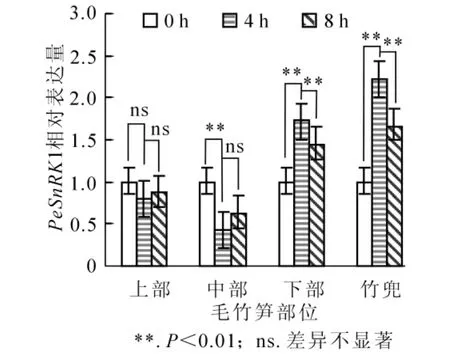
圖4 筍竹PeSnRK1基因在不同部位的定量分析Figure 4 Change of bamboo shoots PeSnRK1 relative expression in different parts of Phyllostachys edulis
3 討論
3.1 毛竹快速生長與可溶性糖質量分數變化關系
糖是植物光合作用的產物,呼吸作用的底物,糖類的合成與分解影響植物體內糖分的運輸,作為一種信號分子調節植物的生長發育過程[28]。例如,葡萄糖和蔗糖可以緩解高濃度海藻糖對植物生長的抑制作用,蔗糖和海藻糖在糖感受調控基因的表達中有相似的作用,海藻糖能代替蔗糖,調控碳水化合物的代謝[29]。筍竹莖稈處于快速生長階段,本研究中,筍竹上部生長發育、老化較晚,主要進行初生生長,耗能較低,可溶性糖質量分數幾乎沒有變化;中部和下部作為同化產物的利用組織代謝活力大幅度上調,隨時間的變化蔗糖、果糖、葡萄糖質量分數均顯著下降,而海藻糖質量分數處于上升的趨勢,可能是因為中部處于顯著伸長期,需要消耗更多的碳水化合物,合成海藻糖以補充能量;黃昏后8 h與4 h相比,可溶性糖及海藻糖質量分數下降均不顯著,其原因可能是下部生長逐漸緩慢,所需能量減少;竹蔸作為輸出同化產物的 “源”輸出被上調,黃昏后4 h可溶性糖質量分數顯著下降,合成大量T6P以維持竹蔸的生命活動,供應地上部分的快速生長。這與董麗娜[22]結論相似,筍竹各節的伸長活動自下而上,按慢—快—慢的規律,以節間為生長單位進行生長。
3.2 毛竹快速生長與相關基因表達量關系
能量缺乏時,T6P通過抑制SnRK1的表達來調控基因的表達,保證植物在逆境條件下能夠存活生長[18]。丁菲等[30]對茶樹不同器官中TPS表達量的研究發現不同組織中TPS表達量不同,而這種差異可能是由于組織和器官的生存環境、空間位置、發育狀況及代謝活動的不同造成的。在我們的研究中,筍竹各部位PeTPS1基因的表達隨時間的變化呈現升高—降低—再升高的趨勢。T6P作為一種信號整合由SnRK1調控的碳代謝、酶反應以及相關基因表達重排,從而調控植物的生長發育[31]。例如,擬南芥中Akinl0過量表達會誘導TPS1基因表達[32],通常蔗糖通過促進T6P的積累來抑制SnRK1活性,植物生長發育過程中細胞內蔗糖不斷被水解為果糖和葡萄糖,而SnRK1被高水平蔗糖或低水平葡萄糖激活[14]。本研究中,筍竹上部幾乎不生長,隨時間變化PeTPS1及PeSnRK1基因表達量幾乎沒有變化。正常條件下植物體內SnRK1水平較低,高水平SnRK1抑制植物生長[33],ZHANG等[19]研究發現,微摩爾濃度的T6P就可以抑制擬南芥幼苗及其他植物幼嫩組織提取物中SnRK1活性。我們的結果顯示,筍竹中部隨時間的變化PeTPS1表達量呈逐漸上升的趨勢,此時PeSnRK1表達量最低;下部已基本完成節間生長,PeSnRK1表達量與上部、中部相比較高,而PeTPS1相對表達量較低,可能是因為下部已完成基本生長,T6P失去對PeSnRK1活性的抑制作用[19];竹蔸是毛竹供應維持生長的碳水化合物的核心部位,需要分解白天儲存的淀粉以供應其夜間生長,因此,黃昏后竹蔸中PeSnRK1表達量處于最高。PeTPS1基因表達量呈現出與海藻糖變化相同的趨勢,說明毛竹快速生長過程中PeTPS1調控海藻糖的合成。黃昏后4 h竹蔸中PeSnRK1基因被激活,表達量達到峰值,可能是因為夜間毛竹不能進行光合作用,而PeSnRK1的表達則通過T6P含量進行調控。PeTPS1/PeSnRK1基因均存在組織特異性表達,基因的調控表達受不同發育時期的影響。
TPS1不僅參與植物體海藻糖的合成,而且調控糖酵解途徑。蔗糖調控基因SnRK1與海藻糖相互作用,調控植物碳代謝及相關基因表達,為植物的生長發育及其代謝提供保證[21]。高蔗糖/低葡萄糖情況下SnRK1被激活,誘導分解代謝基因的表達,激活淀粉合成途徑關鍵酶[34]。本研究中,SnRK1的標記基因TPS1被SnRK1抑制,通過海藻糖上調,這與TSAI等[35]研究結果相似,T6P/SnRK1信號同時參與植物的代謝調控及基因表達調控。筍竹上部伸長生長較慢,對可溶性糖需求量小,糖質量分數及其調控基因變化不顯著,PeSnRK1表達量水平較高;黃昏后筍竹中部葡萄糖、蔗糖和海藻糖質量分數較多,PeTPS1表達水平較高,T6P的濃度可能會比較高,進而抑制PeSnRK1的表達量及活性。植物通過調節T6P水平來調控體內蔗糖質量分數,從而促進幼苗在低蔗糖水平下的生長發育[11],中部伸長生長快,可溶性糖消耗較多,PeSnRK1表達量水平較低;竹蔸作為儲藏分配碳水化合物的重要部位,黃昏后4 h可溶性糖質量分數顯著下降,PeTPS1基因表達量被上調,合成T6P以維持竹蔸的生命活動,供應地上部分的快速生長。綜上所述,毛竹快速生長過程中糖調控相關基因之間交錯調控共同控制糖分的分配與運輸,以保證筍竹的快速生長,T6P/SnRK1信號通路作為必要的生長機制調,在毛竹筍竹快速生長發育過程的起到重要的調控作用。
通過對快速生長期毛竹筍竹夜間各部分可溶性糖質量分數及PeTPS1和PeSnRK1基因在多個部位中表達的分析可知,筍竹養料儲存部位竹蔸可溶性糖質量分數及相關基因表達量始終處于較高的水平;筍竹中部和下部處于快速生長期,可溶性糖質量分數隨時間變化不斷下降,快速伸長期部位中PeSnRK1基因的表達呈現與PeTPS1相反的模式;上部生長發育緩慢,可溶性糖質量分數及PeTPS1和PeSnRK1基因表達無顯著變化。結合上述研究,本實驗認為T6P/SnRK1信號通路通過調節毛竹各部位糖質量分數的分配進而調控筍竹的快速生長。T6P/SnRK1信號通路在植物生長發育中的生物學功能還需要進一步研究。
[1] DIETZE M C,SALA A,CARBONE M S,et al.Nonstructural carbon in woody plants [J].Annu Rev Plant Biol,2014,65(1):667-687.
[2] ROUNIS V,SKARMOUTSOS K,TSANIKLIDIS G,et al.Seeded and parthenocarpic cherry tomato fruits exhibit similar sucrose,glucose,and fructose levels,despite dissimilarities in UGPase and SPS gene expression and enzyme activity [J].J Plant Growth Regul,2015,34(1):47-56.
[3] 秦巧平,張上隆,陳俊偉,等.溫州蜜柑果實發育期間果糖激酶與糖積累的關系[J].植物生理與分子生物學學報, 2004, 30(4): 435-440.QIN Qiaoping,ZHANG Shanglong,CHEN Junwei,et al.The relationship of fructokinase and sugar accumulation during fruit development in satsuma mandarin [J].J Plant Physiol Mol Biol,2004,30(4):435-440.
[4] LU C A,LIN C C,LEE K W,et al.The SnRK1A protein kinase plays a key role in sugar signaling during germination and seedling growth of rice [J].Plant Cell,2007,19(8):2484-2499.
[5] ZHANG Yongqiang,HE Junxian.Sugar-induced plant growth is dependent on brassinosteroids [J].Plant Sign Behav,2015,10(12):1-3.
[6] MüLLER J,AESCHBACHER R A,SPRENGER N,et al.Disaccharide-mediated regulation of sucrose:fructan-6-fructosyltransferase,a key enzyme of fructan synthesis in barley leaves [J].Plant Physiol,2000,123(1):265-274.
[7] WINGLER A,FRITZIUS T,WIEMKEN A,et al.Trehalose induces the ADP-glucose pyrophosphorylase gene,ApL3 and starch synthesis in Arabidopsis [J].Plant Physiol,2000,124(1):105-114.
[8] IORDACHESCU M,IMAI R.Trehalose biosynthesis in response to abiotic stresses [J].J Integr Plant Biol,2008,50(10):1223-1229.
[9] WINGLER A,DELATTE T L,O’HARA L E,et al.Trehalose 6-phosphate is required for the onset of leaf senescence associated with high carbon availability [J].Plant Physiol,2012,158(3):1241-1251.
[10] SCHLUEPMANN H,PELLNY T,van DIJKEN A,et al.Trehalose 6-phosphate is indispensable for carbohydrate utilization and growth in Arabidopsis thaliana [J].Proc Nat Acad Sci,2003,100(11):6849-6854.
[11] HENRY C,BLEDSOE S W,GRIFFITHS C A,et al.Differential role for trehalose metabolism in salt-stressed maize[J].Plant Physiol,2015,169(2):1072-1089.
[12] KARIM S,ARONSSON H,ERICSON H,et al.Improved drought tolerance without undesired side effects in transgenic plants producing trehalose [J].Plant Mol Biol,2007,64(4):371-386.
[13] 丁順華,李艷艷,王寶山.外源海藻糖對小麥幼苗耐鹽性的影響[J].西北植物學報,2005,25(3):513-518.DING Shunhua,LI Yanyan,WANG Baoshan.Effect of exogenous trehalose on salt tolerance of wheat seedlings [J].Acta Bot Boreal-Occident Sin,2005,25(3):513-518.
[14] HALFORD N G,HEY S,JHURREEA D,et al.Metabolic signalling and carbon partitioning:role of Snf1-related(SnRK1) protein kinase [J].J Exp Bot,2003,54(382):467-475.
[15] BAENA-GONZáLEZ E,ROLLAND F,THEVELEIN J M,et al.A central integrator of transcription networks in plant stress and energy signaling [J].Nature,2007,448(7156):938-942.
[16] PURCELL P C,SMITH A M,HALFORD N G.Antisense expression of a sucrose non-fermenting-1-related protein kinase sequence in potato results in decreased expression of sucrose synthase in tubers and loss of sucrose-inducibility of sucrose synthase transcripts in leaves [J].Plant J,1998,14(2):195-202.
[17] CHO Y H,HONG J W,KIM E C,et al.Regulatory functions of SnRK1 in stress-responsive gene expression and in plant growth and development[J].Plant Physiol,2012,158(4):1955-1964.
[18] NUNES C,O’HARA L E,PRIMAVESI L F,et al.The trehalose 6-phosphate/SnRK1 signaling pathway primes growth recovery following relief of sink limitation [J].Plant Physiol,2013,162(3):1720-1732.
[19] ZHANG Yuhua,PRIMAVESI L F,JHURREEA D,et al.Inhibition of SNF1-related protein kinase1 activity and regulation of metabolic pathways by trehalose-6-phosphate [J].Plant Physiol,2009,149(4):1860-1871.
[20] PAUL M J,PRIMAVESI L F,JHURREEA D,et al.Trehalose metabolism and signaling [J].Annu Rev Plant Biol,2008,59(1):417-41.
[21] PAUL M J,JHURREEA D,ZHANG Y H,et al.Up regulation of biosynthetic processes associated with growth by trehalose 6-phosphate [J].Plant Sign Behav,2010,5(4):386-392.
[22] 董麗娜.毛毛竹稈莖高生長的發育解剖研究[D].南京:南京林業大學,2007.DONG Lina.Studies on Developmental Anatomy of Elongated Growth about Bamboo Culms [D].Nanijing:Nanjing Forestry University,2007.
[23] 劉琳,王玉魁,王星星,等.毛竹出筍后快速生長期莖稈色素含量與反射光譜的相關性[J].生態學報,2013, 33(9): 2703-2711.LIU Lin,WANG Yukui,WANG Xingxing,et al.Correlation between pigment content and reflectance spectrum of Phyllostachys pubescens stems during its rapid growth stage [J].Acta Ecol Sin,2013,33(9):2703-2711.
[24] 袁佳麗,溫國勝,張明如,等.毛竹快速生長期的水勢變化特征[J].浙江農林大學學報,2015,32(5):722-728.YUAN Jiali,WEN Guosheng,ZHANG Mingru,et al.Water potential with Phyllostachys edulis in its fast-growth periods [J].J Zhejiang A & F Univ,2015,32(5):722-728.
[25] PENG Zhenhua,LU Ying,LI Lubin,et al.The draft genome of the fast-growing non-timber forest species moso bamboo (Phyllostachys heterocycla) [J].Nat Genet,2013,45(4):456-461.
[26] CUI Kai,HE Caiyun,ZHANG Jianguo,et al.Temporal and spatial profiling of internode elongation-associated protein expression in rapidly growing culms of bamboo [J].J Proteome Res,2012,11(4):2492-2507.
[27] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCtmethod [J].Methods,2001,25(4):402-408.
[28] SHEEN J,ZHOU L,JANG J C.Sugars as signaling molecules [J].Curr Opin Plant Biol,1999,2(5):410-418.
[29] PAUL M J,PRIMAVESI L F,JHURREEA D,et al.Trehalose metabolism and signaling [J].Annu Rev Plant Biol,2008,59(1):417-41.
[30] 丁菲,龐磊,李葉云,等.茶樹海藻糖-6-磷酸合成酶基N(CsTPS)的克隆及表達分析[J].農業生物技術學報,2012, 20(11): 1253-1261.DING Fei,PANG Lei,LI Yeyun,et al.Cloning and expression analysis of trehalose-6-phosphate synthase gene(CsTPS) from tea plant(Camellia sinensis (L.) O.Kuntz) [J].J Agric Biotechnol,2012,20(11):1253-1261.
[31] LAWLOR D W,PAUL M J.Source/sink interactions underpin crop yield:the case for trehalose-6-phosphate/SnRK1 in improvement of wheat[J].Front Plant Sci,2014,5(418):1-14.doi:10.3389/fpls.2014.00418.
[32] GLINSKI M,WECKWERTH W.Differential multisite phosphorylation of the trehalose-6-phosphate synthase gene family in Arabidopsis thaliana:a mass spectrometry-based process for multiparallel peptide library phosphorylation analysis [J].Mol Cellul Prot,2005,4(10):1614-1625.
[33] POKHILKO A,EBENH?H O.Mathematical modelling of diurnal regulation of carbohydrate allocation by osmo-related processes in plants [J].J Royal Soc Interface,2015,12(104):1-11.doi:10.1098/rsif.2014.1357.
[34] GEIGENBERGER P.Regulation of starch biosynthesis in response to a fluctuating environment [J].Plant Physioly,2011,155(4):1566-1577.
[35] TSAI A Y,GAZZARRINI S.Trehalose-6-phosphate and SnRK1 kinases in plant development and signaling:the emerging picture [J].Front Plant Sci,2014,5(119):1-11.doi:10.3389/fpls.2014.00119.
Soluble sugar content and PeTPS1/PeSnRK1 gene expression in Phyllostachys edulis during rapid growth
LI Dandan1,XU Xinlu1,ZHAI Jianyun1,SUN Jianfei1,CAO Youzhi2,GAO Yan1,ZHANG Rumin1
(1.School of Forestry and Biotechnology,Zhejiang A & F University,Hangzhou 311300,Zhejiang,China;2.State Key Laboratory of Subtropical Silviculture,Zhejiang A & F University,Hangzhou 311300,Zhejiang,China)
To discuss expression of the PeTPS1/PeSnRK1 gene and soluble sugar mass fraction in different parts of Phyllostachys edulis bamboo during the process of rapid growth and to clarify their relationship with this rapid growth,the relative expression of PeTPS1 and PeSnRK1 in the bamboo stump and the lower,middle,and upper parts of the Ph.edulis bamboo shoot were analyzed at sunset (0 h),4 h,and 8 h after sunset using the quantitative reverse-transcriptase polymerase chain reaction (qRT-PCR)analysis technique.Also,the mass fraction of soluble sugars was analyzed by the kit method.Results showed that the soluble sugar mass fraction in the upper part of the bamboo shoot did not change.The mid-section of the bamboo shoot mass fraction at 8 h after dusk compared to sunset was lower 2.2 times for glucose,1.4 times for fructose,and 1.6 times for sucrose.Nutrient storage mass fractions in the bamboo stump at 8 h after sunset compared to 8 h after sunset was lowerfor glucose (1.6 times),fructose (1.3 times),sucrose (1.4 times),and trehalose (1.3 times).Expression of the PeTPS1 gene in the middle of the bamboo shoot was 4.8 times lower than in the lower part of the bamboo shoot.Expression of the PeSnRK1 gene in the bamboo stump compared to the other parts was higher at 8 h after sunset and was 1.7 times higher compared to dusk.These results could provide new insights into the mechanism of rapid growth of Ph.edulis as well as direct fast-growth and breeding of other trees.[Ch,4 fig.1 tab.35 ref.]
botany;Phyllostachys edulis;trehalose;PeTPS1;PeSnRK1;rapid growth
S718.3
A
2095-0756(2017)06-1016-08
10.11833/j.issn.2095-0756.2017.06.007
2016-11-23;
2017-01-12
國家自然科學基金資助項目(31570686,30972397)
李丹丹,從事植物生理生態學研究。E-mail:hutaoqiu1112@126.com。通信作者:曹友志,講師,博士,從事林木分子生物學等研究。E-mail:yzcao@zafu.edu.cn

