食品級過氧化氫在細胞水平的毒理學研究
丁宇,楊磊,王晨光,田愷,劉鳳娟,于燕燕
(天津出入境檢驗檢疫局工業產品安全技術中心,天津300308)
食品級過氧化氫在細胞水平的毒理學研究
丁宇,楊磊,王晨光,田愷,劉鳳娟,于燕燕
(天津出入境檢驗檢疫局工業產品安全技術中心,天津300308)
過氧化氫作為強氧化劑的代表物之一,被廣泛應用于食品工業,起到防腐、漂白、除臭等作用。而食品中殘留及非法添加的過氧化氫對消費者健康存在著嚴重危害。近年來,細胞毒理學作為一門熱門學科,用于研究外源性物質對生命細胞損傷作用規律及其機制,從而進行食品安全性分析,具有準確、快速、經濟等特點,在食品安全檢測和研究領域具有良好的應用前景。利用細胞形態學變化以及細胞凋亡檢測技術研究食品級過氧化氫的危害。
過氧化氫;細胞毒理學;食品安全
過氧化氫(H2O2)以其優良的氧化、漂白、消毒作用,廣泛運用在各類化工、食品、紡織、醫藥、電子及環境保護等領域[1]。近年來,隨著我國食品行業不斷發展,食品級過氧化氫在食品領域中的礦泉水、乳品、飲料、水產品、水果、啤酒等食品生產過程中廣泛運用。由于利益驅使及監管不足的內外因素,導致其在食品工藝中存在超標添加的問題,進而引發各類食物中毒事件。例如利用過氧化氫加工雞爪、泡椒魚皮、漂白開心果等。按照我國近年所頒布的食品添加劑運用標準GB 2760-2014《食品安全國家標準食品添加劑使用標準》,過氧化氫在達到食品級別的要求下,可用于食品加工制備,不過在制成出售前,要求能及時清除,并嚴格檢測,只有在其含量達標的情況下,才可以銷售。
在發達國家,過氧化氫的使用在劑量、使用范圍、都受到嚴格監督。在我國,當前百姓越來越關注健康問題,對于各類食品添加劑的殘留也越來越重視,眾多實驗證實,一旦人體攝入過量的過氧化氫,必定會造成身體的傷害,包括對細胞的損害,加速人體衰老、及引發器官癌變等[2],尤其是其能產生過量的羥基自由基,將參與到人體內的羥基化反應及電子轉移,造成人體細胞的壞死或病變,從而危害人體健康,屬于毒性各類毒性中的最大自由基。
相關研究顯示,過氧化氫的檢測方式很多,包括化學滴定法、分光光度法、高效液相色說來法、熒光光度法、電化學分析法等[3-4]。近年來,隨著細胞水平毒理學檢測與研究逐漸興起,通過對外源性毒害因子所產生的致癌性,對機體細胞毒性和特異細胞毒作用、毒物代謝及其毒效應的作用機制的等方式,來開展藥物篩選、食品安全性分析。此外,細胞培養還將對功能食品的效果成分展開毒性評價[5-8]。現階段,有關細胞毒理學已在食品界獲得廣泛運用,細胞毒理學透過離體培育的細胞不僅能用作研究目標毒物對于靶細胞毒性和其毒物于細胞內展開的生物轉化[9-10]。還可用作研究目標毒物對靶細胞的功能,通過細胞毒理學有助于有效評價食品安全性,達到檢測食物中的毒素、重金屬及農藥殘留、添食品加劑等[11-13]。
本文利用細胞毒理學中的細胞形態學變化以及細胞凋亡檢測技術研究食品級過氧化氫的危害。
1 材料
1.1 材料與試劑
無鈣臺氏液:135 mmol/L NaCl,5.4 mmol/L KCl,1.0 mmol/L MgCl2,0.33 mmol/L NaH2PO4,10 mmol/L 4-羥乙基哌嗪乙磺酸,5.5 mmol/L葡萄糖,用NaOH溶液調至pH7.4;含鈣臺氏液:于無鈣臺氏液中加進CaCl2至1.8 mmol/L;KB液:50 mmol/L聚谷氨酸,40 mmol/L KCl,20 mmol/L 牛磺酸,20 mmol/L KH2PO4,10 mmol/L葡萄糖,10 mmol/L HEPES,0.5 mmol/L乙二醇二乙醚二胺四乙酸(EGTA),3 mmol/L MgCl2,以 KOH 溶液調pH7.4;膠原酶、蛋白酶:日本公司 Yakult公司;H2O2、5,5'-二硫雙(2-硝基苯甲酸):Sigma Aldrich公司。
1.2 儀器
Facscan流式細胞儀:美國Dickinson公司;HHS電熱恒溫水浴鍋:天津市華北實驗儀器有限公司;FV300激光掃描共聚焦顯微鏡:日本Olympus公司;311A細胞培養箱:日本ESPC公司;3K15離心機:德國sigma公司。
1.3 方法
1.3.1 心肌細胞分離
試驗選擇選用健康成年豚鼠(300 g~400 g),1%戊巴比妥鈉按進行腹腔注射麻醉后,取出心臟并將主動脈連于Langendorff灌流裝置中,維持37℃恒溫及供氧條件以含鈣臺氏液連續灌流約3 min(沖洗心臟內殘血,予以細胞更加充裕的氧),無鈣臺氏液灌流約6 min(解除心肌細胞內橋粒與連接),以含0.05%膠原酶無鈣臺氏液灌流到心室肌組織被消化(解離細胞間結締組織);以KB液灌流沖洗并剪碎其中的心室肌組織,再機械分散至單個細胞,接著以濾網進行過濾,再以0.002 5%蛋白酶孵育3 min;離心3次(每次3 min);所得細胞存儲在KB液,將溫度調至4℃保存。
1.3.2 細胞鈣瞬變的測定
將制備而成豚鼠心肌細胞內加進二甲基亞砜(DMSO)溶液,將其稀釋至 25 μmol/L 的 Fluo-340 μL染色,此后將培養皿放置在37℃水浴箱內,避光水浴30 min后,加進無鈣液400 μL沖洗2次;通過激光掃描共聚焦顯微鏡,于視野下找出細胞(挑選出其中形態良好、染色程度最好的),以該顯微鏡展開實時監測心肌細胞產生的熒光值變化并記錄下來,即為鈣離子的濃度變化。
參數設置為:激發波長(λex)488 nm,發射波長(λem)520 nm。分別加進濃度5 mmol/L的過氧化氫10、20、30μL,通過氧化氫終濃度:0.125、0.25、0.375 mmol/L,運用Time Coursw程序進行平面掃描,各試驗組均掃描60張,每張間隔10 s,持續性觀察各試驗組500 s內鈣離子熒光強度(FI)產生的變化情況。
1.3.3 細胞凋亡率
將心肌細胞接種于24孔培養板內,隨機分成NC組,0.1、0.25、0.5 mmol/L H2O2處理組,分別作用 1、3、6、12 h,隨后通過(AO/EB)染色法展開檢測。用倒置熒光顯微鏡進行拍照,通過200個細胞計算凋亡率。
1.3.4 數據處理
將每10秒所對應鈣離子熒光值減掉基線鈣離子熒光值,所獲得的數據作為某時鈣瞬變熒光強度,取其中50個時間點并計算平均值,代表鈣瞬變熒光強度值。透過統計學處理,正態分布計量資料以均值±標準差表示,針對多樣本比較運用單因素方差法展開分析,以P<0.05代表具統計學意義。
2 結果與分析
2.1 心肌細胞鈣瞬變
不同濃度H2O2對豚鼠心肌細胞鈣瞬變影響見表1、圖 1。
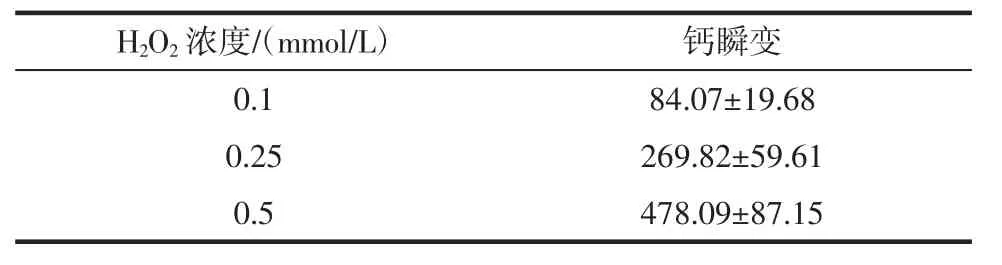
表1 不同濃度H2O2對豚鼠心肌細胞鈣瞬變影響Table 1 Different concentrations of H2O2induced Intracellular Ca2+transient
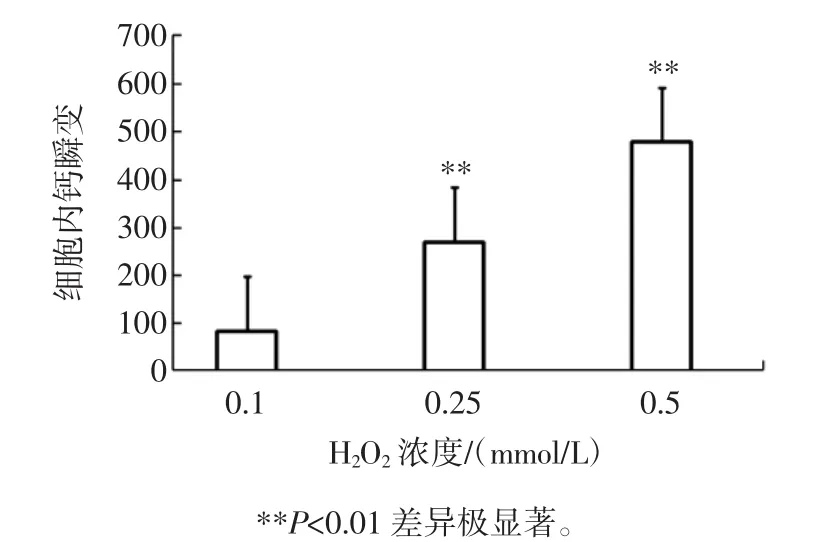
圖1 0.1、0.25、0.5 mmol/L H2O2對豚鼠心肌細胞鈣瞬變Fig.1 Intracellular Ca2+transient induced by 0.1,0.25,0.5 mmol/L H2O2
由表1可見,在加入3種不同濃度(0.1、0.25、0.5 mmol/L)H2O2引起鈣瞬變增加,而且隨濃度升高而增加,統計學比較差異顯著(P<0.01)分別為84.07±19.68,269.82±59.61,478.09±87.15。心肌細胞作為終末分化細胞,正常情況下不存在明顯的凋亡。
2.2 細胞凋亡
H2O2各劑量組的細胞凋亡率和空白對照組展開比較,差異均具統計學意義(P<0.01)。在作用時間1、3 h下H2O2組均伴隨H2O2濃度增大,豚鼠心肌細胞凋亡率隨之增大;作用到6 h時,0.25 mmol/L劑量組細胞凋亡率達到最高值23.3%,該峰值后細胞凋亡率便隨H2O2濃度增大而下降;作用12 h的H2O2組隨H2O2濃度增大,細胞凋亡率隨之增大,至0.25 mmol/L時凋亡率達18.9%的峰值,此后隨H2O2濃度增大反下降。
心肌細胞屬于終末分化細胞,在正常情況下是無明顯凋亡的。不過疾病狀態之下,比如心肌梗塞、缺血、缺氧及再灌注損傷,心肌細胞將產生顯著凋亡;本結果證實低劑量(0.1、0.25、0.5 mmol/L)H2O2可明顯強化心肌細胞鈣離子濃度,同時還有著時間和劑量依賴性,從而可誘導產生心肌細胞的凋亡,進而對整個人體健康造成危害[14-15]。
H2O2對豚鼠心肌細胞凋亡率影響見表2。
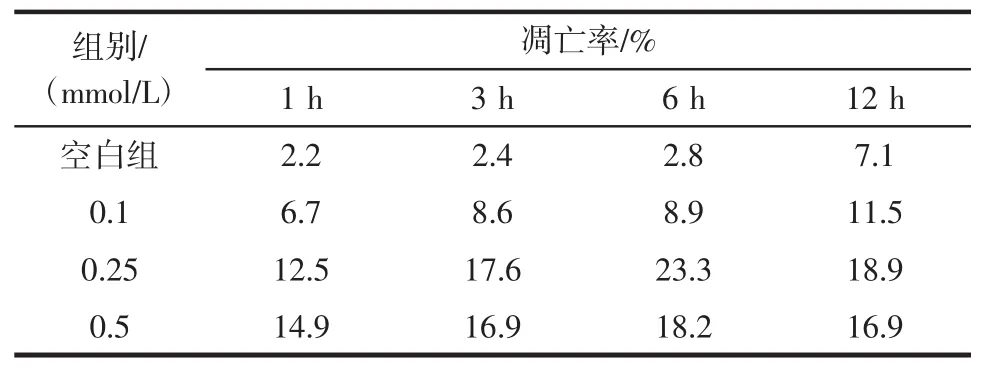
表2 H2O2對豚鼠心肌細胞凋亡率影響Table 2 Flow cytometry analyses of cell apoptosis induced by H2O2
3 結論
1)Ca2+屬于眾多細胞凋亡信號載體,對于細胞生存和凋亡存在重要作用[16-18],本試驗通過激光掃描共聚焦顯微鏡觀察心肌細胞熒光值變化,代表鈣離子濃度變化,發現0.1、0.25、0.5 mmol/L H2O2能明顯增加心肌細胞的鈣離子濃度,并且呈時間及劑量依賴性。
2)豚鼠心肌細胞在 0.1、0.25、0.5 mmol/L H2O2影響下DNA凋亡率隨著暴露劑量增加而增加。
本試驗中的過氧化氫作為外源性活性氧,進入人體內后可作為信號,通過誘導線粒體的通透性轉為變孔開放,推動線粒體的鈣離子內流,同時令細胞自身線粒體和其它線粒體產生氧化應激反應。氧化應激反應是透過影響電壓的依賴性鈣離子通道從而令非特異性細胞膜鈣離子通透性產生變動及產生鈉鈣離子交換等,進而影響鈣離子(Ca2+)由內質網釋放[19],進而破壞內質網中Ca2+穩態,促發內質網出現超負荷反應[20]。由此可判定外源性過氧化氫透過心肌細胞抗氧化防御系統受損,造成內源性活性氧生成的增加,進而出現氧化應激,推動細胞內鈣離子的重新分布,最終誘導心肌細胞凋亡。
本文利用細胞毒理學中的細胞形態學變化以及細胞凋亡檢測技術,研究食品級過氧化氫的對豚鼠心肌細胞鈣瞬變以及細胞凋亡的影響及其作用機制,為今后食品級過氧化氫檢測及毒理學研究提供參考。
[1]張平均.食品級過氧化氫的消毒特性及其在食品行業中的應用[J].中國乳品工業,2005(7):47-50
[2]陳迪航,李綿慶.過氧化氫的應用領域與主要生產方法[J].化工技術與開發,2011,40(3):32-35
[3]黃玉艾,王菲,盧靜.細胞技術在食品毒理學毒性快速篩選方面的應用研究[J].食品科學,2007(8):535-537
[4]S G Rhee,T S Chang,W Jeong,et al.Methods fordetection and measurement of hydrogen peroxide inside andoutside of cells[J].Molecules and Cells,2010,29(6):539-549
[5]MAIER E,KURZ K,JENNY M,et al.Food preservatives sodiumbenzoate and propionic acid and colorant curcumin suppress The L-type immune response in vitro[J].Food and Chemical Toxicology,2010,48(7):1950-1956
[6]BRUNER L H,CARR G J,CURREN R D,et al.Validation of alternativemethods for toxicity testing[J].Environ Health Perspect,1998,106(2):477-484
[7]Makris SL,Kim JH,Ellis A,et al.Current and future needs for developmental toxicity testing.[J].Birth Defects Res B Dev Reprod Toxicol,2011,92(5):384-394
[8]PIERSMA AH.Alternative methods for developmental toxicity testing[J].Basic&Clinical Pharmacology&Toxicology,2006,98(5):427-431
[9]沈雪,王昊,關爽,等.細胞毒性在食品安全性中的應用研究[J].食品科學,2008,29(9):621-623
[10]黃玉艾,王菲,盧靜.細胞技術在食品毒理學毒性快速篩選方面的應用研究[J].食品科學,2007,28(8):535-537
[11]MWANZA M,KAMETLER L,BONAI A,et al.The cytotoxic effect offumonisin B1 and ochratoxin A on human and pig lymphocytes usingthe Methyl Thiazol Tetrazolium (MTT)assay.[J].Mycological Research,2009,25(4):233-238
[12]PENG Liang,WANG Bochu,REN Peng.Reduction of MTT by flavonoids in the absence of cells[J].Colloids and Surfaces B:Biointerfaces,2005,45(2):108-111
[13]BREDFELDT T G.Low-level Arsenic toxicity in human bladder cells[D].Arizona:The University of Arizona,2006
[14]徐長慶,張偉華.心血管系統鈣敏感受體的研究進展[J].中國病理生理雜志,2010,26(2):409-413
[15]吳強,陳吉.氧化應激與心肌細胞凋亡[J].中國心血管病研究雜志,2004,2(7):570-572
[16]Yang L,Xu J,KameyamaM.Mechanisms underlying the modulation of L-type Ca2+channel by hydrogenperoxide in guinea pig ventricular myocytes[J].Physiol Sci.Nov,2013,63(6):419-426
[17]高青華,朱彤,楊磊.壬基苯酚對豚鼠心室肌細胞L-型鈣電流的影響[J].中國醫科大學學報,2010,39(2):81-83
[18]Brookes PS,Yoon Y,Robotham JL,et al.Calcium,ATP,and ROS:Amitochondriallove-hatetriangle[J].AmJPhysiolCellPhysiol,2004,287(4):817-833
[19]東方,高世勇,季宇彬.Ca2+介導的細胞凋亡通路研究進展[J].齊齊哈爾醫學院學報,2008,29(13):1602-1604
[20]Kroemer G,Reed JC.Mitochondrial control of cell death[J].Na Med,2000,6(5):513-519
Toxicological Studies on Food Grade Hydrogen Peroxide at Cell Level
DING Yu,YANG Lei,WANG Chen-guang,TIAN Kai,LIU Feng-juan,YU Yan-yan
(Technical Center for Safety of Industrial Products of Tianjin Enter-Exit Inspection Quarantine Bureau,Tianjin 300308,China)
As one of the representative of strong oxidizing agent,hydrogen peroxide is widely used in the food industry.However,there is a serious harm to the health of consumers in the food residue and illegally added hydrogen peroxide.In recent years,as a hot subject,cellular toxicology has been used to study the law and mechanism of the damage of exogenous substances on living cells which has a good application prospect in the field of food safety detection and research.In this paper,the changes of cell morphology and cell apoptosis were used to study the harm of food grade hydrogen peroxide.
hydrogen peroxide;cell toxicology;food safety
10.3969/j.issn.1005-6521.2017.23.038
丁宇(1980—),男(漢),高級工程師,研究生,研究方向:危險品檢測。
2017-03-23

