黑脈羊肚菌多酚分級(jí)制備及其抗氧化活性
廖 霞,李葦舟,鄭少杰,盧可可,石 芳,吳素蕊,明 建,3,*
(1.西南大學(xué)食品科學(xué)學(xué)院,重慶 400715;2.中華全國(guó)供銷合作總社昆明食用菌研究所,云南 昆明 650223;3.重慶市特色食品工程技術(shù)研究中心,重慶 400715)
黑脈羊肚菌多酚分級(jí)制備及其抗氧化活性
廖 霞1,李葦舟1,鄭少杰1,盧可可1,石 芳1,吳素蕊2,明 建1,3,*
(1.西南大學(xué)食品科學(xué)學(xué)院,重慶 400715;2.中華全國(guó)供銷合作總社昆明食用菌研究所,云南 昆明 650223;3.重慶市特色食品工程技術(shù)研究中心,重慶 400715)
以黑脈羊肚菌為原料,采用不同極性溶劑提取多酚,分別得到乙酸乙酯相、甲醇相和水相多酚提取物,通過高效液相色譜分析其組分,測(cè)定其對(duì)1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力、2,2’-聯(lián)氨-(3-乙基苯并噻唑啉-6-磺酸)二銨鹽(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)自由基清除能力和抗氧化能力指數(shù)(oxygen radical absorbance capacity,ORAC)值,并探討該多酚提取物含量與抗氧化相關(guān)性。結(jié)果表明,黑脈羊肚菌總酚含量為20.109 mg/g,其中水相組分多酚含量最高(14.478 mg /g),甲醇相次之(5.443 mg/g),乙酸乙酯相組分多酚含量最低(0.188 mg/g)。3 種溶劑的多酚提取物組成中,葒草素含量均為最高。水相組分清除DPPH自由基能力最強(qiáng),甲醇相組分清除ABTS+·能力最強(qiáng),乙酸乙酯相組分具有較高的ORAC值。多酚含量與DPPH自由基清除率、ORAC值具有顯著相關(guān)性(p<0.05)。
黑脈羊肚菌;極性溶劑;抗氧化能力;高效液相色譜
羊肚菌是一種珍貴的食藥用真菌[1],屬盤菌綱盤菌目羊肚菌屬,因其子實(shí)體極似羊肚而得名[2]。黑脈羊肚菌(Morchella angusticeps Peck)是其中常見的品種之一,春末夏初生于針葉林地,在我國(guó)主要分布于云南、西藏、甘肅等12 個(gè)地區(qū)[3-4]。黑脈羊肚菌中富含多糖[5]、蛋白質(zhì)[6]、粗纖維[7]、多種常量和微量元素[8],是一種集營(yíng)養(yǎng)、保健、藥用功能于一體的優(yōu)質(zhì)資源,具有抗氧化、抗細(xì)胞增殖、增強(qiáng)免疫和誘導(dǎo)細(xì)胞凋亡等生物功能活性[9-11]。很多研究普遍認(rèn)為活性多糖是羊肚菌中主要的活性物質(zhì),但也有研究發(fā)現(xiàn)黑脈羊肚菌體內(nèi)富含多酚類物質(zhì),具有一定的抗氧化作用[12]。
由于多糖功能活性為人們熟知,因此對(duì)羊肚菌胞外多糖活性研究較多[13-15],對(duì)羊肚菌多酚的研究比較少,對(duì)黑脈羊肚菌的研究更少。用不同極性有機(jī)溶劑萃取植物多酚的研究不少[16-17],但關(guān)于萃取黑脈羊肚菌多酚的研究鮮見報(bào)道。孫瓊[18]采用不同極性溶劑萃取杏鮑菇黃酮類化合物,其中氯仿相總黃酮含量最高,乙酸乙酯相次之,水飽和正丁醇相和石油醚相最少,且不同極性部位均有一定的抗氧化作用。本研究采用不同極性溶劑萃取黑脈羊肚菌多酚類物質(zhì),比較各萃取組分的多酚含量和抗氧化活性,分析其多酚組分,為黑脈羊肚菌綜合利用和產(chǎn)品開發(fā)提供理論依據(jù)。
1 材料與方法
1.1 材料與試劑
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)(分析純)、2,2’-聯(lián)氨-(3-乙基苯并噻唑啉-6-磺酸)二銨鹽(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)、抗壞血酸、熒光素鈉鹽(fluorescein disodium salt,F(xiàn)L)、6-羥基-2,5,7,8-四甲基色烷-2-羧酸(6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid,Trolox) 美國(guó)Sigma公司;2,2’-偶氮二異丁基脒鹽酸鹽(2,2’-azobis(2-methylpropionamidine) dihydrochloride,ABAP)日本W(wǎng)ako Chemicals公司;蘆丁 成都科龍化工試劑廠;乙腈(色譜級(jí)) 德國(guó)Merck公司;其他化學(xué)試劑均為分析純。
1.2 儀器與設(shè)備
XHF-D均質(zhì)機(jī) 寧波新芝生物科技有限公司;JYL-A110粉碎機(jī) 上海恒平科學(xué)儀器有限公司;HH-6數(shù)顯恒溫水浴鍋 金壇市富華儀器有限公司;1-15PK離心機(jī) 美國(guó)Sigma公司;UV-2450紫外-可見分光光度計(jì)、SPD-M20A高效液相色譜儀(high performance liquid chromatography,HPLC) 日本島津公司;DHG-9140A電熱恒溫鼓風(fēng)干燥箱 上海齊欣科學(xué)儀器有限公司;85-2數(shù)顯恒溫磁力攪拌器 金壇市易晨?jī)x器制造有限公司;5810臺(tái)式高速離心機(jī) 德國(guó)Eppendorf公司;RE-5296旋轉(zhuǎn)蒸發(fā)器 上海亞榮生化儀器廠;LGJ-10真空冷凍干燥 北京松原華興科技發(fā)展有限公司;KQ-100超聲波清洗器 昆山市超聲儀器有限公司;722分光光度計(jì) 上海精科科學(xué)儀器廠;PB-10 pH計(jì) 德國(guó)賽多利斯公司;SpectraMax M2多功能酶標(biāo)儀 美國(guó)Molecular公司。
1.3 方法
1.3.1 樣品預(yù)處理
黑脈羊肚菌產(chǎn)自云南,由中華全國(guó)供銷總社昆明食用菌研究所提供。采摘后12 h內(nèi)速凍,于-20 ℃下凍藏,實(shí)驗(yàn)前取出冷凍羊肚菌于50 ℃烘箱烘干至恒質(zhì)量,用中藥粉碎機(jī)粉碎,過60 目篩后密封備用。
1.3.2 多酚提取
參考Chideh等[19]的方法,根據(jù)實(shí)驗(yàn)室條件稍作修改,準(zhǔn)確稱取25 g黑脈羊肚菌粉末,加入500 mL石油醚,磁力攪拌24 h,于3 500 r/min離心10 min,棄去上清液,殘?jiān)貜?fù)操作兩次,棄去上清液。向離心后的殘?jiān)屑尤胍宜嵋阴ビ谑覝靥幚? 次(每次500 mL,24 h),3 500 r/min離心10 min,合并收集上清液,抽濾后于45 ℃旋轉(zhuǎn)蒸干,定容至10 mL,為乙酸乙酯相提取物。離心后的殘?jiān)眉状继幚? 次,合并收集上清液,抽濾后于45 ℃旋轉(zhuǎn)蒸干,定容至25 mL,為甲醇相提取物。離心后的殘?jiān)盟幚? 次,收集上清液,抽濾后于45 ℃旋轉(zhuǎn)蒸干,定容至25 mL,為水相提取物。
1.3.3 多酚含量測(cè)定
標(biāo)準(zhǔn)曲線的制作:參考Chu Yifang等[20]方法,稱取25 mg沒食子酸,加入適量去離子水充分溶解,定容至25 mL,得到1 mg/mL沒食子酸溶液。用去離子水配制成質(zhì)量濃度分別為0、20、40、60、80、100、150、200、250、300 μg/mL的沒食子酸標(biāo)準(zhǔn)液。取200 μL標(biāo)準(zhǔn)液加入試管中,再依次加入800 μL去離子水、200 μL福林-酚試劑,振搖試管使樣品充分混合,避光保存6 min,再加入2 mL 7% Na2CO3溶液和1.6 mL去離子水,避光條件下放置90 min后于760 nm波長(zhǎng)處測(cè)定吸光度。以多酚質(zhì)量濃度為橫坐標(biāo),吸光度為縱坐標(biāo),繪制標(biāo)準(zhǔn)曲線,得回歸方程為:y=0.003 8x+0.054(R2=0.991 5)。
多酚含量測(cè)定:采用福林-酚法,取3 種溶劑提取獲得的多酚提取液(可作適當(dāng)稀釋,200 μL),并用去離子水補(bǔ)至1 mL,后續(xù)操作同標(biāo)準(zhǔn)曲線的制備。結(jié)果以每克黑脈羊肚菌樣品中所含的沒食子酸當(dāng)量表示,以干質(zhì)量計(jì)。
1.3.4 HPLC鑒定羊肚菌多酚組分
參照Palacios等[21]的方法做適當(dāng)修改,將3 種溶劑提取獲得的多酚提取液和多酚標(biāo)準(zhǔn)品經(jīng)0.45 μm有機(jī)濾膜過濾后使用HPLC檢測(cè)。
色譜條件:色譜柱為B D S C18反相柱(250 mm×4.6 mm,5 μm);流動(dòng)相A為0.1%冰乙酸;流動(dòng)相B為100%乙腈,梯度洗脫程序?yàn)椋?~2 min 0% B;2~5 min 5% B;5~23 min 40% B;23~28 min 80% B;28~32 min 5% B;進(jìn)樣量:10 μL;柱溫:25 ℃;流速:0.7 mL/min;檢測(cè)波長(zhǎng)254 nm。
1.3.5 黑脈羊肚菌多酚抗氧化活性測(cè)定
1.3.5.1 DPPH自由基清除率測(cè)定
參考Gangopadhyay等[22]方法并稍作修改。分別吸取100 μL的0、2.5、5、10、20、40 μg/mL不同溶劑提取的多酚提取液和100 μL 120 μmol/L DPPH溶液,一式3 份點(diǎn)樣到96孔酶標(biāo)板,37 ℃溫育30 min,在515 nm波長(zhǎng)處測(cè)定吸光度Ai。以水作空白對(duì)照,測(cè)定空白對(duì)照樣吸光度Aj,抗壞血酸作為陽(yáng)性對(duì)照。按公式(1)計(jì)算樣品DPPH自由基清除率。
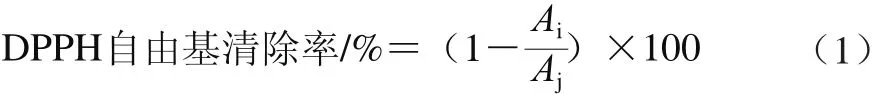
1.3.5.2 ABTS+·清除率測(cè)定
參考Soong等[23]方法測(cè)定,將5 mL 7 mmol/L ABTS溶液和88 μL 140 mmol/L過硫酸鉀溶液混合,在室溫、避光條件下靜置過夜(12~16 h),形成ABTS儲(chǔ)備液。將生成的ABTS儲(chǔ)備液用10 mmol/L pH 7.4的磷酸鹽緩沖液稀釋,使其在室溫條件下于734 nm波長(zhǎng)處吸光度為0.70±0.02,得到ABTS工作液。將3 種溶劑提取獲得的多酚提取液做相應(yīng)稀釋后,取3 mL的0.0、0.1、0.2、0.4、0.6、0.8、1.0 μg/mL不同溶劑提取的多酚提取液和1 mL ABTS工作液于10 mL試管中,以抗壞血酸為陽(yáng)性對(duì)照,混合均勻后30 ℃水浴反應(yīng)6 min,然后于734 nm波長(zhǎng)處測(cè)定吸光度Ai,以水作空白對(duì)照,測(cè)定空白對(duì)照樣吸光度Aj。按公式(2)計(jì)算樣品ABTS+·清除率。
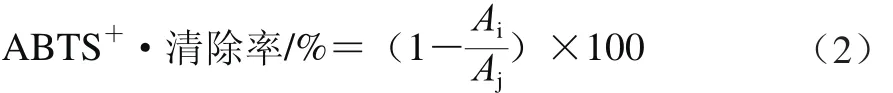
1.3.5.3 ORAC值測(cè)定
參照文獻(xiàn)[24-25]的方法,并根據(jù)本實(shí)驗(yàn)室條件稍作修改,即分別精確吸取20 μL磷酸緩沖液(空白液)、Trolox標(biāo)準(zhǔn)液(6.25 μmol/L)和0.0、0.1、0.2、0.4、0.6、0.8、1.0 μg/mL的不同溶劑提取的多酚提取液,一式3份點(diǎn)樣到96 孔黑色底部透明的酶標(biāo)板。在37 ℃溫育10 min,加入200 μL 0.96 μmol/L熒光工作液,再在37 ℃溫育20 min并間歇搖動(dòng),迅速加入新鮮配制的119 mmol/L ABAP工作液20 μL,于激發(fā)波長(zhǎng)485 nm、入射波長(zhǎng)520 nm條件下立即讀數(shù),每4.5 min進(jìn)行一次讀數(shù),檢測(cè)2.5 h,共讀數(shù)35 次。根據(jù)測(cè)定值計(jì)算抗氧化能力指數(shù)(oxygen radical absorbance capacity,ORAC),按公式(3)計(jì)算熒光衰減曲線下的面積(AUC),帶入Trolox標(biāo)準(zhǔn)曲線,計(jì)算出1 μg/mL樣品的ORAC值,結(jié)果以μmol TE/L表示。
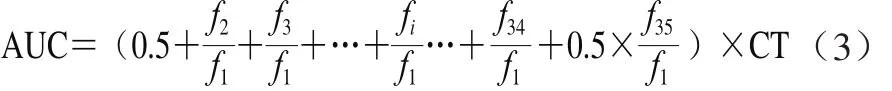
式中:f1為第一次熒光讀數(shù)值;fi為第i次熒光讀數(shù)值;CT為間隔測(cè)定時(shí)間。
1.3.6 數(shù)據(jù)統(tǒng)計(jì)分析
數(shù)據(jù)采用Origin 8.0和Excel 2007軟件統(tǒng)計(jì)分析,實(shí)驗(yàn)重復(fù)3 次,結(jié)果用 ±s表示,并用SPSS軟件進(jìn)行統(tǒng)計(jì)處理,采用ANOVA進(jìn)行顯著性分析。
2 結(jié)果與分析
2.1 黑脈羊肚菌不同溶劑提取物中多酚含量

表1 黑脈羊肚菌不同溶劑提取物中多酚含量Table 1 Polyphenol contents of various extracts from Morchella angusticeps Peck
由表1可知,黑脈羊肚菌不同溶劑提取物中多酚含量具有顯著性差異,乙酸乙酯相和甲醇相含量分別為0.188、5.443 mg/g,水相組分含量為14.478 mg/g,總酚含量為20.109 mg/g,比香菇和猴頭菇[26]中總酚含量高。其中水相提取物多酚含量最高,占總酚含量72%,乙酸乙酯相含量最低,與Anacristina等[27]報(bào)道的8 種歐洲食用菌中水相提取物比甲醇相提取物多酚含量高的趨勢(shì)一致。
2.2 黑脈羊肚菌不同溶劑多酚提取物中多酚組分分析
通過HPLC法進(jìn)一步研究黑脈羊肚菌多酚組成和含量。圖1為6 種標(biāo)準(zhǔn)品的HPLC圖,各種多酚標(biāo)準(zhǔn)品在色譜柱上的保留時(shí)間差異明顯。通過計(jì)算標(biāo)準(zhǔn)品峰面積與含量之間的關(guān)系,得到多酚標(biāo)準(zhǔn)品的回歸方程見表2。由表2可知,甲醇相中含有沒食子酸、原兒茶酸、綠原酸、對(duì)羥基苯甲酸、咖啡酸、葒草素6 種多酚類成分,水相中含有沒食子酸、原兒茶酸、綠原酸、咖啡酸、葒草素5 種多酚類成分,乙酸乙酯相中含有沒食子酸、原兒茶酸、對(duì)羥基苯甲酸、葒草素這4 種多酚類成分。除葒草素外,有關(guān)菌類文獻(xiàn)報(bào)道過含有其他5 種多酚類成分[28-29]。3 種溶劑提取的多酚中,葒草素含量均為最高,甲醇相、水相、乙酸乙酯相中分別為339.56、3 625.05、20.97 μg/g。甲醇相和乙酸乙酯中含量最低的是對(duì)羥基苯甲酸,分別為67.81、2.09 μg/g,水相中最低的是原兒茶酸230.55 μg/g。

圖1 多酚標(biāo)準(zhǔn)品HPLC色譜圖Fig. 1 HPLC chromatogram for a standard mixture of polyphenols
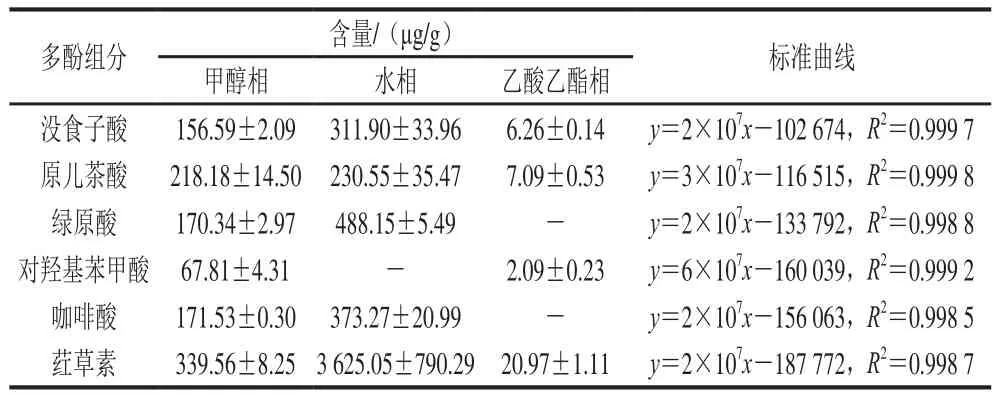
表2 黑脈羊肚菌多酚組分和含量Table 2 Polyphenol composition of various extracts from Morchella angusticeps Peck
2.3 黑脈羊肚菌不同溶劑多酚提取物清除DPPH自由基能力

圖2 黑脈羊肚菌多酚提取物對(duì)DPPH自由基的清除率Fig. 2 DPPH radical scavenging capacity (IC50) of polyphenols in various extracts from Morchella angusticeps Peck
DPPH自由基在有機(jī)溶劑中穩(wěn)定并在517 nm波長(zhǎng)處有強(qiáng)吸收,抗氧化物質(zhì)能與其孤對(duì)電子配對(duì),使光吸收減弱,從而測(cè)得清除效果[30]。在一定濃度范圍內(nèi),黑脈羊肚菌多酚提取物清除DPPH自由基能力隨多酚含量增加而增強(qiáng)。由圖2可知,乙酸乙酯相、甲醇相和水相的半數(shù)抑制濃度(half maximal inhibitory concentration,IC50)值分別為13.070、12.363、11.754 μg/mL,與抗壞血酸相比,均較弱。其中水相多酚提取物清除DPPH自由基能力最強(qiáng),與甲醇相多酚提取物相比無顯著性差異(P>0.05),但顯著強(qiáng)于乙酸乙酯相多酚提取物(p<0.05),這可能與不同溶劑提取的多酚組分不同有關(guān)。
2.4 黑脈羊肚菌不同溶劑多酚提取物清除ABTS+·能力
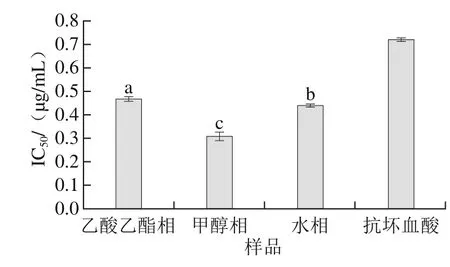
圖3 黑脈羊肚菌各多酚提取物ABTS+·清除率Fig. 3 ABTS radical scavenging capacity (IC50) of polyphenols in various extracts from Morchella angusticeps Peck
ABTS經(jīng)活性氧氧化后,可生成穩(wěn)定的藍(lán)綠色陽(yáng)離子ABTS+·,抗氧化物質(zhì)可與ABTS+·發(fā)生反應(yīng)而使反應(yīng)體系退色,根據(jù)吸光度的變化可以測(cè)定抗氧化能力[31]。在一定濃度范圍內(nèi),隨著多酚含量增加,ABTS+·清除率增強(qiáng)。由圖3可知,乙酸乙酯相IC50值最大(0.466 μg/mL),顯著高于水相(0.440 μg/mL)(p<0.05),甲醇相IC50值為0.308 μg/mL,顯著低于水相(p<0.05),表明甲醇相組分具有較好的ABTS+·清除能力。3 種溶劑的多酚提取物對(duì)ABTS+·清除率均高于抗壞血酸。
2.5 黑脈羊肚菌不同溶劑多酚提取物ORAC值
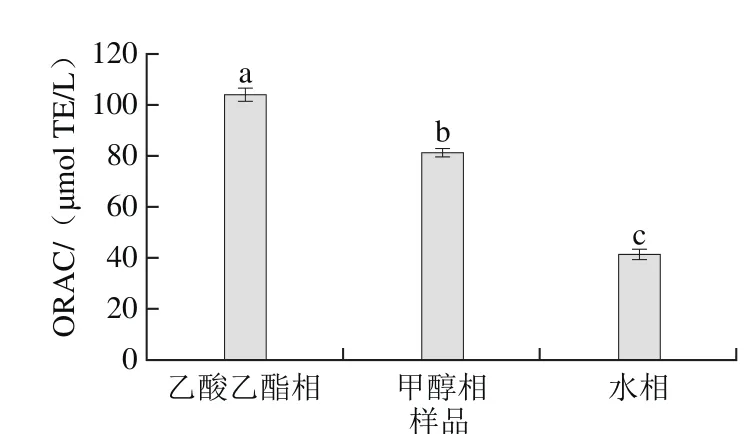
圖 4 黑脈羊肚菌多酚提取物ORAC值Fig. 4 ORAC values of polyphenols in various extracts from Morchella angusticeps Peck
根據(jù)ABAP自由基破壞熒光探針,使熒光強(qiáng)度產(chǎn)生變化的原理,以Trolox為定量標(biāo)準(zhǔn),熒光強(qiáng)度變化大小反映ABAP的破壞程度,當(dāng)抗氧化劑存在時(shí),它可延緩ABAP引起的熒光變化,其抑制程度反映了它對(duì)自由基的抗氧化能力[32]。ORAC值越大,抗氧化能力越強(qiáng)。由圖4可知,3 種溶劑多酚提取物中,乙酸乙酯相抗氧化能力最強(qiáng),ORAC值為101.408 μmol TE/L,顯著高于甲醇相的81.483 μmol TE/L(p<0.05),而水相的ORAC值最低,為41.345 μmol TE/L,不足乙酸乙酯相多酚ORAC值的一半,且顯著低于甲醇相(p<0.05)。
2.6 黑脈羊肚菌3種多酚提取物含量與抗氧化能力相關(guān)性分析

表3 多酚提取物含量與抗氧化能力相關(guān)性Table 3 Correlation between polyphenol contents and antioxidant activity
黑脈羊肚菌多酚提取物含量與抗氧化能力相關(guān)性分析結(jié)果見表3。多酚含量與DPPH自由基清除率呈顯著負(fù)相關(guān)(p<0.05),與ORAC值呈極顯著負(fù)相關(guān)(p<0.01),而多酚含量與ABTS+·清除率相關(guān)性很差。抗氧化評(píng)價(jià)方法之間,除DPPH自由基清除率與ORAC值有顯著正相關(guān)性(p<0.05),其余間均無顯著相關(guān)性。由于,不同抗氧化活性評(píng)價(jià)方法的作用機(jī)理不同,也會(huì)導(dǎo)致評(píng)估結(jié)果不同,采用不同的抗氧化活性評(píng)價(jià)方法,更能全面體現(xiàn)其生物學(xué)意義[33]。
3 結(jié) 論
黑脈羊肚菌總酚含量為20.109 mg/g,其中水相組分含量最高為14.478 mg/g,貢獻(xiàn)率占72%,乙酸乙酯相組分含量最低為0.188 mg/g,甲醇相含量為5.443 mg/g。采用HPLC分析3 種不同溶劑獲得的多酚提取物組分,初步鑒定甲醇相中含有6 種已知多酚類成分,水相中含有5 種,乙酸乙酯相中含有4 種,且葒草素含量均為最高,甲醇相、水相、乙酸乙酯相中分別為339.56、3 625.05、20.97 μg/g。體外抗氧化結(jié)果表明,水相多酚提取物清除DPPH自由基能力最強(qiáng),甲醇相多酚提取物清除ABTS+·能力最強(qiáng),而乙酸乙酯相ORAC值最高。可見,3 種不同溶劑提取的多酚抗氧化效果不相同,這與3 種溶劑多酚提取物的組分不同、粗提物中其他非酚類抗氧化化合物的存在及各化學(xué)抗氧化方法原理不同有密切關(guān)系。
[1] 蘭進(jìn), 曹文芩, 徐錦堂. 中國(guó)羊肚菌屬真菌資源[J]. 資源科學(xué), 1999,21(2): 56-61. DOI:10.3321/j.issn:1007-7588.1999.02.010.
[2] 劉青青, 戴玄, 陳今朝. 羊肚菌液體發(fā)酵研究進(jìn)展[J]. 北方園藝,2015(1): 190-193. DOI:10.11937/bfyy.201501051.
[3] 董雪. 黑脈羊肚菌(Morchella angusticeps)生物學(xué)特性研究[D]. 北京: 首都師范大學(xué), 2004: 3-5.
[4] 王龍, 郭瑞, 路等學(xué), 等. 羊肚菌物種多樣性研究現(xiàn)狀[J]. 西北農(nóng)業(yè)學(xué)報(bào), 2016, 25(4): 477-489. DOI:10.7606/j.issn.10041389.2016.04.001.
[5] 段巍鶴, 郭瑞, 張起瑩, 等. 羊肚菌活性成分應(yīng)急性抗疲勞功能的研究[J]. 安徽農(nóng)業(yè)科學(xué), 2015, 43(8): 1-3. DOI:10.3969/j.issn.0517-6611.2015.08.001.
[6] 張強(qiáng), 吳彩娥. 羊肚菌菌絲體蛋白的理化特性及抗氧化活性[J]. 浙江農(nóng)業(yè)學(xué)報(bào), 2016, 28(8): 1408-1415. DOI:10.3969/j.issn.1004-1524.2016.08.20.
[7] 吳素蕊, 侯波, 郭相, 等. 黑脈羊肚菌營(yíng)養(yǎng)成分分析比較[J]. 食品科技, 2011, 36(7): 65-66; 72. DOI:10.13684/j.cnki.spkj.2011.07.007.
[8] 張倩茹, 曾陽(yáng), 孫玉俠, 等. ICP-MS法測(cè)定粗柄羊肚菌中無機(jī)元素含量[J]. 食用菌, 2016, 38(4): 59-61. DOI:10.3969/j.issn.1000-8357.2016.04.031.
[9] 盧可可, 鄭少杰, 吳素蕊, 等. 響應(yīng)面試驗(yàn)優(yōu)化黑脈羊肚菌多酚純化工藝及其抗氧化活性[J]. 食品科學(xué), 2015, 36(18): 13-20.DOI:10.7506/spkx1 002-6630-201518003.
[10] 鄭少杰, 廖霞, 盧可可, 等. 基于體外模擬消化的黑脈羊肚菌多酚細(xì)胞抗氧化及抗增殖活性[J]. 食品科學(xué), 2016, 37(21): 234-240.DOI:10.7506/spkx1002-6630-201621040.
[11] 呂曉蓮, 郭宏, 賈建會(huì), 等. 羊肚菌發(fā)酵產(chǎn)物功能性研究[J]. 食品科學(xué), 2013, 34(1): 311-314.
[12] GURSOY N, SARIKURKCU C, CENGIZ M, et al. Antioxidant activities, metal contents, total phenolics and flavonoids of seven Morchella species[J]. Food and Chemical Toxicology, 2009, 47(9):2381-2388. DOI:10.1016/j.fct.2009.06.032.
[13] 李謠, 陳金龍, 王麗穎, 等. 羊肚菌多糖抑制人乳腺癌細(xì)胞MDAMB-231增殖和誘導(dǎo)細(xì)胞凋亡研究[J]. 食品科學(xué), 2016, 37(21): 214-218. DOI:10.7506/spkx1002-6630-201621036.
[14] 冮潔, 麥海美, 解彬, 等. 羊肚菌菌絲體富硒條件優(yōu)化及其硒多糖抗氧化活性研究[J]. 食品與發(fā)酵工業(yè), 2016, 42(9): 120-125.DOI:10.13995/j.cnki.11-1802/ts.201609021.
[15] 明建, 吳素蕊, 曾凱芳, 等. 羊肚菌多糖PMEP-1對(duì)大鼠腸道內(nèi)短鏈脂肪酸的影響[J]. 食品科學(xué), 2010, 31(19): 367-371.
[16] ZIELI?SKA S, KOLNIAK-OSTEK J, DZIADAS M, et al.Characterization of polyphenols in Agastache rugosa leaves and inflorescences by UPLC-qTOF-MS following FCPC separation[J].Journal of Liquid Chromatography & Related Technologies, 2016,39(4): 209-219. DOI:10.1080/10826076.2016.1147461.
[17] 沈維治, 鄒宇曉, 劉凡, 等. 桑葉不同極性溶劑提取物的總多酚含量與抑菌活性[J]. 蠶業(yè)科學(xué), 2013, 39(1): 135-138. DOI:10.13441/j.cnki.cykx.2013.01.008.
[18] 孫瓊. 杏鮑菇黃酮類化合物提純及抗氧化活性研究[D]. 臨汾: 山西師范大學(xué), 2015: 15-18.
[19] CHIDEH S, PILARD S, ATTOUMBRé J, et al. 5-O-Caffeoylshikimic acid from Solanum somalense leaves: advantage of centrifugal partition chromatography over conventional column chromatography[J].Journal of Separation Science, 2014, 37(17): 2331-2339. DOI:10.1002/jssc.201400226.
[20] CHU Yifang, SUN Jie, WU Xianzhong, et al. Antioxidant and antiproliferative activities of common vegetables[J]. Journal of Agricultural and Food Chemistry, 2002, 50(23): 6910-6916.DOI:10.1021/jf020665f.
[21] PALACIOS I, LOZANO M, MORO C, et al. Antioxidant properties of phenolic compounds occurring in edible mushrooms[J]. Food Chemistry, 2011, 128: 674-678. DOI:10.1016/j.foodchem.2011.03.085.
[22] GANGOPADHYAY N, RAI D K, BRUNTON N P, et al. Antioxidantguided isolation and mass spectrometric identification of the major polyphenols in barley (Hordeum vulgare) grains[J]. Food Chemistry,2016, 210: 212-220. DOI:10.1016/j.foodchem.2016.04.098.
[23] SOONG Y Y, BARLOW P J. Antioxidant activity and phenolic content of selected fruit seeds[J]. Food Chemistry, 2004, 88(3): 411-417. DOI:10.1016/j.foodchem.2004.02.003.
[24] WOLFE K L, KANG X, HE X, et al. Cellular antioxidant activity of common fruits[J]. Journal of Agricultural and Food Chemistry, 2008,56(18): 8418-8426. DOI:10.1021/jf801381y.
[25] HUANG D J, OU B X, HAMPSCH-WOODILL M, et al. Highthroughput assay of oxygen radical absorbance capacity (ORAC)using a multichannel liquid handling system coupled with a microplate fl uorescence reader in 96-well format[J]. Journal of Agricultural and Food Chemistry, 2002, 50(16): 4437-4444. DOI:10.1021/jf0201529.
[26] YILDIZ O, CAN Z, LAGHARI A Q, et al. Wild edible mushrooms as a natural source of phenolics and antioxidants[J]. Journal of Food Biochemistry, 2015, 39(2): 148-154. DOI:10.1111/jfbc.12107.
[27] ANACRISTINA R A, SANTOYO S, REGLERO G, et al. Radical scavenging activities, endogenous oxidative enzymes and total phenols in edible mushrooms commonly consumed in Europe[J]. Journal of the Science of Food and Agriculture, 2007, 87(12): 2272-2278.DOI:10.1002/jsfa.2983.
[28] BARROS L, DUE?AS M, FERREIRA I C F R, et al. Phenolic acids determination by HPLC-DAD-ESI/MS in sixteen different Portuguese wild mushrooms species[J]. Food and Chemical Toxicology, 2009,47(6): 1076-1079. DOI:10.1016/j.fct.2009.01.039.
[29] FATIHA B, DIDIER H, NAIMA G, et al. Phenolic composition, in vitro antioxidant effects and tyrosinase inhibitory activity of three Algerian Mentha species: M. spicata (L.), M. pulegium (L.) and M. rotundifolia (L.) Huds (Lamiaceae)[J]. Industrial Crops and Products, 2015, 74: 722-730. DOI:10.1016/j.indcrop.2015.04.038.
[30] HAN S S, LO S C, CHOI Y W, et al. Antioxidant activity of crude extract and pure compounds of Acer ginnala Max.[J]. Bulletin of the Korean Chemical Society, 2004, 25(3): 389-391. DOI:10.5012/bkcs.2004.25.3.389.
[31] OLIVERIRA C M, FERREIRA A C, DE PINHO P G, et al. New qualitative approach in the characterization of antioxidants in white wines by antioxidant free radical scavenging and NMR techniques[J].Journal of Agricultural and Food Chemistry, 2008, 56(21): 10326-10331. DOI:10.1021/jf8013662.
[32] OU B, HAMPSCH-WOODILL M, PRIOR R L. Development and validation of an improved oxygen radical absorbance capacity assay using fl uorescein as the fl uorescent probe[J]. Journal of Agricultural and Food Chemistry, 2001, 49(10): 4619-4626. DOI:10.1021/jf010586o.
[33] 焦揚(yáng), 宋海, 張勇, 等. 3 種野生漿果果酒中活性物質(zhì)及抗氧化活性比較[J]. 食品與發(fā)酵工業(yè), 2015, 41(1): 60-65. DOI:10.13995/j.cnki.11-1802/ts.201501012.
Fractionation and Antioxidant Activity of Polyphenols from Morchella angusticeps Peck
LIAO Xia1, LI Weizhou1, ZHENG Shaojie1, LU Keke1, SHI Fang1, WU Surui2, MING Jian1,3,*
(1. College of Food Science, Southwest University, Chongqing 400715, China;2. Kunming Edible Fungi Institute, All China Federation of Supply and Marketing Cooperatives, Kunming 650223, China;3. Chongqing Engineering Research Center for Special Foods, Chongqing 400715, China)
Phenolic components were sequentially extracted from Morchella angusticeps Peck using solvents with different polarities. As a result, ethyl acetate extract, methanol extract and water extract were obtained, and the phenolic components were identified by high performance liquid chromatography. Then, the 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical scavenging capacity, 2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate) (ABTS) radical scavenging capacity and oxygen radical absorbance capacity (ORAC) of the extracts were determined, and the correlation between phenolic contents of the extracts and antioxidant activity was investigated. The results revealed that the total polyphenol content of M. angusticeps Peck was approximately 20.109 mg/g. The highest content of polyphenols (14.478 mg/g) was detected in the water extract, followed by the methanol extract (5.443 mg/g), and the ethyl acetate extract had the lowest content of polyphenols(0.188 mg/g). Orientin was the most abundant in all three extracts. The DPPH radical scavenging capacity of the water extract was the strongest, the methanol extract possessed the highest ABTS radical scavenging capacity, and ethyl acetate extract exhibited the highest ORAC value. An excellent correlation between ABTS radical scavenging activity or ORAC value and polyphenol contents was observed.
Morchella angusticeps Peck; polar solvents; antioxidant activity; high performance liquid chromatography
10.7506/spkx1002-6630-201723005
TS201.2
A
1002-6630(2017)23-0026-06
廖霞, 李葦舟, 鄭少杰, 等. 黑脈羊肚菌多酚分級(jí)制備及其抗氧化活性[J]. 食品科學(xué), 2017, 38(23): 26-31.
10.7506/spkx1002-6630-201723005. http://www.spkx.net.cn
2017-02-20
國(guó)家自然科學(xué)基金面上項(xiàng)目(31471576);中央高校基本科研業(yè)務(wù)費(fèi)專項(xiàng)資金項(xiàng)目(XDJK2016E113);
云南省科技廳科技創(chuàng)新人才計(jì)劃項(xiàng)目(2008OC008);
重慶市特色食品工程技術(shù)研究中心能力提升項(xiàng)目(cstc2014pt-gc8001)
廖霞(1992—),女,碩士研究生,研究方向?yàn)槭称坊瘜W(xué)與營(yíng)養(yǎng)學(xué)。E-mail:994671521@qq.com
*通信作者:明建(1972—),男,教授,博士,研究方向?yàn)槭称坊瘜W(xué)與營(yíng)養(yǎng)學(xué)。E-mail:mingjian1972@163.com
LIAO Xia, LEI Weizhou, ZHENG Shaojie, et al. Fractionation and antioxidant activity of polyphenols from Morchella angusticeps Peck[J]. Food Science, 2017, 38(23): 26-31. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201723005. http://www.spkx.net.cn

