桑葚濃縮汁對D-半乳糖誘導氧化損傷大鼠腎臟的保護作用
黃 磊,彭新顏,*,于海洋,李華敏,毛慧敏,張 輝,邱靜茹
(1.魯東大學食品工程學院,山東 煙臺 264025;2.山東商務職業學院食品工程系,山東 煙臺 264670)
桑葚濃縮汁對D-半乳糖誘導氧化損傷大鼠腎臟的保護作用
黃 磊1,彭新顏1,*,于海洋2,李華敏1,毛慧敏1,張 輝1,邱靜茹1
(1.魯東大學食品工程學院,山東 煙臺 264025;2.山東商務職業學院食品工程系,山東 煙臺 264670)
研究桑葚濃縮汁對氧化損傷大鼠腎臟的保護作用。采用D-半乳糖(D-galactose,D-Gal)建立衰老模型,將實驗大鼠隨機分為6 組:空白對照組、陰性對照組(D-Gal模型)、陽性對照組(D-Gal+VE)、桑葚濃縮汁低、中、高劑量組。通過檢測大鼠腎臟組織勻漿中超氧化物歧化酶(superoxide dismutase,SOD)、過氧化氫酶(catalase,CAT)和谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)活力、丙二醛(malondialdehyde,MDA)含量,測定大鼠血清一氧化氮(nitric oxide,NO)、血尿素氮(blood urea nitrogen,BUN)和血清肌酐(serum creatinine,Scr)濃度、總抗氧化能力(total antioxidant capacity,T-AOC)及B淋巴細胞瘤-2相關X蛋白(B-cell lymphoma-2-associated X protein,Bax)基因的表達,并通過病理組織學切片評價桑葚濃縮汁對氧化損傷蛋白的影響。結果表明:與陰性對照組相比,桑葚濃縮汁中、高劑量組可以顯著提高腎組織SOD、GSH-Px、CAT活力和T-AOC(p<0.05);降低MDA、BUN及Scr濃度;抑制NO濃度升高(p<0.05),并成一定量效依賴關系;Bax表達降低;其中桑葚濃縮汁高劑量效果最好,GSH-Px活力為150.33 U、Scr濃度為34.54 μmol/L、BUN濃度為8.96 mmol/L,均達到了陽性對照組水平(P>0.05);NO濃度為29.78 μmol/L,達到空白對照組水平(P>0.05)。病理學組織切片顯示,與陰性對照組相比,桑葚處理組癥狀明顯減輕,尤其中、高劑量組,極少量腎小管上皮細胞胞漿疏松、淡染,無明顯的充血、出血。綜上所述,桑葚濃縮汁對D-Gal誘導氧化損傷大鼠腎臟有較好的保護作用。
桑葚濃縮汁;D-半乳糖;氧化損傷;腎臟保護作用
衰老是隨著年齡增長機體自身結構和功能衰退,也是機體適應性和抵抗力下降的一個自發過程[1]。引起衰老的因素有很多種,包括端粒縮短、癌基因激活及活性氧自由基引起的DNA損傷等,其中最為關鍵的因素是自由基代謝失衡[2]。自由基學說認為,由于機體自由基過量產生,組織器官結構和功能發生紊亂,引起機體衰老。為了延緩衰老,最理想的方法是向食物中添加抗氧化劑,抑制氧化的發生[3]。目前,合成抗氧化劑雖被廣泛用于食品,但是其安全性受到質疑,如將二叔丁基羥基甲苯及其代謝產物注射到雄性幼鼠腹膜內,會使大鼠肺細胞增生、肺組織質量增加。因此,國外不少發達國家已明令禁止在食品或部分食品中使用合成抗氧化劑[4]。可見,開發天然、安全、高效的食品抗氧化劑具有廣闊發展前景。
桑葚富含VC、多酚、花青素、胡蘿卜素、黃酮、硒等成分[5],并且具有防衰老、抗氧化、調節免疫、降脂、降血糖的生理功效[6],是天然抗氧化劑的良好來源。目前,國內外對于桑葚的研究多集中在桑葚花青素、多酚、多糖、花色苷等單獨成分的作用效果[7],而對桑葚全果實或全果汁的抗氧化研究鮮有報道。2000年,Eberhardt等[8]提出了“全食品”對健康有益的新理念。有研究表明D-半乳糖(D-galactose,D-Gal)能使大鼠腎小球球體縮小、腎小球稀疏且形狀不規則、腎小囊囊腔明顯擴大、組織病理改變,類似人類腎臟衰老[9]。因此,本課題以建立D-Gal衰老模型為切入點,以桑葚全濃縮果汁為研究對象,探討濃縮汁對氧化應激大鼠腎臟的保護作用。這將對實際生產和開發天然功效產品具有重要的現實意義。
1 材料與方法
1.1 材料與試劑
新鮮無籽大十桑葚(Fructus Mori) 煙臺惠安市場。
清潔級2 月齡健康Wistar雄性大鼠,由北京維通利華實驗動物中心提供,共82 只,體質量280~320 g,合格證號:SCXK(京)2011-0011,使用許可證號:SYXK(魯)20160022。
VE、D-Gal粉劑(原裝) 上海伯奧生物科技有限公司;谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)試劑盒、過氧化氫酶(catalase,CAT)試劑盒、總抗氧化能力(total antioxidant capacity,T-AOC)試劑盒、超氧化物歧化酶(superoxide dismutase,SOD)試劑盒、丙二醛(malondialdehyde,MDA)試劑盒、一氧化氮(nitric oxide,NO)試劑盒、血尿素氮(blood urea nitrogen,BUN)試劑盒、血清肌酐(serum creatinine,Scr)試劑盒 南京建成生物工程研究所;B淋巴細胞瘤-2相關X蛋白(B-cell lymphoma-2-associated X protein,Bax)免疫組化試劑盒 美國Bioworld Technology公司。
1.2 儀器與設備
YB-P50001型電子天平 北京長拓銳新科技發展有限公司;722型紫外-可見分光光度計 上海光譜儀器有限公司;101A型電熱鼓風干燥箱 德國Leica公司;RE-52AA旋轉蒸發器 上海亞榮生化儀器廠;HTZ-1013榨汁機 江門市恒天科技有限公司出品;XD811F型快速生化分析儀 武漢三豐醫療設備有限公司;DY89Ⅱ電動玻璃勻漿機 浙江寧波新芝生物科技股份有限公司;CK40型光學顯微鏡 日本Olympus公司。
1.3 方法
1.3.1 桑葚濃縮汁的制備流程
新鮮桑葚→洗凈晾干→榨汁(出汁率約70%~80%)→4、8 層紗布分別過濾3 次→0.45 μm膜過濾→桑葚原汁→濃縮2 倍→4 ℃冷藏保存備用
1.3.2 D-Gal致衰老模型大鼠的建立
將大鼠分籠、給予標準飲食,飼養1 周后,隨機分為6 組:空白對照組、陰性對照組(D-Gal模型)、陽性對照組(D-Gal+VE)、桑葚濃縮汁低、中、高劑量組,期間有淘汰,最終每組10 只。空白對照組大鼠頸背部皮下注射生理鹽水并于第2周給予50 mg/kg雙蒸水。其他5 組于第2周頸背部注射D-Gal(120 mg/kg),每日注射1 次,連續注射8 周建立衰老模型;并于第2周每日分別灌胃50 mg/kg雙蒸水,50 mg/kg VE,2.5、5.0、10.0 mL/kg桑葚濃縮汁(以體質量計)。
1.3.3 血清的制備和生化指標測定
灌胃56 d后,摘眼球取血,血樣于4 ℃冰箱放置12 h,3 000 r/min離心10 min,取上清液,即為血清樣品。嚴格參照試劑盒說明書步驟分別測定血清中Scr(Jeff法[10])濃度、BUN(脲酶法[10])濃度、T-AOC(比色法[11],單位定義為在37 ℃,每分鐘每毫升血清使反應體系的吸光度增加0.01)和NO(硝酸還原酶法[12])濃度的變化。
1.3.4 腎臟組織制備和生化指標測定
斷椎處死大鼠,解剖取出腎臟,剔除表面脂肪及筋膜,用生理鹽水洗去多余血液(4 ℃),濾紙吸收水分,天平稱質量并勻漿,用生理鹽水稀釋成10%腎臟勻漿液,按試劑盒說明書的方法測定腎臟組織中相關指標。GSH-Px活力使用比色法[11]測定,每0.1 mL血清在37 ℃反應5 min,扣除非酶促反應作用,使體系中谷胱甘肽濃度降低1 μmol/L為一個酶活力單位。SOD活力使用黃嘌呤氧化酶比色法[12]測定,以反應體系產生的超氧陰離子的自由基清除率定義為一個酶活力單位。CAT活力使用紫外法[11]測定,每克血紅蛋白中CAT每秒鐘分解吸光度為0.50~0.55底物中的過氧化氫相對量為一個酶活力單位。MDA含量使用硫代巴比妥酸法[12]測定。
1.3.5 病理組織學檢查
采用石蠟切片觀察病理變化,取大鼠腎組織,體積約為2.0 cm×2.0 cm×0.3 cm。經甲醛固定后,再經80%、90%、95%、100%乙醇脫水、石蠟包埋、切片機切片、蘇木素-伊紅法(hematoxylin-eosin,HE)染色、封片等步驟制成切片,在光學顯微鏡下觀察病理變化。
1.3.6 免疫組化檢測腎組織Bax蛋白表達
大鼠腎組織經常規脫蠟、水化后,滴加一抗(Bax單克隆抗體(1∶50 稀釋))、二抗(生物素化羊抗兔IgG(1∶100 稀釋)),按試劑盒方法對切片標本進行染色,3,3-四鹽酸二氨基聯苯胺顯色,蒸餾水洗、染色、脫水、封片,顯微鏡觀察,免疫組化陽性產物定位于細胞質,表現為棕黃色顆粒。
1.4 數據統計分析
實驗結果表示為 ±s。采用Excel 6.0和Sigmaplot 12.0軟件作圖,采用Statistix 8.1軟件包中Linear Models程序進行統計,差異顯著性(p<0.05)分析使用Tukey HSD程序。
2 結果與分析
2.1 桑葚濃縮汁對D-Gal致衰老大鼠腎臟SOD活力的影響
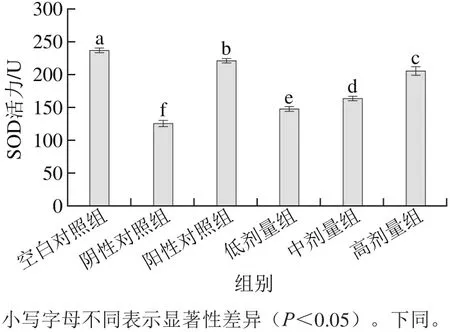
圖1 桑葚濃縮汁對D-Gal致衰老大鼠腎臟SOD活力的影響Fig. 1 Effect of mulberry juice concentrate on SOD activity in kidney tissue of aging rats
造模后,陰性對照組大鼠腎組織SOD活力明顯低于空白對照組(p<0.05)(圖1),說明造模成功。在桑葚濃縮汁處理組中,以桑葚濃縮汁高劑量組的SOD活力為最好,其活力為204.07 U,比低、中劑量組分別提高了39.3%和24.9%,但沒有達到空白對照組和陽性對照組效果(p<0.05)。
多元社會思潮的影響。當前,社會上各種自由主義、功利主義蔓延至大學校園,對大學生的思想道德進行侵蝕,對主流教育思想構成了威脅,部分大學生對傳統文化進行了全盤否定,一味追求“符號化”“快餐化”的文化價值觀。這是導致大學生文化自信不足直接原因。
2.2 桑葚濃縮汁對D-Gal致衰老大鼠腎臟GSH-Px活力的影響
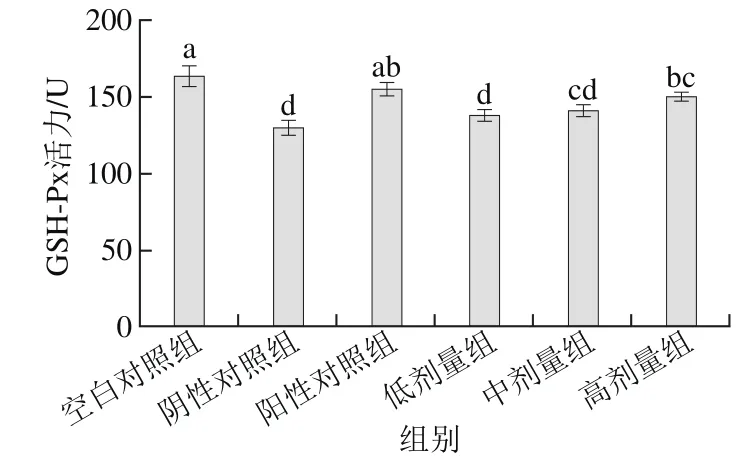
圖2 桑葚濃縮汁對D-Gal致衰老大鼠腎臟GSH-Px活力的影響Fig. 2 Effect of mulberry juice concentrate on GSH-Px activity in aging rats
如圖2所示,桑葚濃縮汁的低、中、高劑量組GSH-Px活力分別為137.60、140.63、150.33 U。高劑量組效果最好,與陰性對照組相比差異顯著(p<0.05),且比低、中劑量組和陰性對照組分別提高了9.3%、6.9%和15.9%,達到陽性對照組水平(P>0.05)。
2.3 桑葚濃縮汁對D-Gal致衰老大鼠腎臟CAT活力的影響
由圖3可以看出,低、中、高劑量組的CAT活力分別為252.93、277.40、314.20 U,與陰性對照組相比均有明顯提高(p<0.05),表明通過添加桑葚濃縮汁可以提高CAT活力;其中以高劑量組的提高效果最佳,比低、中劑量組CAT活力分別高了61.27、36.80 U,但未達到陽性對照組和空白對照組水平(P>0.05)。
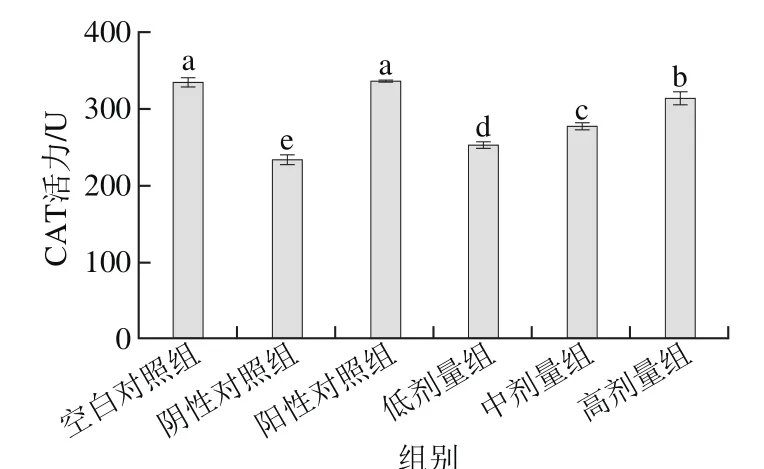
圖3 桑葚濃縮汁對D-Gal致衰老大鼠腎臟CAT活力的影響Fig. 3 Effect of mulberry juice concentrate on CAT activity in aging rats
2.4 桑葚濃縮汁對D-Gal致衰老大鼠腎臟MDA含量的影響
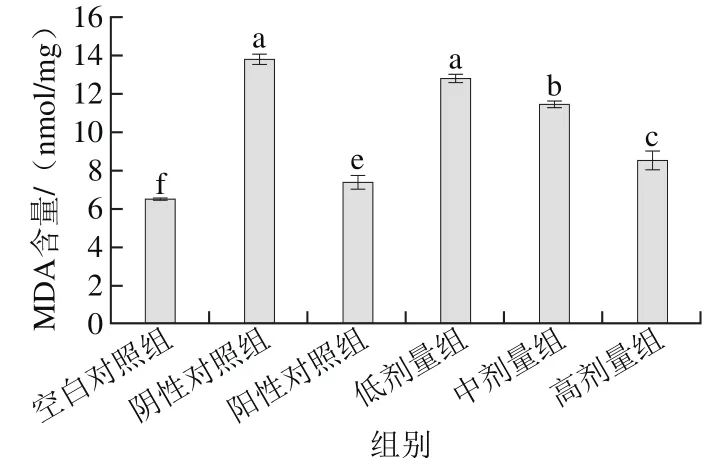
圖 4 桑葚濃縮汁對D-Gal致衰老大鼠腎臟MDA含量的影響Fig. 4 Effect of mulberry juice concentrate on MDA level in aging rats
由圖4可以看出,與空白對照組比,陰性對照組衰老大鼠腎臟MDA含量顯著增加(p<0.05),表明MDA含量與大鼠腎臟氧化應激反應有一定聯系;低、中、高劑量組MDA含量分別為12.86、11.47 nmol/mg和8.54 nmol/mg,與陰性對照組相比,分別降低了7.1%、17.2%和38.3%,表明高劑量組桑葚濃縮汁效果最佳;但均未達到陽性對照組和空白對照組的水平(p<0.05)。
2.5 桑葚濃縮汁對D-Gal致衰老大鼠血清NO濃度的影響

圖5 桑葚濃縮汁對D-Gal致衰老大鼠血清NO濃度的影響Fig. 5 Effect of mulberry juice concentrate on serum NO level in aging rats
如圖5所示,桑葚濃縮汁低、中、高劑量組均具有降低血清中NO濃度的作用,并且呈一定的劑量依賴關系(p<0.05)。高劑量組比陰性對照組降低了39.4%,并顯著低于低、中劑量組(p<0.05),表明高劑量桑葚濃縮汁能明顯降低D-Gal致衰老大鼠血清中NO濃度。
2.6 桑葚濃縮汁對D-Gal致衰老大鼠血清T-AOC的影響
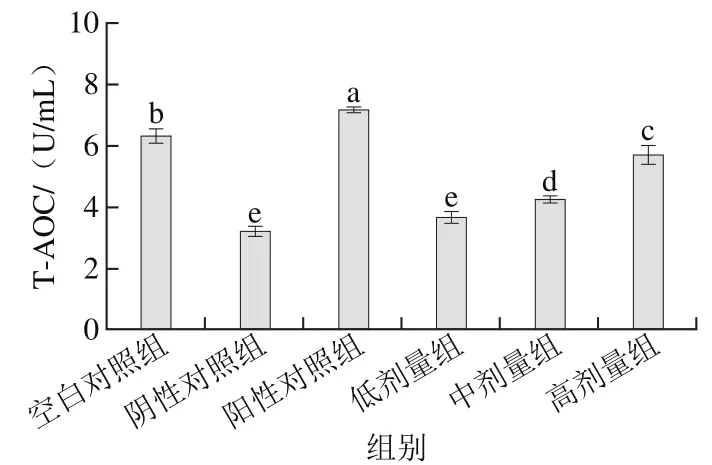
圖6 桑葚濃縮汁對D-Gal致衰老大鼠血清T-AOC的影響Fig. 6 Effect of mulberry juice concentrate on serum T-AOC in aging rats
如圖6所示,桑葚濃縮汁的低、中、高劑量組的T-AOC分別為3.66、4.23、5.67 U/mL,其中高劑量組比低、中劑量組和陰性對照組分別增加了54.9%、31.4%和77.7%,但未達到陽性對照組和空白對照組的水平(p<0.05),說明高劑量桑葚濃縮汁對D-Gal致衰老大鼠血清T-AOC的影響最為顯著(p<0.05)。
2.7 桑葚濃縮汁對D-Gal致衰老大鼠Scr濃度的影響
如圖7所示,桑葚濃縮汁的低、中、高劑量組均能顯著抑制Scr濃度升高(p<0.05)。其中,中、高劑量組比陰性對照組分別降低了55.1%和54.4%,其中高劑量組Scr濃度為34.54 μmol/L,均達到了陽性對照組及空白對照組效果水平(P>0.05),結果表明桑葚濃縮汁在一定劑量范圍內具有抑制Scr濃度升高的作用。
2.8 桑葚濃縮汁對D-Gal致衰老大鼠血清BUN濃度的影響
如圖8所示,與陰性對照組相比,桑葚濃縮汁的低、中、高劑量組均能顯著抑制BUN濃度升高(p<0.05),分別比陰性對照組降低了32.85%、59.03%、65.85%,其中高劑量組為8.96 mmol/L,已達到陽性對照組和空白對照組水平(P>0.05),表明高劑量組桑葚濃縮汁效果最佳。
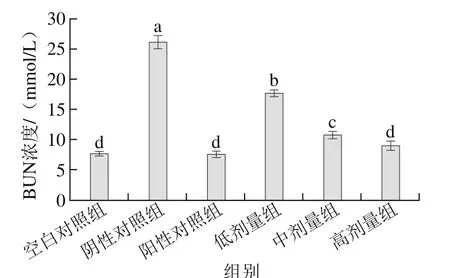
圖8 桑葚濃縮汁對D-Gal致衰老大鼠血清BUN濃度的影響Fig. 8 Effect of mulberry juice concentrate on serum BUN in aging rats
2.9 HE染色顯微鏡觀察腎臟組織結構
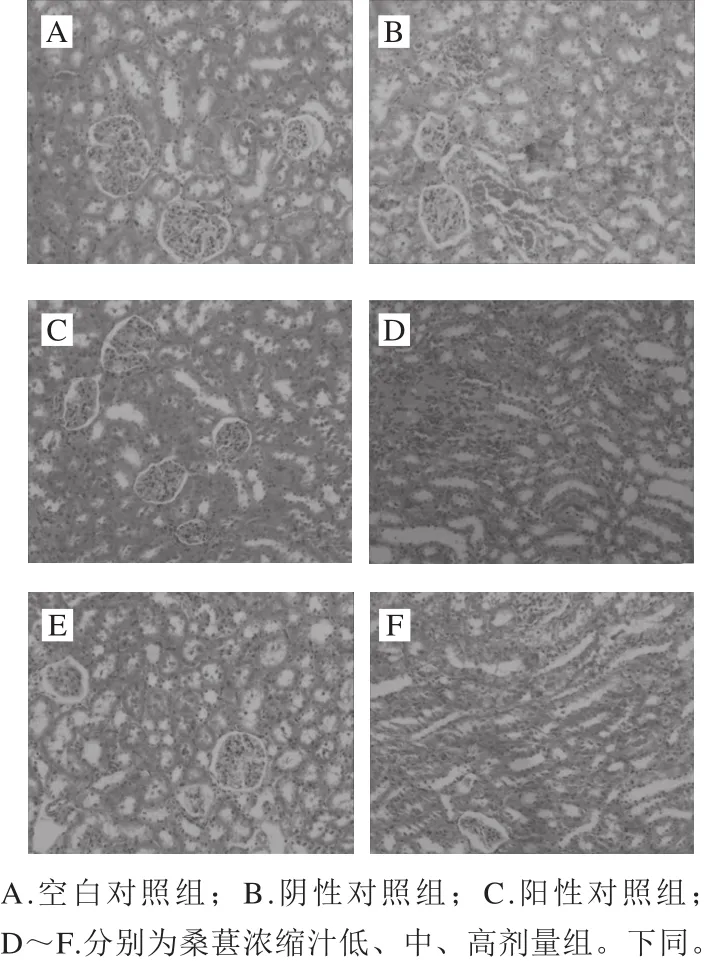
圖9 各處理組大鼠腎臟病理學切片Fig. 9 Histopathological examination of kidney tissues
由圖9可以看出,空白對照組大鼠腎臟的結構完整,腎皮質部腎小球及其周圍腎小管結構清晰,球囊腔清晰可見,間質無充血、水腫。陰性對照組大鼠腎臟的皮質部腎小管上皮細胞體積增大,胞漿疏松淡染、濁腫,部分區域腎間質淤血、出血,炎細胞浸潤。桑葚濃縮汁低、中、高劑量組與陰性對照組比較,癥狀明顯減輕,尤其中、高劑量組,極少量腎小管上皮細胞胞漿疏松、淡染,無明顯的充血、出血。陽性對照組與空白對照組比較無明顯差異。
2.10 桑葚濃縮汁對D-Gal致衰老大鼠腎臟Bax蛋白表達的影響
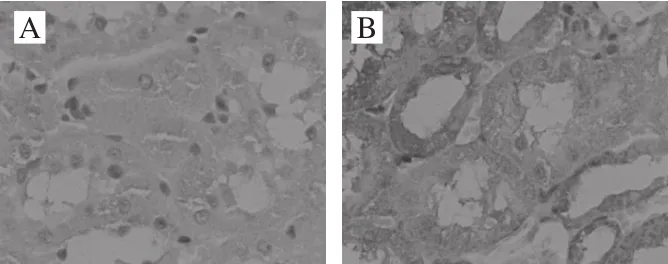
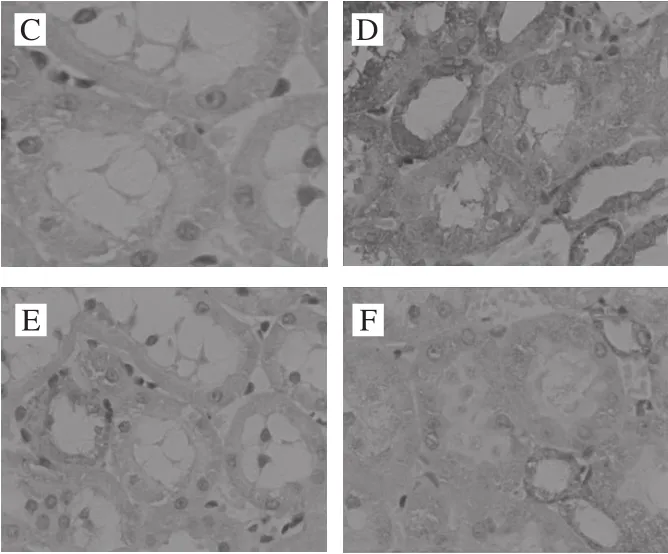
圖10 各處理組大鼠腎臟組織Bax表達Fig. 10 Bax expression in kidney tissues
Bax是促凋亡因子,參與組織細胞的凋亡。由圖10可見,其陽性表達部位主要是腎小管上皮細胞的胞漿,出現棕黃色顆粒。在正常組中,Bax的表達率低。而陰性對照組與空白對照組比較,具有明顯差異,Bax的陽性表達明顯增高,出現深棕黃色顆粒。而與陰性對照組比較,中、高劑量組Bax表達明顯減少,低劑量組差異不明顯。
3 討 論
外源性的D-Gal可有效誘導細胞內大量活性氧自由基的生成,造成組織器官的氧化性損害,是加速衰老的重要誘因,也是目前公認的衰老動物造模方法[13]。抗氧化酶系統是機體抗自由基損傷的重要防御體系,其中SOD能消除超氧陰離子自由基(),在機體內可使歧化為O2和H2O2,若機體SOD活力降低,就會造成組織細胞的損傷,并導致疾病的發生[14];GSH-Px在體內的主要作用是催化還原型谷胱甘肽變成氧化型谷胱甘肽[15],從而保護細胞膜結構和功能不受過氧化物的干擾損害[16]。CAT是一種中心酶,可以將H2O2分解為H2O和O2-·,從而防止H2O2積累,降低氧化對生物的危害[17]。MDA是脂質氧化分解的產物,其含量反映了氧自由基水平和過氧化反應強度和速率,因此MDA可以間接反映細胞和組織損傷程度[18]。本實驗結果表明,桑葚濃縮汁能提高腎臟組織SOD、GSH-Px、CAT活力、降低MDA濃度,高劑量效果最好。這表明桑葚濃縮汁在消除自由基方面可發揮作用,進而延緩機體衰老。與之相似,目前已發現很多具有抗氧化活性的植物提取物能夠提高抗氧化酶活力和降低MDA含量。如Fan Jing等[19]發現川楝素多糖可以通過提高大鼠腎臟中SOD、GSH-Px的活力,降低MDA的含量,提高大鼠機體抗氧化活性,減輕氧化損傷。Vranje?等[20]報道,實驗組大鼠在用荷蘭芹和熊果葉等植物提取物飼養后,與正常組的大鼠相比,大鼠腎臟中抗氧化酶活力明顯升高,表現出良好的抗氧化活性。Jiang Yan等[21]也發現,藍莓花青素可以通過增強CAT等抗氧化酶活力,對氧化損傷的大鼠腎臟起到保護作用。Zhang Zifeng等[22]的研究表明,大鼠經D-Gal誘導造成腎臟氧化損傷后,若灌胃紫甘薯色素則可以減輕損傷的癥狀;Momeni等[23]經實驗后也發現,姜黃色素可以降低腎臟中MDA含量,從而起到抗氧化的作用。
BUN和Scr是臨床上用于檢查腎功能的主要指標之一[24]。血清BUN是蛋白質和氨基酸代謝的最終產物,Scr經常被用于表征腎衰、尿毒癥等病理指標,因此腎臟機能與BUN和Scr水平有著密切的聯系[25]。另外,NO是體內重要的信號分子和內源性血管擴張物質,在正常生理情況下,少量NO對腎臟有一定的保護作用,而病理狀態時,過量NO是造成組織細胞氧化應激損傷的主要原因[26]。本實驗表明,與陰性對照組比,3 種劑量的桑葚濃縮汁均能顯著降低血清BUN、Scr和NO水平(p<0.05),表明桑葚濃縮汁能有效抑制D-Gal所致腎細胞損傷,具有改善大鼠腎功能的作用,而且呈一定的量效關系。Al-Attar等[27]研究發現,如果給大鼠灌胃一定劑量具有抗氧化功能的橄欖葉和杜松葉提取物可以顯著地降低大鼠血清BUN水平,減少氧化SS損傷。Ouyang Mingzi等[28]也證明,靈芝提取物同樣也能夠降低大鼠血清中Scr水平,有效地抑制D-Gal所致腎細胞損傷并保護腎臟。Huang Yi等[29]也報道山姜素同樣可以降低大鼠血清BUN和Scr水平。Momeni等[23]研究發現姜黃素可以降低亞砷酸鈉大鼠模型腎臟中NO含量,起到抗氧化、保護腎臟的作用。Shan Qun等[30]證明,如果給高脂飲食大鼠灌胃適當劑量紫甘薯色素,能夠顯著降低高脂飲食大鼠NO生成,起到保護腎臟作用。
Bax是細胞凋亡調控的關鍵信號介質,Bax具有促凋亡作用,因此通過測定生物體Bax蛋白水平可以間接反映生物體的抗氧化性能[31]。在D-Gal致衰老模型大鼠的模型組中,Bax的表達率較高,但經灌胃楔葉茶蔍后,Bax的表達明顯下降,說明楔葉茶蔍對于抑制細胞凋亡具有較好效果,具有抗氧化功能[32]。本實驗病理切片也同樣說明,不同劑量桑葚濃縮汁能減輕腎臟破壞程度,尤其中、高劑量組,只有極少數腎小管上皮細胞胞漿疏松、淡染,無明顯的充血、出血,改善效果明顯。
近年來,眾多蔬菜水果表現出良好的抗氧化活性,其有效成分幾乎涉及各類植物成分,包括維生素類(VC、VE、類胡蘿卜素)、多酚類(酚酸、黃酮、單寧)、多糖類、皂苷類和生物堿類等。桑葚富含大量具有抗氧化活性的生物活性物質,如類黃酮、類檸檬苦素、香豆素類、類胡蘿卜素等,而且在預防心腦血管疾病、癌癥以及炎癥等方面具有突出的效果。Yue Chanjuan等[17]研究發現,桑葚果實的抗氧化能力隨品種而異,其抗氧化活性與可溶性固體、滴定酸、酚醛樹脂和花青素含量有關。Wang Lihua等[33]分析桑葚中總酚、總黃酮、總花青素等成分及含量,發現這些成分含量決定著其抗氧化活性,而且桑葚多酚可作為清除劑和還原劑[34]。Jiang Dongqing等[5]也報道,桑葚中花青素與VC或5 種花青素單體的1,1-二苯基-2-三硝基苯肼自由基清除率相同。鄧秀婷等[35]用不同劑量的桑葚提取液灌胃大鼠40 d,發現其血清及肝臟中SOD、GSH-Px活力升高,MDA含量下降。可見,桑葚含有總酚、黃酮、東莨菪素、花青素多種抗氧化成分。本實驗中桑葚濃縮汁能夠對D-Gal所致衰老大鼠腎臟有保護作用,可能是由于桑葚各種不同的抗氧化成分之間存在相互補充、互相協調的關系,在體內通過作用于抗氧化和氧化酶系統、影響Bax表達、減少脂質過氧化物含量、降低BUN和Scr水平等多種途徑聯合發揮抗氧化、防衰老作用。
桑葚濃縮汁對D-Gal氧化損傷大鼠有保護作用,這可能與其通過多途徑清除體內代謝紊亂所產生的自由基相關。表現為提高腎臟組織抗氧化酶系CAT、SOD和GSH-Px活力、降低NO、MDA、BUN和Scr水平、抑制Bax的表達,而且大鼠腎臟病理學切片也證實,桑葚濃縮汁可以在一定程度上保護腎組織結構,對延緩D-Gal引起腎臟的損傷、改善衰老狀態起到良好的作用。
[1] WANG Meixian, ZHANG Yuxuan, GUO Peiyong. Effect of florfenicol and thiamphenicol exposure on the photosynthesis and antioxidant system of Microcystis fl os-aquae[J]. Aquatic Toxicology,2017, 186: 67-76. DOI:10.1016/j.aquatox.2017.02.022.
[2] VULETA A, JOVANOVI? M S, TUCI? B. Adaptive flexibility of enzymatic antioxidants SOD, APX and CAT to high light stress:the clonal perennial monocot Iris pumila as a study case[J]. Plant Physiology and Biochemistry, 2016, 100: 166-173. DOI:10.1016/j.plaphy.2016.01.011.
[3] AKPINAR O, NAZIRO?LU M, AKPINAR H. Different doses of dexmedetomidine reduce plasma cytokine production, brain oxidative injury, PARP and caspase expression levels but increase liver oxidative toxicity in cerebral ischemia-induced rats[J]. Brain Research Bulletin,2016, 130: 1-9. DOI:10.1016/j.brainresbull.2016.12.005.
[4] SUHAJ M. Spice antioxidants isolation and their antiradical activity: a review[J]. Journal of Food Composition and Analysis, 2006, 19(6/7):531-537. DOI:10.1016/j.jfca.2004.11.005.
[5] JIANG Dongqing, GUO Ying, XU Dianhong, et al. Antioxidant and anti-fatigue effects of anthocyanins of mulberry juice purification(MJP) and mulberry marc purif i cation (MMP) from different varieties mulberry fruit in China[J]. Food and Chemical Toxicology, 2013, 59:1-7. DOI:10.1016/j.fct.2013.05.023.
[6] SHIH P H, CHAN Y C, LIAO J W, et al. Antioxidant and cognitive promotion effects of anthocyanin-rich mulberry (Morus atropurpurea L.)on senescence-accelerated mice and prevention of Alzheimer’s disease[J]. The Journal of Nutritional Biochemistry, 2010, 21(7): 598-605. DOI:10.1016/j.jnutbio.2009.03.008.
[7] CHEN Yao, ZHANG Weijie, ZHAO Ting, et al. Adsorption properties of macroporous adsorbent resins for separation of anthocyanins from mulberry[J]. Food Chemistry, 2016, 194: 712-722. DOI:10.1016/j.foodchem.2015.08.084.
[8] EBERHARDT M V, LEE C Y, LIU R H. Antioxidant activity of fresh apples[J]. Nature, 2000, 405(6789): 903-904.
[9] 龔玉芳, 于曉敏, 關麗華, 等. 燈盞花素對D-半乳糖引起小鼠記憶障礙及肝、腎異常變化的影響[J]. 中藥藥理與臨床, 2012, 28(1): 73-76.
[10] 尚立芝, 崔明霞, 王建人. 川芎嗪預處理對大鼠腎臟缺血再灌注損傷的保護作用[J]. 河南醫學研究, 2006(3): 215-217.
[11] 宋家樂, 周燕園, 趙超超, 等. 六堡茶總黃酮對老齡小鼠抗氧化功能的影響[J]. 食品研究與開發, 2016, 37(20): 173-176.
[12] 宋春梅, 馬洪波, 王長文, 等. 老齡大鼠心臟和腦組織中NO、SOD和MDA含量與衰老的關系[J]. 吉林醫藥學院學報, 2005(3): 130-131.
[13] 陳貴堂, 趙立艷, 趙霖, 等. 花生肽對半乳糖致大鼠肝損傷的抑制作用[J]. 食品科學, 2011, 32(5): 296-300.
[14] YOSHIOKA Y, FUJIBAYASHI H, KAMEDA K, et al. Induction of apoptosis in Caco-2 cells by exogenously addedproduced by a nanodevice[J]. Experimental Cell Research, 2015, 331(2): 408-415.DOI:10.1016/j.yexcr.2014.12.007.
[15] MACIEJCZYK M, MIKOLUC B, PIETRUCHA B, et al. Oxidative stress, mitochondrial abnormalities and antioxidant defense in Ataxiatelangiectasia, Bloom syndrome and Nijmegen breakage syndrome[J].Redox Biology, 2017, 11: 375-383. DOI:10.1016/j.redox.2016.12.030.
[16] KONG Youqin, DING Zhili, ZHANG Yixiang, et al. Dietary selenium requirement of juvenile oriental river prawn Macrobrachium nipponense[J]. Aquaculture, 2017, 476: 72-78. DOI:10.1016/j.aquaculture.2017.04.010.
[17] YUE Chanjuan, CHEN Jin, HOU Ranran, et al. The antioxidant action and mechanism of selenizing Schisandra chinensis polysaccharide in chicken embryo hepatocyte[J]. International Journal of Biological Macromolecules, 2017, 98: 506-514. DOI:10.1016/j.ijbiomac.2017.02.015.
[18] MARTINI D, ROSSI S, BIASINI B, et al. Claimed effects, outcome variables and methods of measurement for health claims proposed under European Community Regulation 1924/2006 in the framework of protection against oxidative damage and cardiovascular health[J].Nutrition Metabolism and Cardiovascular Diseases, 2017, 27(6): 473.DOI:10.1016/j.numecd.2017.01.008.
[19] FAN Jing, FENG Haibo, YU Yu, et al. Antioxidant activities of the polysaccharides of Chuanminshen violaceum[J]. Carbohydrate Polymers, 2017, 157: 629-636. DOI:10.1016/j.carbpol.2016.10.040.
[20] VRANJE? M, POPOVI? B M, ?TAJNER D, et al. Effects of bearberry, parsley and corn silk extracts on diuresis, electrolytes composition, antioxidant capacity and histopathological features in mice kidneys[J]. Journal of Functional Foods, 2016, 21: 272-282.DOI:10.1016/j.jff.2015.12.016.
[21] JIANG Yan, DAI Min, NIE Wenjing, et al. Effects of the ethanol extract of black mulberry (Morus nigra L.) fruit on experimental atherosclerosis in rats[J]. Journal of Ethnopharmacology, 2017, 200:228-235. DOI:10.1016/j.jep.2017.02.037.
[22] ZHANG Zifeng, LU Jun, ZHENG Yuanlin, et al. Purple sweet potato color protects mouse liver against d-galactose-induced apoptosis via inhibiting caspase-3 activation and enhancing PI3K/Akt pathway[J].Food and Chemical Toxicology, 2010, 48(8/9): 2500-2507.DOI:10.1016/j.fct.2010.06.023.
[23] MOMENI H R, ESKANDARI N. Effect of curcumin on kidney histopathological changes, lipid peroxidation and total antioxidant capacity of serum in sodium arsenite-treated mice[J]. Experimental and Toxicologic Pathology, 2017, 69(2): 93-97. DOI:10.1016/j.etp.2016.08.006.
[24] CONG Guangting, CUI Lei, ZANG Meng, et al. Attenuation of renal ischemia/reperfusion injury by a polysaccharide from the roots of Dipsacus asperoides[J]. International Journal of Biological Macromolecules, 2013, 56: 14-19. DOI:10.1016/j.ijbiomac.2012.12.024.
[25] WU Xin, GUO Xiaoyun, XIE Chunyan, et al. Effects of a two-meal daily feeding pattern with varied crude protein levels on growth performance and antioxidant indexes in pigs[J]. Animal Nutrition,2016, 2(4): 267-270. DOI:10.1016/j.aninu.2016.08.002.
[26] LI Xinpeng, WANG Jing, ZHANG Hong, et al. Renoprotective effect of low-molecular-weight sulfated polysaccharide from the seaweed Laminaria japonica on glycerol-induced acute kidney injury in rats[J].International Journal of Biological Macromolecules, 2017, 95: 132-137. DOI:10.1016/j.ijbiomac.2016.11.051.
[27] AL-ATTAR A M, ALROBAI A A, ALMALKI D A. Protective effect of olive and juniper leaves extracts on nephrotoxicity induced by thioacetamide in male mice[J]. Saudi Journal of Biological Sciences,2017, 24(1): 15-22. DOI:10.1016/j.sjbs.2015.08.013.
[28] OUYANG Mingzi, LIN Lizhu, Lü Wenjiao, et al. Effects of the polysaccharides extracted from Ganoderma lucidum on chemotherapy-related fatigue in mice[J]. International Journal of Biological Macromolecules, 2016, 91: 905-910. DOI:10.1016/j.ijbiomac.2016.04.084.
[29] HUANG Yi, ZHOU Lishan, YAN Li, et al. Alpinetin inhibits lipopolysaccharide-induced acute kidney injury in mice[J].International Immunopharmacology, 2015, 28(2): 1003-1008.DOI:10.1016/j.intimp.2015.08.002.
[30] SHAN Qun, ZHENG Yuanlin, LU Jun, et al. Purple sweet potato color ameliorates kidney damage via inhibiting oxidative stress mediated NLRP3 inflammasome activation in high fat diet mice[J].Food and Chemical Toxicology, 2014, 69: 339-346. DOI:10.1016/j.fct.2014.04.033.
[31] MA Gaoxing, YANG Wenjian, FANG Yong, et al. Antioxidant and cytotoxicites of Pleurotus eryngii residue polysaccharides obtained by ultraf i ltration[J]. LWT-Food Science and Technology, 2016, 73: 108-116. DOI:10.1016/j.lwt.2016.05.049.
[32] TILYEK A, CHAI C, HOU X, et al. The protective effects of Ribes diacanthum Pall on cisplatin-induced nephrotoxicity in mice[J].Journal of Ethnopharmacology, 2016, 178: 297-306. DOI:10.1016/j.jep.2015.10.003.
[33] WANG Lihua, SUN Xiangyu, LI Fan, et al. Dynamic changes in phenolic compounds, colour and antioxidant activity of mulberry wine during alcoholic fermentation[J]. Journal of Functional Foods, 2015,18: 254-265. DOI:10.1016/j.jff.2015.07.013.
[34] NATI? M M, DABI? D ?, PAPETTI A, et al. Analysis and characterisation of phytochemicals in mulberry (Morus alba L.) fruits grown in Vojvodina, North Serbia[J]. Food Chemistry, 2015, 171:128-136. DOI:10.1016/j.foodchem.2014.08.101.
[35] 鄧秀婷, 羅姮, 李彥彬, 等. 桑葚提取液對D-半乳糖致衰老小鼠抗氧化能力的影響[J]. 中國老年學雜志, 2016(1): 36-37.
Protective Effect of Mulberry Juice Concentrate on D-Galactose-Induced Oxidative Stress in Kidney of Rats
HUANG Lei1, PENG Xinyan1,*, YU Haiyang2, LI Huamin1, MAO Huimin1, ZHANG Hui1, QIU Jingru1
(1. College of Food Engineering, Ludong University, Yantai 264025, China;2. Department of Food Engineering, Shandong Business Institute, Yantai 264670, China)
To study the protective effect of mulberry juice concentrate on oxidative injury in the kidney of rats, an aging rat model was established by injection of D-galactose (D-Gal) and the experimental rats were divided into six groups,including normal control, negative control, positive control group (D-Gal + VE), D-Gal + mulberry juice concentrate low-,middle- and high-dose groups. Superoxide dismutase (SOD), catalase (CAT) and glutathione peroxidase (GSH-Px) activities and malondialdehyde (MDA) content in liver homogenate, nitric oxide (NO), urea nitrogen (BUN), creatinine (Scr) and total antioxidant capacity (T-AOC) in serum, and the expression of B-cell lymphoma-2-associated X protein (Bax) gene in kidney were measured. Besides, hematoxylin-eosin stained kidney sections were histopathologically examined. The results showed that compared with the negative control group, mulberry juice concentrate at middle and high doses could signif i cantly increase the activities of SOD, GSH-Px, CAT and T-AOC in renal tissue (P < 0.05), decrease MDA level in renal tissue, serum BUN and Scr levels and repress the increase in serum NO (P < 0.05) in a dose-dependent manner. In addition, the expression of Bax was signif i cantly reduced (P < 0.05), and the best result was observed at high dose, where GSH-Px activity was 150.33 U and serum Scr and BUN were 34.54 μmol/L and 8.96 mmol/L, respectively, which were close to the levels of the positive control group (P > 0.05), and serum NO was 29.78 μmol/L, which was similar to that of the blank control group (P > 0.05). Histopathological examination showed that compared with the model group, the symptomsof kidney injury in the treatment groups were obviously alleviated, especially in the middle- and high-dose groups, where few renal tubular epithelial cells were loose and pale, without obvious congestion or bleeding. In summary, mulberry juice concentrate has a good protective effect on D-Gal-induced oxidative stress in the kidney of rats.
mulberry juice concentrate; D-galactose; oxidative damage; renal protection
2017-06-01
國家自然科學基金青年科學基金項目(31401491);城新創新獎學金項目;大學生創新創業訓練計劃項目(7422)
黃磊(1995—),男,本科,研究方向為天然產物功能因子。E-mail:912878985@qq.com
*通信作者:彭新顏(1976—),女,副教授,博士,研究方向為天然產物功能因子。E-mail:pengxinyan2006@163.com
10.7506/spkx1002-6630-201723029
TS255.2
A
1002-6630(2017)23-0184-07
黃磊, 彭新顏, 于海洋, 等. 桑葚濃縮汁對D-半乳糖誘導氧化損傷大鼠腎臟的保護作用[J]. 食品科學, 2017, 38(23):184-190.
10.7506/spkx1002-6630-201723029. http://www.spkx.net.cn
HUANG Lei, PENG Xinyan, YU Haiyang, et al. Protective effect of mulberry juice concentrate on D-galactose-induced oxidative stress in kidney of rats[J]. Food Science, 2017, 38(23): 184-190. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201723029. http://www.spkx.net.cn

