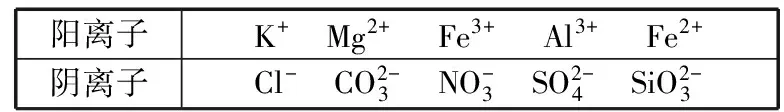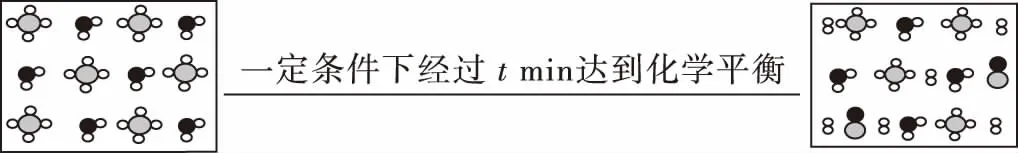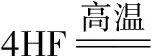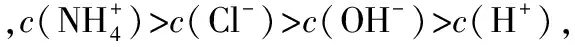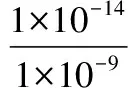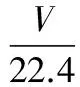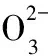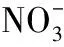2018高考模擬試題
——陜西師大附中高三年級第二次模擬考試
2018高考模擬試題
——陜西師大附中高三年級第二次模擬考試
本試卷分第Ⅰ卷(選擇題)和第Ⅱ卷(非選擇題)兩部分。滿分100分,考試時間90分鐘。
可能用到的相對原子質量:O—16 Na—23 K—39 Mn—55
第Ⅰ卷(選擇題 共48分)
一、選擇題(本題共16小題,每小題3分,共48分。每小題只有一個選項符合題意)
1.化學與生活、環境密切相關,下列說法正確的是
( )
A.可以用淀粉檢驗加碘食鹽中是否含有碘元素
B.適量飲酒對身體有利的原因是酒精不能使蛋白質變性
C.PM2.5亦稱可入肺顆粒物,表面積大,能吸附有毒有害物質
D.使用生物酶降解生活污水中的有機物,可以防止水體富營養化
2. X、Y、Z、W是元素周期表中原子序數依次增大的四種短周期元素,其相關信息如表:

元素相關信息XX的最高價氧化物對應的水化物化學式為H2XO3YY是地殼中含量最高的元素ZZ元素的原子最外層有3個電子WW的一種核素的質量數為28,中子數為14
則相關判斷正確的是
( )
A.W原子半徑大于Z
B.X、Y分別與氫元素形成的二元化合物分子間容易形成氫鍵
C.向Z單質與鹽酸反應后的無色溶液中滴加NaOH溶液直至過量,無明顯現象
D.W的單質與氫氟酸反應生成兩種無色氣體
3.有關電解質溶液,下列說法正確的是
( )
A.常溫下同濃度的強酸、強堿等體積混合后,由水電離出的c(H+)=10-7mol·L-1
B.將AlCl3溶液、Na2SO3溶液蒸干并灼燒可以得到Al2O3、Na2SO3
C.常溫下0.1 mol·L-1的Na2A溶液的pH=10,則該溶液中由水電離的c(OH-)=10-10mol·L-1
4.短周期元素X、Y、Z所在的周期數依次增大,它們的原子序數之和為20,且Y2-與Z+核外電子層結構相同。下列化合物中同時存在極性和非極性共價鍵的是
( )
A.X2Y2B.Z2Y C.Z2Y2D.ZYX
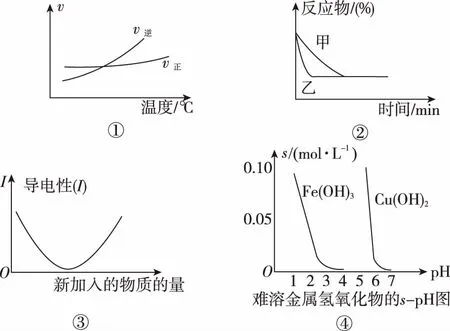
5.某溫度下,Fe(OH)3(s)、Cu(OH)2(s)分別在溶液中達到沉淀溶解平衡后,改變溶液pH,金屬陽離子濃度變化如圖所示。據圖分析,下列判斷錯誤的是
( )
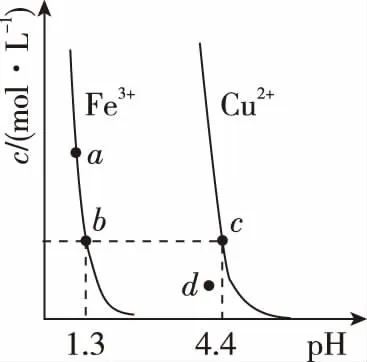
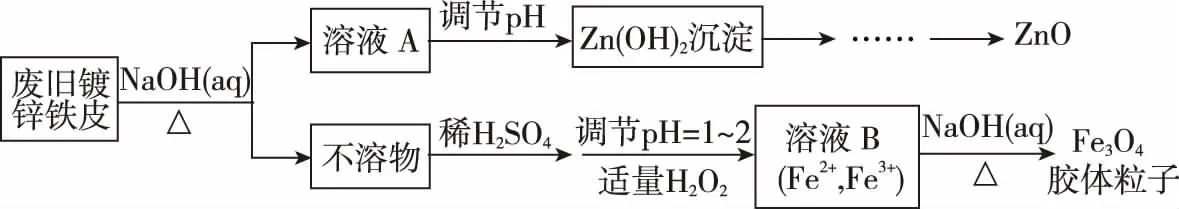
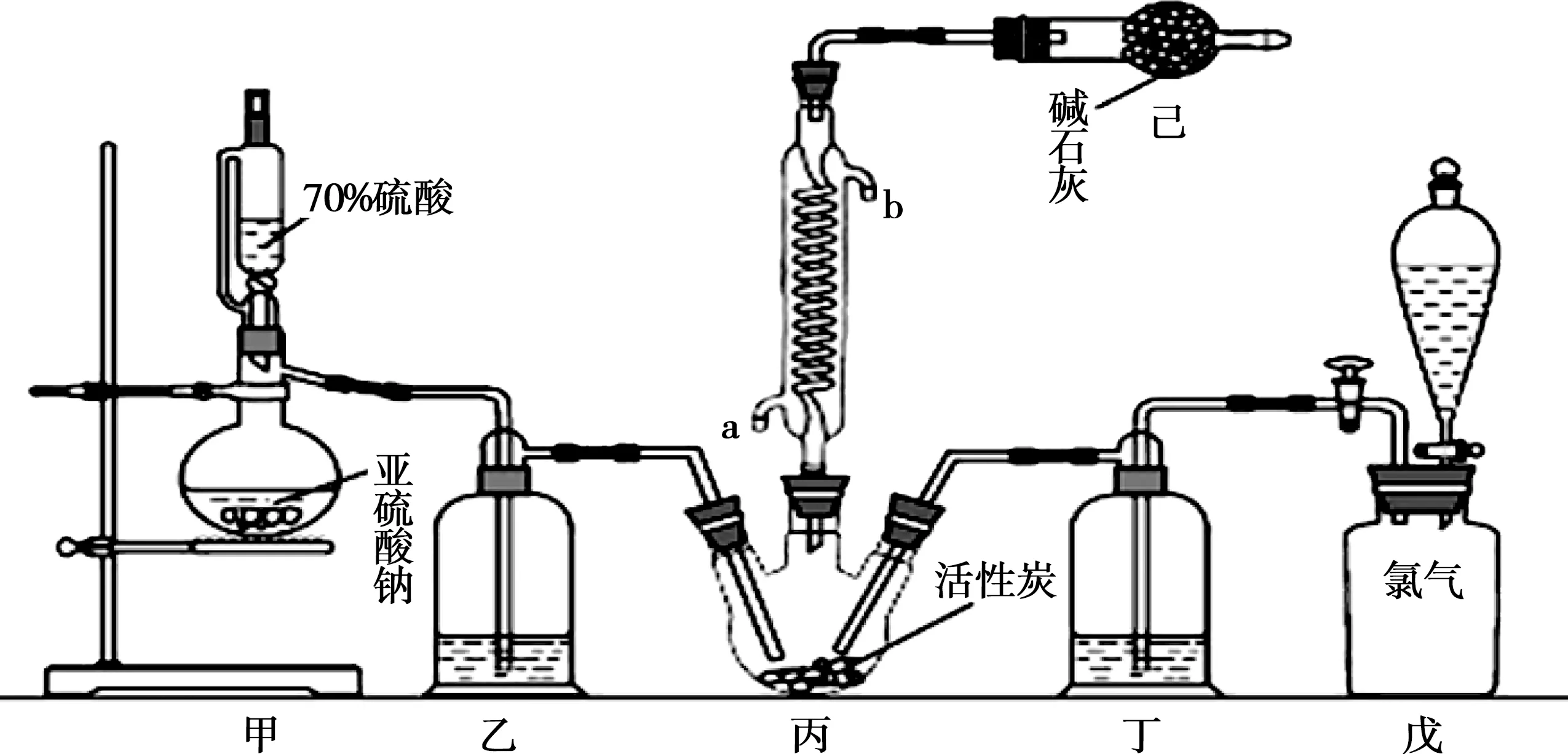
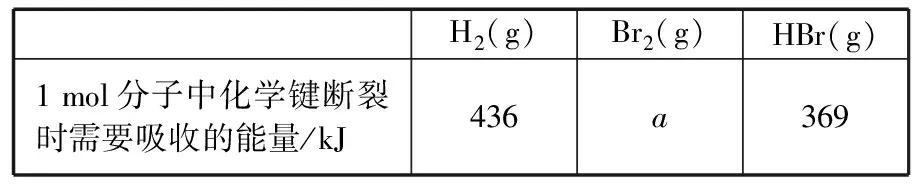
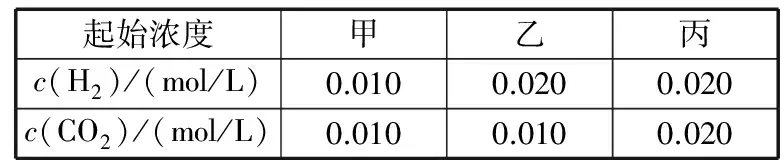
A.Ksp[Fe(OH)3] B.加適量NH4Cl固體可使溶液由a點變到b點 C.c、d兩點代表的溶液中c(H+)與c(OH-)乘積相等 D.Fe(OH)3、Cu(OH)2分別在b、c兩點代表的溶液中達到飽和 H2(g)Br2(g)HBr(g)1mol分子中化學鍵斷裂時需要吸收的能量/kJ436a369 則表中a為 ( ) A.404 B. 260 C.230 D.200 7.下列實驗設計及其對應的離子方程式均正確的是 ( ) ( ) A.Li-Al在電池中作為負極材料,該材料中Li的化合價為+1價 9. 在一定的溫度、壓強下,向100 mL CH4和Ar的混合氣體中通入400 mL O2,點燃使其完全反應,最后在相同條件下得到干燥氣體460 mL,則反應前混合氣體中CH4和Ar的物質的量之比為 ( ) A.1∶4 B.1∶3 C.1∶2 D.1∶1 10.在用RCl2固體配制溶液時,為了得到澄清溶液并防止變質,常向溶液中加入少量R的單質和鹽酸。已知R2+有5個電子層,其最外層有2個電子,下列推斷正確的是 ( ) A.R為ⅡA族元素 B.R(OH)2是強堿 C.R2+的硝酸鹽溶液呈中性 D.RCl2有還原性,容易被氧化 起始濃度甲乙丙c(H2)/(mol/L)0.0100.0200.020c(CO2)/(mol/L)0.0100.0100.020 下列判斷不正確的是 ( ) A.平衡時,乙中CO2的轉化率大于60% B.平衡時,甲中和丙中H2的轉化率均是60% C.平衡時,丙中c(CO2)是甲中的2倍,是0.012 mol/L D.反應開始時,丙中的反應速率最快,甲中的反應速率最慢 12.常溫下,取0.3 mol/L HY溶液與0.3 mol/L NaOH溶液等體積混合(忽略混合后溶液體積的變化),測得混合溶液的pH = 9,則下列說法(或關系式)正確的是 ( ) A.混合溶液中由水電離出的c(OH-)=10-9mol/L B.溶液中離子濃度由大到小的順序為c(Y-)>c(Na+)>c(OH-)>c(H+) C.c(OH-)-c(HY)=c(H+)=1×10-9mol/L D.c(Na+)=c(Y-)+c(HY)=0.3 mol/L 13.標準狀況下,VL氨氣溶解在1 L水中(水的密度近似為1 g/mL),所得溶液的密度為ρg/mL,質量分數為ω,物質的量濃度為cmol/L,則下列關系中不正確的是 ( ) 14.NA表示阿伏加德羅常數的數值,下列有關說法正確的是 ( ) A.18.4 mol/L的濃硫酸與等質量的水混合所得溶液的物質的量濃度大于9.2 mol/L B.室溫下,1 L pH=13的NaOH溶液中,由水電離的OH-數目為0.1NA C.50 mL 14.0 mol·L-1濃硝酸與足量銅反應,轉移的電子數為0.35NA D.同溫同壓同體積下的兩種氣體12C18O和14N2具有的電子數相等 15.下列有關說法正確的是 ( ) A.測量硫酸銅晶體的含水量時,加熱坩堝中的硫酸銅晶體,失水后須在干燥器中冷卻,再稱量 B.檢驗蔗糖水解產物是否具有還原性,可向水解后的溶液中直接加入新制的Cu(OH)2懸濁液并加熱 C.用蒸餾水潤濕的試紙測溶液的pH,一定會使結果偏低 D.做鋅銅稀硫酸原電池實驗時,反應一段時間后鋅片表面還是呈銀白色 16. 化學中常用圖象直觀地描述化學反應的進程或結果。下列圖象描述正確的是 ( ) C.圖③可表示乙酸溶液中通入氨氣至過量過程中溶液導電性的變化 D.根據圖④,若除去CuSO4溶液中的Fe3+,可向溶液中加入適量CuO至pH為4左右 17.(10分)某工業廢水中僅含下表離子中的5種(不考慮水的電離及離子的水解),且各種離子的物質的量濃度相等,均為0.1 mol·L-1。 陽離子K+ Mg2+ Fe3+ Al3+ Fe2+陰離子Cl- CO2-3 NO-3 SO2-4 SiO2-3 甲同學欲探究廢水的組成,進行了如下實驗: ① 用鉑絲蘸取少量溶液,在火焰上灼燒,無紫色火焰(透過藍色鈷玻璃觀察)。 ② 取少量溶液,加入KSCN溶液無明顯變化。 ③ 另取溶液加入少量鹽酸,有無色氣體生成,該無色氣體遇空氣變成紅棕色,此時溶液依然澄清,且溶液中陰離子種類不變。 ④ 向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成。 請推斷: (1)由①②③判斷,溶液中一定不含有的陽離子是_______,一定不含的陰離子是_______(寫離子符號)。 (2)③中加入少量鹽酸生成無色氣體的離子方程式是____________________________, ④中生成白色沉淀的離子方程式是____________________________。 (3)將③中所得紅棕色氣體通入水中,氣體變無色,所發生的化學反應方程式為____________________________。 (4)甲同學最終確定原溶液中所含陽離子是________,陰離子是________(寫離子符號)。 18.(10分)實驗室可由軟錳礦(主要成分為MnO2)制備KMnO4,方法如下:軟錳礦與過量固體KOH和KClO3在高溫下反應,生成錳酸鉀(K2MnO4)和KCl;用水溶解,濾去殘渣,濾液酸化后,K2MnO4轉變為MnO2和KMnO4;濾去MnO2沉淀,濃縮濾液,結晶得到深紫色的針狀KMnO4。請回答: (1)軟錳礦制備K2MnO4的化學方程式是____________________________。 (2)K2MnO4制備KMnO4的離子方程式是____________________________。 (3)若用2.5 g軟錳礦(含MnO280%)進行上述實驗,KMnO4的理論產量為____________。 (4)KMnO4能與熱的經硫酸酸化的Na2C2O4溶液反應生成Mn2+和CO2,該反應的化學方程式是____________________________。 (5)上述制得KMnO4產品0.165 g,恰好與0.335 g Na2C2O4反應完全,該KMnO4的純度為________。 19.(12分)利用廢舊鍍鋅鐵皮可制備磁性Fe3O4膠體粒子及副產物ZnO。制備流程圖如下: 已知:Zn及其化合物的性質與Al及其化合物的性質相似。請回答下列問題: (1)用NaOH溶液處理廢舊鍍鋅鐵皮的作用有________。 A.去除油污 B.溶解鍍鋅層 C.去除鐵銹 D.鈍化 (2)調節溶液A的pH可產生Zn(OH)2沉淀,為制得ZnO,后續操作步驟是____________________。 (3)由溶液B制得Fe3O4膠體粒子的過程中,須持續通N2,其原因是____________________________。 (4)Fe3O4膠體粒子能否用減壓過濾法實現固液分離?________(填“能”或“不能”),理由是____________________________。 (5)用重鉻酸鉀法(一種氧化還原滴定法)可測得產物Fe3O4中二價鐵含量。若需配制濃度為0.010 00 mol/L的K2Cr2O7的標準溶液250 mL,應準確稱取________g K2Cr2O7(保留4位有效數字,已知M(K2Cr2O7)=294.0 g/mol)。配制該標準溶液時,下列儀器不必要用到的有________(用編號表示)。 ①電子天平 ②燒杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥膠頭滴管 ⑦移液管 (6)滴定操作中,如果滴定前裝有K2Cr2O7標準溶液的滴定管尖嘴部分有氣泡,而滴定結束后氣泡消失,則測定結果將________(填“偏大”“偏小”或“不變”,下同),到達滴定終點時俯視液面讀數,則測定結果將________。 20.(10分)硫酰氯(SO2Cl2)可用作有機化學的氯化劑,在藥物和染料的制取中也有重要作用。某化學學習小組擬用干燥的氯氣和二氧化硫在活性炭催化下制取硫酰氯。 已知:硫酰氯通常條件下為無色液體,熔點-54.1℃,沸點69.1℃;在潮濕空氣中“發煙”;100°C以上開始分解,生成二氧化硫和氯氣,長期放置也會發生分解。 回答下列問題: (1)盛放活性炭的儀器名稱是________,丙中冷凝水的入口是________(填“a”或“b”)。如何控制反應物比例相等:____________________________。 (2)戊裝置上方分液漏斗中最好選用下列________(填字母)試劑。 a.蒸餾水 b.飽和食鹽水 c.濃氫氧化鈉溶液 d.6.0 mol/L鹽酸 (3)若缺少裝置乙和丁(均盛放濃硫酸),潮濕氯氣和二氧化硫發生反應化學方程式是____________________________。 a.重結晶 b.過濾 c.蒸餾 d.萃取 (5)長期儲存的硫酰氯會發黃,可能的原因是______________________________(使用必要文字和相關方程式加以解釋)。 (6)若反應中消耗的氯氣體積為896 mL(標準狀況下),最后經過分離提純得到4.05 g純凈的硫酰氯,則硫酰氯的產率為________。為提高本實驗中硫酰氯的產率,在實驗操作中需要注意的事項有________(填序號)。 ①先通冷凝水,再通氣 ②控制氣流速率,宜慢不宜快 ③若丙裝置發燙,可適當降溫 ④加熱丙裝置 21.(10 分)鋁是地殼中含量最高的金屬元素,其單質及合金在生產生活中的應用日趨廣泛。 ②Al4C3也是該反應過程中的一種中間產物。Al4C3與鹽酸反應(產物之一是含氫量最高的烴)的化學方程式為____________________________。 ③甲烷和水反應可以制水煤氣(混合氣體),在恒溫、固定體積為VL的密閉容器中的反應微觀示意圖如圖所示,根據微觀示意圖得出的結論中,正確的是________。 b.該反應平衡前后壓強比為3∶4 c.該反應體系中含氫元素的化合物有3種 d.該反應中甲烷的平衡轉化率為50% ④水煤氣中的H2可用于生產NH3,在進入合成塔前常用[Cu(NH3)2]Ac溶液來吸收其中的CO,防止合成塔中的催化劑中毒,其反應如下: [Cu(NH3)2]Ac溶液吸收CO的適宜生產條件應是____________________,該條件下用氣體表示的平衡常數表達式K=________________。 (2)鎂鋁合金(Mg17Al12)是一種潛在的貯氫材料,一般在氬氣環境中將一定化學計量比的Mg、Al 單質在一定溫度下熔煉獲得。該合金在一定條件下可完全吸氫得到混合物Y(含MgH2和Al),Y在一定條件下可釋放出氫氣。 ①熔煉制備鎂鋁合金(Mg17Al12)時通入氬氣的目的是____________________________。 ②寫出鎂鋁合金(Mg17Al12) 在一定條件下完全吸氫的化學方程式:____________________________。 ③在6. 0 mol·L-1HCl 溶液中,混合物Y 能完全釋放出H2。1 mol Mg17Al12完全吸氫后得到的混合物Y與上述鹽酸完全反應,釋放出H2的物質的量為________。 參考答案及解析 1.C 【解題思路】A項,食鹽中添加碘酸鉀,不含碘單質,遇淀粉變藍色是碘單質的性質,錯誤;B項,酒精可以使蛋白質變性,錯誤;C項,PM2.5是指大氣中直徑小于或等于2.5 μm的顆粒物,表面積大,能吸附有毒有害物質,正確;D項,廢水中的N、P等元素會導致水體富營養化,使用生物酶降解生活污水中的有機物并沒有消除N、P等元素,錯誤。 4.A 【解題思路】由題意可推出,X是H,Y是O,Z是Na。A項,X2Y2為H2O2,同時存在極性和非極性共價鍵,正確;B項,Z2Y為Na2O,只含離子鍵,錯誤;C項,Z2Y2為Na2O2,既含有離子鍵,又含有非極性共價鍵,錯誤;D項,ZYX為NaOH,含有離子鍵和極性共價鍵,錯誤。 5.B 【解題思路】A項,b、c兩點金屬陽離子的濃度相等,設為x,c(OH-)c=1×10-9.6mol·L-1,c(OH-)b=1×10-12.7mol·L-1,Ksp[Fe(OH)3]=x×c3(OH-)b,Ksp[Cu(OH)2]=x×c2(OH-)c,代入數據,可以得出Ksp[Fe(OH)3] 9.A 【解題思路】根據甲烷完全燃燒的化學方程式可知1體積甲烷完全燃燒需要2體積的氧氣,生成 1體積的二氧化碳,所以氣體體積減少2體積,現在氣體體積減少100 mL+400 mL-460 mL=40 mL,所以有20 mL的甲烷參加反應,則原混合氣體中甲烷的體積是 20 mL,Ar的體積是80 mL,在溫度壓強一定的條件下,二者的體積之比也是物質的量之比為20∶80=1∶4,故選A。 10.D 【解題思路】依題意可知R屬于第ⅣA族元素,為Sn元素,A錯誤;B項,配制SnCl2溶液時,加入少量鹽酸,防止Sn2+水解,所以Sn(OH)2是弱堿,錯誤;C項,Sn2+的硝酸鹽溶液由于Sn2+水解呈酸性,錯誤;D項,配制SnCl2溶液時,加入少量Sn,說明SnCl2有還原性,容易被氧化,正確。 14.D 【解題思路】A項,混合后溶液的質量為原硫酸溶液的2倍,溶液的密度減小,故稀釋后所得溶液的體積大于原硫酸溶液的體積的2倍,H2SO4的物質的量不變,則稀釋后所得溶液的濃度小于9.2 mol/L,錯誤;B項,該溶液中,c(OH-)=0.1 mol/L,c(OH-)水=1×10-13mol/L,N(OH-)水為1×10-13NA,錯誤;C項,若只發生銅與濃HNO3反應生成NO2時,轉移電子數為0.35NA, 若只發生銅與稀硝酸反應生成NO時,轉移電子數大于0.35NA,所以轉移電子數一定大于0.35NA,錯誤;D項,同溫同壓同體積下的兩種氣體,物質的量一定相等,12C18O和14N2具有的電子數都是14,正確。 15.A 【解題思路】A項,加熱后容器未放入干燥器中冷卻會導致測定的水的質量偏小,影響測定結果,正確;B項,蔗糖水解是在酸性條件下進行的,直接加入新制的Cu(OH)2懸濁液并加熱,會發生酸堿中和反應,無法檢驗醛基,錯誤;C項,用蒸餾水潤濕的試紙測溶液的pH,若溶液顯中性,對結果無影響,若溶液呈酸性,pH偏大,若溶液呈堿性,pH偏小,錯誤;D項,做鋅銅稀硫酸原電池實驗時,鋅作負極,反應一段時間后鋅片表面變得凹凸不平,失去銀白色金屬光澤,錯誤。 19.(1)AB (2)抽濾、洗滌、灼燒 (3)N2氣氛下防止Fe2+被氧化 (4)不能 膠體粒子太小,抽濾時易透過濾紙 (5)0.735 0 ③⑦ (6)偏大 偏小 【解題思路】(1)根據Zn及其化合物的性質與Al及其化合物的性質相似可知,Zn也能和氫氧化鈉溶液反應,氫氧化鈉溶液起到溶解鍍鋅層和去除油污的作用,選AB。(2)調節溶液A的pH可產生Zn(OH)2沉淀,抽濾就可以得到氫氧化鋅沉淀,洗滌除去附著的離子,高溫灼燒,氫氧化鋅分解得到ZnO。(3)持續通入保護氣N2,可以防止Fe2+被氧化。(4)Fe3O4膠體粒子能透過濾紙,所以不能用過濾的方法實現固液分離。(5)m(K2Cr2O7)=0.010 00 mol·L-1×0.250 L×294.0 g·mol-1=0.735 0 g。(6)在滴定操作中,若滴定前裝有K2Cr2O7標準溶液的滴定管尖嘴部分有氣泡,而滴定結束后氣泡消失,造成消耗的V(標準)偏大,根據c(待測)=c(標準)×V(標準)/V(待測),則測定結果偏大;到達滴定終點時俯視液面讀數,導致V(標準)偏小,則測定結果偏小。 20.(1)三頸燒瓶 a 觀察乙、丁導管口產生氣泡的速度相等 (2)b (4)c (6)75% ①②③ 21.(1)①a+b (2)①排除空氣,防止引入雜質 (解析人:劉洪旭) [本文選自西藏人民出版社出版的《2018全國卷Ⅱ高考模擬試題匯編》(化學),有刪改]



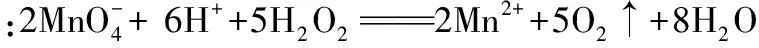




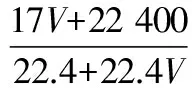
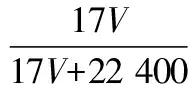

第Ⅱ卷(非選擇題 共52分)
二、非選擇題(本題共5小題,共52分)