黃條不同組織碳穩定同位素的轉化率與分餾
韓羽嘉 ,田甲申 ,李多慧 ,王震 ,鹿志創 ,木云雷
(1.大連海洋大學,遼寧 大連 116023;2.遼寧省海洋水產科學研究院,遼寧省海洋生物資源和生態學重點實驗室,遼寧 大連 116023;3.大連市水產研究所,遼寧 大連 116019)
韓羽嘉1,2,田甲申2,李多慧3,王震1,2,鹿志創2,木云雷2
(1.大連海洋大學,遼寧 大連 116023;2.遼寧省海洋水產科學研究院,遼寧省海洋生物資源和生態學重點實驗室,遼寧 大連 116023;3.大連市水產研究所,遼寧 大連 116019)
在水溫18.79~22.15℃的實驗室條件下,給體質量(34.2±1.8)g的黃條Seriola aureovittata投喂已知碳源的冰鮮玉筋魚Ammodytes personatus肌肉,研究黃條不同組織碳穩定同位素的轉化率差異及分餾系數,以探討組織生長和代謝對不同組織碳穩定同位素轉化的相對貢獻。結果表明,黃條各組織碳穩定同位素半衰期從小到大依次為肝臟(3.2d)、腸(3.4d)、鰓(3.6d)、心臟(5.5d)、肌肉(6.4d),各組織與餌料間的碳穩定同位素富集系數(Δδ13C)從小到大依次為肝(0.15‰)、腸(0.48‰)、心臟(0.98‰)、鰓(1.02‰)、肌肉(1.08‰)。代謝作用對肝臟和腸組織的碳穩定同位素轉化率的貢獻占主導地位(>60%),生長作用對其貢獻相對較小。肝臟和腸組織可反映黃條短期內的攝食特征,而肌肉組織則可反映較長時間的攝食特征。本研究結果可豐富黃條基礎生物學內容,為不同時間尺度的穩定同位素研究取樣和工廠化養殖中的營養強化、餌料選擇等提供參考。
黃條;碳穩定同位素;同位素分餾;轉化率
近年來,穩定同位素技術已廣泛應用于海洋生態系統研究,成為海洋生物攝食特征、食物網結構特征、生物間的營養關系等問題研究的重要分析手段之一[1]。穩定同位素分析方法雖然能夠反映生物較長期的攝食特征,但當生物體攝食發生變化時,其穩定同位素特征反映的攝食變化存在著時間上的滯后[2]。監測生物穩定同位素比率在食性轉變后重新達到分餾平衡所需的時間,將同位素比率隨時間的變化擬合成函數探究穩定同位素轉化規律,可以提高穩定同位素分析方法在研究生物攝食中的精確度[3,4]。穩定同位素轉化由新組織的生長和舊組織的降解代謝共同決定,穩定同位素轉化率不僅具有物種特質,還受個體生長階段、食物營養結構、環境溫度等多種因素的影響,甚至同一生物個體的不同組織間也存在差異。Witting等[5]研究美洲擬鰈Pseudopleuronectes americanus穩定同位素轉化率發現,水溫較高時肌肉組織半衰期較短,認為代謝活動與同位素轉化率呈正相關。Logan等[6]研究發現,與肌肉組織和血液細胞相比,內部器官和血漿具有較高的穩定同位素轉化率。組織在不同的時間尺度整合食物,對多個組織的檢查可以潛在地提供關于資源使用的時間動態信息[7]。一般來說,肝組織代謝速率高于肌肉和心臟,仔魚的半衰期不到一個星期,而大魚可能要幾個月[5-7]。在應用穩定同位素方法分析生物體攝食習性時,要根據所研究的時間選擇適合的組織。
目前在實驗室條件下對魚類不同組織碳穩定同位素轉化率和分餾系數(Δδ13C)的研究較多。如Guelinckx等[8]研究發現,刺鰭魚 Pomatoschistus minutus肌肉組織的轉化率較低,半衰期為25d,而肝臟的半衰期僅為3d,肌肉和肝臟的Δδ13C分別為0.21‰和0.77‰。Buchheister和Latour[9]發現犬齒牙鲆Paralichthys dentatus肌肉和肝臟的半衰期分別為49d和10d,Δδ13C分別為0.23‰和0.91‰。張妙等[10]研究發現,黃顙魚Pelteobagrus fulvidraco肝臟和鰓的半衰期為 26d和 197d,Δδ13C為 -2.1‰和0.3‰。但關于黃條碳穩定同位素轉化率與分餾效應的研究尚未見報道。
1 材料與方法
1.1 材料
1.2 方法
1.2.1 實驗設計和日常管理
1.2.2 樣品處理
1.2.3 穩定同位素測定
所有樣品在遼寧省海洋水產科學研究院穩定同位素實驗室,用穩定同位素質譜儀為菲尼根Flash 2000 HT型元素分析儀和菲尼根Delta V Advantage同位素比率質譜儀相連進行測定。穩定C同位素的自然豐度表示為:
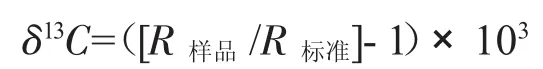
式中,R代表13C/12C。δ13C是相對于PDB(Pee Dee Belemnite)標準的自然豐度[14]。每個樣品測定3個平行樣,每測定5個樣品后插測1個標準樣。δ13C精密度<±0.15‰。
1.2.4 相關指標的計算
相對增長率WR=ln(Wt/Wi)/t×100%
特定生長率SGR=(lnWt-lnWi)/t×100%/d
式中,Wi、Wt分別為初始和t時的體質量(濕質量,g);t為實驗時間。

式中,δt代表t時各組織的同位素比值;δf代表各組織同餌料達到平衡的最終同位素比值;δi代表食性轉變前初始同位素比值;轉化常數為生長系數(k)和新陳代謝轉化常數(m)之和。
生長常數:Wt=Wiekt
半衰期:T0.5=-ln(0.5)/(k+m)
由k和m與(k+m)的比值計算生長和代謝對魚類組織碳穩定同位素轉化的貢獻率,通常用Pg和Pm表示[15]。

1.2.5 數據處理
實驗數據以平均值±標準差(X±SD)表示。采用SPSS 20.0軟件處理和分析數據,用OriginPro 8.0軟件曲線擬合和制圖。
2 結果與分析
2.1 黃條的生長
2.2 餌料魚的碳穩定同位素值
餌料魚的碳穩定同位素比值(δ13C)變化范圍為-20.88‰~-20.50‰,跨度為0.38‰,經t檢驗發現,餌料魚的 δ13C 無顯著性差異(P>0.05)(表 1)。
2.3 黃條不同組織碳穩定同位素營養分餾
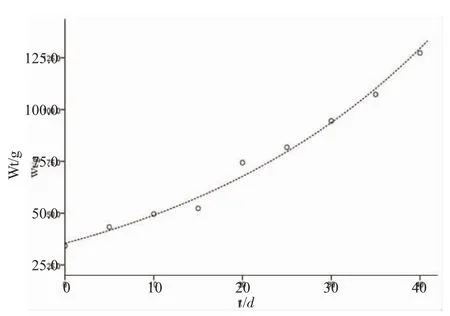
圖1 黃條的生長Fig.1 The growth of yellow tail Seriola aureovittata
2.4 黃條不同組織碳穩定同位素轉化率及半衰期
2.5 生長和代謝對黃條不同組織碳穩定同位素轉化率的影響

表1 餌料魚的δ13CTab.1 The δ13C value of the fish diets
表2 黃條不同組織的δ13CTab.2 The δ13C values of different tissues in yellow tail Seriola aureovittata

表2 黃條不同組織的δ13CTab.2 The δ13C values of different tissues in yellow tail Seriola aureovittata
組織肝臟腸心臟鰓肌肉第 0d 的 δ13C/‰-23.71±0.11-22.43±0.10-21.33±0.02-21.35±0.08-21.76±0.21 δf13C 范圍 /‰-20.50~-20.49-20.27~-20.18-19.65~-19.61-19.77~-19.64-19.57~-19.51 δf13C/‰-20.50±0.01-20.17±0.05-19.67±0.02-19.63±0.07-19.56±0.03 Δδ13C/‰0.15 0.48 0.98 1.02 1.08
3 討論
3.1 黃條不同組織碳穩定同位素的轉化率
生物體的碳穩定同位素值是由其所攝食的食物所決定,當攝食改變時,生物體組織中穩定同位素值取決于穩定同位素在其體組織中的轉化速率[7,16,17]。大量的研究結果表明[17-19],攝食新食物后,生物的體質量要增長2.5~4倍才能與其食物達到同位素平衡。如果生物體沒有與食物達到同位素平衡,穩定同位素分餾分析就可能產生偏差[20]。本研究中,實驗30d后黃條體質量增長3倍,第30d與第35d、第40d肌肉的 δ13C無顯著差異(P>0.05),認為黃條各組織已與其餌料達到穩定同位素分餾平衡,不同組織的轉化率由大到小依次為:肝、腸、鰓、心臟、肌肉,其中肝臟的轉化率大約是肌肉的2倍,與Witting[5]等對犬齒牙鲆食性轉變實驗的結果一致。生物體各組織與食物達到穩定同位素平衡的速率與其蛋白質周轉速率有關,這可能是本研究中肝臟同位素轉化率最快的主要原因。Tieszen等[1]在對沙鼠Meriones unguienlatus的攝食生態研究中發現,脂質含量高的組織同位素轉化速率高。Church等[21]對虹鱒Oncorhynchus mykiss不同組織穩定同位素轉化率分析后發現,粘液具有很高的免疫活性和再生能力,同樣有較高的同位素轉化率。腸和鰓絲都是黏膜結構,脂質含量高且能夠分泌黏液,這可能是引起本研究中黃條腸、鰓組織轉化率高的原因之一。
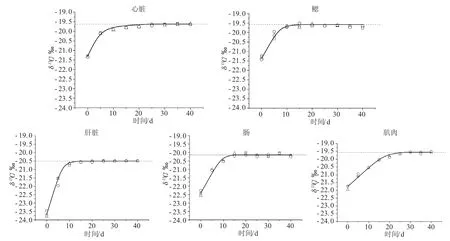
圖2 黃條不同組織的δ13C隨時間的變化Fig.2 The changes in δ13C value with time in different tissues of yellow tail Seriola aureovittata
表3 黃條不同組織基于時間模型的碳穩定同位素轉化參數Tab.3 The transformation parameters of carbon stable isotope in different tissues of yellow tail Seriola aureovittata based on time model
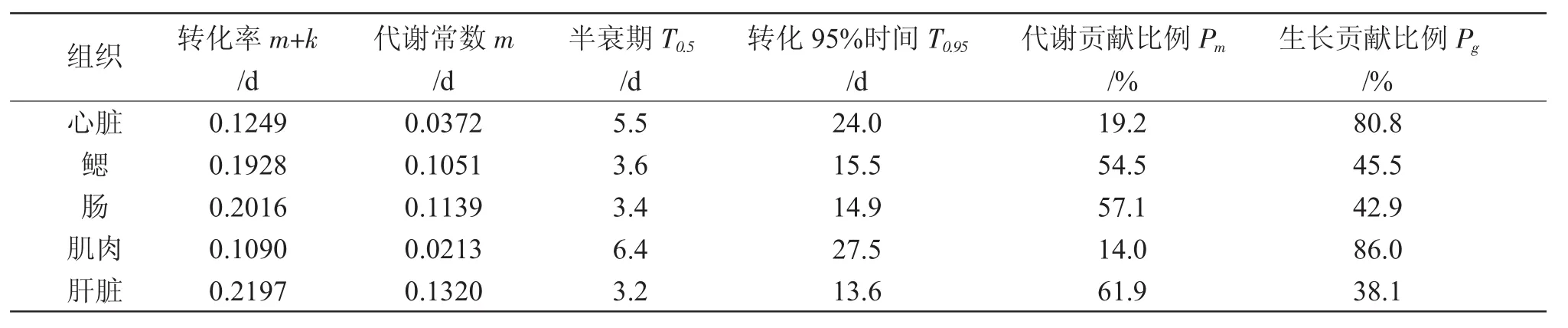
表3 黃條不同組織基于時間模型的碳穩定同位素轉化參數Tab.3 The transformation parameters of carbon stable isotope in different tissues of yellow tail Seriola aureovittata based on time model
組織心臟鰓腸肌肉肝臟轉化率m+k/d 0.1249 0.1928 0.2016 0.1090 0.2197代謝常數m/d 0.0372 0.1051 0.1139 0.0213 0.1320半衰期T0.5/d 5.5 3.6 3.4 6.4 3.2轉化95%時間T0.95/d 24.0 15.5 14.9 27.5 13.6代謝貢獻比例Pm/%19.2 54.5 57.1 14.0 61.9生長貢獻比例Pg/%80.8 45.5 42.9 86.0 38.1
眾多研究表明[22-25],穩定同位素在生物體內會發生差異分配,即生物體所攝取的不同食物成分會被其特定組織或部位選擇性吸收;生物不同組織對食物變化的響應速度也不同,組織達到同位素分餾平衡所需的時間差異較大,這可能導致動物特定組織無法反映其整體的同位素組成和變化規律,因此在采用穩定同位素方法開展動物食性與營養相關研究時,應根據特定研究目的和時間選取具有代表性的體組織。
3.2 生長與代謝對黃條不同組織碳穩定同位素轉化的影響
穩定同位素轉化由兩個不同的過程組成,即組織生長和新陳代謝過程[3]。生長過程中,新合成組織的穩定同位素組成會稀釋原有組織的穩定同位素組成,而代謝過程則產生組織替換作用[26]。Nathan等[27]認為,生長作用對于生長速率較快的生物同位素轉化的影響占主導地位,而代謝作用可能對生長緩慢的生物影響更明顯。但Suzuki等[22]對此提出異議,認為生物體不同組織的氨基酸、脂肪酸等營養成分組成及生理代謝速率不同,導致代謝作用對不同組織同位素轉化率的影響不同。本研究中,新組織生長對黃條心臟和肌肉組織的轉化率貢獻占主導作用,而代謝作用對肝臟、腸和鰓組織同位素轉化率貢獻比例較生長作用更大,這可能與肝臟、腸、鰓組織的代謝速率較高有關,與Madigan等[28]對太平洋藍鰭金槍魚Thunnus orientalis同位素轉化率研究結果一致。
3.3 黃條不同組織碳穩定同位素的富集系數
碳同位素富集系數即動物組織與其食物之間同位素豐度(δ13C)的差異值(Δδ13C),是應用穩定性同位素技術分析生態系統營養關系、食性和食物網時的重要參數[29]。Peterson等[30]比較大量研究文獻后發現,消費者的碳穩定同位素和食物來源基本相似,富集系數總體平均值在0‰~1‰,同一營養級的碳穩定同位素富集為1.5‰左右,經常用于分析食物來源及物質與能量的流動。Rio等[31]指出,在食性轉變實驗中,選用的餌料應盡量滿足研究生物的營養需求,若餌料缺乏該種生物在特定生長階段必需的營養物質,生物體就會提高攝食量來彌補食物中缺乏營養物質,這使得生物體必須進行更多非必須營養物質的代謝循環,導致更多重穩定同位素在生物體內大量積累,使生物與食物間分餾系數過高。Trueman等[32]通過投喂人工飼料研究發現,大西洋鮭Salmo salar肌肉的Δδ13C為2.1‰、肝臟為1.6‰。周暉等[33]以啤酒酵母和玉米蛋白為餌料,發現軍曹魚 Rachycentron canadum肌肉的 Δδ13C為 4.04‰。本研究中黃條不同組織的Δδ13C差異可能是由于脂肪含量不同引起,生物體在合成脂肪的過程中,發生明顯的碳歧視效應,即趨向于利用較輕的12C合成脂肪,脂肪中的δ13C要比蛋白質和單糖類化合物低6‰[34]。肝臟的脂肪含量高于其他組織,可能就是本研究中肝臟的分餾系數小于其他組織的原因。黃條不同組織的Δδ13C為0.15‰~1.08‰,不同組織的富集系數從小到大依次為:肝、腸、心臟、鰓、肌肉,這與黃條在新陳代謝過程中體內物質與能量的流動途徑基本一致,即從肝、腸等消化器官通過血液流入心臟,再通過循環系統進入鰓完成氣體交換最后到達肌肉。蔡德陵等[35]對鱸Lateolabrax japonicus的穩定同位素分餾作用研究中也發現相似的規律。本研究認為,結合生物體不同組織的穩定同位素轉化率和不同組織的穩定同位素富集系數這兩項參數共同分析,可能會量化展示出生物體內營養物質和能量的流動途徑。
[1]Tieszen LL,Boutton TW,Tesdahl K G,et al.Fractionation and turnover of stable carbon isotopes in animal tissues:implications for δ13C analysis of diet[J].Oecologia,1983,57(1-2):32-37.
[2]Fry B and Arnold C.Rapid13C/12C turnover during growth of brown shrimp (Penaeus aztecus)[J].Oecologia,1982,54(2):200-204.
[3]Macavoy S E,Macko S A and Garman G C.Isotopic turnover in aquatic predators:quantifying the exploitation of migratory prey[J].Canadian Journal of Fisheries&Aquatic Sciences,2001,58(5):923-932.
[4]Mcintyre P B and Flecker A S.Rapid turnover of tissue ni-trogen of primary consumers in tropical freshwaters[J].Oecologia,2006,148(1):12-21.
[5]WittingD A,Chambers R C,Bosley K L,et al.Experimental evaluation of ontogenetic diet transitions in summer flounder (Paralichthys dentatus),using stable isotopes as diet tracers[J].Canadian Journal of Fisheries&Aquatic Sciences,2004,61(11):2069-2084.
[6]Logan J,Haas H,Deegan L,et al.Turnover rates ofnitrogen stable isotopes in the salt marsh mummichog,Fundulus heteroclitus,following a laboratory diet switch[J].Oecologia,2006,147(3):391-395.
[7]Del Rio C M,Wolf N,Carleton S A,et al.Isotopic ecology ten years after a call for more laboratory experiments[J].Biological Reviews of the Cambridge Philosophical Society,2009,84(1):91-111.
[8]Guelinckx J,Maes J,Van D D P,et al.Changes in δ13C and δ15N in different tissues of juvenile sand goby Pomatoschistus minutus:a laboratory diet-switch experiment[J].Marine EcologyProgress,2007,341(1):205-215.
[9]Buchheister Aand Latour R J.Turnover and fractionation of carbon and nitrogen stable isotopes in tissues of a migratory coastal predator,summer flounder(Paralichthys dentatus)[J].Canadian Journal of Fisheries&Aquatic Sciences,2010,67(3):445-461.
[10]張妙,陳新軍,陳亞,等.黃顙魚不同組織碳氮穩定同位素的周轉與分餾研究[J].上海海洋大學學報,2016,25(6):822-830.
[11]姜大為,林樂玲,陳勇,等.黃條室內越冬及生長觀察[J].大連海洋大學學報,2001,16(3):223-227.
[12]鐘建興,蔡良候,鄭惠東,等.黃條胚胎發育觀察[J].漁業研究,2010(2):22-25.
[13]Bligh E G and Dyer W J.A rapid method oftotal lipid extraction and purification[J].Canadian JournalofBiochemistryand Physiology,1959,37(8):911-917.
[14]Mariotti A.Atmospheric nitrogen is a reliable standard for natural15N abundance measurements[J].Nature,1983,303(5919):685-687.
[15]Buchheister A B and Latour R J.Turnover and fractionation of carbon and nitrogen stable isotopes in tissues of a migratorycoastal predator,summer flounder(Paralichthys dentatus)[J].Canadian Journal of Fisheries&Aquatic Sciences,2009,67(3):445-461.
[16]Deniro MJ and Epstein S.Influence of diet on the distribution of carbon isotope ratios in animals[J].Geochim CosmochimActa,1978,42(5):495-506.
[17]Deniro MJ and Epstein S.Influence of diet on the distribution of nitrogen isotopes in animals[J].Geochim CosmochimActa,1981,45(3):341-351.
[18]Anderson R K,Parker P L and Lawrence A.A13C/12C Tracer studyofthe utilization ofpresented feed by a commercially important shrimp Penaeus vannamei in a pond growout system[J].Journal ofthe World Aquaculture Society,1987,18(3):148-155.
[19]Vander Zanden MJ,HulshofM,Ridgway M,et al.Application of stable isotope techniques to trophic studies of age-0 smallmouth bass[J].Transactions of the American Fisheries Society,1998,127(5):729-739.
[20]O′Reilly C M,Hecky R E,Cohen A S,et al.Interpreting stable isotopes in food webs:recognizing the role of time averaging at different trophic levels[J].Limnology&O-ceanography,2002,47(1):306-309.
[21]Church MR,Ebersole J L,Rensmeyer K M,et al.Mucus:a new tissue fraction for rapid determination of fish diet switchingusingstable isotope analysis[J].Canadian Journal ofFisheries&Aquatic Sciences,2009,66(1):1-5.
[22]Suzuki K W,Kasai A,Nakayama K,et al.Differential isotopic enrichment and half-life among tissues in Japan[J].Canadian Journal of Fisheries&Aquatic Sciences,2005,62(3):671-678.
[23]SeminoffJ A,Bjorndal K A and Bolten A B.Stable carbon and nitrogen isotope discrimination and turnover in pond sliders Trachemys scripta:insights for trophic study of freshwater turtles[J].Copeia,2001,2007(3):534-542.
[24]Sweeting C J,Barry J,Barnes C,et al.Effects of body size and environment on diet-tissue δ15N fractionation in fishes[J].Journal of Experimental Marine Biology&E-cology,2007,340(1):1-10.
[25]Yan V,Banas D,Thomas M,et al.Stable isotope variability in tissues of the Eurasian perch Perca fluviatilis[J].Comparative Biochemistry&Physiology Part A Molecular&Integrative Physiology,2007,148(3):504-509.
[26]Hesslein R H,Hallard K A and Ramlal P.Replacement of sulfur,carbon,and nitrogen in tissue of growing broad whitefish (Coregonus nasus)in response to a change in diet traced by δ34S,δ13C,and δ15N[J].Canadian Journal of Fisheries&Aquatic Sciences,1993,50(6):1267-1272.
[27]Wolf N,Carleton S A and del Rio C M.Ten years of experimental animal isotopic ecology[J].Functional Ecology,2009,23(1):17-26.
[28]Madigan D J,Litvin S Y,Popp B N,et al.Tissue turnover rates and isotopic trophic discrimination factors in the en-dothermic teleost,Pacific bluefin tuna(Thunnus orientalis)[J].Plos One,2012,7(11):e49220.
[29]Hobson K A and Clark R G.Assessing avian diets using stable isotopes I:turnover of13C in tissues[J].Condor,1992,94(1):181-188.
[30]Peterson B J and Fry B.Stable isotopes in ecosystem studies[J].AnnualReviewofEcology&Systematics,1987,18(1):293-320.
[31]Rio C MD and Wolf B O.Mass-balance models for animal isotopic ecology[M].In:Physiological and Ecological Adaptations toFeedingin Vertebrates(eds Starck,J.M.&Wang,T.).SciencePublishers,2005,Enfield,NewHampshire,pp.141-174.
[32]Trueman C N,Mcgill R A and Guyard P H.The effect of growth rate on tissue-diet isotopic spacing in rapidly growing animals.An experimental study with Atlantic salmon(Salmo salar)[J].Rapid Communications in Mass SpectrometryRcm,2005,19(22):3239-3247.
[33]周暉,陳剛,施鋼,等.不同蛋白源對軍曹魚碳、氮穩定同位素分餾的影響[J].熱帶海洋學報,2014,33(5):35-40.
[34]DeNiro M J and Epstein S.Mechanism of carbon isotope fractionation associated with lipid synthesis[J].Science,1977,197(4300):261-263.
[35]蔡德陵,張淑芳,唐啟升,等.鱸魚新陳代謝過程中的碳氮穩定同位素分餾作用[J].海洋科學進展,2003,21(3):308-317.
Conservation Rate and Fractionation of Carbon Stable Isotope from Different Tissues in Yellow Tail Seriola aureovittata
HAN Yu-jia1,2,TIAN Jia-shen2,LI Duo-hui3,WANG Zhen1,2,LU Zhi-chuang2,Mu Yun-lei2
(1.Dalian Ocean University,Dalian 116023,China;2.Liaoning Key Laboratory of Marine Biological Resources and Ecology,Liaoning Ocean and Fisheries Science Research Institute,Dalian 116023,China;3.Dalian Fisheries Research Institute,Dalian 116085,China)
In this study,the conversion difference and fractionation coefficient of carbon stable isotope in different tissues were investigated in yellow tail Seriola aureovittata with body weight of(34.2± 1.8)g fed diets containing detected carbon source by stable isotope technique in a laboratory condition at water temperature of 18.79~22.15℃in order to understand the effects of tissue growth and metabolism on the relative contribution of the carbon stable isotope conversion in different tissues of yellow tail.The results showed that the minimal half-life of carbon stable isotope was observed in liver (3.2 d),followed by intestine (3.4 d),gill(3.6 d),heart(5.5 d),and muscle(6.4 d),and that the minimal enrichment coefficients of carbon stable isotope in liver and diet(0.15‰),followed by intestine(0.48‰),heart(0.98‰),gill(1.02‰)and muscle(1.08‰).The higher stable isotope conversion rates in liver and intestine were involved in high metabolic rate(>60%),thus relatively less contribution to growth.Liver and intestine can reflect the isotope alteration during the assimilation of dietary carbon in short-term feeding,while the muscle reflects the isotope alteration of long-term feeding.The findings improved the biology of yellow tail,and provided information for the stable isotope sample collection at different period,diet enrichment and selection in the aquaculture industry.
Seriola aureovittata;carbon stable isotope;isotope fractionation;conservation rate
S917
A
1005-3832(2017)06-0034-07
2017-06-05
遼寧省科技計劃項目(2014203006);遼寧省海洋與漁業廳科研項目(201609).
韓羽嘉(1993-),男,碩士研究生,從事水產養殖研究.E-mail:luhuaqing@sina.cn
木云雷(1960-),男,副研究員,從事魚類育種研究.E-mail:muyunlei@sina.com

