應用Illumina Miseq測序分析飲用水源水中病毒多樣性
葛英亮,于水利*,時文歆*
應用Illumina Miseq測序分析飲用水源水中病毒多樣性
葛英亮1,2,于水利2,3,*,時文歆2,*
(1.哈爾濱學院食品工程學院,黑龍江 哈爾濱 150080;2.哈爾濱工業大學市政環境工程學院,黑龍江 哈爾濱 150090;3.同濟大學環境科學與工程學院,上海 200092)
以東太湖水源水為研究對象,應用梯度-串聯-循環-切向流超濾技術對水體中病毒進行分離濃縮,使用非序列依賴性單引物擴增技術擴增源水中病毒基因組,采用Illumina Miseq進行測序,與NCBI基因數據庫進行比對,質控后獲得1 190 914 928 bp基因數據,可組裝成5 554 條scaffolds序列,獲知病毒基因組功能,經比對可注釋到尾噬菌體目(Caudovirales)、皰疹病毒目(Herpesvirales)、線狀病毒目(Ligamenvirales),在科的水平上,注釋到40 個科病毒的同源序列,其中含量較高的病毒科為Microviridae占27.590 1%,Siphoviridae占23.010 7%,Phycodnaviridae占5.322 2%,Retroviridae占1.691 2%,Mimiviridae占1.960 8%,其中無法注釋(norank)占21.572 8%,102 112 條reads在科水平上norank,研究可以高通量的獲得水源水中病毒多樣性信息,并為水體中病毒的檢測提供理論參考依據。
Illumina Miseq測序;飲用水源水;病毒;多樣性
病毒是一種沒有細胞結構的特殊生物體,幾乎可以感染所有具有細胞結構的生命體(動物、植物、微生物等)[1-2]。病毒不僅存在于宿主細胞及生物體內,且可獨立存在于生態環境中[3]。水體是病毒可長期存活的環境之一,也是病毒傳播的主要介質之一,水體中病毒分析一直以來都是水體微生物中最具挑戰性的研究。自20世紀50年代以來,人們越來越關注水體中病毒對人類健康的危害[4]。有研究發現,部分病毒在自然水體中存活時間很長。在水體病毒實驗室檢測中,采用配制水研究病毒在水體中存活的狀態,不夠合理,也不能有效說明自然水體中病毒的組成和豐度[5-7]。病毒個體小、變異速度快,且不具有類似細菌、真菌等微生物的保守系統發育序列,難以采用常規的分子生物學檢測手段進行分類評估,不能同細菌、真菌等微生物群體一樣采用16S rDNA、18S rDNA及ITS保守序列進行多樣性分析[8],因而,病毒多樣性研究一直是微生物生態學研究的難點[9-10]。目前,已有研究方法效率低,準確率不高。由于飲用水生產過程中病毒的檢測難以進行,僅有美國和加拿大等幾個發達國家在飲用水標準中有極少的與病毒相關的要求和指標[11],且病毒對飲用水消毒中常用消毒劑抗性強于細菌,具有一定的泄露風險,因此,應當增加水體中病毒多態性的分析和檢測領域的研究[12-13]。
出廠水中可能存在病毒的種類和豐度可能取決于源水中病毒的多態性和豐度,本研究采用梯度-串聯-循環-切向流超濾(gradient-series connection-circulation-tangential flow ultrafiltration,GSC-TFF)技術可有效分離濃縮水源水中病毒;采用非序列依賴性單引物擴增技術(sequence independent single primer amplification,SISPA)[14]擴增未知的核苷酸序列,使得未知微量基因序列的有效測序成為可能[15];采用新一代測序技術對獲得RNA病毒[16]、DNA病毒的基因序列進行測序、生物信息學分析,為飲用水生產中病毒多樣性的全面快速檢測方法的建立打下一定理論基礎[17],為水體病毒的多樣性研究提供了新的途徑[18-21],為飲用水病毒快速檢測技術的開發提供一定的參考依據。
1 材料與方法
1.1 材料與處理
研究選取中國東太湖某凈水廠源水(N31o0’8.88”,E120o27’21.15”),該凈水廠于2013年投入生產,日產飲用水300 000 t,源水水質相對穩定。2014年分別于1月、4月、7月和10月進行采樣,每月采樣4 次,每次采集源水200 L,研究采用GSC-TFF的方法:將水體先后通過1 μm濾膜進行預過濾,濾液進行0.22 μm TFF,獲得濾液經過50 kDa切向流超濾,將濃縮液用蠕動泵循環注入至0.22 μm TFF超濾后獲得濾液中,直至獲得濃縮液體積約100 mL,后采用超濾管進一步濃縮,流程見圖1。
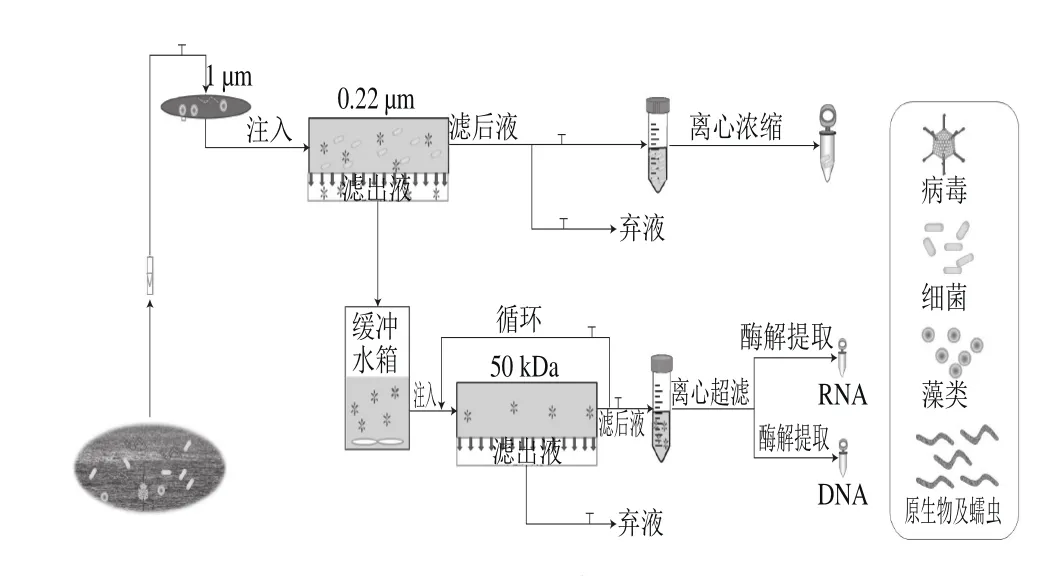
圖1 GSC-TFF法分離富集源水中病毒Fig. 1 Separation and enrichment of virus by GSC-TFF method from source water
1.2 試劑
Innu PREP Virus DNA/RNA Kit 德國Analytik Jena AG公司;AxyPrepDNA凝膠回收試劑盒 美國Axygen公司;Rna EZ Reagents H RNase-Be-Gone for solution applications RT4202 加拿大BIO Basic Canada Inc.公司;M-MuLV一步法RT-PCR試劑盒SK24320 生工生物工程(上海)股份有限公司。
1.3 儀器與設備
SK-15臺式高速冷凍離心機 德國Sigma公司;JS-400A恒溫金屬浴 上海培清科技有限公司;GeneAmp?9700型聚合酶鏈式反應(polymerase chain reaction,PCR)儀 美國ABI公司;NanoDrop2000超微量分光光度計 美國Thermo Scientific公司;QuantiFluor?-ST藍色熒光定量系統 美國Promega公司;MiSeq PE250測序儀 美國Illumina公司;Amicon Ultra-15 mL、50 kDa Centrifugal Filter Unit、Pellicon XL 50 cm2切向流超濾 美國Millipore公司。
1.4 方法
1.4.1 源水中DNA病毒、RNA病毒中基因組提取
各采樣時間獲得濃縮病毒液體分成10 份,每份200 μL,采用DNaseⅠ和RNaseⅠ消解非病毒DNA及RNA片段(濃縮液200 μL,DNaseⅠ10 μL,DNaseⅠbuffer 30 μL,RNase 3 μL,37 ℃孵育90 min,75 ℃孵育10 min),以去除混雜的DNA和RNA,采用Innu PREP Virus DNA/RNA Kit提取病毒DNA和RNA。
1.4.2 RNA病毒基因組RNA反轉錄、DNA及cDNA的SISPA擴增[22-24]
為保證后續實驗的穩定進行,對獲取RNA樣本進行隨機反轉錄,將1.4.1節中獲得RNA 10 μL,FR26RV-N(5’-GCCGGAGCTCTGCAGATATCNNNNNNN-3’)2 μL,FR40RV-T(5’-GCCGGAGCTCTGCAGATATCTT TTTTTTTTTTTTTT-3’)2 μL以RNase free ddH2O定容至12 μL,混勻后離心3~5 s,65 ℃反應5 min,移至冰上,在冰浴中加入以下組分:5×Frist strand buffer 4 μL,RNase Inhibitor(20 U/μL)8 U 1 μL,DTT 4 μL,dNTP(10 mmol/L)2 μL,M-MulV RT(200 U/μL) 1 μL,混勻后離心3~5 s,RNA病毒反轉錄條件為:25 ℃反應10 min,42 ℃反應50 min,70 ℃反應10 min,轉移至冰浴冷卻后置于-20 ℃保存。同時進行DNA基因組處理:DNA樣本20 μL,1×Ecopol buffer 2.5 μL,dNTP(10 mmol/L)1 μL,FR20RV-N 2 μL,于94 ℃溫浴3 min,轉移至冰浴冷卻后置于-20 ℃保存。分別向上述獲得溶液中加入3’-5’ exo klenow DNA polymerase 0.5 μL,37 ℃、60 min。
SISPA擴增反應體系如下:1×GeneAmp PCR buffer 5 μL,MgCl2(12.5 mmol/L)4 μL,dNTP(10 mmol/L)1 μL,R20RV(10 μmol/L)1 μL,AmpliTaq酶(2.5 U/μL)0.25 μL,ddH2O補齊至50 μL;94 ℃預變性10 min,擴增反應程序為94 ℃變性1 min,60 ℃退火1 min,72 ℃延伸2 min進行40 個循環,72 ℃延伸7 min,4 ℃保存,置入-20 ℃保藏。
1.4.3 瓊脂糖凝膠電泳鑒定及回收
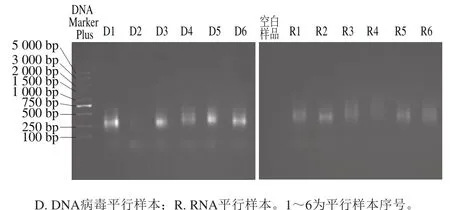
圖2 SISPA產物瓊脂糖凝膠電泳圖Fig. 2 Agarose gel electrophoresis of the SISPA products
將全年4 次采樣并擴增獲得DNA及RNA產物分別混合,采用2%瓊脂糖凝膠鑒定,具體為采用1×TAE緩沖溶液、DNA Marker Plus、65 V,70 min,見圖2。采用AxyPrep DNA kit試劑盒回收150~1 500 bp片段。
1.4.4 源水中病毒基因組測序質控、分析及組裝
采用Covaris M220對獲得基因組片段化,片段化后DNA長度小于400 bp,構建文庫(DNA片段兩端鏈接接頭,瓊脂糖凝膠電泳篩選片段,保留AB接頭完整片段,氫氧化鈉變性,獲得單鏈DNA),橋式PCR,Illumina Miseq測序,基因測序委托上海美吉生物醫藥科技有限公司進行,DNA序列測序、拼接、質控由該公司協助完成。測序結果表明基因組測序質量較好,具有研究意義,對原始測序數據進行質控,剪切adapter,修剪低質量reads末端和含N比例較高的reads(>10%),去除小片段。
1.4.5 源水中病毒基因組比對方法
宏基因組測序獲得reads經質檢、篩選、拼接后與美國國家生物信息中心(National Center for Biotechnology Information,NCBI)病毒庫(https://www.ncbi.nlm.nih.gov/genomes/GenomesGroup.cgi?taxid=10239)進行分析比對[25],在BLAST比對過程中參數設置期望值e-value設置為1×10-5,而未采用在病毒基因比對過程中常用的1×10-3水平,提高了對基因相似程度的要求,雖減少了比對出病毒的分類數量,拋棄了因病毒變異導致的大規模基因差異,但同時提高了對病毒基因比對存在性的可能,對病毒多樣性研究更具有實際的意義。
2 結果與分析
2.1 測序結果及數據初步分析

表1 源水病毒基因組測序數據統計Table 1 Statistics of viral genome sequences in source water
經1.4.4節質控后測序共獲得基因組1 190 914 928 bp,測序數據統計見表1所示。將獲得基因序列進行組裝,對trim后的數據采用Errorcorrection校正,對校正后的序列merge,并基于overlap關系進行拼接,拼接后的數據采用GS De Novo Assembler v2.8軟件進行處理[26]。組裝后獲得5 554 條scaffolds(框架序列),在所有scaffolds中的堿基共3 900 026 bp,超過1 000 bp的長scaffolds序列共445 條,最長的基因堿基長度5 386 bp。其中scaffold N50的長度為1 177 bp、scaffold N90的長度為1 023 bp,這表明采用該方法獲得的病毒基因組的基因序列信息優于此前Kyle Bibby對污泥中病毒基因組的測序獲得病毒基因組信息[27]。
2.2 飲用水源水中病毒基因組COG、KOG功能分析
將測序獲得reads采用Barrnap 0.4.2和tRNAscan-SE v1.3.1軟件對基因組中包含的rRNA和tRNA進行預測,利用Glimmer 3.02(http://www.cbcb.umd.edu/software/glimmer/)軟件進行病毒的基因預測,共識別出368 個orf,平均長度為697 bp,與string數據庫(V9.05版)進行BLASTP(BLAST 2.2.28+)比對,進行COG功能分析,見圖3。
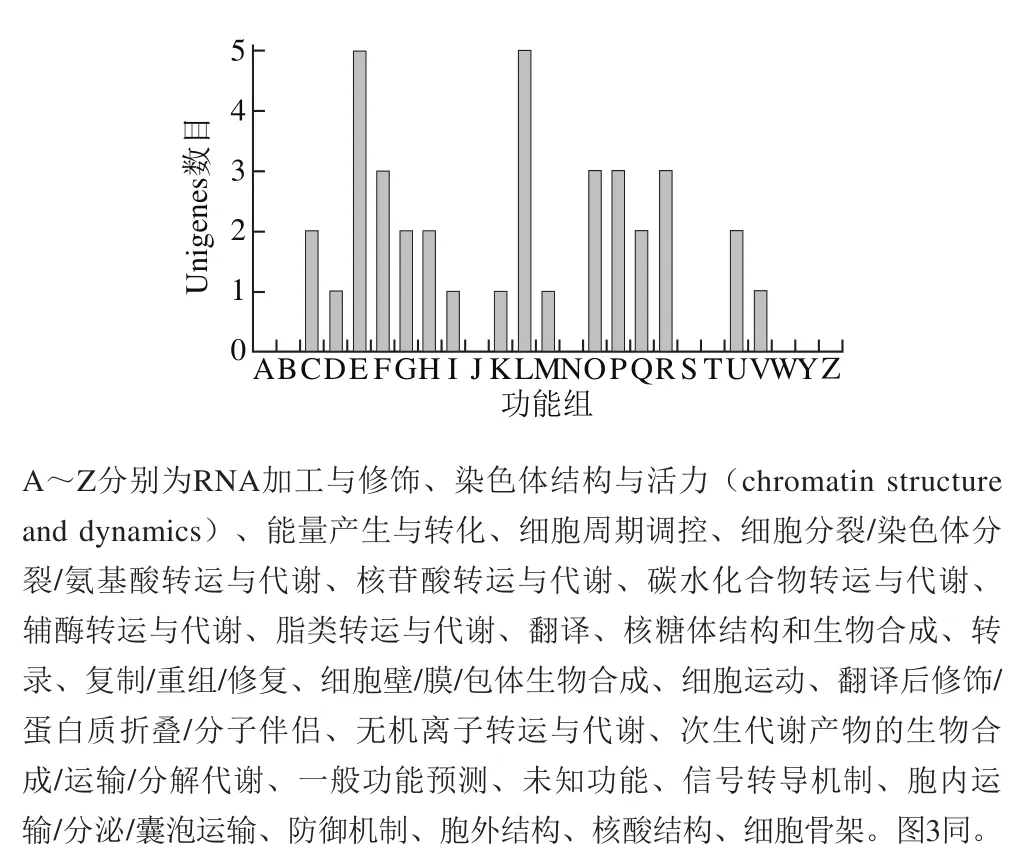
圖3 源水病毒基因組COG功能分析Fig. 3 COG functional analysis of viral genome in source water
圖3表明,Unigenes可劃分為16 個功能組,大部分功能均為可知,較多的COG功能分類組集中在氨基酸運輸和代謝、復制、重組和修復、翻譯后修飾、蛋白折疊和分子伴侶等功能,這些功能均與病毒體在宿主細胞內的復制、繁殖相關,而部分功能則與病毒侵入細胞膜、胞內運輸、基因防御有關,卻不具備核結構、染色體結構、胞外骨架、核糖核酸修飾等原核和真核微生物基因所擁有的功能,研究獲得病毒的基因組無其他微生物基因摻雜,具有可信性。同時進行KOG功能分類,圖4結果顯示,預測基因僅具有翻譯后修飾、蛋白折疊和分子伴侶,相較之下,病毒基因功能預測中Unigenes數量相較原核微生物和真核微生物少的多,且其功能相較簡單。這些功能多介入宿主細胞的調控、宿主細胞過程和調控、控制細胞的代謝。

圖4 源水病毒基因組KOG功能分類Fig. 4 KOG functional classification of viral genome in source water
2.3 飲用水源水中病毒基因KEGG通路分析
測序獲得病毒基因組與KEGG(http://www.genome.jp/kegg/)數據庫[28]運用BLAST算法(blastx/blastp 2.2.28+)進行比對,共獲得92 個基因,被注釋到68 個orf區(open reading frame)中,其中包括與噬菌體相關基因xtmB、obg,與病毒侵入宿主后影響宿主DNA復制相關基因dnaG、mraW、rsmH、parA、soj、DPO1、polA等,通過KEEG通路分析可了解病毒基因組功能,難以獲得源水中病毒的多樣性信息。這些基因可參與到61 個基因通路中,這些基因通路中可能由病毒影響宿主發生相應變化的有:錯配修復、同源重組、細胞周期、堿基切除修復、DNA復制、代謝途徑、RNA降解等,其中與代謝途徑相關的基因功能片段最多共26個orf區。
2.4 飲用水源水中病毒多樣性分析
獲得的病毒基因組測序reads用1.4.5節中所述方法進行比對,經過比對按照國際病毒分類委員會的分類方法[29],在目的水平上分為:有尾噬菌體目(Caudovirales)、皰疹病毒目(Herpesvirales)、線狀病毒目(Ligamenvirales),未定義到剩余四個目:單股反鏈病毒目(Mononegavirales)、網巢病毒(Nidovirales)、小核糖核酸病毒(Picornavirales)和蕪菁黃花葉病毒目(Tymovirales),剩余的scaffolds序列被定義為norank,這說明在源水中病毒的分類較為豐富。
在科的水平上,宏基因組測序獲得基因序列經過比對可注釋到40 個科病毒的同源序列,其中含量最高的病毒科為Microviridae占27.590 1%,Siphoviridae占23.010 7%,Phycodnaviridae占5.322 2%,Podoviridae占4.884 5%,Retroviridae占1.691 2%,Mimiviridae占1.960 8%,norank占21.572 8%,表明有102 112 條reads在科水平上無法分類(norank),見圖5。
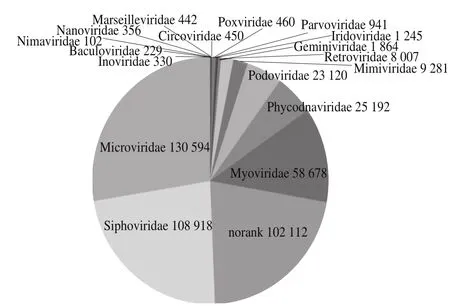
圖5 源水科水平主要病毒多樣性及豐度Fig. 5 Diversity and abundance of viruses in source water at the family level
在比對出的4 0 個科的病毒涵蓋了動物病毒(Baculoviridae、Asfarviridae、Iridoviridae等)、植物病毒(Potyviridae、Caulimoviridae、Geminiviridae等)、古菌病毒(Lipothrixviridae)、藻類病毒(Phycodnaviridae)、噬菌體(Myoviridae、Rudiviridae)、逆轉錄病毒(Retroviridae)等,從遺傳物質結構來看在比對結果中存在DNA病毒(Herpesviridae、Alloherpesviridae、Adenoviridae、Poxviridae等)、RNA病毒(Reoviridae、Retroviridae、Orthomyxoviridae等)、噬菌體(Myoviridae、Inoviridae等),此外,從遺傳物質的鏈型來看,存在ssDNA病毒、dsDNA病毒、線狀DNA病毒、環狀DNA病毒、環狀單鏈DNA病毒、dsRNA病毒、ssRNA病毒、線狀RNA病毒、環狀RNA病毒等,驗證了將RNA病毒中RNA反轉錄后與DNA病毒DNA一同進行SISPA的可行性,同時說明了在源水中病毒的多樣性,采用病毒宏基因組測序的方法結合RNA病毒反轉錄和與DNA病毒的DNA序列一同進行SISPA可有效探知環境(水體)中RNA病毒和DNA病毒的多樣性,破解了病毒高通量檢測的難題。
從病毒的致病性來看,比對出的40 個科的病毒中含有大量致病性的病毒,包括魚貝類致病病毒(Malacoherpesviridae、Alloherpesviridae)、豬致病病毒(Asfarviridae,流行病學調查以前未出現于亞洲)[30-31]、無脊椎動物病毒(Iridoviridae、Baculoviridae等)、植物致病病毒(Caulimoviridae、Geminiviridae等)、人及動物病毒(Flaviviridae、Reoviridae、Retroviridae等)、藻類病毒(Phycodnaviridae)等,這些病毒菌具有較強的致病性,且其中部分病毒、可導致人體腫瘤、癌癥,采用宏基因組測序的方法可以將各類病毒一次檢測,具有高通量的特點。
3 結 論
在飲用水生產中病毒的主要來源可能為源水,源水中病毒滴度低,難以富集,采用GSC-TFF法富集源水中病毒,源水濃縮效果好,源水中病毒經過基因組提取,RNA病毒反轉錄后與DNA病毒基因一起進行SISPA擴增,擴增產物長度較長而進行片段化后,采用Illumina Miseq病毒基因組測序,結果表明:1)飲用水源水中含有大量病毒,KEEG分析及病毒基因預測發現基因組中含有基因功能與病毒侵入細胞進行復制繁殖等相關,不具備核結構、染色體結構,表明研究采用濃縮方法可以很好剔除非病毒微生物,為后期研究提供參考依據;2)病毒基因組COG和KOG分析表明,病毒基因組中存在病毒相關功能基因,但如僅采用基因組功能分析,難以揭示環境中(源水)病毒的豐度和多樣性;3)因病毒基因中不具有高度保守性和特異性的序列,多樣性分析困難,病毒變異速度快,將病毒基因組與NCBI中病毒基因數據庫直接進行BLAST是病毒多樣性分析中有效的方法,通過比對獲得源水中病毒多樣性的信息,以及致病性較強的病毒信息,為后期的病毒的分子生物學快速檢測奠定基礎,研究在源水中獲得3 個病毒目、40 個病毒科、119 個病毒屬的多樣性信息,獲知源水中病毒多態性,可以此為基礎開發水體病毒的快速檢測技術,應用于飲用水生產中病毒的快速檢測。
[1] FUHRMAN J A. Microbial community structure and its functional implications[J]. Nature, 2009, 459: 193-199. DOI:10.1038/nature08058.
[2] KOONIN E V, SENKEVICH T G, DOLJA V V. The ancient virus world and evolution of cells[J]. Biology Direct, 2006, 1(1): 29.DOI:10.1186/1745-6150-1-29.
[3] ZHOU Y, FERNANDEZ S, YOON I, et al. Metagenomics study of viral pathogens in undiagnosed respiratory specimens and identification of human enteroviruses at a Thailand hospital[J]. The American Journal of Tropical Medicine and Hygiene, 2016, 95(3):663-669. DOI:10.1186/1745-6150-1-29.
[4] GOYAL S M C J L. Viruses in foods[M]. Switzerland: Springer International Publishing, 2016: 5-42.
[5] DALZIEL A E, DELEAN S, HEINRICH S, et al. Persistence of low pathogenic influenza a virus in water: a systematic review and quantitative meta-analysis[J]. PLoS ONE, 2016, 11(10): e016878912.DOI:10.1371/journal.pone.0168789.
[6] DALZIEL A E, DELEAN S, HEINRICH S, et al. Correction:persistence of low pathogenic influenza a virus in water: a systematic review and quantitative meta-analysis[J]. PLoS ONE, 2016, 11(12):e168789. DOI:10.1371/journal.pone.0168789.
[7] PREVOST B, GOULET M, LUCAS F S, et al. Viral persistence in surface and drinking water: suitability of PCR pre-treatment with intercalating dyes[J]. Water Research, 2016, 91: 68-76. DOI:10.1016/j.watres.2015.12.049.
[8] ROHWER F, EDWARDS R. The phage proteomic tree: a genomebased taxonomy for phage[J]. Journal of Bacteriology, 2002, 184(16):4529-4535. DOI:10.1016/j.watres.2015.12.049.
[9] YU D, HAN L, ZHANG L, et al. Diversity and distribution characteristics of viruses in soils of a marine-terrestrial ecotone in East China[J]. Microbial Ecology, 2017, 74(263): 1-12. DOI:10.1007/s00248-017-1049-0.
[10] HUNTER P. Viral taxonomy: the effect of metagenomics on understanding the diversity and evolution of viruses[J]. EMBO Reports, 2017, 18(10): 1673-1870. DOI:10.15252/embr.201744982.
[11] 張云, 劉燕, 張強, 等. 飲用水標準中病毒指標應用現狀及研究進展[J].中國公共衛生, 2010(5): 540-542.
[12] SANGSANONT J, DANG T D, TRAN T V N, et al. Detection of pepper mild mottle virus as an indicator for drinking water quality in Hanoi, Vietnam, in large volume of water after household treatment[J].Journal of Environmental Science and Health Part A-Toxic/Hazardous Substances & Environmental Engineering, 2016, 51(13): 1100-1106.DOI:10.1080/10934529.2016.1199650.
[13] SARMA M P, AHMED G, MEDHI S, et al. Hepatitis B virus genome analysis in patients of hepatocellular carcinoma and asymptomatic carriers from northern, southern and North East India[J]. Current Science, 2016, 111(4): 648-661. DOI:10.18520/cs/v111/i4/648-661.
[14] CHRZASTEK K, LEE D, SMITH D, et al. Use of sequenceindependent, single-primer-amplification (SISPA) for rapid detection,identification, and characterization of avian RNA viruses[J]. Virology,2017, 509: 159-166. DOI:10.1016/j.virol.2017.06.019.
[15] DJIKENG A, HALPIN R, KUZMICKAS R, et al. Viral genome sequencing by random priming methods[J]. BMC Genomics, 2008,9(1): 5. DOI:10.1186/1471-2164-9-5.
[16] DJIKENG A, KUZMICKAS R, ANDERSON N G, et al. Metagenomic analysis of RNA viruses in a fresh water lake[J]. PLoS ONE, 2009,4(9): e72649. DOI:10.1371/journal.pone.0007264.
[17] HALL R J, WANG J, TODD A K, et al. Evaluation of rapid and simple techniques for the enrichment of viruses prior to metagenomic virus discovery[J]. Journal of Virological Methods, 2014, 195: 194-204. DOI:10.1016/j.jviromet.2013.08.035.
[18] 夏駿, 汪岷, 宮政, 等. 以宏基因組技術探討渤海秋冬季節病毒多樣性[J]. 海洋與湖沼, 2016, 47(3): 572-580. DOI:10.11693/hyhz20151100293.
[19] ROSARIO K, NILSSON C, LIM Y W, et al. Metagenomic analysis of viruses in reclaimed water[J]. Environmental Microbiology, 2009,11(11): 2806-2820. DOI:10.1111/j.1462-2920.2009.01964.x.
[20] POPGEORGIEV N, TEMMAM S, RAOULT D, et al. Describing the silent human virome with an emphasis on giant viruses[J].Intervirology, 2013, 56(6): 395-412. DOI:10.1159/000354561.
[21] COLSON P, FANCELLO L, GIMENEZ G, et al. Evidence of the megavirome in humans[J]. Journal of Clinical Virology, 2013, 57(3):191-200. DOI:10.1016/j.jcv.2013.03.018.
[22] YAO S, LI X, ZHAO S, et al. Duck enteritis virus identified in chickens with acute viral infection syndrome using DNAase-SISPA[J].2012 7thInternational Conference on System of Systems Engineering(SOSE), 2012: 797-800. DOI:10.1109/SYSoSE.2012.6333676.
[23] ROSSEEL T, SCHEUCH M, HOEPER D, et al. DNase SISPA-Next generation sequencing confirms schmallenberg virus in belgian field samples and identifies genetic variation in Europe[J]. PLoS ONE,2012, 7(7): e419677. DOI:10.1371/journal.pone.0041967.
[24] MASON P N, BERTOLINI G, LANCEROTTO R. Toothbrushing simulator:technical note[J]. G Stomatol Ortognatodonzia, 1985, 4(1): 71-74.
[25] NORLING M, KARLSSON-LINDSJO O E, GOURLE H, et al.MetLab: an in silico experimental design, simulation and analysis tool for viral metagenomics studies[J]. PLoS ONE, 2016, 11(8):e01603348. DOI:10.1186/1471-2105-12-119.
[26] KUMAR S, BLAXTER M L. Comparing de novo assemblers for 454 transcriptome data[J]. BMC Genomics, 2010, 11(1): 571.DOI:10.1186/1471-2164-11-571.
[27] VIAU E, BIBBY K, PAEZ-RUBIO T, et al. Toward a consensus view on the infectious risks associated with land application of Sewage Sludge[J]. Environmental Science & Technology, 2011, 45(13):5459-5469. DOI:10.1021/es200566f.
[28] DU J L, YUAN Z F, MA Z W, et al. KEGG-PATH: Kyoto encyclopedia of genes and genomes-based pathway analysis using a path analysis model[J]. Molecular Biosystems, 2014, 10(9): 2441-2447. DOI:10.1039/C4MB00287C.
[29] ADRIAENSSENS E M, KRUPOVIC M, KNEZEVIC P, et al.Taxonomy of prokaryotic viruses: 2016 update from the ICTV bacterial and archaeal viruses subcommittee[J]. Archives of Virology,2017, 162(4): 1153-1157. DOI:10.1007/s00705-016-3173-4.
[30] BAJRAI L H, BENAMAR S, AZHAR E I, et al. Kaumoebavirus,a new virus that clusters with Asfarviridae and Faustoviruses[J].Viruses-Basel, 2016, 8(11): 278. DOI:10.3390/v8110278.
[31] ANDREANI J, BOU KHALIL J Y, SEVVANA M, et al. Pacmanvirus,a new giant icosahedral virus at the crossroads between Asfarviridae and Faustoviruses[J]. Journal of virology, 2017, 91(22): 12-17.DOI:10.1128/JVI.00212-17.
Analysis of Virus Diversity in Drinking Source Water by Using Illumina MiSeq Sequencing Technology
GE Yingliang1,2, YU Shuili2,3,*, SHI Wenxin2,*
(1. School of Food Engineering, Harbin University, Harbin 150080, China;2. School of Municipal and Environmental Engineering, Harbin Institute of Technology, Harbin 150090, China;3. College of Environmental Science and Engineering, Tongji University, Shanghai 200092, China)
The viruses in drinking source water from east Tai Lake were separated and concentrated by gradient-series connection-circulation-tangential flow ultrafiltration (GSC-TFF). The viral genome was amplified by sequence independent single primer amplification (SISPA), sequenced by Illumina Miseq, and compared with the NCBI gene database using the basic local alignment search tool (BLAST). After quality control, 1 190 914 928 bp gene data were obtained, which could be assembled into 5 554 scaffold sequences. Viral genome function was found and annotated to Caudovirales, Herpesvirales and Ligamenvirales at the family level. A total of 40 families of homologous sequences were annotated, Microviridae (27.590 1%),Siphoviridae (23.010 7%), Phycodnaviridae (5.322 2%), Retroviridae (1.691 2%), Mimiviridae (1.960 8%) being the dominant ones. A total of 102 112 reads (21.572 8%) were identified as no rank at the family level. The approach proposed in this study can allow high throughput analysis of virus diversity in source water, paving the foundation for detecting virus in water.
Illumina Miseq sequencing; drinking source water; virus; diversity
10.7506/spkx1002-6630-201802045
Q939.9
A
1002-6630(2018)02-0287-06
葛英亮, 于水利, 時文歆. 應用Illumina Miseq測序分析飲用水源水中病毒多樣性[J]. 食品科學, 2018, 39(2): 287-292.
DOI:10.7506/spkx1002-6630-201802045. http://www.spkx.net.cn
GE Yingliang, YU Shuili, SHI Wenxin. Analysis of virus diversity in drinking source water by using Illumina Miseq sequencing technology[J]. Food Science, 2018, 39(2): 287-292. (in Chinese with English abstract)
10.7506/spkx1002-6630-201802045. http://www.spkx.net.cn
2017-07-15
“十二五”國家科技重大專項(2012ZX07403-001)
葛英亮(1979—),男,副教授,博士研究生,研究方向為食品生物技術、飲用水生物安全。E-mail:geyingliang@126.com
*通信作者簡介:于水利(1962—),男,教授,博士,研究方向為膜處理工藝、飲用水安全技術。E-mail:yushuiligd@126.com
時文歆(1970—),男,教授,博士,研究方向為膜分離技術、飲用水安全技術。E-mail:shiwx_hit@163.com

