長江口海域春季浮游植物的年際變化*
林 梅 李 揚
(華南師范大學生命科學學院 廣州市亞熱帶生物多樣性與環境生物監測重點實驗室 廣州 510631)
浮游植物是海洋生態系統的初級生產者, 具有種類多、數量大、繁殖快等特點, 是物質循環和能量轉化中的關鍵環節, 具有重要的生態意義(Armbrust,2009; 高亞輝等, 2011; 孫曉霞等, 2011)。作為浮游動物、魚、蝦、貝等直接或間接的食物來源, 浮游植物還是很好的水產餌料生物, 其種類數和細胞豐度可以用來估計海洋漁業資源(高亞輝等, 2011)。此外, 某些浮游植物也是全球重要的藻華原因種(Fryxell et al,2004)。
長江口海域是我國重要的河口水域、傳統漁場和水產品養殖基地, 也是我國重要的藻華高發區(Wang et al, 2009)。重要的地理位置和獨特的環境特征使之成為各學科領域的理想研究區域(全為民等, 2005)。其中關于長江口浮游植物的研究, 已有諸多報道。尤其是近二十年來, 該海域藻華頻發, 浮游植物研究持續備受關注。
另外, 隨著人類活動和全球氣候變化對海洋環境的影響日益顯著, 環境變化下的生物響應逐漸成為研究熱點。我國學者在膠州灣、臺灣海峽等海域開展了相關研究, 并在部分海域總結性提出“營養鹽結構改變”、“硅酸鹽含量降低”、“甲藻優勢度上升”等觀點(林更銘等, 2011; 孫曉霞等, 2011)。長江口海域作為我國沿海的典型代表, 歷史研究較為豐富, 但是類似的歸納總結還相對有限(Jiang et al,2014; 賈海波等, 2014), 直接的數據化證據相對較少, 未能從浮游植物群落結構的角度給出全面的響應解析。
基于上述原因, 本文于2014年5月在長江口海域采集浮游植物水樣, 分析了浮游植物總量, 以及硅藻和甲藻群落的種類組成、細胞豐度、優勢種類組成等。還收集整理了該海域 1986—2014年間的歷史數據, 分析了硅藻、甲藻主要群落特征的年際變化, 以及硅藻優勢種類細胞粒徑的變化趨勢, 以期能夠發現規律性現象, 明晰浮游植物對海域環境變化的響應途徑, 也為深刻理解海洋環境變化對浮游植物的影響提供數據支撐。
1 材料與方法
在 長 江 口 海 域 (27°93′N—32°5′N, 122°27′E—125°52′E)設置了 45個代表性站位(圖 1), 于 2014 年 5月搭載“科學1號”科考船進行浮游植物水樣的采集。每個站位分別采1m、10m、20m、50m水樣各2.5L, 現場加 Lugol’s試劑進行固定。帶回實驗室后, 轉移樣品到量筒中, 靜置沉淀24h以上, 然后用虹吸管輕輕吸掉上清液。如此操作 2次, 最終將樣品濃縮至 10—15mL。從中取 0.1mL樣品, 用浮游植物計數框在光學顯微鏡(Leica DM1000, Leica Microsystems, 中國)下進行浮游植物的種類鑒定和定量計數。
浮游植物種類鑒定主要參考《中國海洋浮游硅藻類》(金德祥等, 1965)、《中國海洋底棲硅藻類》(上、下卷)(金德祥等, 1982, 1991)、《中國海藻志》(第五卷硅藻門第一冊中心綱)(郭玉潔等, 2003)、《南海甲藻(一)》(林永水等, 1993)、《中國海域甲藻 I》(楊世民等, 2014)、《Identifying Marine Phytoplankton》(Tomas,1997)。
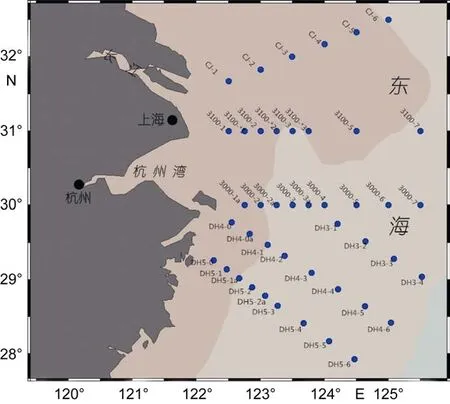
圖1 長江口海域采樣站位圖Fig.1 Sampling stations in Changjiang River estuary
利用 Excel 2013軟件的統計功能對歷史數據進行分析, 并制作柱狀圖、散點圖, 以及相關趨勢性分析。運用Surfer 8.0作優勢種水平分布圖。
2 結果與分析
2.1 2014年春季長江口海域浮游植物群落結構
2.1.1 浮游植物的種類組成 在2014年長江口春季樣品中, 共鑒定浮游植物105種, 其中浮游硅藻30屬56種, 浮游甲藻19屬41種, 以及隸屬于金藻門、藍藻門等的 8個種類。其中硅藻以根管藻屬(Rhizosolenia)的種類最多, 鑒定到 8個種類, 占春季硅藻總種類數的 14.2%。其次是角毛藻屬(Chaetoceros), 有 5個種類。甲藻以原甲藻屬(Prorocentrum)的種類最多, 鑒定到7個種類。浮游硅藻的生態類型以半咸水為主, 中肋骨條藻(Skeletonema costatum)是典型代表; 浮游甲藻的生態類型以沿岸廣布種為主, 東海原甲藻(P. donghaiense)是第一優勢種。
2.1.2 浮游硅藻的優勢種類組成及其水平分布
中肋骨條藻是浮游硅藻的第一優勢種, 優勢度達0.38。中肋骨條藻的出現頻率不高, 主要出現在部分站位的表層水體, 但是其細胞豐度普遍較高, 占浮游植物總細胞豐度的 85.6%。擬菱形藻(Pseudo-nitzschiaspp.)是第二優勢種, 優勢度為0.04。擬菱形藻的出現頻率較高, 在大部分站位均有檢出,但細胞豐度不高, 主要分布在表層和10m水層。長江口春季浮游硅藻優勢種組成詳見表1。
在表層水體中, 中肋骨條藻是第一優勢種, 細胞豐度最高達 1863.8×103cell/L, 平均豐度值為18.42×103cell/L, 主要集中在近岸海域, 124°E以東站位幾近沒有。水平分布圖(圖2a)顯示, 細胞豐度高值區位于長江入海口, 與以往報道的高值區較為接近(高亞輝等, 2003; 謝文玲, 2006)。擬菱形藻是第二優勢種(圖 2b), 細胞豐度最高值為 41.54×103cell/L, 位于舟山定海附近, 而在長江入海口的分布較少。

表1 長江口春季浮游硅藻優勢種組成Tab. 1 List of dominant diatom species in Changjiang River estuary
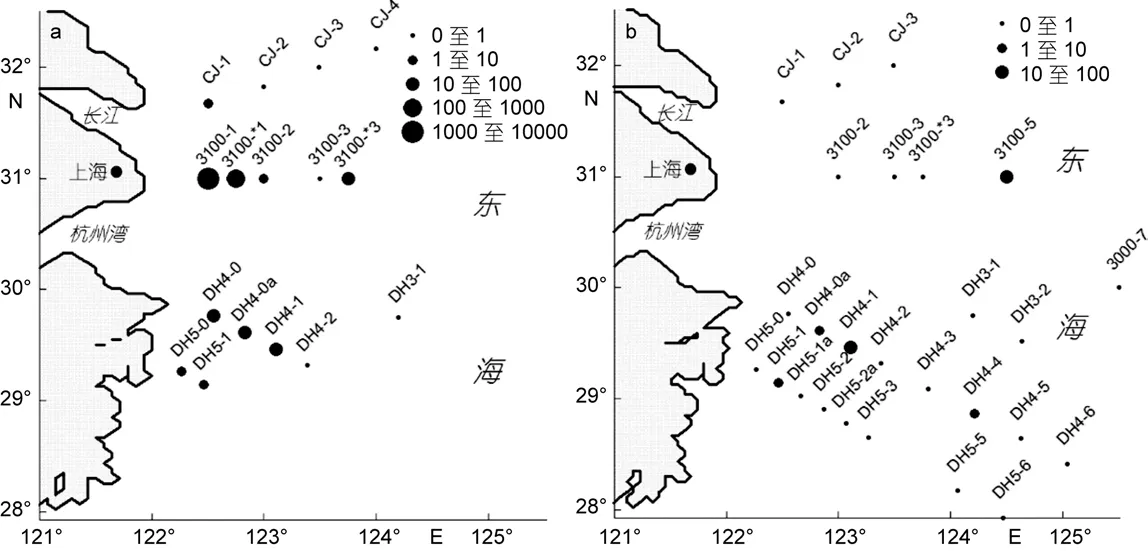
圖2 表層水體中浮游硅藻優勢種的水平分布圖Fig.2 Horizontal distribution of dominant diatom species at water surface
2.2 長江口海域浮游植物年際變化
2.2.1 相關歷史資料 由于長江口重要的地理位置和特殊的環境特征, 關于該海域浮游植物的歷史研究較為豐富, 尤其是近二十多年的數據相對連續。但是由于年份跨度大, 以往研究在采樣和處理方法、觀察和鑒定技術、統計學手段上均存在差異; 另外隨著科學水平的進步, 對藻類分類學和系統學的認知也發生了改變, 造成不同年份的調查數據在可比性上多有偏差, 以上因素正是中長尺度年際變化規律不易建立的原因所在。本文集中整理了長江口海域在1986—2014年之間的歷史文獻資料(表 2), 選取其中的春季數據, 進行浮游植物的年際變化分析。需要說明的是, 由于采樣方法的不同(網樣和水樣)、觀察技術的差異(光學顯微鏡的精密度不同), 以及計數統計手段的變化(濃縮樣抽樣計數法或 Uterm?hl計數法等), 導致浮游植物細胞豐度數據的跳躍度較大, 缺乏可比性。此外, 因部分資料數據不完整, 本文將不就細胞豐度的年際變化展開討論, 而將分析重點放在浮游植物種類數、硅藻和甲藻種類數貢獻率、浮游硅藻優勢種細胞粒徑等三個方面。
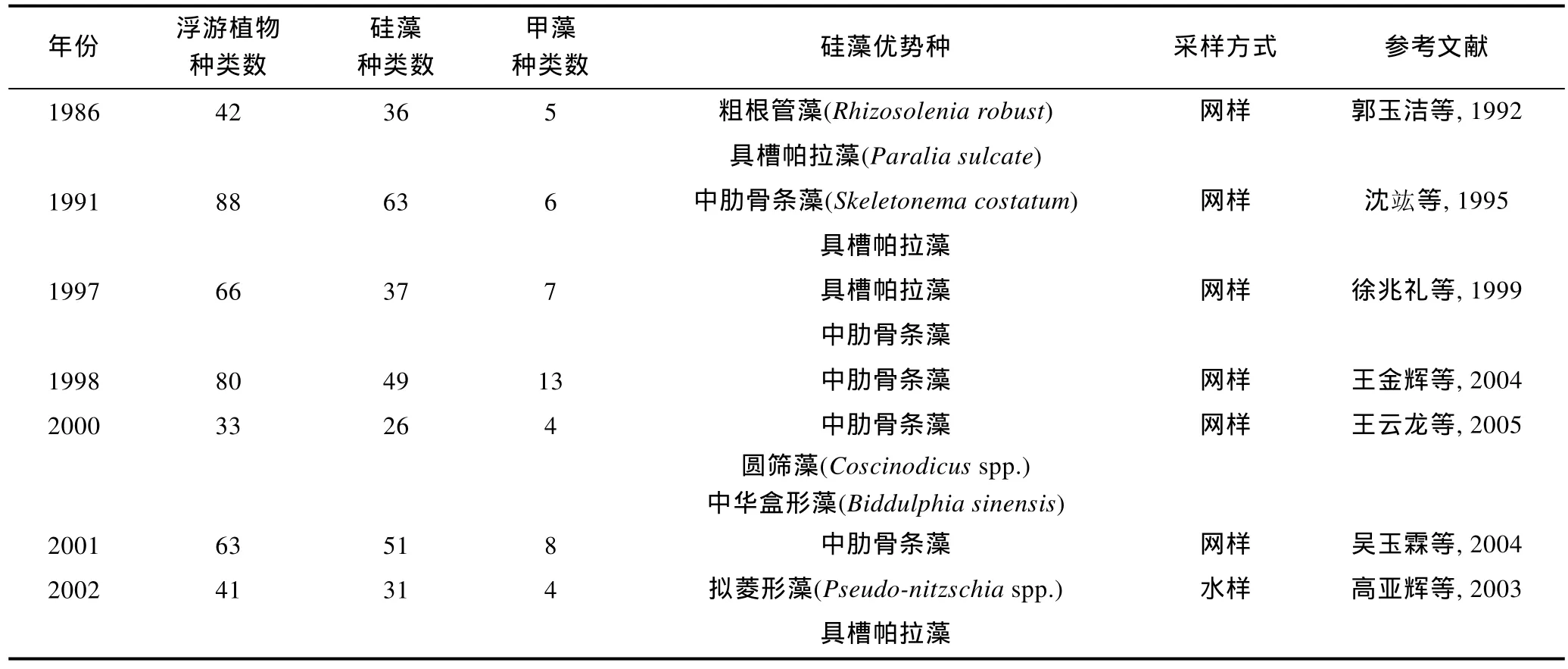
表2 長江口春季浮游植物的歷史數據Tab. 2 Historical data of phytoplankton assemblage in Changjiang River estuary in spring during 1986—2014
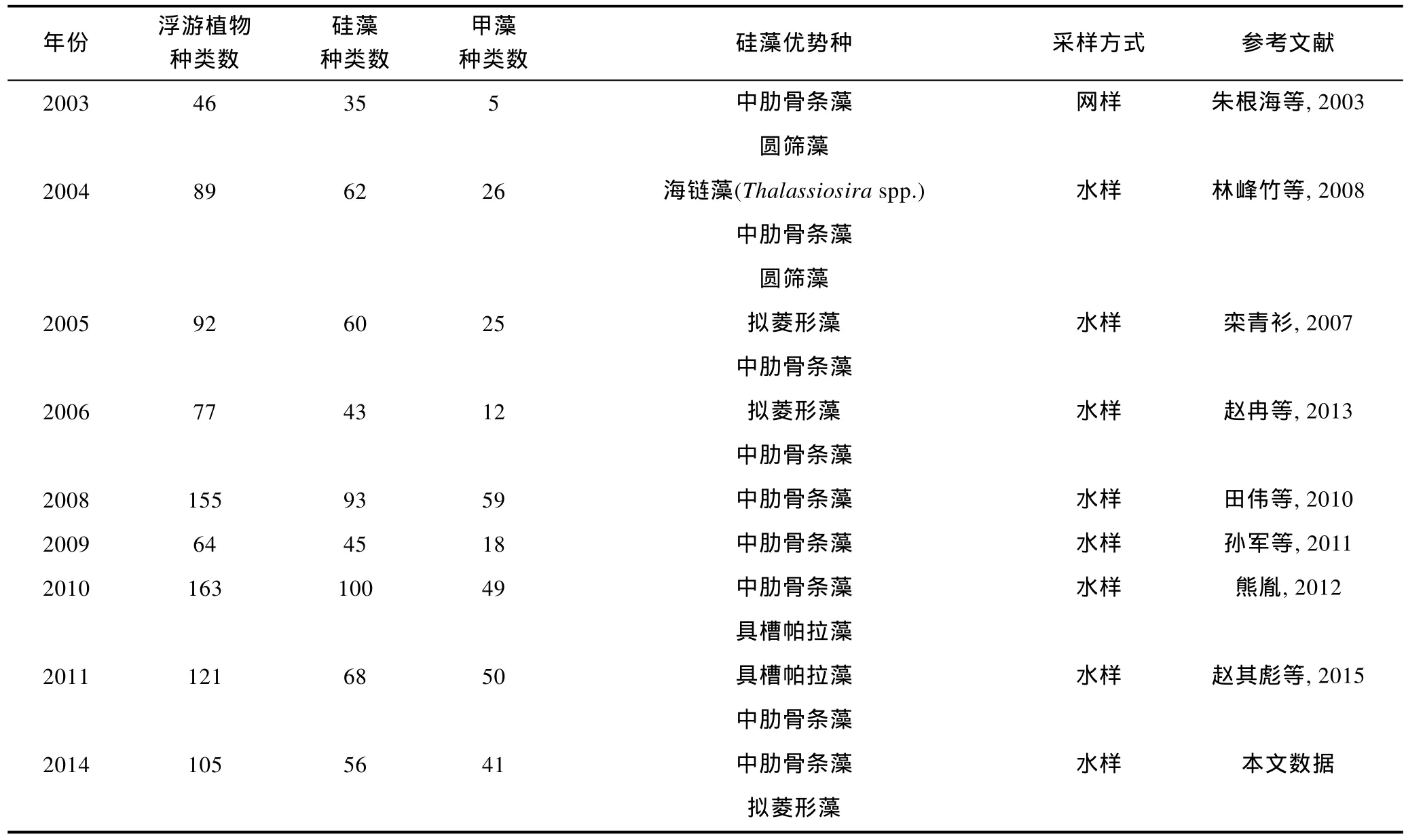
續表
2.2.2 浮游植物種類數的年際變化 按照采樣方法的差異, 本文歸類整理了春季浮游植物的網樣數據和水樣數據, 分別比較了其種類數的年際變化。
網樣數據中(圖 3a), 浮游植物種類數最高為 88種(1991年), 最低為33種(2000年); 浮游硅藻種類數呈現相同的變化規律, 最高有63種(1991年), 最低為26種(2000年); 浮游甲藻種類數最高為 13種(1998年), 最低僅有4種(2000年)。水樣數據中(圖 3b), 浮游植物最高種類數達到 163種(2010年), 其次是 155種(2008年), 最低為41種(2002年); 浮游硅藻種類數的年際變化基本相似, 最高有100種(2010年), 其次為93種(2008年), 最低為31種(2002年); 浮游甲藻種類數最高為59種(2008年), 其次為50種(2011年), 最低僅有 4種(2002年)。綜上結果可以看出, 浮游硅藻的種類數均高于浮游甲藻, 但是浮游植物、浮游硅藻、浮游甲藻的種類數的年際變化趨勢均不明顯。水樣數據(圖3b)顯示浮游植物、浮游甲藻的種類數均呈現不同程度的上升趨勢, 其中浮游甲藻的上升趨勢更為明顯。
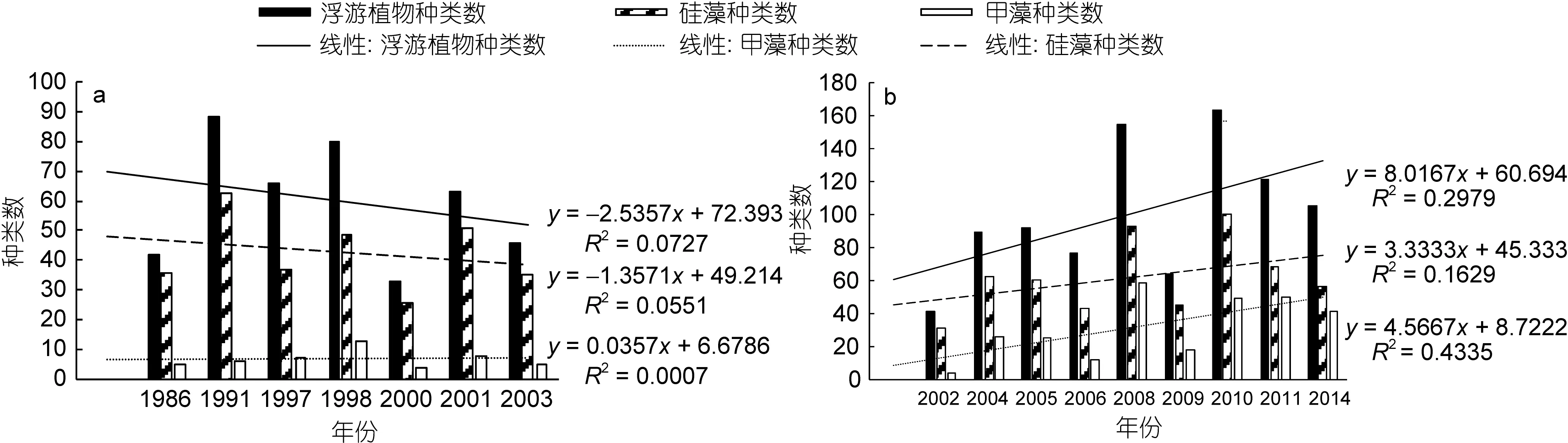
圖3 長江口春季浮游植物種類數的年際變化Fig.3 Changes in species number for phytoplankton in Changjiang River estuary in spring during 1986—2003
2.2.3 硅藻、甲藻種類數占有比例的年際變化 從圖3可知, 雖然采樣方法不同, 但浮游硅藻和浮游甲藻依然是長江口春季浮游植物的重要組成, 其中浮游硅藻穩居浮游植物第一大類群。但是若以種類數占有比例作為分析依據(圖4), 則呈現出另一個有價值的趨勢。
在網樣數據中(圖4a), 1986年春季浮游植物的種類數為42, 其中硅藻為36種, 所占比例達到 85.7%;甲藻僅為5種, 所占比例為11.9%。2003年春季浮游硅藻種類數的占有比例為 76.1%, 甲藻為 10.9%。圖4a顯示在 1986—2003年間, 浮游硅藻、浮游甲藻在浮游植物中比例較穩定, 變化趨勢不明顯。但在水樣數據中(圖4b), 2002年春季浮游植物的種類數為41,其中硅藻為31種, 所占比例達到75.6%; 甲藻僅為4種, 所占比例為 9.8%。2008年春季浮游硅藻種類數的占有比例下降為60%, 甲藻則上升為38.1%。再到2011年春季, 硅藻種類數的占有比例進一步下降到56.2%, 甲藻則上升到41.3%。雖然浮游硅藻種類數的占有比例在 56%—75.6%之間波動, 始終處于最大貢獻類群, 但整體而言呈下降趨勢。而浮游甲藻種類數的占有比例則呈現大幅上升的趨勢, 且趨勢明顯。這說明硅藻和甲藻在浮游植物中的重要性發生了變化,浮游硅藻的重要性逐漸下降, 而浮游甲藻的重要性正在快速上升。
考慮到種類數占有比例是樣品數據的自身對比,其受采樣方法的影響相對有限, 故本文綜合了網樣和水樣數據(圖4c), 亦呈現與水樣數據相一致的變化趨勢, 即“浮游硅藻的重要性逐漸下降, 而浮游甲藻的重要性顯著上升”。
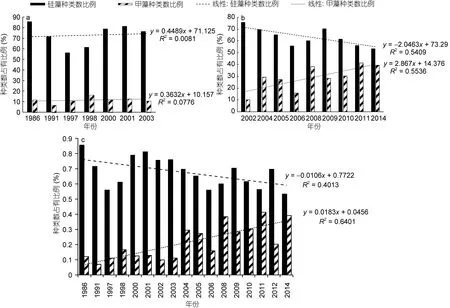
圖4 長江口春季硅藻和甲藻種類數占有比例的年際變化Fig.4 Continuous variations in species number proportion for diatoms and dinoflagellates in total phytoplankton in Changjiang River estuary in spring during 1986—2014
以甲藻和硅藻之間的種類數比值為分析依據,亦可得出同樣的結論。網樣數據(圖5a)中, 該比值呈現逐漸上升的趨勢, 而在水樣數據(圖 5b)中, 該比值的上升趨勢更為顯著。
2.2.4 浮游硅藻優勢種類細胞粒徑的年際變化
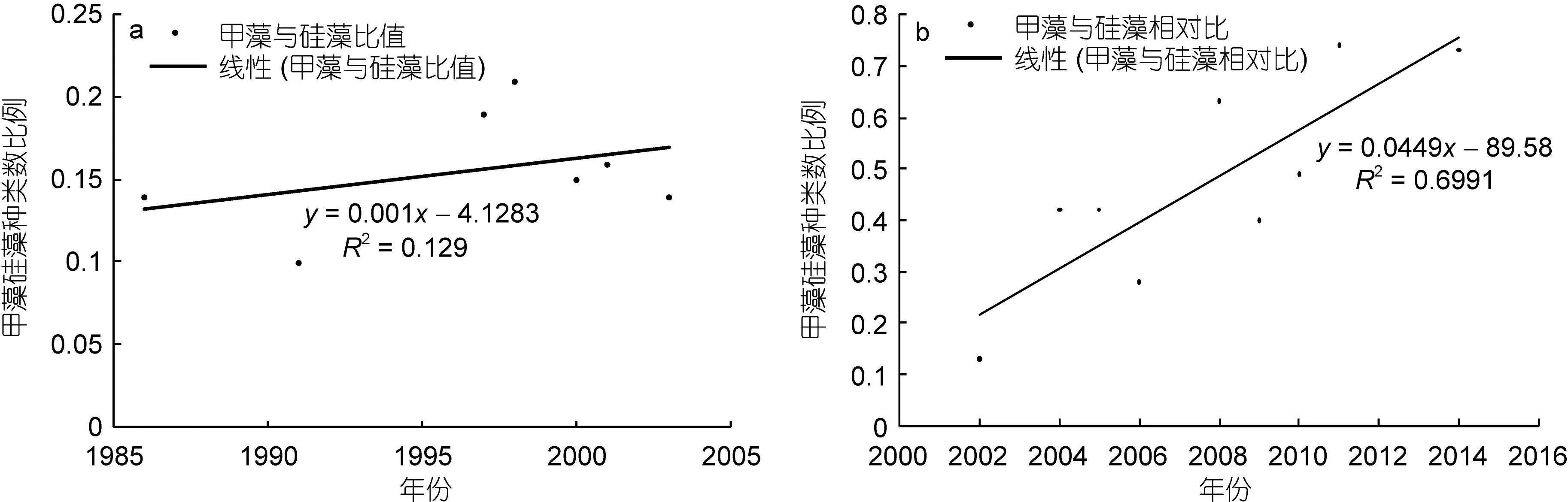
圖5 甲藻與硅藻種類數比值的年際變化Fig.5 Changes of the ratio of dinoflagellate species number to diatom species number in Changjiang River estuary in spring during 1986—2014
本文以優勢度大于 0.01作為選取浮游硅藻優勢種類的標準, 建立了長江口春季浮游硅藻優勢種類的年際數據(表 2)。由表 2可知, 中肋骨條藻是該水域最為常見的優勢種, 在多個調查年份均有報道, 該種較為集中地分布在長江入海口。中肋骨條藻常以鏈狀群體存在, 是近岸半咸水種的典型代表。其次, 擬菱形藻、具槽帕拉藻(Paralia sulcate)也是常見的優勢種, 它們也常以鏈狀群體生活。此外, 圓篩藻(Coscinodiscusspp.)、海鏈藻(Thalassiosiraspp.)、盒形藻(Biddulphiaspp.)等種類也偶有報道。
結合歷史資料中對浮游硅藻優勢種類的個體參數記錄, 統計上述優勢硅藻種類的平均細胞直徑。需要說明的是, 由于 2000年之前的文獻較少有細胞個體大小的記載, 而2000年之后的相關記錄較為全面,因此本文僅對 2000—2014年間的硅藻優勢種類進行了細胞粒徑的統計分析。假設藻細胞均為球形(Sheldonet al, 1972), 制作硅藻優勢種類細胞直徑的年際變化圖, 并進行線性擬合(圖 6)。圖 6顯示浮游硅藻優勢種類的細胞粒徑呈現逐漸下降的趨勢, 說明長江口優勢硅藻的細胞個體越來越小, 其平均直徑由 96μm(2000 年)降到 6μm(2014 年)。2000 年、2002—2004年間長江口硅藻優勢種類中還有細胞個體較大的盒形藻和圓篩藻, 而在之后的調查中, 再未有此類細胞個體較大的硅藻種類進入優勢種行列, 而細胞個體較小的中肋骨條藻、擬菱形藻、具槽帕拉藻則更多地占據優勢地位。
3 討論
3.1 浮游硅藻和浮游甲藻種類數的年際變化
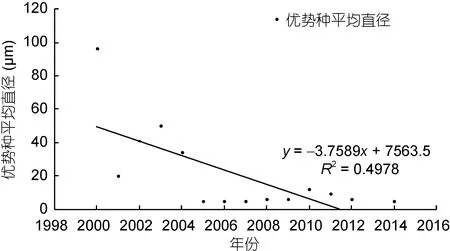
圖6 長江口春季硅藻優勢種類細胞粒徑的年際變化Fig.6 Interdecadal variation in average cell diameter for diatom dominant species in Changjiang River estuary in spring during 1998—2016
曾有學者分析了1990—2002年間長江口海域浮游植物的年際變化(王金輝等, 2004), 認為浮游植物種類數呈現逐漸降低的趨勢, 其中硅藻種類數占有比例下降, 而甲藻的種類數占有比例逐年上升。本文研究結論部分贊同上述觀點。還有學者研究了在過去50年中長江口海域浮游植物的演替(Jianget al, 2014),認為浮游植物種類數, 以及硅藻和甲藻的種類數均呈現上升的趨勢, 但由于甲藻的上升幅度更為顯著,從而導致甲藻種類數占有比例逐漸上升, 這與本文的研究結論較為一致。需要注意的是, 若僅僅考慮1986—2003年間的網樣數據(圖3a), 浮游植物種類數確實呈現出緩慢下降的趨勢。若針對水樣數據進行相關分析(圖3b), 浮游植物、浮游硅藻和浮游甲藻均呈現上升的趨勢, 其中浮游甲藻的上升趨勢更為明顯。本文統計的年際范圍更為廣泛, 涵蓋1986—2014年,或許更能反映真實情況。另一方面, 無論網樣數據還是水樣數據, 甲藻與硅藻之間的種類數比值均呈現上升趨勢, 只是水樣數據的上升趨勢尤為顯著, 這也從另一個角度支持了上述觀點, 即浮游硅藻的重要性逐漸下降, 而浮游甲藻的重要性日益顯著。與此同時, 研究手段和分析方法的進步, 以及對甲藻關注度的增加, 在一定程度上也促進更多的甲藻種類被發現。
雖然浮游硅藻和浮游甲藻的種類數都呈現上升趨勢, 但是甲藻的上升幅度更為顯著, 從而導致其占有比例逐年上升, 這可能與長江口海域環境的變化密不可分。有學者總結了長江口近半個多世紀以來的徑流量和泥沙含量變化(辛明, 2014), 發現長江口徑流量變化不大, 基本在 8.92×1011m3這一平均值上下波動, 但長江沖淡水所攜帶的泥沙含量逐漸降低, 由1.354×108t(2003 年)下降至 0.718×108t(2008 年)。入海輸沙量的減少, 使得長江口海水透明度增加, 有利于浮游植物進行光合作用, 可促進浮游植物種類數和細胞豐度的增加。另外, 入海輸沙量的減少, 降低了溶解態硅向海洋的輸送通量, 造成長江口海域硅酸鹽絕對含量和相對含量的降低, 逐漸形成了不利于硅藻種類競爭的生態環境。
長江口海域營養鹽的變化趨勢也驗證了上述情況(林峰竹等, 2008; Jiang et al, 2014; 辛明, 2014)。長江口海域無機氮和磷酸鹽入海通量有所增加, 而硅酸鹽入海通量卻有所降低。其中無機氮的濃度由22.9μmol/L(1963年)上升到122.9μmol/L(2007年), 累積增加了 436.7%; 磷酸鹽的濃度則由 0.12μmol/L(1963年)升高到 1.58μmol/L(2007年), 累計增加了1217%。無機氮和磷酸鹽的增加使長江口海域水體富營養化程度加重, 更有利于浮游植物的生長。而硅酸鹽則由 303.7μmol/L(1963 年)下降到 94.4μmol/L(2007年), 累積下降約 70.0%, 硅酸鹽的降低, 限制了硅藻群落的發展。
綜上所述, 長江入海輸沙量的減少, 加強了浮游植物的光合作用, 可促進其種類數和細胞豐度的增加。但是與此同時, 該海域無機氮和磷酸鹽呈現增加趨勢, 硅酸鹽含量卻大幅降低, 限制了硅藻群落的發展, 使得浮游硅藻在浮游植物中的占有比例越來越低, 而浮游甲藻的占有比例和重要性大幅增加。
3.2 浮游硅藻優勢種類的變化特征
在以往報道的長江口浮游硅藻優勢種類組成中,鏈狀群體種類占據較大的比重, 如中肋骨條藻、擬菱形藻、具槽帕拉藻、海鏈藻等, 說明鏈狀群體硅藻種類在該海域具有更好的環境適應性, 在營養鹽、光照等環境資源競爭中更易占據優勢, 較易成為優勢種(何青等, 2009; Jiang et al, 2014; Valiela, 2015)。首先,群體細胞可以使細胞較長時間抵御下沉, 更好地停留在真光層進行光合作用。其次, 在對營養鹽的攝取中, 群體細胞在下沉過程中較單細胞有更大的細胞營養鹽通量(Karp-Boss et al, 1996); 另外, 群體細胞能夠減少浮游動物的攝食(Fryxell et al, 2004)。因此,相較于單細胞種類, 群體細胞種類對環境的適應力更強。
硅藻優勢種類的細胞粒徑小型化也是一種適應環境的表現, 因為小個體種類具有更高的細胞表面積與體積比值, 更有利于對營養鹽的吸收。環境因素對細胞粒徑也有顯著影響。有學者在室內半連續培養條件下, 分析了不同 Si∶P供應比例對藻細胞粒徑的影響, 結果顯示兩者之間具有顯著關系(Grover, 1989), 研究表明在高Si∶P條件下, 藻細胞有更大的細胞粒徑, 而在低Si∶P條件下, 小個體的藻細胞更具有生存優勢。同樣, 在高營養鹽條件下,硅酸鹽的增加可以促進硅藻大個體細胞的生長, 而在低硅酸鹽濃度條件下, 無機氮和磷酸鹽的增加可以促進硅藻小個體細胞的生長。在對長江口營養鹽的長期研究中, 辛明(2014)發現長江口海域硅酸鹽含量呈現逐漸降低的趨勢, 而無機氮和磷酸鹽含量則逐年上升。大個體硅藻種類對硅酸鹽的需求更高,對硅酸鹽的依賴性也更強, 因此, 在硅酸鹽含量降低的情況下, 小個體硅藻種類更易占據競爭優勢。Grover(1989)的室內營養生理研究工作正好可為長江口海域浮游硅藻優勢種類小型化的趨勢提供合理的理論解釋。
4 結語
(1) 2014年春季長江口海域共鑒定浮游植物105種, 其中浮游硅藻30屬56種, 浮游甲藻19屬41種。浮游硅藻以半咸水種為主, 中肋骨條藻是第一優勢種。浮游甲藻以沿岸廣布種為主, 東海原甲藻是典型代表。
(2) 在過去30年中, 浮游植物、浮游硅藻、浮游甲藻的種類多樣性均呈現不同程度的上升趨勢, 其中甲藻的上升趨勢最為明顯。甲藻種類數在浮游植物種類數中的占有比例呈上升趨勢, 而硅藻所占比例呈下降趨勢。
(3) 浮游硅藻優勢種類的細胞粒徑呈現小型化趨勢。這與長江口海域硅酸鹽含量減少、無機氮和磷酸鹽增加、入海輸沙量減少等因素密切相關。
致謝 感謝暨南大學赤潮與海洋生物學研究中心的呂頌輝教授和高健同學提供2014年春季浮游甲藻的相關數據。
王云龍, 袁 騏, 沈新強, 2005. 長江口及鄰近水域春季浮游植物的生態特征. 中國水產科學, 12(3): 300—306
王金輝, 黃秀清, 劉阿成等, 2004. 長江口及鄰近水域的生物多樣性變化趨勢分析. 海洋通報, 23(1): 32—39
田 偉, 孫 軍, 樊孝鵬等, 2010. 2008年春季東海近海浮游植物群落. 海洋科學進展, 28(2): 170—178
朱根海, 許衛憶, 朱德第等, 2003. 長江口赤潮高發區浮游植物與水動力環境因子的分布特征. 應用生態學報, 14(7):1135—1139
全為民, 沈新強, 韓金娣等, 2005. 長江口及鄰近水域富營養化現狀及變化趨勢的評價與分析. 海洋環境科學, 24(3):13—16
孫 軍, 田 偉, 2011. 2009年春季長江口及其鄰近水域浮游植物—物種組成與粒級葉綠素 a. 應用生態學報, 22(1):235—242
孫曉霞, 孫 松, 吳玉霖等, 2011. 膠州灣網采浮游植物群落結構的長期變化. 海洋與湖沼, 42(5): 639—646
楊世民, 李瑞香, 董樹剛, 2014. 中國海域甲藻 I(原甲藻目、鰭藻目). 北京: 海洋出版社, 1—156
吳玉霖, 傅月娜, 張永山等, 2004. 長江口海域浮游植物分布及其與徑流的關系. 海洋與湖沼, 35(3): 246—251
何 青, 孫 軍, 2009. 長江口及其鄰近水域網采浮游植物群落. 生態學報, 29(7): 3928—3938
辛 明, 2014. 長江口海域關鍵環境因子的長期變化及其生態效應. 青島: 中國海洋大學博士學位論文, 44—102
沈 竑, 徐 韌, 王桂蘭, 1995. 上海市海島周圍水域浮游植物的調查研究. 海洋通報, 14(4): 26—37
林永水, 周近明, 1993. 南海甲藻(一). 北京: 科學出版社,1—115
林更銘, 楊清良, 2011. 全球氣候變化背景下臺灣海峽浮游植物的長期變化. 應用與環境生物學報, 17(5): 615—623
林峰竹, 吳玉霖, 于海成等, 2008. 2004年長江口浮游植物群落結構特征分析. 海洋與湖沼, 39(4): 401—410
金德祥, 陳金環, 黃凱歌, 1965. 中國海洋浮游硅藻類. 上海:上海科學技術出版社, 1—230
金德祥, 程兆第, 劉師成等, 1991. 中國海洋底棲硅藻類(下卷). 北京: 海洋出版社, 1—437
金德祥, 程兆第, 林均民等, 1982. 中國海洋底棲硅藻類(上卷). 北京: 海洋出版社, 1—323
趙 冉, 孫 軍, 宋書群, 2013. 2006年春季長江口及其鄰近水域浮游植物. 海洋通報, 32(4): 421—428
趙其彪, 孫 軍, 李 丹等, 2015. 東海低氧區及鄰近水域浮游植物的季節變化. 生態學報, 35(7): 2366—2379
賈海波, 邵君波, 胡顥琰等, 2014. 三峽水庫蓄水前后長江口及其鄰近海域浮游植物群落結構的變化及原因分析. 海洋通報, 33(3): 305—314
徐兆禮, 白雪梅, 袁 騏等, 1999. 長江口浮游植物生態研究.中國水產科學, 6(5): 52—54
欒青衫, 2007. 長江口及其鄰接水域浮游植物群集生態學研究.青島: 中國海洋大學碩士學位論文, 13—19
高亞輝, 梁君榮, 陳長平等, 2011. 海洋硅藻多樣性與生態作用研究. 廈門大學學報(自然科學版), 50(2): 455—464
高亞輝, 虞秋波, 齊雨藻等, 2003. 長江口附近海域春季浮游硅藻的種類組成和生態分布. 應用生態學報, 14(7):1044—1048
郭玉潔, 楊則禹, 1992. 長江口區浮游植物的數量變動及生態分析. 海洋科學集刊, 33: 167—189
郭玉潔, 錢樹本, 2003. 中國海藻志 第 5卷 硅藻門 第 1冊中心綱. 北京: 科學出版社, 1—493
謝文玲, 2006. 東海典型海域浮游硅藻群落結構與動態研究.廈門: 廈門大學博士學位論文, 22—61
熊 胤, 2012. 長江口及鄰近海域浮游植物群落結構研究. 廣州: 華南師范大學碩士學位論文, 15—38
Armbrust E V, 2009. The life of diatoms in the world’s oceans.Nature, 459(7244): 185—192
Fryxell G A, Hasle G R, 2004. Taxonomy of harmful diatoms. In:Hallegraeff G M, Anderson D M, Cembella A D eds. Manual on Harmful Marine Microalgae. Paris, France: United Nations Educational, Scientific and Cultural Organization,465—510
Grover J P, 1989. Effects of Si: P supply ratio, supply variability,and selective grazing in the plankton: an experiment with a natural algal and protistan assemblage. Limnology and Oceanography, 34(2): 349—367
Jiang Z B, Liu J J, Chen J F et al, 2014. Responses of summer phytoplankton community to drastic environmental changes in the Changjiang (Yangtze River) estuary during the past 50 years. Water Research, 54: 1—11
Karp-Boss L, Boss E, Jumars P A, 1996. Nutrient fluxes to planktonic osmotrophs in the presence of fluid motion.Oceanography and Marine Biology, 34: 71—107
Sheldon R, Prakash A, Sutcliff W, 1972. The size distribution of particles in the ocean. Limnology and Oceanology, 17(3):327—340.
Tomas C R, 1997. Identifying Marine Phytoplankton. San Diego,Chile: Academic Press, 1—858
Valiela I, 2015. Marine Ecological Processes. 3rd ed. New York,U.S.A.: Springer-Verlag, 364—440
Wang J H, Wu J Y, 2009. Occurrence and potential risks of harmful algal blooms in the East China Sea. Science of the Total Environment, 407(13): 4012—4021

