鼠尾藻(Sargassum thunbergii)對鄰苯二甲酸二甲酯(DMP)脅迫的響應*
呂 芳 丁 剛 王翔宇 房 慧 吳海一①
(1. 山東省海洋生物研究院 青島 266104; 2. 青島市大型海藻工程技術研究中心 青島 266104;3. 山東省海水健康養殖工程技術研究中心 青島 266104)
有機物是近海環境的主要污染物之一, 這類污染物難以降解、易于積蓄, 對海洋生物造成毒害, 使一些海洋水產資源受到嚴重影響(顏天等, 2000; Chen et al, 2005)。藻類作為海洋環境中的初級生產者, 是生態系統中物質循環和能量流動的重要基礎, 其生長和代謝會直接受到有機污染物的影響, 進而影響到初級消費者和次級消費者的生命活動。因此, 研究藻類對有機污染物的響應, 有助于揭示有機污染物對整個生態系統造成的威脅, 為解決海洋環境的污染問題提供科學依據。
鄰苯二甲酸酯類(phthalate esters, PAEs)是海洋中主要的有機污染物之一, 對人和動物具有致癌、致畸、致突變和干擾內分泌等毒性(Kasahara et al, 2002),對水生生物(如浮游動物、魚類、藻類)的生長和繁殖產生影響(Rhodes et al, 1995; 況琪軍, 2003; Chen et al, 2005; 余江等, 2007), 且能在生物體內富集和放大(遲杰等, 2005; 聶湘平等, 2008), 其中鄰苯二甲酸二甲酯(dimethy1 phthalate, DMP)、鄰苯二甲酸二丁酯(dibutyl phthalate, DBP)和鄰苯二甲酸二異辛酯[Di(2-ethylhexyl) phthalate, DEHP]被我國列為環境優先控制污染物(陳濟安, 2007)。因此PAEs對海洋環境的污染日益引起學者的重視。
國內外在有機污染物對大型海藻生理生化特征的影響方面已有一些報道, 主要集中在色素、蛋白及抗氧化防疫指標的測定方面(李欽等, 2004; 吳志輝等,2006; Yu et al, 2007)。對于大型海藻, 光合生理特征的變化是衡量其生長狀況的一個首要指標, 但目前關于有機污染物對大型海藻光合生理特征以及關鍵基因表達變化的研究還較少。
鼠尾藻(Sargassum thunbergii)是我國沿海常見的經濟海藻, 其藻體長、生長快、適應環境能力強, 可用于提取褐藻膠、甘露醇、碘等工業原料以及褐藻多酚、多糖等活性物質, 而且是海洋生態環境修復的理想生物材料(詹冬梅等, 2006; 吳海一等, 2010), 具有廣泛的應用前景。本試驗以鼠尾藻為研究對象, 選取海洋環境中常見的有機污染物 DMP為代表, 研究鼠尾藻對 DMP的響應, 以期為保護海洋經濟藻類的養殖環境提供評價指標和管理依據。
1 材料與方法
1.1 實驗材料
鼠尾藻采自青島市太平灣潮間帶(36°05′N,120°35′E)。采集的藻體用低溫采集箱運回實驗室, 海水反復清洗去除泥沙及雜質后, 置于溫度 15°C, 光照1000lx的恒溫光照培養箱中充氣培養, 5天后用于實驗。選取生長健壯、形態較一致、長度在 4—5cm的個體用于實驗。
1.2 實驗方法
實驗培養基質是加DMP的過濾海水, DMP濃度設為 0.1mg/L(低)、0.3mg/L(中)、1.0mg/L(高)三個梯度, 以天然海水加等量的丙酮作為對照組。
實驗在容積為3000mL的三角瓶中進行, 每個三角瓶裝2000mL培養液。每個實驗處理組設置3個重復, 每個重復放置15株藻體。實驗在溫度15°C、光周期12h∶12h、光照強度3000lx的恒溫光照培養箱內充氣進行, 每天更換培養液。于實驗開始后的第3、5、10、15天取樣測定鼠尾藻的比生長速率、葉綠素a含量、光合放氧速率和呼吸速率、rbcL基因的表達量等指標。
1.3 比生長速率的測定
比生長速率(relative growth rate, RGR)的計算公式如下:
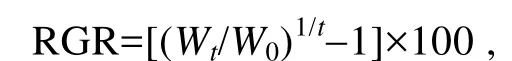
式中Wt為實驗中期或結束時藻體鮮重(g),W0為實驗開始時藻體鮮重(g),t為培養時間(d)。
1.4 葉綠素a含量的測定
參照 Jeffrey等(1975)與王麗梅(2011)的方法測定。將藻體在液氮中研磨成勻漿狀, 加入8mL80%丙酮于4°C黑暗處抽提12h。4000r/min, 4°C離心15min,棄沉淀, 上清用80%丙酮定容至10mL。以80%丙酮作為空白對照, 通過分光光度計測定 639、647和664nm處的光密度值。重復3次以上, 計算平均值。葉綠素a的濃度(Cchla)按照公式Cchla=11.85×OD664-1.54×OD647-0.08×OD639計算, 單位為 mg/L。最后根據稀釋倍數計算每克鮮重藻體中的色素含量,單位為mg/g。
1.5 光合放氧速率和呼吸速率的測定
采用氧電極(Chlorolab-3, Hansatech, 英國)測定藻體的光合放氧速率和呼吸速率。測定反應杯的環境溫度為 20°C。光照強度選擇預實驗測定的飽和光強300μmol/m2·s, 光合速率表示為每單位鮮重藻體的放氧速率(nmolO2/min·gFW), 呼吸速率表示為每單位鮮重藻體的耗氧速率(nmolO2/min·gFW), 以凈光合放氧速率與呼吸耗氧速率之比獲得P/R的值。
1.6 rbcL基因mRNA相對表達量的測定
以 E.Z.N.A.TMPlant RNA Kit(Omega Biotek)提取待測藻體的總RNA, 以High Capacity cDNA Reverse Transcription Kit參照說明書反轉錄合成cDNA第一鏈。以18S rRNA作為內參基因, 設計特異性擴增引物(表1), PCR反應在CFX96實時熒光定量PCR檢測系統(Bio Rad, USA)中進行, 所有反應均設置3個重復, 反應條件如下: 95°C預變性10min; 95°C處理10s,58°C處理30s, 40個循環; 應用CFX96 Manager軟件分析實驗數據。以自然海水中生長的藻體作為參照,用ΔΔCT法(Livaket al, 2001)計算待測組藻體rbcL基因的相對表達量。
1.7 數據分析
所得數值以平均值±標準誤差表示。顯著性差異用單因素方差分析, 分析軟件為 SPSS 13.0, 當P<0.05時為顯著性差異。
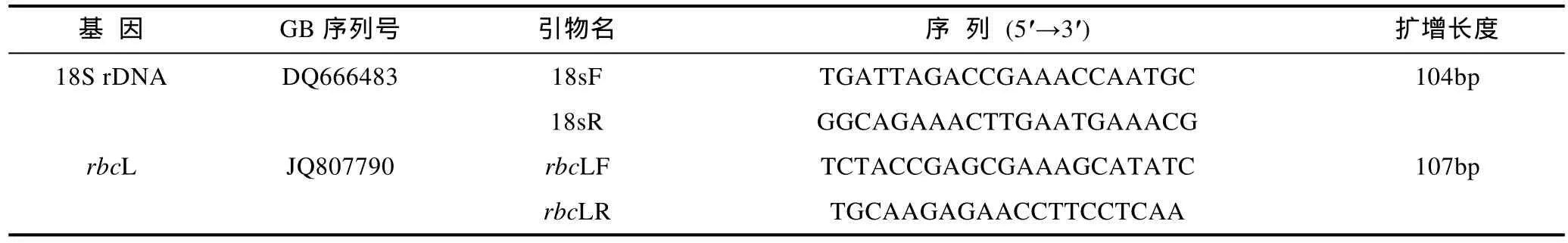
表1 熒光定量PCR的引物Tab. 1 The primers for real-time quantitative PCR
2 結果與分析
2.1 比生長速率
如圖 1所示, 當鼠尾藻暴露在不同質量濃度的DMP溶液時, 對照組藻體的比生長速率在實驗期間沒有顯著變化(P>0.05), 低濃度 DMP(0.1mg/L)下藻體的生長速率在實驗前5天內顯著升高, 然后逐漸下降, 至 15d時已顯著低于對照組(P<0.05)。而中、高濃度 DMP下藻體的生長在實驗期間均呈負增長, 且DMP濃度越高, 藻體的生長速率越低。
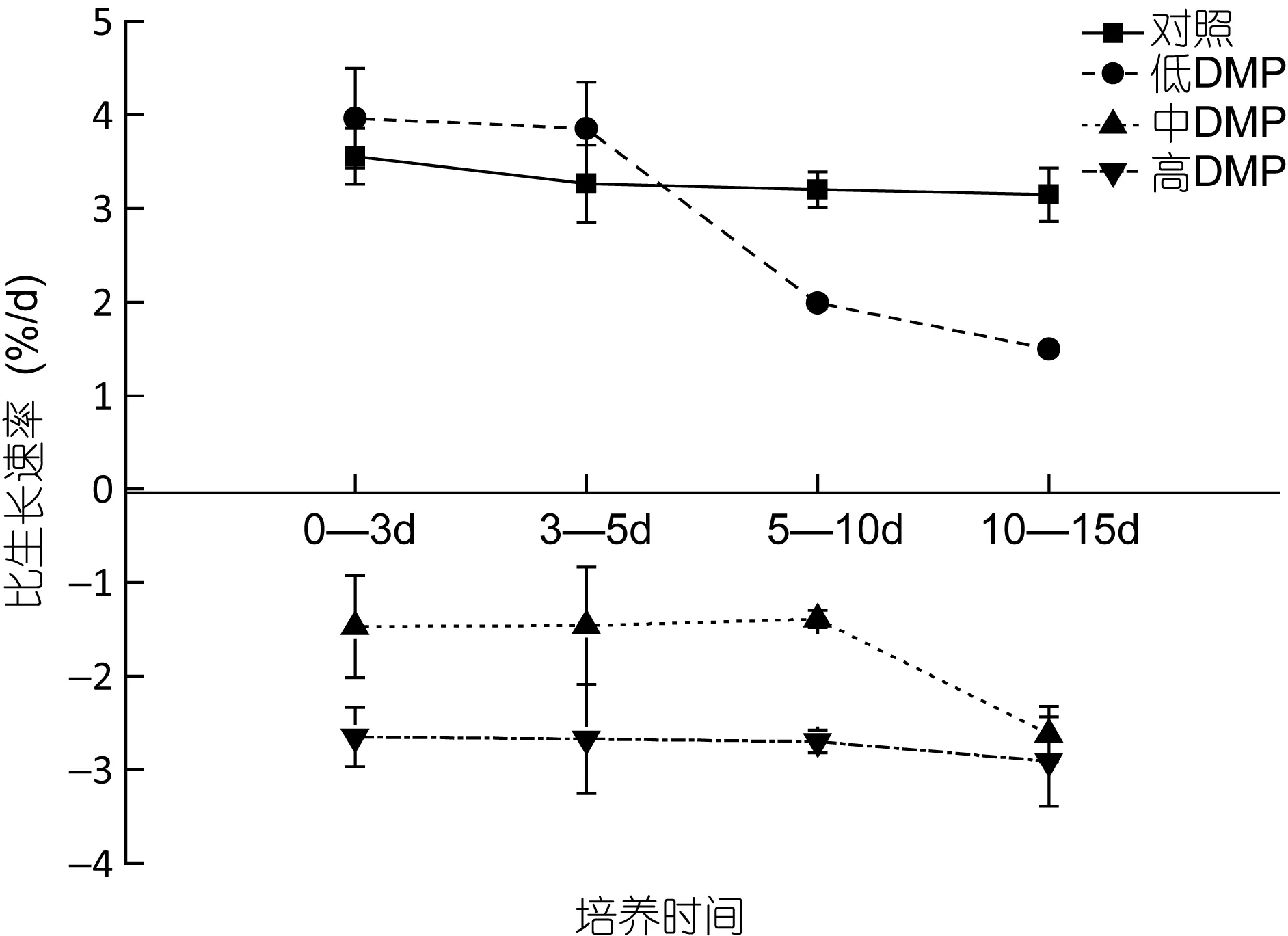
圖1 DMP處理下鼠尾藻的比生長速率Fig. 1 The effects of DMP on the specific growth rate of Sargassum thunbergii
2.2 葉綠素a的含量
鼠尾藻在低濃度DMP中, 藻體的葉綠素a含量隨著暴露時間的延長呈明顯的上升趨勢, 至 15d時,較對照組上升了28.4%; 但在中、高濃度DMP中時,葉綠素a含量隨著培養時間的延長呈明顯的下降趨勢, 且DMP濃度越高, 葉綠素a的含量越低, 至培養15d時, 中、高質量濃度DMP下的葉綠素a含量較對照組分別下降了17.9%、22.8%(圖2)。
2.3 光合放氧速率和呼吸速率
從圖3的比較中可以看出, 對照組藻體的光合放氧速率、呼吸速率和P/R值沒有明顯變化, 而不同DMP濃度處理下卻呈現差異性。低濃度DMP組藻體培養3d后的光合放氧速率和P/R都顯著高于對照組(P<0.05), 而呼吸速率與對照組間差異不顯著(P>0.05)。中、高濃度 DMP處理下藻體的光合放氧速率明顯下降, 在培養15d后, 較對照組分別下降了69%和 92.8%, 而呼吸速率在培養 3d時無顯著變化,隨后逐漸下降,P/R值在培養期間持續下降, 且DMP濃度越高, 降幅越大, 至15d時較對照組分別下降了66.2%和92.1%。
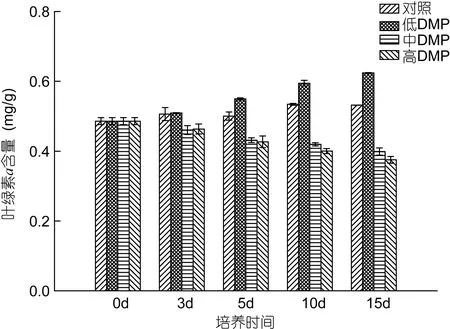
圖2 DMP對鼠尾藻葉綠素a含量的影響Fig. 2 The effects of DMP on chlorophyll a content of S.thunbergii
2.4 rbcL基因相對表達量的變化
如圖 4所示, 對照組rbcL基因的表達量無顯著變化, 低濃度DMP組rbcL基因的表達量卻隨著培養時間逐漸升高, 15d時升至對照組的1.6倍; 與此同時,中、高濃度DMP組rbcL基因的表達量均顯著下降,15d時僅為對照的38.4%和17.4%。
3 討論
3.1 不同DMP濃度對鼠尾藻生長的影響
本研究結果表明, 有機污染物 DMP對鼠尾藻生長的影響表現為濃度和作用時間的相關性。低濃度DMP(0.lmg/L)下鼠尾藻生長情況良好, 生物量隨培養時間的增加而逐漸變大, 表明低濃度的 DMP對鼠尾藻不但沒有毒害作用, 反而有促進作用。而高濃度的 DMP(≥0.3mg/L)則明顯抑制鼠尾藻的生長, 且隨著 DMP濃度的升高和暴露時間的推移, 藻體的新陳代謝受到抑制, 藻細胞開始衰退甚至死亡, 藻體表現出發黃、發白、脫落等表觀性狀。余江等(2007)在龍須菜(Gracilaria lemaneiformis)對DMP毒性響應的研究中也發現, 低濃度的 DMP(0.lmg/L)對龍須菜有促進作用, 而DMP濃度超過0.3mg/L時表現明顯的抑制作用。此外, 在其他一些種類的有機污染物對藻類毒性的研究中, 也發現了同樣的現象(李鈞等, 2000;李欽等, 2004), 因此這可能是普遍存在的一種毒理學現象。
目前, 有機污染物對藻類產生毒性的機理還沒有統一的定論。關于較低濃度污染物對藻類產生促進作用的原因, 學者們普遍認可的一種解釋是生物具有一種“毒物的興奮效應”(Hormesis), 是其自我保護的一種機制(Stebbing, 1982)。產生的機制可能是:(1)低濃度的有機污染物激活了藻細胞內一些相關酶的活性, 因而促進了藻類的代謝; (2)有機物對藻類的毒害和藻類降解有機污染物兩個過程同時存在,在濃度較低時降解過程占主導地位, 因而在整體上表現為降解(Chiet al, 2004; 遲杰等,2005; Gaoet al,2015), 降解產物可作為促進藻類生長的營養源; (3)低濃度的有機污染物可以引起藻細胞脂質過氧化程度在一定范圍的升高, 而此時脂質過氧化程度的升高并不引發對細胞的傷害, 反而具有刺激藻細胞生長繁殖的作用(謝榮等, 2000)。而高濃度有機污染物對藻類一般都有抑制作用, 本研究也進一步證實了這一結論。
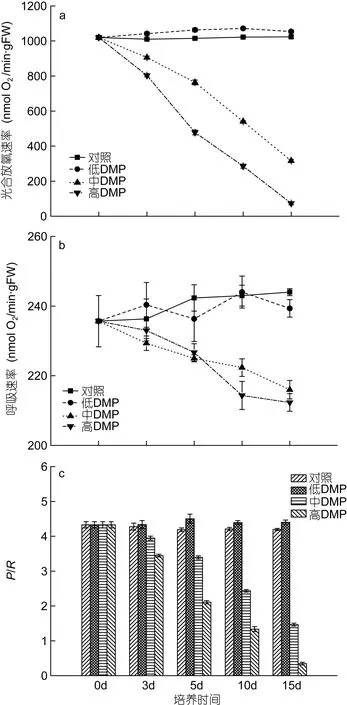
圖3 DMP處理下鼠尾藻藻體的光合放氧速率(a)、呼吸速率(b)和P/R (c)的比較Fig. 3 The effects of DMP on the oxygen exchange parameters of S. thunbergii
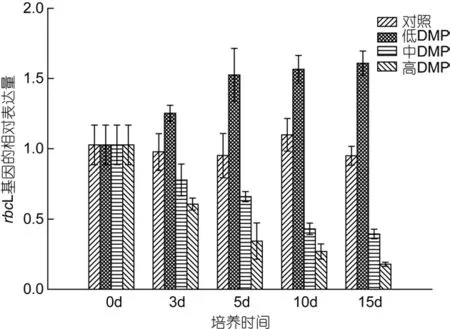
圖4 DMP處理下rbcL基因在轉錄水平上相對表達量的變化Fig. 4 The effects of DMP on the relative expression of rbcL gene at the transcriptional level of S. thunbergii
3.2 不同DMP濃度對鼠尾藻光合作用的影響
高濃度有機污染物對藻類的毒性效應主要表現為抑制光合作用、呼吸作用和固氮作用, 降低酶的活性, 從而影響藻類的活性代謝和生理進程(李鈞等,2000; Yuet al, 2007; Liuet al, 2016)。葉綠素a是植物最重要的光合色素, 因此光合作用的強弱與植物體中葉綠素a的含量息息相關。李欽等(2004)對壇紫菜(Porphyra haitannensis)的研究表明0.lmg/L的甲胺磷可使葉綠素a的含量上升; 余江等(2007)對龍須菜的研究結果也表明0.1mg/L DMP作用下葉綠素a含量逐漸上升, 而高濃度的DMP則引起葉綠素a含量的降低。本文的研究結果也充分證實了這一點, 鼠尾藻暴露在DMP中葉綠素a含量變化表現為低濃度略升高而高濃度顯著下降的趨勢。在一定濃度DMP脅迫下, 葉綠素a含量的上升可能與低濃度DMP脅迫并未對藻的生長造成影響, 反而促進其生長有一定關系。而高濃度DMP作用下, 葉綠素a含量下降的原因可能是: (1)葉綠素a的合成受到抑制, Alberte等(1977)研究發現, 逆境脅迫下葉綠素a含量降低的主要原因是葉綠體片層中捕光 chla/b-Pro復合體合成受到抑制; (2)已有的葉綠素a降解, 原因可能是DMP脅迫使一些葉綠素酶的活性增強, 因此促進了葉綠素a的分解或者DMP脅迫導致藻細胞中活性氧和自由基的催化合成, 進一步引起葉綠素a的降解。
從氧電極的檢測結果來看(圖3), 低濃度DMP處理下藻體的光合放氧速率高于對照組(P<0.05), 而呼吸速率與對照組間差異不顯著, 中、高濃度 DMP處理下藻體的光合放氧速率迅速下降, 而呼吸速率在處理 3d才出現下降趨勢。這表明在藻細胞內, 葉綠體可能比線粒體更易受到 DMP的毒害, 但這還需要進一步的實驗證實。凈光合放氧速率與凈呼吸耗氧速率的比值 P/R是衡量細胞代謝水平的有效參數(Humphrey, 1975), 它受眾多因素影響, 如細胞生長狀態(Ryther, 1955)、營養環境(McAllister et al, 1964)等, 在正常藻體中這一比值約為4 (Melis et al, 2006)。本實驗中正常藻體的 P/R比為 4.3, 低濃度 DMP下P/R值約為4.4, 呈現出正常的光合能力, 且光合活性略微增強。而中、高濃度DMP處理5d后, P/R值分別降為3.4和2.1, 已顯著低于正常值, 至15d時, P/R值只有約1.5和0.3(圖3), 表明此時藻體的光合作用已受到極大的破壞。
3.3 不同DMP濃度對鼠尾藻光合基因rbcL表達的影響
核酮糖-1, 5-二磷酸羧化酶/加氧酶(ribulose bisphosphate carboxylase oxygenase, Rubisco)是植物體內重要的功能蛋白和儲能蛋白, 是光合碳同化過程的關鍵限速酶, 對光合作用的研究有重要意義, 其亞基的編碼基因 rbcL的表達受植物生長發育狀態和生長環境的影響。許建方(2013)研究了滸苔(Ulva prolifera)的 rbcL基因在干出、不同鹽度、不同光照強度和不同溫度條件下的表達模式, 結果表明 rbcL基因在干出過程中的表達量逐漸降低, 而在鹽度稍高(45‰)或稍低(15‰)、強光和黑暗、高溫和低溫等脅迫處理時表達量都會升高, 但超過一定范圍時, 表達量都會有所降低。Shao等(2014)對海帶(Saccharina japonica)的研究發現 rbcL基因的表達是一種快遞光響應模式, 光照下表達量上升, 而黑暗條件下表達量下降, 呈現晝夜變化的規律。對于大型海藻在溫度、鹽度、光照、營養鹽等環境脅迫下光合作用的分子變化機制的研究不僅局限于此, 但是有關大型海藻對有機物脅迫的研究卻多在生理水平上, 在分子水平的相關研究尚未見報道。
本實驗用熒光定量 PCR技術檢測了鼠尾藻在不同濃度DMP作用下rbcL基因相對表達量的變化。從本研究的結果(圖 4)看, 低濃度的 DMP(0.lmg/L)可以在短時間內誘導 rbcL基因的表達, 長時間暴露和高濃度DMP則抑制rbcL基因的表達。以上結果表明,DMP作用下, rbcL基因表達量與光合作用變化規律一致, 因此我們推測 DMP對鼠尾藻光合作用產生影響的作用機制之一可能是影響 rbcL基因的表達量,從而對細胞中Rubisco酶的合成量產生影響, 使藻的光合作用發生變化。
以上結果可以看出, 有機物脅迫與溫度、鹽度、光照、營養鹽等環境因子一樣均可導致 rbcL基因表達的變化, rbcL基因的表達量與藻的生長狀況有一定的相關性, 因此, rbcL基因可以作為診斷大型海藻生長狀況的潛在分子指標, 通過 rbcL基因的表達量來評估大型海藻應對環境變化的響應特征, 這將為評價海洋經濟藻類養殖環境的影響提供一種新的思路。
4 結論
水體有機物污染和藻類生長發育有明顯的相關性, 即低濃度的 DMP能促進鼠尾藻的生長和葉綠素a的合成, 并使藻體的光合作用增強, 誘導rbcL基因的表達, 而高濃度的 DMP則抑制鼠尾藻的生長、光合作用和 rbcL基因的表達。藻類對有機物脅迫的響應是多層次的, 既有生理生化方面的, 也有基因轉錄方面的, 并且這種調控在不同的藻類中可能不同。因此我們下一步將對大量藻種開展廣泛研究, 用多項指標綜合評價環境脅迫對藻類的潛在影響, 從而更有效地對水環境污染做出早期預警, 對藻類個體、種群、群落和生態系統造成的環境脅迫做出更準確的預測。
王麗梅, 李世國, 柴 雨等, 2011. 鼠尾藻幼苗的室內培養及有性生殖同步化. 水產學報, 35(3): 395—404
許建方, 2013. 滸苔中C3和C4途徑關鍵酶的研究. 國家海洋局第一海洋研究所碩士學位論文, 49—58
李 欽, 魏鳳琴, 陳紀新等, 2004. 甲胺磷、辛硫磷對壇紫菜葉狀體的生理效應. 水產學報, 28(2): 221—224
李 鈞, 于仁誠, 李正炎等, 2000. 三苯基氯化錫(TPTC)對孔石莼光合作用及生長的影響. 海洋與湖沼, 31(4):404—407
吳志輝, 楊宇峰, 聶湘平等, 2006. 酞酸酯對龍須菜的生態毒理研究. 海洋科學, 30(6): 46—50
吳海一, 詹冬梅, 劉洪軍等, 2010. 鼠尾藻對重金屬鋅、鎘富集及排放作用的研究. 海洋科學, 34(1): 69—74
余 江, 楊宇峰, 2007. 龍須菜對鄰苯二甲酸二甲酯(DMP)毒性的響應. 中山大學學報(自然科學版), 46(5): 88—92
況琪軍, 趙文玉, 鄧 萍, 2003. DBP對斜生柵藻及天然混合藻類致毒效應研究. 水生生物學報, 27(1): 103—105
遲 杰, 劉 華, 郎鐵柱, 2005. 普通小球藻與DBP的相互作用. 環境科學與技術, 28(2): 26—28
陳濟安, 邱志群, 舒為群等, 2007. 我國水環境中鄰苯二甲酸酯污染現狀及其生物降解研究進展. 癌變·畸變·突變,19(3): 212—214
聶湘平, 李桂英, 吳志輝等, 2008. 4種酞酸酯在龍須菜-籃子魚食物鏈中的積累放大研究. 海洋科學, 32(1): 19—23
謝 榮, 唐學璽, 李永祺等, 2000. 丙溴磷影響海洋微藻生長機理的初步研究. 環境科學學報, 20(4): 473—477
詹冬梅, 李美真, 丁 剛等, 2006. 鼠尾藻有性繁育及人工育苗技術的初步研究. 海洋水產研究, 27(6): 55—59
顏 天, 李 鈞, 李正炎等, 2000. 三苯基氯化錫對黑褐新糠蝦的毒性效應. 海洋與湖沼, 31(5): 485—489
Alberte R S, Thornber J P, 1977. Water stress effects on the content and organization of chlorophyll in mesophyll and bundle sheath chloroplasts of maize. Plant Physiology, 59(3):351—353
Chen W L, Sung H H, 2005. The toxic effect of phthalate esters on immune responses of giant freshwater prawn(Macrobrachium rosenbergii) via oral treatment. Aquatic Toxicology, 74(2): 160—171
Chi J, Liu H, Ji M, 2004. Interaction between DEHP and particulate in a eutrophic lake. Transactions of Tianjin University, 10(3): 167—170
Gao J, Chi J, 2015. Biodegradation of phthalate acid esters by different marine microalgal species. Marine Pollution Bulletin, 99(1—2): 70—75
Humphrey G F, 1975. The photosynthesis: respiration ratio of some unicellular marine algae. Journal of Experimental Marine Biology and Ecology, 18(2): 111—119
Jeffrey S W, Humphrey G F, 1975. New spectrophotometric equations for determining chlorophylls a, b, c1 and c2 in higher plants, algae, and natural phytoplankton. Biochemie and Physiologie der Pflanzen, 167: 191—194
Kasahara E, Sato E F, Miyoshi M et al, 2002. Role of oxidative stress in germ cell apoptosis induced by di(2-ethylhexyl)phthalate. Biochemical Journal, 365(3): 849—856
Liu N, Wen F L, Li F M et al, 2016. Inhibitory mechanism of phthalate esters on Karenia brevis. Chemosphere, 155:498—508
Livak K J, Schmittgen T D, 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2–ΔΔCTmethod. Methods, 25(4): 402—408
McAllister C D, Shah N, Strickland J D H, 1964. Marine phytoplankton photosynthesis as a function of light intensity:a comparison of methods. Journal of the Fisheries Research Board of Canada, 21(1): 159—181
Melis A, Melnicki M R, 2006. Integrated biological hydrogen production. International Journal of Hydrogen Energy,31(11): 1563—1573
Rhodes J E, Adams W J, Biddinger G R et al, 1995. Chronic toxicity of 14 phthalate esters to daphnia magna and rainbow trout (Oncorhynchus mykiss). Environmental Toxicology and Chemistry, 14(11): 1967—1976
Ryther J H, 1955. The ratio of photosynthesis to respiration in marine plankton algae and its effect upon the measurement of productivity. Deep Sea Research, 2(2): 134—139
Shao Z R, Liu F L, Li Q Y et al, 2014. Characterization of ribulose-1, 5-bisphosphate carboxylase/oxygenase and transcriptional analysis of its related genes in Saccharina japonica (Laminariales, Phaeophyta). Chinese Journal of Oceanology and Limnology, 32(2): 377—389
Stebbing A R D, 1982. Hormesis—the stimulation of growth by low levels of inhibitors. Science of the Total Environment,22(3): 213—234
Yu J, Yang C C, Yu R A et al, 2007. Toxic response of dimethyl phthalate (DMP) to Gracilaria Lemaneiformis. Electronic Journal of Biology, 3(4): 80—86

