條斑紫菜PyMGST3基因克隆、表達及功能分析*
佟少明 陳禹先 張 晶 侯和勝
(遼寧師范大學生命科學學院遼寧省植物生物工程重點實驗室 大連 116081)
谷胱甘肽硫轉移酶(Glutathione S-transferases,簡稱 GST)是一類由多基因編碼的具有多種生理功能的同工酶, 在細胞內能催化谷胱甘肽的巰基(-SH)與疏水的異源物質結合, 使親電子化合物轉變形成親水物質, 從而增加其可溶性, 有利于將異源物質排出細胞, 在生物解毒過程中起到至關重要的作用。GST廣泛存在于哺乳動物、鳥類、昆蟲、植物和各種微生物等生物體中。已發現的有活性的 GST主要有三種類型(Hayes et al, 2005), 其中前兩類型分別存在于細胞質及線粒體中, 為可溶性的GST蛋白, 其家族成員和原核生物的 GST蛋白有相似的立體結構, 認為它們有共同的起源。第三種類型是存在于微粒體中的MGST(microsomal glutathione S-transferases), 為膜結合蛋白, 在進化上不同于前者, 被認為是獨立分化出來的一類蛋白(Bresell et al, 2005)。目前, 在模式植物擬南芥的基因組中共發現 55個 GST基因, 其中 54個屬于細胞質或線粒體型的可溶性蛋白, 只有1個微粒體 GST基因, 但在其它物種中也可能含有多個微粒體GST基因(Edwards et al, 2005)。
微粒體 GST成員組成了 MAPEG(membrane associated proteins in eicosanoid and glutathione metabolism)超基因家族, 該家族成員主要參與花生四烯酸及谷胱甘肽的生物代謝過程(Jakobsson et al,1999a)。人類的MAPEG家族共分為三個組, 包括六個成員。第一組含有5-脂肪氧合酶激活蛋白(5-lipoxygenase activating protein, FLAP)和白三烯C4合酶(leukotriene C4 synthase, LTC4)2個成員, 主要參與白三烯的生物合成(Jakobsson et al, 1996); 第二組含前列腺素E合酶(prostaglandin E synthase, PGES), 主要催化前列腺素E的合成(Jakobsson et al, 1999b); 第三組包含MGST1、MGST2和MGST3, 具有谷胱甘肽轉移酶及過氧化物酶活性(Jakobsson et al, 1997; Xu et al, 2015)。
目前已經分離、純化得到的三類MGST在結構、蛋白質分子性質、生物學功能等方面都有一定的區別(Leeet al, 1999), 其中人類的MGST1和PGES在蛋白質序列上有38%的相似性, 形成共同的分支, 但在功能上相差很大(Thorénet al, 2003)。同樣, MGST2與FLAP和LTC4合成酶在氨基酸序列上有更近的相似關系, 而MGST3形成另外單獨的分支(Bresellet al,2005)。MGST各成員的分子質量一般較小, 大約為17KDa, 正常情況下MGST會形成同源三聚體, 三聚體的每個亞基相互依存, 都含有一個半胱氨酸殘基,通過疏基烷化劑, 疏基/二硫鍵交換, 蛋白水解, 熱激活以及氧化應激等方式激活后, 參與并加速毒性物質的代謝(Jakobssonet al, 1996)。MGST是生物體內重要的解毒酶系之一, 對重金屬等環境污染反應靈敏, 具有降解毒物及抗氧化等作用, 也常被作為水體污染的指示分子之一(Guoet al, 2014)。
本研究采用RACE技術, 從條斑紫菜的絲狀體中克隆獲得微粒體GST(PyMGST3)的cDNA全長序列,分析了在重金屬脅迫下該基因的表達水平。嘗試將PyMGST3進行原核表達后, 驗證其生物學活性和功能, 為條斑紫菜抵抗重金屬毒害作用機理的研究提供實驗和理論依據。
1 材料與方法
1.1 供試材料
條斑紫菜(Pyropia yezoensis)絲狀體由遼寧省植物生物工程重點實驗室藻類培養室保存, 實驗前接種到PES培養液中, 置于環境溫度為18, ℃光強為50μmol/(m2·s), 光周期為14∶10h的條件下擴大培養。
以 PES培養液作為對照, 在 PES培養液中分別添加CdCl2及CuSO4溶液, 使培養液中的Cd2+及Cu2+的終濃度分別達到0.5mg/L及1mg/L, 將擴大培養后的條斑紫菜的絲狀體分別接種到 PES培養液及含有Cd2+及Cu2+的培養液中, 分別培養1、2、4、8、12 h后取樣, 每個處理做三次重復。
1.2 條斑紫菜總RNA提取及cDNA合成
采用RNAiso for Polysaccharide-rich Plant Tissue試劑盒(TaKaRa, 大連)進行條斑紫菜總RNA的提取,提取過程完全參照說明書進行; 總 RNA用 DNaseⅠ(TaKaRa, 大連)去除剩余的基因組 DNA 后, 采用Nanodrop 2000C核酸蛋白檢測儀和1%瓊脂糖凝膠電泳檢測總 RNA濃度及完整性; cDNA合成采用PrimeScript? 1st Strand cDNA Synthesis Kit (TaKaRa,大連)試劑盒, 按照使用說明書進行操作, 反轉錄后合成的cDNA保存在–20℃作為基因克隆和實時定量PCR的模板備用。
1.3 PyMGST3基因全長cDNA的克隆及測序
在 NCBI的 EST數據庫中(http://www.ncbi.nlm.nih.gov/nucest/)搜索條斑紫菜GST基因EST序列, 將搜索結果下載存盤后, 采用 Sequencher軟件進行序列拼接, 獲得較長的拼接 EST序列, 利用 NCBI的CD-search程序(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)驗證該拼接片段編碼的氨基酸序列是否含有GST基因編碼的功能域。以含有GST功能域的 cDNA序列為模板, 設計合成正反向引物PyMGST3-F及PyMGST3-R(見表1)進行PCR擴增。回收PCR產物進行克隆和測序。
以獲得的片段為模板, 設計合成 5′和 3′端的 outer和 inner特異性引物(見表 1), 采用 Clontech公司的SMARTerTMRACE 5'/3'Kit試劑盒, 按試劑盒的操作指南進行實驗。PCR擴增獲得該基因的5′及3′端的cDNA片段, 擴增產物用1%的瓊脂糖凝膠電泳分離, 切膠回收目的片段, 克隆后送上海生工生物工程有限公司測序。
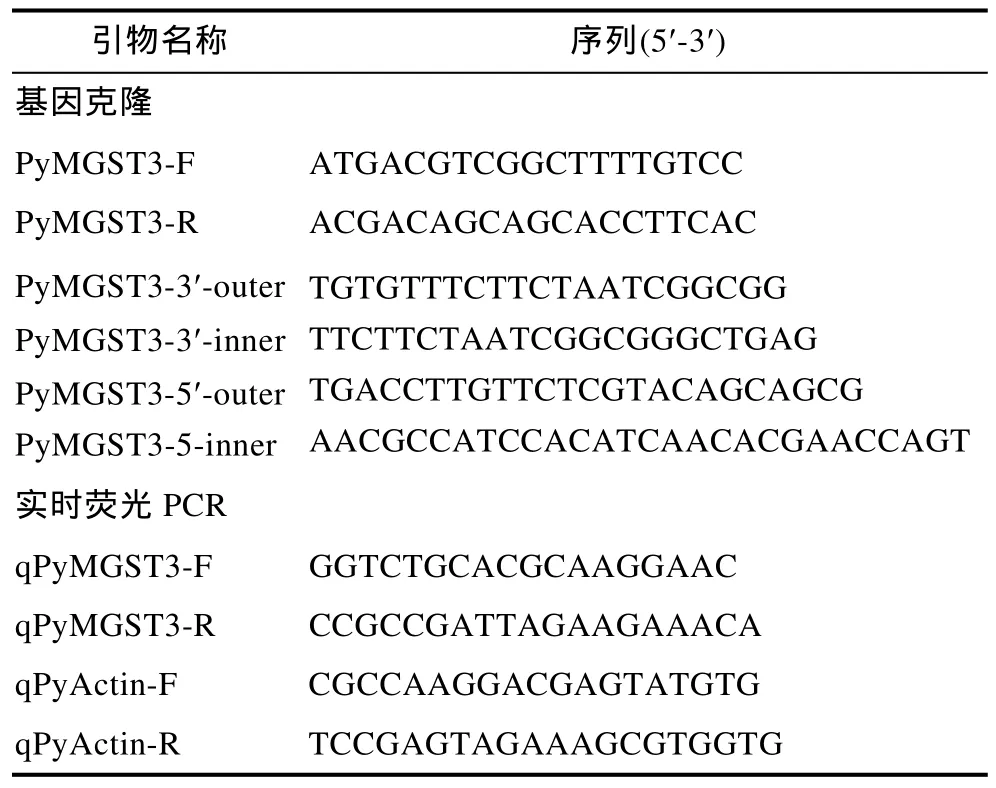
表1 引物名稱及序列Tab.1 Name and sequence of the primers
1.4 PyMGST3基因的序列分析
將測序獲得的 GST基因序列拼接后, 提交到NCBI。采用 ORF Finder程序在線分析開放閱讀框;同時采用 SignalP 3.0 Server(http://www.cbs.dtu.dk/services/SignalP-3.0/、TMHMM 2.0(http://www.cbs.dtu.dk/services/TMHMM/)、ProtScale(http://web.expasy.org/protscale/)軟件分別進行蛋白質的信號肽、跨膜結構域和氨基酸疏水區域的分析; 利用NCBI (http://www.ncbi.nlm.nih.gov/)的 Blast P程序進行相似蛋白查找,并采用Clustal X軟件對預測的氨基酸序列進行多序列比對; 采用 SWISS-MODEL 工作平臺 (http://swissmodel.expasy.org/)預測PyMGST3蛋白的三級結構域。
1.5 PyMGST3基因在重金屬脅迫下的表達分析
根據PyMGST3基因測序結果設計熒光定量PCR引物qPyMGST3-F和qPyMGST3-R(見表1)擴增產物長度為142bp, 以β-actin(Accession No. AB292772.1)為內參, 擴增產物長度為135bp。采用RT-PCR法, 分析Cd2+和Cu2+脅迫下PyMGST3基因的表達水平。反應在TaKaRa TP800 PCR儀上進行, 采用兩步法進行擴增, 即95°C預變性1min, 95°C變性 10s, 60°C延伸45s, 共 40個循環, 設置陰性對照和無模板對照, 每個反應設置3個重復。PyMGST的相對表達量分析采用ΔΔCt的方法進行。
1.6 PyMGST3基因的原核表達及酶活性分析
將PyMGST3基因的5′端及3′端分別引入BamH I及 Sal I酶切位點, 插入到pET-28a表達載體的多克隆位點中, 構建pET-28a/PyMGST3原核表達載體,將其與空載體 pET-28a分別轉化大腸桿菌菌株BL21(DE3), 選取陽性克隆提取質粒DNA進行酶切和測序驗證。將驗證后的陽性轉化菌株分別在 LB培養基中過夜培養, 然后按 1∶50的比例轉接到50mL的 LB液體培養基中, 培養至 OD600約為 0.6左右, 加入終濃度為1mmol/L的IPTG誘導4h后收集菌體, 進行 SDS-PAGE電泳檢測目標蛋白的表達情況。
酶活性分析采用谷胱甘肽 S-轉移酶測定試劑盒KGT005(凱基生物, 南京)進行, 具體操作完全按照說明書進行。
1.7 PyMGST3基因轉化菌對重金屬脅迫的耐受力分析
分別挑取重組菌(轉pET-28a/PyMGST3)和對照菌(轉 pET-28a空載體)的單菌落, 在含有 60μg/ mLAmp的新鮮LB培養液中37°C培養過夜, 按1∶100的比例將培養好的菌液(OD600值為1.0左右)轉至50mL新鮮LB培養液中擴大培養2h(至OD600值為0.5左右), 然后加入IPTG至終濃度為1mmol/L, 同時在培養體系中分別加入終濃度為 400μmol/L CdCl2和 200μmol/L的CuSO4繼續培養, 每隔 1h取樣測定 OD600值, 連續測定12h, 并繪制生長曲線。每個處理設3次重復, 未加入CdCl2和CuSO4的菌液同時培養作為對照組。
2 結果與分析
2.1 條斑紫菜PyMGST3基因的全長cDNA序列
以 PyMGST3-F和 PyMGST3-R為上下游引物,以條斑紫菜的 cDNA為模板進行 PCR擴增, 獲得了大小440bp左右的片段。在5′及3′RACE的擴增中, 分別得到172bp和375bp的片段。采用Sequencher軟件將三個DNA片段拼接后得到全長為681bp的序列。將此序列提交NCBI, 運用ORF Finder程序預測開放閱讀框。結果顯示PyMGST3基因具有一個417bp的開放閱讀框, 起始密碼子 ATG, 終止密碼子為 TGA,編碼138個氨基酸, 分子量為15.3KDa, 5′端非翻譯區長度為 80bp, 3′端非翻譯區長度為 184bp。條斑紫菜GST基因cDNA序列及其所推測的氨基酸序列如圖1所示。已經將序列提交到 GenBank中, Accession Number為 KX447713。

圖1 PyMGST3基因的cDNA序列及其推測氨基酸序列Fig.1 The nucleotide sequence of GST gene and deduced amino acid sequence注: 圖中下劃線序列為保守結構域
2.2 PyMGST3蛋白的跨膜結構域、疏水區域、信號肽及三級結構預測
PyMGST3作為膜結合蛋白, 一般具有一個以上的跨膜結構域, TMHMM 2.0 Server分析的結果如圖2a所示, PyMGST3蛋白存在3個跨膜結構域, 第一個跨膜區域在第 10—30氨基酸處, 第二個跨膜區域在第74—96氨基酸處, 第三個跨膜區域在115—133氨基酸處。另外, 位于 1—9及 97—114區域內的氨基酸位于膜外側, 位于 31—73區域內的氨基酸位于膜內側。
跨膜結構域的疏水跨膜區一般由 20個左右的疏水性氨基酸殘基組成, ProtScale在線分析PyMGST3蛋白的疏水區的結果如圖2b所示, PyMGST3蛋白具有3個明顯的疏水區域, 與推測形成跨膜結構的氨基酸位置一致, 這也和跨膜結構域的預測結果相互印證。
SignalP 3.0 Server對PyMGST3蛋白的信號肽分析的結果表明, 在第36與37位氨基酸之間可能存在信號肽剪切位點(圖 2c), 最大切割位點概率為 0.766,可以推測PyMGST3蛋白的N端1—36個氨基酸可能為信號肽序列。PyMGST3蛋白一般定位于微粒體,其N-端含有36個氨基酸作為跨膜信號, 在引導膜蛋白跨膜時, 由于疏水跨膜區的存在可以使膜蛋白停留在細胞膜中。
PyMGST3蛋白的三級結構預測在 SWISSMODEL平臺上在線完成, 根據序列相似性共發現了26個模板, 我們選擇了與PyMGST3序列相似性最高的Leukotriene C4 synthase(模板號為4jrz.1.A)作為模板來模擬 PyMGST3蛋白的三級結構(圖 2d), 其中GMQE(global model quality estimation)值為 0.61, 也說明了預測的三級結構相對準確。
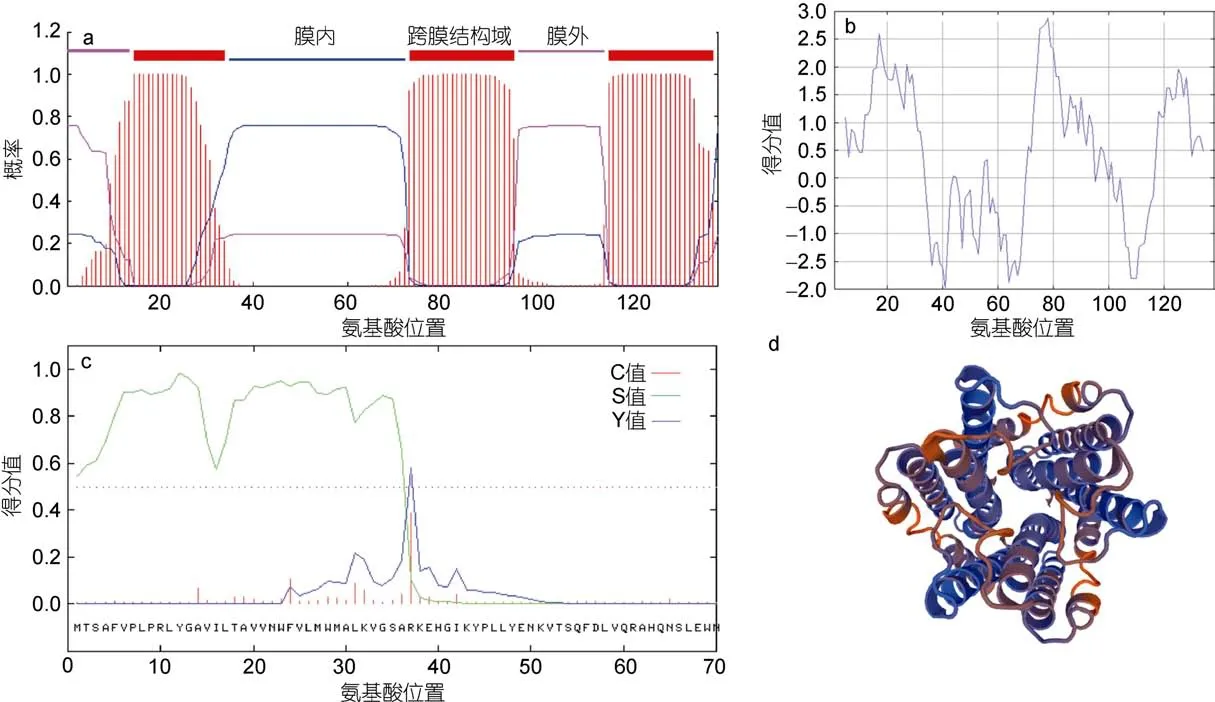
圖2 PyMGST3跨膜結構域、疏水性、蛋白信號肽及三級結構預測Fig.2 The prediction of transmembrance domains, hydrophobicity profile, signal peptide, and three-dimensional structure in PyMGST3
2.3 PyMGST3蛋白的多序列比對
將條斑紫菜PyMGST3基因編碼區推測的氨基酸序列提交到NCBI中采用Blast P程序進行相似性搜索。結果表明, 與該序列相似性高的其它物種 GST均為MGST3家族成員。選擇了6個相似性較高的其它藻類的MGST蛋白, 用ClustalX進行多序列比對分析。結果如圖 3所示, 在所選取的序列中, 與PyMGST3蛋白相似性最高的是皺波角叉菜(Chondrus crispus), 序列的相似性為60%, 其次為衣藻相似性為39%, 與其它藻類的相似性在25%—35%之間, 與細小微胞藻的相似性最低為25%。
2.4 PyMGST3基因在Cd2+和Cu2+脅迫條件下的表達變化
采用實時熒光定量 PCR方法, 檢測了條斑紫菜絲狀體的PyMGST3基因在Cd2+和Cu2+脅迫下的轉錄水平變化。結果表明: 在 0.5mg/LCd2+(圖 4a)的條件下, PyMGST3基因的表達逐步上升, 4h表達量為對照組的3倍, 8h表達量最高, 是對照表達量的7倍, 隨后下降。在1mg/LCu2+(圖4b)的處理下,PyMGST3基因的表達變化趨勢與 0.5mg/LCd2+處理的表達變化類似, 不同的是在處理 1h后,PyMGST3基因的表達量變化就已經是對照組的 2倍以上, 8h時表達量達到最高, 是對照表達量的6倍, 隨后下降。

圖3 PyMGST3蛋白與其他藻類MGST蛋白的多序列比對Fig.3 Multiple alignment of PyMGST3 and MGSTs from other species
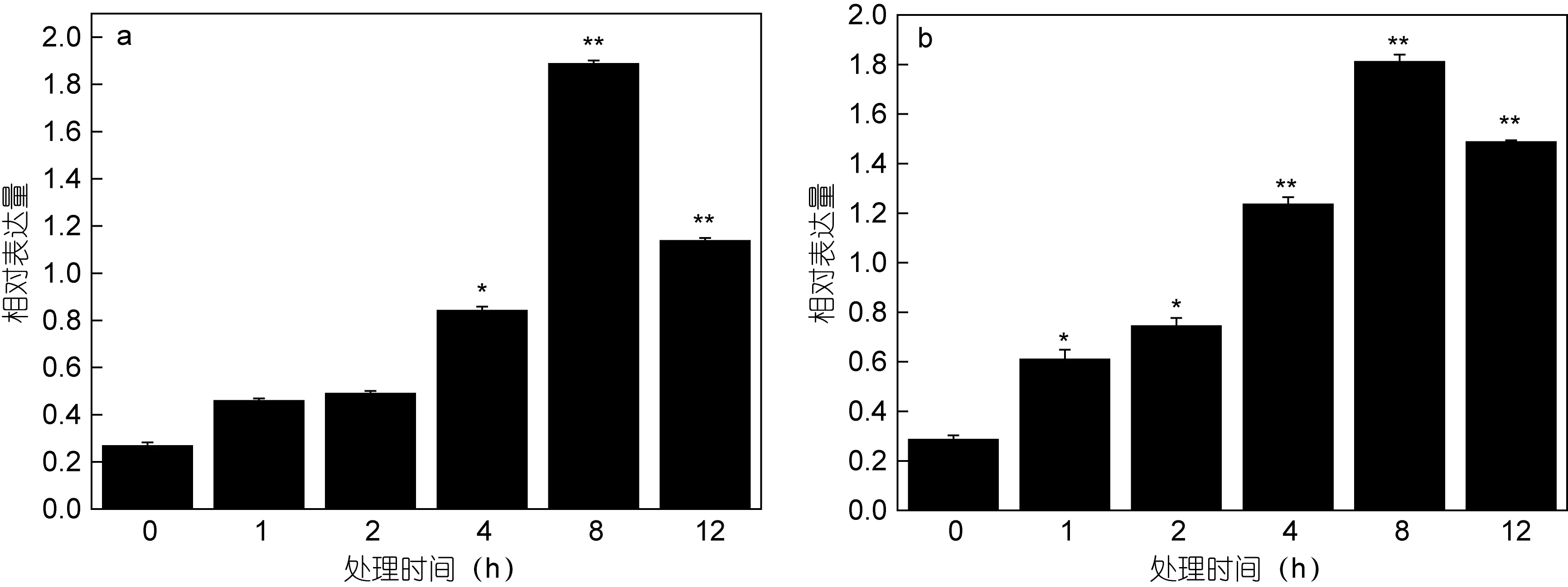
圖4 PyMGST3基因在Cd2+和Cu2+脅迫下不同時間(1、2、4、8和12h)的表達變化Fig.4 The transcription levels of PyMGST3 at different time points under Cd2+和Cu2+ stresses
2.5 純化后的 PyMGST3蛋白具有谷胱甘肽 S-轉移酶活性
含有表達載體 pET-28a/PyMGST3的E.coliBL21(DE3)菌株經IPTG誘導表達4h后, 分別取表達產物進行 SDS-PAGE檢測(圖5)。結果表明, 與未誘導的對照組(圖5中的2泳道)比對, IPTG誘導的重組菌在20KDa左右出現一條特異的條帶(圖5中的3、4泳道), 在大約21KDa處成功表達了帶有His標簽的融合蛋白, 與預測的 PyMGST3蛋白相對分子質量15.3KDa的結果相一致。
SDS-PAGE電泳后, 將PyMGST3蛋白進行純化,用試劑盒進行谷胱甘肽 S-轉移酶活性的測定, 結果顯示, 酶活性為 0.17μmol/(min·mg)。
2.6 PyMGST3基因過表達提高了重組菌株的重金屬耐受性
用較高濃度的 Cd2+和 Cu2+兩種重金屬離子處理pET-28a/PyMGST3重組菌和pET-28a空載體對照菌,探索pET-28a/PyMGST3重組菌對這兩種重金屬離子的耐受能力。結果表明, 培養液中不添加重金屬時,重組菌和對照菌的生長情況基本一致(圖6a)。在加入400μmol/LCd2+和 200μmol/LCu2+后, 重組菌對兩種重金屬脅迫響應的生長曲線基本相似。但與對照菌相比,二者的生長出現了明顯的差異, 如圖 6b所示, 在IPTG誘導后的前1h內, 重組菌和對照菌生長差異不顯著, 1h后, 重組菌生長速度明顯高于對照菌(P<0.01), 差異極顯著。在處理8h和9h后, 重組菌生長進入平臺期, 隨后生長速度緩慢下降, 對照菌在 6h左右進入平臺期, 生長速度開始下降, 且下降幅度更大。

圖5 PyMGST3融合蛋白在E. coli BL21(DE3)中表達的SDS-PAGEFig.5 SDS-PAGE of PyMGST3 fusion protein
3 討論
活性GST是一種多功能酶, 主要存在細胞質、線粒體及微粒體中, 其中胞質GST的種類最多, 也是研究得最為深入的一類GST。動物細胞的胞質GST分為 Alpha、Mu、Pi、Omega、和 Sigma等類型, 植物細胞的胞質 GST分為 Lambda、Phi、Zeta、Theta、Tau和DHAR等類型, 其中Tau和Phi是植物特有的兩種類型(Hu et al, 2016)。本文通過RACE技術, 克隆得到條斑紫菜的PyMGST3基因的全長cDNA序列,經過序列的比對分析, 并結合蛋白質的跨膜結構域及疏水性等的分析, 表明我們分離到的條斑紫菜的GST基因為一種新型的微粒體 GST基因, 與其它物種的 MGST3蛋白相似性很高, 因此命名該基因為PyMGST3, 有關條斑紫菜的微粒體 GST3基因的序列及功能研究還未見報道。先前的研究表明, 哺乳動物及高等綠色植物中的MGST3基因的保守結構域的模式為 F-N-C-[AIV]-Q-R-[AGS]-H-[AQ]-[NQ]-x(2)-E-x(2,3)-P, 本文克隆得到的PyMGST3蛋白也具有相似的保守結構域, 但是第二及第三位的氨基酸“N”及“C”分別被“D”及“L”所取代, 以及最后一位的“P”被“W”所取代。同樣的氨基酸替代現象也在微小原甲藻(Prorocentrum minimum)的 PmMGST3序列中發現,如第三位的“C”被“S”所替代。因此, MGST3基因保守結構域的模式應改寫為 F-[DN]-[CSL]-[AIV]-Q-R-[AGS]-H-[AQ]-[NQ]-x(2)-E-x(2,3)-[PW]。

圖6 不同大腸桿菌菌株BL21(DE3)在不同條件下的生長曲線Fig.6 Growth of different E. coli BL21 (DE3) cells under different conditions
海洋生物暴露在 Cd2+等重金屬的脅迫下, 可誘導機體產生大量的諸如 H2O2、O2–等活性氧自由基,引起生物體的氧化損傷, 機體抗氧化防御系統作為活性氧自由基平衡的重要調節體系, 在減輕或解除重金屬等引起的氧化脅迫中扮演著重要角色, 也常被作為監測海洋重金屬污染物的候選生物標記(陳曉聰等, 2015; Tiwari et al, 2016)。GST作為機體抗氧化防御系統的第二階段的解毒酶一般是通過兩種方式來進行污染物的解毒: 一是催化還原型谷胱甘肽直接與重金屬離子共價結合, 從而降低重金屬離子毒性并促進重金屬向液泡或質外體轉運; 二是 GST的過氧化物酶活性能利用還原型谷胱甘肽向氫過氧化物發動親核攻擊, 使其還原為低毒的一元醇, 從而緩解重金屬脅迫產生的氧化脅迫(Li et al, 2017)。作為抗氧化酶GST家族成員之一, MGST的主要作用也是清除氧化脅迫過程中產生的有毒物質(Hayes et al,2005), 且MGST多以脂溶性的親電子化合物為底物,比可溶性GST更易于與底物結合。此外, 凡由P-450氧化酶催化的外源性化合物都可以直接由 MGST排出體外, 而可溶性 GST的催化作用需要親電子基團通過微粒體膜到胞漿才能得以實現(Regoli et al, 2014;鄭英等, 2003), 因此, 微粒體GST相比之下可能比胞質GST去除污染物的效率更高。研究發現, 重金屬脅迫下的 GST基因均呈現先上升后下降的“毒物興奮效應”的表達模式(顧海龍等, 2013), 但不同物種中的GST家族的不同成員對于不同的氧化脅迫都有各自不同的表達模式(Guo et al, 2014)。在本研究中, 實時熒光定量表達分析發現, Cd2+和Cu2+脅迫均能使條斑紫菜絲狀體的PyMGST3基因表達水平在短時間內升高(Cd2+4h, Cu2+1h), 且隨時間的延長表達量增加, 隨后下降(Cd2+12h, Cu2+12h), 說明PyMGST3基因很可能在參與清除 Cd2+和 Cu2+脅迫所產生的氧化脅迫中起作用。另外, 周向紅等人(2011)用不同濃度鉛處理條斑紫菜葉狀體時, 發現胞質 PyGST基因的轉錄表達也與PyMGST3基因呈現相似的結果, 推測MGST和可溶性GST協同作用來清除重金屬離子等的毒害,相信在進一步確定其調控位點后, 將為利用該基因提高藻類抵抗重金屬污染的分子機制奠定基礎。基于條斑紫菜PyMGST3基因對Cd2+和Cu2+的敏感性, 可以考慮將其作為環境污染指示分子之一用于環境污染的評估和監測。
GST具有催化還原型谷胱甘肽(GSH)與 1-氯-2,4-二硝基苯(CDNB)結合的能力, 在本研究中通過在大腸桿菌中表達并純化的紫菜 PyMGST蛋白的具有GST活性, 能催化GSH與CDNB的結合, 也說明了PyMGST是一個功能酶。另外, PyMGST3的重組菌株對 Cd2+和 Cu2+脅迫的耐受性都顯著高于對照菌, 表明由于外源PyMGST3基因的誘導表達, 降低或解除了重金屬離子 Cd2+和 Cu2+對重組菌的毒性, 使其表現出更強的重金屬離子耐受能力。越來越多的研究結果表明, 超表達 GST基因會增加生物體對抗重金屬脅迫的能力, 如超表達水稻 GST基因提高了轉基因水稻抗Cd2+的能力(Zhao et al, 2009)。近年來, 隨著重金屬對土壤及水域污染的逐漸加重, 嘗試通過超表達及異位表達氧化脅迫相關基因, 如 GST及過氧化氫酶(Catalase, CAT)等方法來增加植物體對重金屬的吸收, 獲得了抗重金屬的轉基因植物來增加對重金屬離子的吸收, 以期通過生物修復的方法來減輕重金屬的傷害, 但在研究中也發現在植物體獲得重金屬抗性的同時也會造成重金屬在植物體內的大量積累, 使其應用受到了很大的限制。但最近的報道表明,在煙草中(Nicotiana tabacum)超表達綠木霉(Trichoderma virens)GST基因, 在使煙草獲得了較強重金屬抗性的同時, 沒有增加重金屬的富集(Dixit et al, 2012)。這為利用GST基因來培育即抗重金屬脅迫又沒有富集的新品種提供了理論支持。
4 結論
MGST是存在于除古細菌以外的所有原核及真核生物中的高度保守的基因, 本研究從條斑紫菜的絲狀體中首次克隆得到PyMGST3基因, 該基因隸屬于 MAPEG超基因家族, 其編碼蛋白與其他物種MGST3蛋白含有相似的結構域, 具有谷胱甘肽 S-轉移酶活性。在 Cd2+和 Cu2+等重金屬離子存在的環境中, PyMGST基因上調表達, 減輕由重金屬離子產生的氧化脅迫, 保護細胞免受傷害。MGST在藻類及高等植物中除了參與抗氧化脅迫等生物代謝以外, 其他生物學功能的研究還有待于進一步深入。
陳曉聰, 張 冉, 李成華等, 2015. 菲律賓蛤仔(Venerupis philippinarum)對重金屬 Hg2+的富集及相關生物標記物的識別. 海洋與湖沼, 46(4): 928—936
周向紅, 易樂飛, 李信書等, 2011. 條斑紫菜谷胱甘肽 S-轉移酶基因的克隆與表達分析. 水產學報, 35(9): 1354—1361
鄭 英, 樓宜嘉, 2003. 微粒體谷胱甘肽S-轉移酶與藥物代謝.中國藥學雜志, 38(7): 484—487
顧海龍, 沈偉良, 孫長森等, 2013. 低濃度 Cd2+長期脅迫對泥蚶抗氧化防御系統及 MDA含量的影響. 海洋環境科學,32(5): 741—745
Bresell A, Weinander R, Lundqvist G et al, 2005. Bioinformatic and enzymatic characterization of the MAPEG superfamily.The FEBS Journal, 272(7): 1688—1703
Dixit P, Mukherjee P K, Ramachandran V et al, 2012.Glutathione transferase from Trichoderma virens enhances cadmium tolerance without enhancing its accumulation in transgenic Nicotiana tabacum. PLoS One, 6(1): e16360
Edwards R, Dixon D P, 2005. Plant glutathione transferases.Methods in Enzymology, 401: 169—186
Guo R Y, Ebenezer V, Ki J S, 2014. PmMGST3, a novel microsomal glutathione S-transferase gene in the dinoflagellate Prorocentrum minimum, is a potential biomarker of oxidative stress. Gene, 546(2): 378—385
Hayes J D, Flanagan J U, Jowsey I R, 2005. Glutathione transferases. Annual Review of Pharmacology and Toxicology, 45(1): 51—88
Hu B, Zhao J T, Lai B et al, 2016. LcGST4 is an anthocyanin-related glutathione S-transferase gene in Litchi chinensis Sonn. Plant Cell Reports, 35(4): 831—843
Jakobsson P J, Mancini J A, Ford-Hutchinson A W, 1996.Identification and characterization of a novel human microsomal glutathione S-transferase with leukotriene C4synthase activity and significant sequence identity to 5-lipoxygenase-activating protein and leukotriene C4synthase.Journal of Biological Chemistry, 271(36): 22203—22210
Jakobsson P J, Mancini J A, Riendeau D et al, 1997.Identification and characterization of a novel microsomal enzyme with glutathione-dependent transferase and peroxidase activities. Journal of Biological Chemistry,272(36): 22934—22939
Jakobsson P J, Morgenstern R, Mancini J et al, 1999a. Common structural features of mapeg—a widespread superfamily of membrane associated proteins with highly divergent functions in eicosanoid and glutathione metabolism. Protein Science, 8(3): 689—692
Jakobsson P J, Thorén S, Morgenstern R et al, 1999b.Identification of human prostaglandin E synthase: a microsomal, glutathione-dependent, inducible enzyme,constituting a potential novel drug target. Proceedings of the National Academy of Science of the United States of America, 96(13): 7220—7225
Lee S H, DeJong J, 1999. Microsomal GST-I: genomic organization, expression, and alternative splicing of the human gene. Biochimica et Biophysica Acta (BBA)-Gene Structure and Expression, 1446(3): 389—396
Li D Z, Xu L, Pang S et al, 2017. Variable levels of glutathione S-transferases are responsible for the differential tolerance to metolachlor between maize (Zea mays) shoots and roots.Journal of Agricultural and Food Chemistry, 65(1): 39—44
Regoli F, Giuliani M E, 2014. Oxidative pathways of chemical toxicity and oxidative stress biomarkers in marine organisms.Marine Environmental Research, 93: 106—117
Thorén S, Weinander R, Saha S et al, 2003. Human microsomal prostaglandin E synthase—1: purification, functional characterization, and projection structure determination.Journal of Biological Chemistry, 278(25): 22199—22209
Tiwari V, Patel M K, Chaturvedi A K et al, 2016. Functional characterization of the tau class glutathione-S-transferases gene (SbGSTU) promoter of Salicornia brachiata under salinity and osmotic stress. PLoS One, 11(2): e0148494
Xu Z B, Zou X P, Zhang N et al, 2015. Detoxification of insecticides, allechemicals and heavy metals by glutathione S-transferase SlGSTE1 in the gut of Spodoptera litura.Insect Science, 22(4): 503—511
Zhao F Y, Liu W, Zhang S Y, 2009. Different responses of plant growth and antioxidant system to the combination of cadmium and heat stress in transgenic and non—transgenic rice. Journal of Integrative Plant Biology, 51(10): 942—950

