骨小梁仿生微結構的解析與構建
趙小文 白雪嶺 張 鵬 張東鋒 穆 林
1(深圳市艾科賽龍科技股份有限公司 深圳 518053)
2(中國科學院深圳先進技術研究院 深圳 518055)
1 引 言
松質骨由大量骨小梁相互交織構成,呈海綿狀,排列方向與骨所承受的壓力和張力的方向一致,遵循用最小的骨量達到最大的骨強度的原則,起到支持、減輕重量、緩沖、容納骨髓以及應對形變、適應形變等功能[1,2]。骨小梁在人體內分布廣,雖然松質骨僅占人體骨量的 20%,但構成 80% 的骨表面,包含有膠原、礦物質以及骨組織細胞等各種不同的結構,是多種代謝發生的場所,也是血液系統的重要發源地。
骨缺損是臨床上常見的疾病,也是骨科臨床治療的難題之一。目前,治療骨缺損的方法有自體骨和異體骨移植、組織工程技術和基因治療法及生長因子、物理治療法的輔助治療等。利用3D 打印技術構建多孔支架[3]是骨缺損修復的發展趨勢之一,已廣泛地應用于因創傷、骨腫瘤、感染、先天性骨病等所致的骨缺損[4]。多孔支架的修復缺損過程主要依靠其提供的細胞生長微環境[5],傳導力學刺激實現成骨,同時復合生物材料的骨誘導性能發揮積極作用[6-8]。然而,傳統骨骼缺損修復體大多采用均勻、規則的幾何體,只保證了孔徑和孔隙率[9,10],雖然可以滿足少部分松質骨的生物力學特性和生理微環境特征,但與真實的松質骨結構和生理功能還有很大的差距,甚至會造成死腔,成為新的治療風險。
本研究首先采用 Micro CT 掃描兔股骨近端松質骨,并分別應用 Mimics 和 Rhino 軟件構建三維[11]松質骨模型并分析其幾何特征;然后,基于斯特林公式對松質骨模型進行仿生建模[12-15],構建仿生骨小梁并進行 3D 打印;最后,通過幾何相似性分析對比和體外細胞實驗驗證仿生骨小梁的有效性。骨小梁仿生微結構的解析與構建方法,可為動物骨骼的修復與重建提供建模的參考方法,對人體組織工程學的發展提供參考和方法依據。
2 材料與方法
2.1 材料
(1)樣本:遴選 10 例活體兔的后肢股骨,骨齡 3 歲,骨骼發育正常、完整。
(2)硬件:Micro CT 機;圖形工作站:CPU E5-2609 1.9 G,內存 128 G。
(3)軟件:Mimics 19,Rhino5.0。
(4)3D 打印材料:羥基磷灰石(HA)納米材料 100 g,聚己內酯(PCL)材料 100 g 等。
(5)艾科賽龍生物打印機 1 臺。
2.2 松質骨結構解析
(1)Micro CT 掃描兔活體后肢股骨,掃描斷層與后肢骨長軸垂直[16]。掃描參數[17]:層厚為0.013 872mm;電流 100 mA;電壓 69 kV;共622 幅(1 000×1 000)斷層圖像,如圖1所示。

圖1 兔股松質骨顯微 CT 圖像Fig. 1 Micro CT image of cancellous bone of rabbit proximal femur
(2)應用 Mimics 三維重建軟件,截取松質骨廣泛均勻分布的關節頭區域,重建三維兔后肢股骨圖像,輸出為 stl 文件(一種 3D 模型文件格式),結果如圖2 所示。

圖2 兔股骨關節頭區域松質骨 stl 三維模型Fig. 2 3D stl model of cancellous bone of rabbit proximal femur
(3)將文件導入 Rhino 軟件,對圖像進行測量,分析骨小梁的空間直徑等幾何特征,并做統計分析[18,19]。

圖3 容積比(V骨小梁/V立方體)Fig. 3 Volume ratio(trabecular bones/cube)
根據測量結果,對松質骨內的骨小梁性狀可以總結以下幾點:精確測量一組骨小梁的外徑數據范圍分布在 0.12~0.06mm,平均值為0.086mm;骨小梁之間的匯集交點在空間以隨機的形態分布;骨小梁在空間基本呈現均勻狀態分布;容積比(V骨小梁/V立方體)在 0.4~0.5,平均值為0.433,結果見圖3。
2.3 骨小梁仿生微結構構建
(1)取單位體積(1mm×1mm×1mm)的松質骨樣品,測量骨小梁的總體積(體積0.505mm3),結果如圖4 所示。

圖4 松質骨樣品Fig. 4 Cancellous bone sample
(2)仿真數學算法模型。計算和優化各項空間向量指標,獲得富含骨小梁微結構的松質骨結構,算法如下:
松質骨由海量不規則的多維球體單元(點)構成復雜的三維結構,每個單元為n維,將斯特林公式作為n! 的近似值(n約為 1023)。設r為半徑,Kn(r)代表n維球,中心在原點,滿足以下公式:
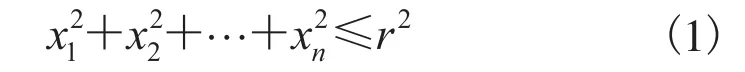

對Kn(r)的體積Vn和表面積On,滿足雅可比公式:
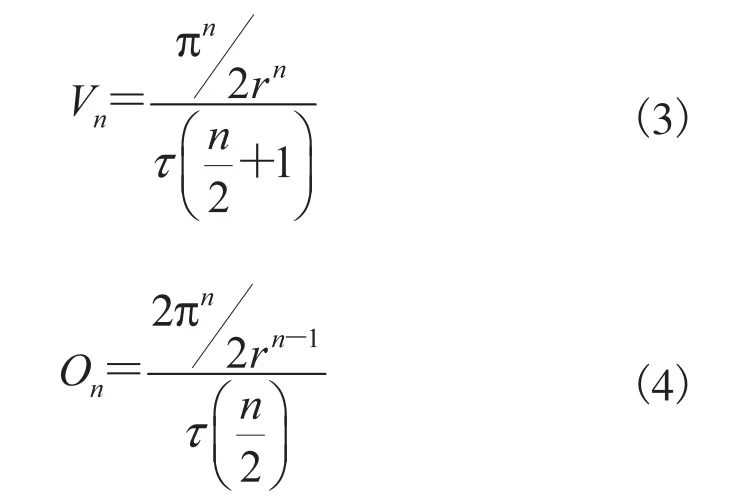
由賦予屬性的各單元組成完整的空間結構,從橫截面(自上而下)截取m個斷層,得到斷層面為三維結構的斷層面積,相應算法為:

設定一個與天然骨小梁等體積等結構的空間正方體(1mm×1mm×1mm)(圖5(a)),將多維度的空間點陣裝入此空間,多次疊加(圖5(b)),產生空間多維度連線(圖5(c))[20],構建外徑0.09mm 的仿生骨小梁體,應用仿真數學算法,通過容積逼近空間邊際極限,最終達到二者體積相等,完成仿生松質骨構建(圖5(d))。

圖5 骨小梁仿真過程Fig. 5 Simulation process of trabecular bone
3 結 果
3.1 松質骨樣本與仿生松質骨微結構對比分析
首先,對松質骨樣本和仿生松質骨進行 0.1mm等距切割骨小梁面積對比,結果如圖6 所示。仿生松質骨與天然松質骨具有很高的相似度,其中仿生松質骨骨小梁外徑為 0.09mm。表1 為在x、y、z三維度做0.1mm 的等距切割對比數據。從表1 可見,松質骨樣本與仿生松質骨在x、y、z三個方向 0.1mm 的等距切割骨小梁面積分別為 0.500mm2vs 0.516mm2、0.507mm2vs 0.515mm2、0.497mm2vs 0.504mm2。統計分析顯示,二者無顯著性差異(P>0.05),表明本文構建的仿生松質骨與真實松質骨樣本模型在x、y、z三個方向 0.1mm 等距切割的骨小梁面積極其接近。
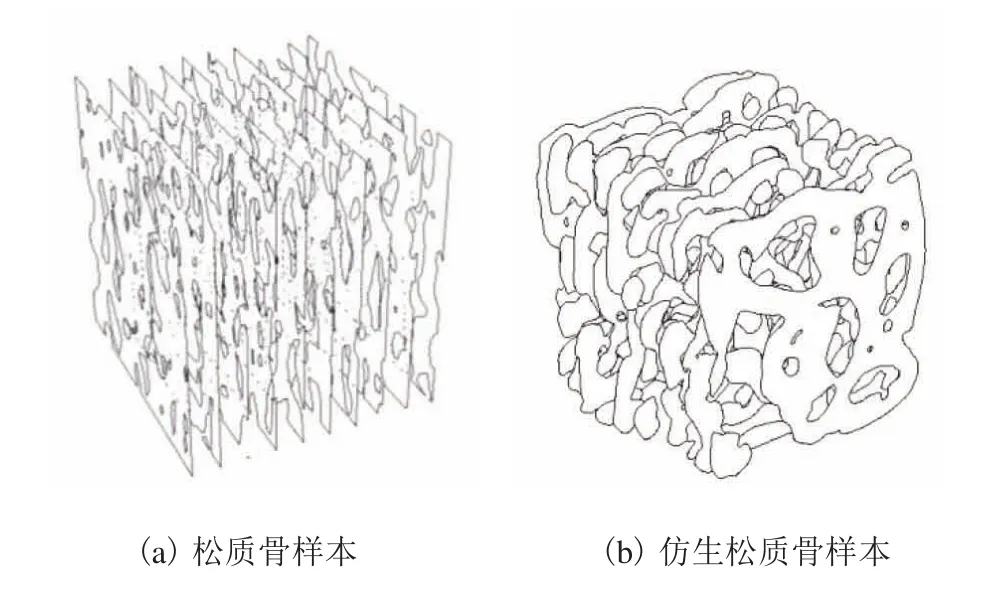
圖6 松質骨樣本等距切割對比Fig. 6 Comparison of cancellous bone sample
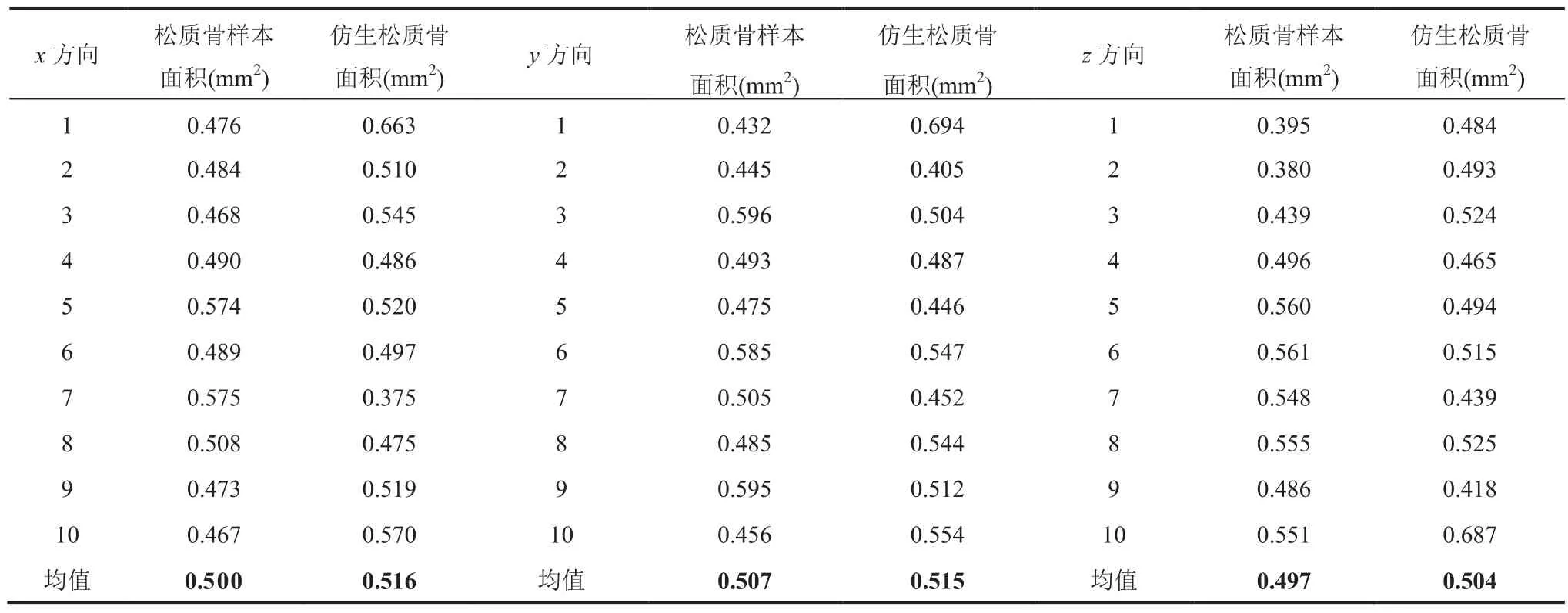
表1 松質骨樣本與仿生松質骨 x、y、z 方向 0.1mm 的等距切割骨小梁面積對比Table 1 Comparison of trabeculae area between cancellous bone samples and bionic cancellous bone in x, y, and z directions under 0.1mm equidistant cutting

表2 松質骨樣本與仿生松質骨 x、y、z 方向隨機不等距切割骨小梁面積對比Table 2 Comparison of trabeculae area between cancellous bone samples and bionic cancellous bone in x, y, and z directions under unequidistant cutting
其次,對松質骨樣本和仿生松質骨進行隨機不等距切割[21],結果如圖7所示。從橫截面(自上而下)截取m個斷層,得到斷層面積計算方法如公式(5)所示。表2 為松質骨樣本與仿生松質骨在x、y、z三維度隨機不等距切割骨小梁面積對比數據。從表2 可見,松質骨樣本與仿生松質骨在x、y、z三個方向0.1mm 的不等距切割骨小梁面積分別為 0.505mm2vs 0.543mm2、0.476mm2vs 0.534mm2、0.507mm2vs 0.491mm2。統計分析顯示,二者無顯著性差異(P>0.05),表明本文構建的仿生松質骨與真實松質骨樣本模型的x、y、z三個方向隨機不等距切割的骨小梁面積極其接近。

圖7 隨機不等距切割示意圖Fig. 7 Random unequidistant cutting
最后,對松質骨樣本和仿生松質骨進行相似性分析。
設計定量數據和定性數據的距離計算函數是常用的度量數據對象之間相似關系的方式。以下是根據解剖學的復雜程度更具針對性建立的相似性數學模型[22]。
為了計算松質骨樣本和仿生松質骨的相似度,構建特征矩陣打分比較:
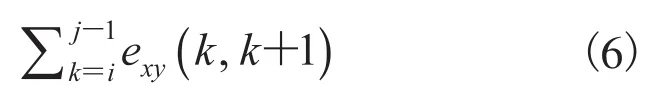
公式(6)表示(i,j)兩點之間的距離之和,構建曲線上兩點在x、y軸上歐氏距離與圖論距離之比。

公式(7)表示(i,j)兩點之間的距離之和,構建曲線上兩點在z軸上歐氏距離與圖論距離之比。
整體空間距離為:

如果兩個對比向量具有相似性,則其歐氏距離最小。三維向量參數(γ/N)可以比較相似性分析上的差異,N為空間點的數量,則不同曲線正則化參數的向量之間的歐氏距離為:

根據公式(6)~(9),可以構建松質骨樣本與仿生松質骨相似性數學模型,距離函數Da,b描述兩數據對象之間的關系。如果a和b越相似,則兩者距離Da,b的值越小。表3 為松質骨樣本與仿生松質骨在x、y、z方向歐氏距離相似性比較結果。從表3 可知,松質骨樣本與仿生松質骨在x、y、z方向歐氏距離Da,b為 0.007~0.058。統計分析顯示,二者無顯著性差異(P>0.05)。相似性分析表明,仿生松質骨結構與松質骨樣本的生理結構具有極高的相似度。
骨小梁仿生微結構的解析與構建方法通過容積逼近構建與天然松質骨骨小梁體積相等的仿生松質骨(也即是說仿生松質骨與天然松質骨具有同樣的孔隙率),并且仿生松質骨與天然松質骨結構達到很高的相似度(可達 95% 以上,見表1~3)。
3.2 3D 打印仿生松質骨
以羥基磷灰石(HA)為主要基質 3D 打印[23,24]尺寸為 20mm×10mm×10mm(長×寬×高)仿生松質骨,結果如圖8所示。實驗需要打印的骨小梁直徑為 0.4~0.9mm、孔徑為 300~500 μm,而艾科賽龍生物打印機 Nozzle 擠出材料的最小線徑為 0.02mm、精度為 0.05mm,完全滿足了打印仿生松質骨細微結構的要求。

表3 松質骨樣本與仿生松質骨 x、y、z 方向歐氏距離相似性比較Table 3 Comparison of Euclidean distance similarity between cancellous bone samples and bionic cancellous bone in x, y, and z directions

3.3 體外實驗
3.3.1 小鼠成骨細胞在仿生骨小梁結構中增殖變化
首先,選取處于對數生長期的小鼠成骨細胞(MC3T3-E1),選用 10% FBS (胎牛血清)+DMEM 培養基作為細胞培養液。將 100 μL 濃度為 8 000~10 000 個/孔的細胞懸液種植到仿生骨小梁結構中,置于 37℃、5% CO2溫箱中培養,每隔兩天更換培養液,同時設置空白對照組。其次,分別在培養時間的第 1、3、5 和 7天,吸去上清液,加入 20 μL MTT(噻唑藍)溶液(5 mg/mL,即 0.5% MTT)繼續培養 4 h 后吸掉上清,每孔加入 150 μL 二甲基亞砜,置搖床上低速振蕩 10 min,使結晶物充分溶解。最后,應用酶聯免疫檢測儀測量各孔 490 nm 吸光值,計算細胞增殖率。圖9 為小鼠成骨細胞在仿生骨小梁結構中的細胞分布。從圖9 可見,成骨細胞沿仿生松質骨的骨小梁結構分布且隨時間的增加而迅速增殖(見圖10)。

圖9 小鼠成骨細胞在仿生骨小梁結構中細胞分布Fig. 9 Cell distribution of MC3T3-E1 osteoblasts in bionic trabecular structure
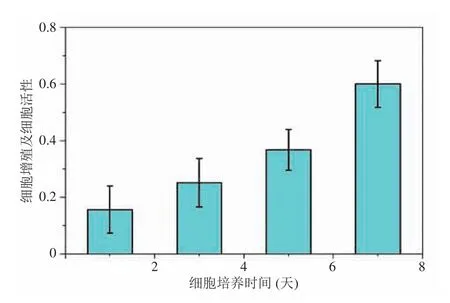
圖10 小鼠成骨細胞在仿生骨小梁結構中增殖變化Fig. 10 The proliferation of MC3T3-E1 osteoblasts in bionic trabecular structure
3.3.2 仿生骨小梁區域成骨細胞聚集效應及其再生微結構功能化驗證
用抗 iNOS 和抗 RANKL 抗體染色觀察[25]發現,促進骨形成的一氧化氮合酶陽性細胞在骨小梁結構區域大量出現,并高表達骨重建蛋白RANKL,結果如圖11 所示。把培養 4~6 周后的仿生骨小梁微結構支架切成 10mm 的片狀體,在電鏡下對三維微觀結構進行觀察(圖12)。通過Micro CT(精度 0.013 872mm,掃描層厚設定為0.625mm)掃描并構建三維模型觀察發現,小鼠成骨細胞逐漸形成骨小梁生理微結構和進一步功能化趨勢(圖13)。

圖11 骨小梁結構區域一氧化氮合酶陽性細胞聚集并高表達骨重建蛋白 RANKLFig. 11 Accumulation of nitric oxide synthase positive cells in bionic trabecular structure and high expression of bone remodeling protein RANKL

圖12 10mm 切片骨小梁結構電鏡圖像Fig. 12 10mm slice of trabecular structure with electron microscopy
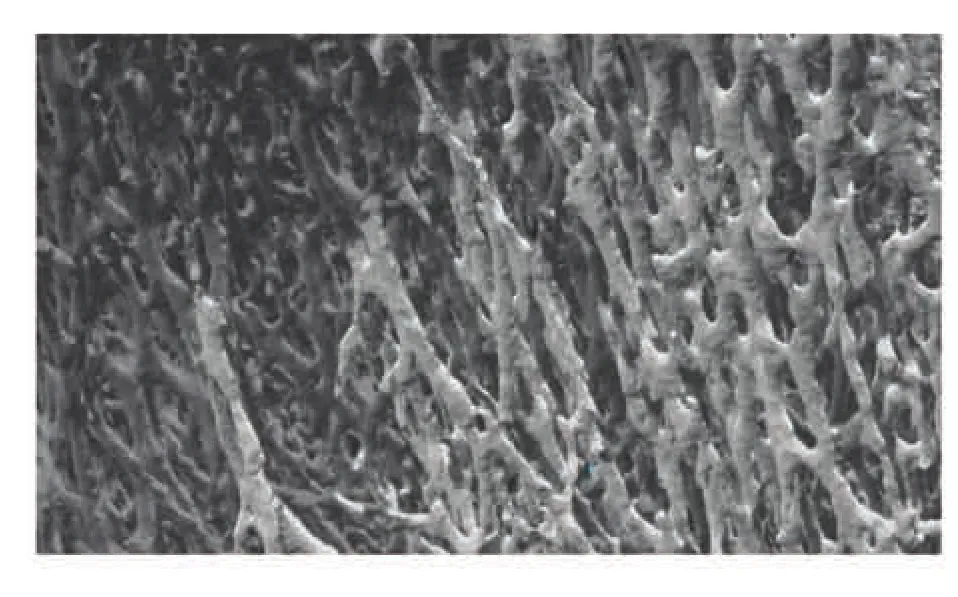
圖13 三維骨小梁微結構模型Fig. 13 3D trabecular microstructure model
4 討 論
本研究開發了一種新的骨小梁仿生微結構的解析與構建方法,成功地構建了兔仿生松質骨微結構,算法通過容積逼近空間邊際極限最終達到仿生松質骨與天然松質骨骨小梁體積相等,也即是說仿生松質骨與天然松質骨具有同樣的孔隙率,并且仿生松質骨與天然松質骨結構達到很高的相似度(可達 95% 以上)。傳統松質骨多孔支架的制備方法(如相分離法、溶媒擴散法、氣體發泡法等),隨機產生連結并不能為支架的組織長入提供最理想的滲透性,也不能為再生組織的力學性能提供最大程度優化的連結性[26]。3D 打印技術能夠精確地制備出外形符合要求的支架,雖然均勻孔隙率多孔支架能夠在整體孔隙率逼近真實樣本,但在骨小梁微結構的制造上與真實松質骨還有較大的差距[27,28]。Lui 等[29]介紹過使用傳統方法制備羥基磷灰石基多孔柱狀支架修復骨缺損,使用自體間充質干細胞培養和未使用間充質干細胞的組織學和形態統計分析表明,成骨數量存在顯著性差異(P<0.05),復合了自體干細胞的多孔支架也僅在表面與宿主骨骨膜區的骨痂結合形成了最大厚度為 3.14mm 外層圈。而本文復合成骨細胞成功培養了尺寸為 20mm×10mm×10mm 大小的 3D 打印仿生松質骨。最新的研究但并非本文提供的方法構建的細胞生長的拓撲結構,顯示了直徑為 700 nm,最遠柱間距為 5.6 μm的納米柱才有利于骨形成,但在空間寬度和間距為 1~10 μm,高度為 0.35~10 μm 的格柵上,脊髓間充質干細胞(hMSC)的伸長現象并不明顯且影響細胞增殖[30]。這類結構還達不到本文仿生骨小梁微結構的目的,遠不如真實的骨小梁的自然三維結構。本文所采用的骨小梁仿生微結構的解析與構建方法,能夠在最大程度上對松質骨骨小梁結構進行仿生建模,滿足真實松質骨的微結構和生物力學特性,在骨小梁仿生設計領域具有極大的優勢。
天然松質骨結構復雜,傳統骨骼缺損修復體大多采用均勻、規則的幾何體,只能滿足少部分松質骨的生物力學特性和生理微環境特征,與真實的松質骨微結構和生理功能還有很大的差距,甚至會造成死腔。本研究通過對天然松質骨結構的解析與構建,還原出結構高度相似的仿生松質骨,雖然仿生松質骨與天然松質骨還是有差距,但通過生物活性的自身調節和修復,最終可以達到天然松質骨的性狀。另外,骨小梁仿生微結構的解析與構建方法可以擴展到大尺寸松質骨的人工制造,通對大體積松質骨分布情況分析和量化,最終完成大尺寸的仿生松質骨的構建。
5 結 論
研究通過生物 3D 打印制備仿生松質骨微結構,并進行體外細胞培養實驗證明,骨小梁仿生微結構的解析與構建方法可以構建與實體松質骨相似的仿生松質骨骨小梁微結構和細胞生長微環境。本研究開發的骨小梁仿生微結構的解析與構建方法,結合 3D 打印技術,可應用于人體骨缺損修復與功能重建,為植入物的骨小梁結構設計提供了思路和理論依據,為 3D 打印技術在醫學研究、臨床研究、臨床應用提供了更真實的生理結構,為人體組織工程在微結構和微環境的研究及應用方面提供了路徑參考和理論依據。
[1]Greenwood C, Clement JG, Dicken AJ, et al. The micro-architecture of human cancellous bone from fracture neck of femur patients in relation to the structural integrity and fracture toughness of the tissue [J]. Bone Reports, 2015, 3(C): 67-75.
[2]Wolff J. The Law of Bone Remodeling [M]. New York: Springer-Verlag, 1986.
[3]Agarwal T, Kabiraj P, Narayana GH, et al. Alginate bead based hexagonal close packed 3D implant for bone tissue engineering [J]. ACS Applied Materials& Interfaces, 2016, 8(47): 32132-32145.
[4]Lai YH, Cao HJ, Wang XL, et al. Porous composite scaffold incorporating osteogenic phytomolecule icariin for promoting skeletal regeneration in challenging osteonecrotic bone in rabbits [J].Biomaterials, 2018, 153: 1-13.
[5]Laurent J, Blin G, Chatelain F, et al. Convergence of microengineering and cellular self-organization towards functional tissue manufacturing [J]. Nature Biomedical Engineering, 2017: 933-956.
[6]Zhu XH, He G, Gao BZ. The application of topology optimization on the quantitative description of the external shape of bone structure[J]. Journal of Biomechanics, 2005, 38(8): 1612-1620.
[7]Thomsen JS, Laib A, Koller B, et al. Stereological measures of trabecular bone structure: comparison of 3D micro computed tomography with 2D histological sections in human proximal tibial bone biopsies [J]. Journal of Microscopy, 2005, 218(Part 2): 171-179.
[8]Yao XF, Wang P, Dai RC, et al. Microstructures and properties of cancellous bone of avascular necrosis of femoral heads [J]. Acta Mechanica Sinica, 2010,26(1): 13-19.
[9]Jiang Y, Zhao J, White DL, et al. Micro CT and micro MR imaging of 3D architecture of animal skeleton [J]. Journal of Musculoskeletal & Neuronal Interactions, 2000, 1(1): 45-51.
[10]Thomsen JS , Jensen MV, Niklassen AS, et al. Agerelated changes in vertebral and iliac crest 3D bone microstructure-differences and similarities [J].Osteoporosis International, 2014, 26(1): 219-228.
[11]Boland ED, Pawlowski KJ, Barnes CP, et al.Electrospinning of bioresorbable polymers for tissue engineering scaffolds [J]. Polymeric Nanofibers,2006, 918: 188-204.
[12]Xu P, Xie R, Liu Y, et al. Bioinspired microfibers with embedded perfusable helical channels [J].Advanced Materials, 2017, 29(34): 1701664.
[13]Gómez S, Vlad MD, López J, et al. Design and properties of 3D scaffolds for bone tissue engineering [J]. Acta Biomaterialia, 2016, 42: 341-350.
[14]Pedde RD, Mirani B, Navaei A, et al. Emerging biofabrication strategies for engineering complex tissue constructs [J]. Advanced Materials, 2017,29(19): 1606061.
[15]Yeni YN, Zinno MJ, Yerramshetty JS, et al.Variability of trabecular microstructure is age-,gender-, race and anatomic site-dependent and affects stiffness and stress distribution properties of human vertebral cancellous bone [J]. Bone, 2011,49(4): 886-894.
[16]Rossi M, Casali F, Romani D, et al. 3D micro-CT analysis of cancellous bone architecture [C]// SPIE Proceedings, 2002: 9.
[17]Sun M, Star-Lack JM. Improved scatter correction using adaptive scatter kernel superposition [J].Physics in Medicine and Biology, 2010, 55(22):6695-6720.
[18]Schneide R, Hindenlang U, Copf P. Dynamic fi nite element analysis of cancellous bone micro structure[C]// Computational Science and High Performance Computing IV, 2011: 339-347.
[19]Boyle C, Kim IY. Three-dimensional micro-level computational study of Wolff’s law via trabecular bone remodeling in the human proximal femur using design space topology optimization [J].Journal of Biomechanics, 2010, 44 (5): 935-942.
[20]Kucukkoc I, Zhang DZ. Mathematical model and agent based solution approach for the simultaneous balance and sequencing of mixed model parallel two-sided assembly lines [J]. International Journal of Production Economics, 2014, 158 (12): 314-333.
[21]Danz JC, Habegger M, Bosshardt DD, et al. Virtual tissue alignment and cutting plane de fi nition : a new method to obtain optimal longitudinal histological sections [J]. Journal of Anatomy, 2014, 224(2): 85-94.
[22]Bai X, Luo S. Combining bag of words model and information theoretic method for image clustering[C]// Lecture Notes in Electrical Engineering,2010: 423-430.
[23]Forget A, Blaeser A, Miessmer F, et al.Mechanically tunable bioink for 3D bioprinting of human cells [J]. Advanced Healthcare Materials,2017, 6(20): 1700255.
[24]Blaeser A, Duarte Campos DF, Puster U, et al.Controlling shear stress in 3D bioprinting is a key factor to balance printing resolution and stem cell integrity [J]. Advanced Healthcare Materials, 2016,5(3): 326-333.
[25]Huang R, Wang X, Zhou YH, et al. RANKL-induced M1 macrophages are involved in bone formation [J]. Bone Research, 2017, 5: 17019.
[26]Bruder SP, Kraus KH, Goldberg VM, et al.The effect of implants loaded with autologous mesenchymal stem cells on the healing of canine segmental bone defects [J]. The Journal of Bone and Joint Surgery, 1998, 80(7): 985-996.
[27]Seitz H, Rieder W, Irsen S, et al. Three-dimens ional printing of porousceramic scaffolds for bone tissue engineering [J]. Journal of Biomedical Materials Research Part B: Applied Biomaterials,2005, 74(2): 782-788.
[28]Freed LE, Engelmayr G, Borenstein JT, et al.Advanced materials strategies for tissue engineering scaffolds [J]. Advanced Materials, 2009, 21(32-33):3410-3418.
[29]Lui H, Vaquette C, Bindra R. Tissue engineering in hand surgery: a technology update [J]. The Journal of Hand Surgery, 2017, 42(9): 727-735.
[30]Wong ST, Teo SK, Park S, et al. Anisotropic rigidity sensing on grating topography directs human mesenchymal stem cell elongation [J]. Biomech Model Mechanobiol, 2014, 13(1): 27-39.

