盆栽菊花的莖尖組織培養快繁技術
李曉亮, 張軍云, 張 鐘, 段永華, 張建康, 王文智, 楊光炤, 錢遵姚, 張翠萍
(玉溪市農業科學院,云南玉溪 653100)
菊花[Dendranthemamorifolium(Ramat.)Tzvel.]為菊科多年生宿根草本植物,是我國的傳統名花,也是世界四大切花之一,是一種被廣泛栽培的重要花卉[1-3]。菊花目前主要用于園林的綠化和觀賞,如制作花束、花環、觀賞盆花、秋季花壇、花臺、盆花群等,深受人們喜愛[3-4]。菊花傳統的繁殖方法主要是扦插和嫁接,但存在很多缺點:需較多母株材料、植株病毒逐代積累加重、品質退化、繁殖速度不快、易受季節變化和外界環境條件的影響、病蟲害發生頻率高等[5-8],為解決這些問題,目前最有效的技術措施之一是菊花的莖尖組織培養快繁技術[2,4-6,9]。
我國的菊花組織培養技術研究始于20世紀80年代[10],截至目前的研究主要集中于菊花的花瓣[11-13]、花蕾[2,14]、葉片[15-16]、莖段[6,17]的組織培養,而有關菊花莖尖組織培養技術的研究報道較少[7,9,18],且這些報道的研究內容簡單,僅主要涉及激素與菊花增殖量、生根量的關系,更是幾乎沒有涉及種苗綜合素質。因此,建立完善的菊花莖尖組織培養快繁技術體系,對菊花脫毒復壯、工廠化快繁育苗、種質資源保存等,進而更好地促進菊花的生產發展,具有重要意義。
為此,以盆栽菊花香草水晶的莖尖為材料,研究HgCl2濃度及其滅菌時間、基礎培養基、6-BA等9種主要因素對菊花莖尖組織培養快繁的影響,分析培養基與種苗綜合素質的關系并據此篩選出適合的培養基,旨在建立一套完善的且能育出優良綜合素質種苗的盆栽菊花莖尖組織培養快繁技術體系,為菊花脫毒復壯、工廠化快繁育苗、種質資源保存等提供重要的技術支撐。
1 材料與方法
1.1 試驗時間及地點
試驗于2017年1—7月在玉溪市農業科學院研和基地的組培室實施。
1.2 試驗材料
采用盆栽菊花香草水晶的莖尖作為外植體,于玉溪紫玉花卉產業有限公司的盆栽菊花母本園里采集帶莖尖長3~5 cm 的菊花莖段。
1.3 培養條件
培養基以MS或1/2 MS或1/4 MS為基礎培養基,均含瓊脂(強度為1 200 g/cm2)5.2 g/L、白砂糖30 g/L(增殖試驗除外),附加不同的植物生長調節劑。培養基pH值為 5.4~5.6,并用121 ℃高壓蒸汽滅菌25 min。培養室溫度為(25±2) ℃,相對濕度為35%~40%,光照度約為2 500 lx,光照時間為12 h/d。
1.4 試驗方法
1.4.1 外植體的滅菌 剪取莖段的頂芽,用自來水流水沖洗1 min,再用洗潔精的水溶液浸泡2 min,在超凈工作臺上用70%乙醇浸泡30 s后滅菌外植體,設置8個處理:處理1(0.15% HgCl2滅菌2 min)、處理2(0.15% HgCl2滅菌 3 min)、處理3(0.15% HgCl2滅菌4 min)、處理4(0.15% HgCl2滅菌5 min)、處理5(0.20% HgCl2滅菌2 min)、處理6(0.20% HgCl2滅菌3 min)、處理7(0.20% HgCl2滅菌 4 min)、處理8(0.20% HgCl2滅菌5 min)。每個處理滅菌10個菊花莖尖,重復3次,滅菌后的莖尖用無菌水浸泡2 min,切取莖尖生長點(約1.0 mm),接種生長點入MS+6-芐氨基腺嘌呤(6-BA)0.8 mg/L+萘乙酸(NAA)0.01 mg/L中(莖尖生長點數為1個/瓶)培養15 d,記錄莖尖的細菌污染和存活,統計莖尖的細菌污染率和死亡率,計算公式:細菌污染率=細菌污染的莖尖個數/接種的莖尖總數×100%;死亡率=死亡的莖尖個數/接種的莖尖總數×100%。
1.4.2 初代培養 設置2種處理的培養基:處理1(MS+6-BA 0.4 mg/L+NAA 0.01 mg/L)、處理2(MS+6-BA 0.8 mg/L+NAA 0.01 mg/L)。將滅菌后無污染的莖尖生長點接種于2種培養基中初代培養30 d。
1.4.3 增殖培養 設計L9(34)正交試驗(表1),每個處理10瓶,每瓶接種5個含雙腋芽的無菌莖段,增殖培養35 d后調查各處理的植物形態類型、成株(芽)率、株(叢芽)高、節間距、莖粗、增殖系數。調查方法:當接種的莖段分化長成植株或芽時,則認為該莖段已成株(芽),將成株(芽)數記錄為1;調查增殖系數時,若母瓶內為芽(叢芽)時,將2個單芽等同于1個雙腋芽的莖段;當調查株(叢芽)高、節間距、莖粗、增殖系數時,均分別在各自所有樣本中隨機取樣調查10個樣本,若樣本量不足10個,則以實際樣本調查;統計成株(芽)率和增殖系數,計算公式:成株(芽)率=[成株(芽)數/接種莖段數]×100%;增殖系數=新莖段(芽)數/接種莖段數。
1.4.4 生根培養 采用正交試驗+對比試驗+附加試驗的方法開展菊花生根試驗,其中正交試驗為L9(34) 設計,對比試驗為正交試驗的每個處理均添加0.1%的活性炭(AC),附加試驗為植物組織培養中一些經驗性或常用的生根培養基,共24種處理的培養基(表2),每個處理9瓶,每瓶接種5個無菌莖段,生根培養35 d后調查各處理的成株率、植株的根發生部位、生長勢、生根率、株高、莖粗、葉片數、生根數、根長、根粗。調查方法:當接種的莖段分化成植株時,則認為該莖段已成株,將成株數記錄為1;當調查株高、莖粗、葉片數、生根數、根長、根粗時,均分別在各自所有樣本中隨機取樣調查10個樣本,若樣本量不足10個,則以實際樣本數調查為準;統計成株率和生根率,計算公式:成株率=[成株數/接種莖段數]×100%;生根率=生根的植株數/成株數×100%。

表1 盆栽菊花香草水晶增殖培養正交試驗L9(34)設計
1.5 統計分析
采用Excel 2003和SPSS 16.0處理和分析數據,用SNK檢驗顯著性。
2 結果與分析
2.1 外植體滅菌
處理間的菊花莖尖滅菌效果差異顯著(P<0.05)(表3)。同一HgCl2濃度下,增加滅菌時間,莖尖的細菌污染率降低,死亡率增加。綜合分析處理間的細菌污染率和死亡率,菊花莖尖最佳的滅菌方法是0.20% HgCl2滅菌4~5 min,此處理下的莖尖細菌污染率較低(P<0.05),死亡率也不算高(<30%),滅菌非常徹底。
2.2 初代培養
菊花莖尖生長點接種于培養基(圖1-A)上培養,5 d后莖尖的生長點萌動,伸長,基部膨大。培養15 d時,誘導莖尖生長點分化成高約1.0 cm的頂芽,芽體形態正常(圖1-B),培養30 d時,分化成高約2.0 cm、含6~8個單芽組成的叢生芽(包括不定芽),單芽的芽體形態結構良好、健壯、無玻璃化、無黃化(圖1-C)。
菊花莖尖在2種初代培養基中的培養效果無明顯差異,均表現為芽體的形態結構良好、生長勢健壯(圖1)。因此,菊花莖尖的適宜初代培養基為MS+6-BA 0.4~0.8 mg/L+NAA 0.01 mg/L。
2.3 增殖繼代培養
菊花莖段接種(圖2-A)培養后,處理間菊花莖段的發育和增殖分化差異明顯,出現了3種植物形態類型:叢生芽(圖2-B~圖2C)、植株(圖2-D~圖2-H)、愈傷組織(圖2-I、圖2-J)。其中,處理1~7的植物形態(圖2-B~圖2-H)生長勢較好,呈(深)綠色、無玻璃化、無黃化、健壯。
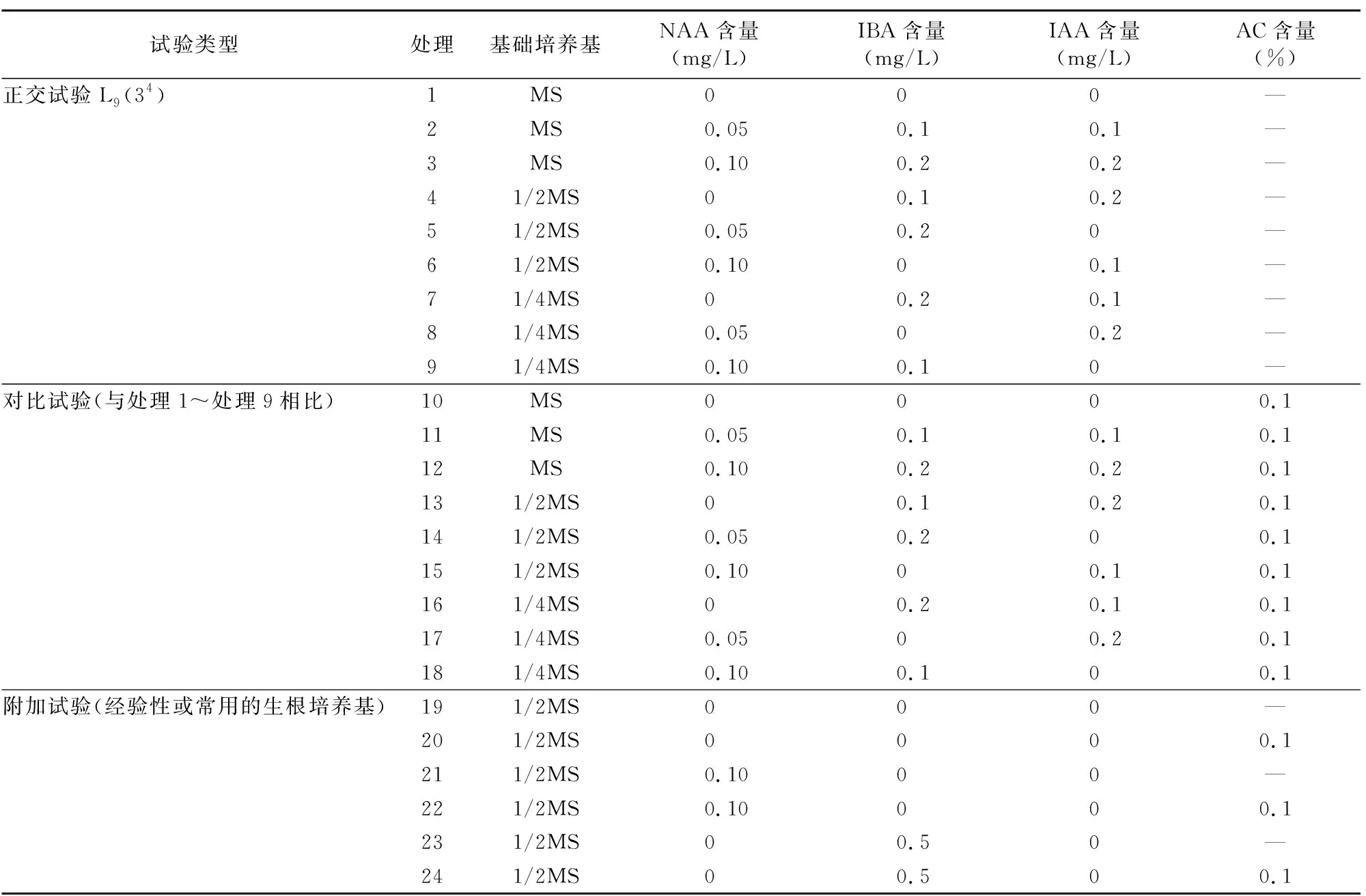
表2 盆栽菊花香草水晶生根培養試驗設計

表3 盆栽菊花香草水晶外植體滅菌效果
處理間菊花莖段生長量和增殖量的差異明顯(表4):較低的成株(芽)率是處理7、8、9,分別為48.00%、0、0,其余處理(處理1~處理6)的成株(芽)率變化范圍為80.00%~92.00%;處理間的株(叢芽)高范圍為1.63~3.40 cm;處理間節間距(范圍為0.18~0.31 cm)和莖粗(范圍為0.87~0.98 mm)的差異均不顯著(P>0.05);處理1、2的增殖系數(分別為17.95、12.30)均顯著大于其他處理(范圍為4.90~7.10)(P<0.05)。
表1、圖2、表4顯示,處理1~處理6(基礎培養基為MS或1/2MS、6-BA含量為0.5~2.0 mg/L、NAA含量為0.01~0.10 mg/L、白砂糖含量為20~30 g/L)具有較高的成株(芽)率和增殖系數(4.90~17.95),其中處理1的增值系數最大,且處理1~處理6均具有較好生長勢的植物形態。因此,菊花增殖繼代的適宜培養基是MS(或1/2MS)+6-BA 0.5~2.0 mg/L+NAA 0.01~0.10 mg/L+白砂糖20~30 g/L,最佳培養基是MS+6-BA 0.5 mg/L+NAA 0.01 mg/L+白砂糖20 g/L。
2.4 生根培養
處理間成株率差異明顯,變化范圍為20.00%~95.56%;處理間的生根率(范圍為86.67%~100.00%)差異較小,生根率>90.00%的處理占83.33%,其中處理1、10、24成株率和生根率均>90%;處理間的株高范圍為1.58~4.84 cm,莖粗范圍為0.75~1.19 mm,葉片數范圍為6.70~13.90張,生根數范圍為2.50~8.20條,根長范圍為1.64~5.94 cm,根粗范圍為 0.13~0.46 mm(表5)。說明菊花比較容易生根,但處理間的菊花植株生長量和生根量的差異卻較大。
處理間菊花的根發生和植株生長勢的差異明顯(表6)。菊花主要從基部(無愈傷組織)或(和)基部愈傷組織的部位處生根,植株生長勢有較好、一般、較差。根系發生和植株生長勢均較好的特征是根從基部(無愈傷組織)發出,植株健壯、深綠、筆直、整齊、無玻璃化、無黃化,如處理10、24(表6、圖3)。
綜合分析成株率、生根率、根發生和植株生長勢等,菊花生根的最佳培養基是處理10(MS+AC 0.1%)、處理24(1/2MS+IBA 0.5mg/L+AC 0.1%),其生根培養效果較好(圖3)。
不同因素及其不同水平對菊花生根培養中的成株率、生根率、株高、莖粗影響差異明顯(表2、表7)。當基礎培養基為MS或1/2MS、NAA含量為0~0.05 mg/L、IBA含量為0~0.2 mg/L、IAA含量為0~0.1 mg/L時,菊花的成株率、生根率、株高、莖粗總體上均具有較大的水平均值(表2、表7)。



表4 不同處理對盆栽菊花香草水晶增殖培養中莖段生長量和增殖量的影響
因此,菊花適宜生根培養基為MS(或1/2MS)+NAA 0~0.05 mg/L+IBA 0~0.2 mg/L+IAA 0~0.1 mg/L+AC 0.1%,試驗篩選出的處理10屬于此范圍。
3 討論與結論
在有關菊花莖尖組織培養快繁技術的報道中:莖尖的滅菌方法是0.1% HgCl2(無或添加吐溫)滅菌1.5~8.0 min,適宜的初代培養基是MS+6-BA 1.0~2.0 mg/L+NAA 0.01~0.1 mg/L(或IAA 1.0 mg/L),適宜的增殖繼代培養基是 MS+6-BA 1.0~5.0 mg/L+NAA 0.01~0.5 mg/L(或IAA 0.8 mg/L),適宜的生根培養基是1/2MS+NAA 0.1~0.2 mg/L(或IAA 1.0mg/L)[5,7,9,18]。這些報道與本研究主要區別于:(1)正交設計是植物組織培養試驗研究中一種重要的、常用的方法[19],其應用于菊花組織培養試驗研究中的報道較少[20-21],本研究進一步采用正交、對比、附加等試驗研究方法,比較系統、全面、科學、準確地揭示出盆栽菊花莖尖組織培養快繁的規律。(2)本研究基于成株(芽)率、株(叢芽)高、節間距、莖粗、增殖系數、植物形態、生根率、葉片數、生根數、根長、根粗、根發生的部位、植株生長勢等13個指標構成種苗的綜合素質來試驗分析培養基與種苗綜合素質的關系,據此篩選出能育出優良綜合素質菊花種苗的適合或最佳培養基,而已有的報道幾乎沒有涉及種苗綜合素質。(3)本研究確定了HgCl2濃度及其滅菌時間與莖尖滅菌效果的定量關系(表3),篩選出滅菌效果最佳的滅菌方法,而已有的報道卻沒有具體的滅菌效果。(4)本研究的初代培養是基于器官發生途經(芽誘導),而已有的報道大多為愈傷組織發生途經。(5)本研究篩選的增殖繼代培養的6-BA(0.5~2.0 mg/L)和NAA(0.01~0.10 mg/L)較已有的報道(分別為1.0~5.0、0.01~0.5 mg/L)偏低,這主要是由本研究基于莖段增殖和種苗綜合素質來篩選培養基的,而已有的報道大多是先增殖擴繁愈傷組織,分化出芽后再進行芽的增殖。已有報道中的增殖階段的基礎培養基為MS,本研究提出1/2MS也可以用作增殖階段的基礎培養基。有研究表明,當增殖階段的基礎培養基由MS變為1/2MS時,會影響植物形態的發育分化,如生長勢變弱,淺綠或黃化或偏黃等[22-23],而本研究菊花的植物形態在同類情況下(由MS變為1/2MS)的增殖分化未受到明顯影響(表1、圖2),說明菊花比較容易分化,其增殖分化階段的正常生長發育對營養物質需求量的范圍較寬。(6)已有報道中的生根培養基(對應本研究的生根培養試驗處理21)雖能使菊花生根和生長,但菊花根系的基部附有中度愈傷組織(表2、表6),本研究從24個處理中篩選出了生根培養效果更佳的培養基:植株根系基部無愈傷組織,生長健壯、深綠、筆直、整齊、無玻璃化、無黃化(表6、圖3)。當生根階段的基礎培養基由MS變為1/2MS、1/4MS時,菊花植株的生長勢會隨之遞減變弱(表2、表6),這與其他作物生根培養上的同類表現情況相似[22],說明基礎培養基對盆栽菊花的生根培養影響較大。本研究表明活性炭總體可以減少生根培養植株基部的愈傷組織,促進盆栽菊花的生根和生長,如處理23和24(表2、表6),這與其他作物生根培養上所述的觀點[23-24]相一致,說明活性炭是盆栽菊花生根培養基的必需成分。筆者研究提出了盆栽菊花生根適合培養基的選取范圍,為其他類型菊花(切花型菊花、造型菊花等)生根培養基的篩選提供重要參考。
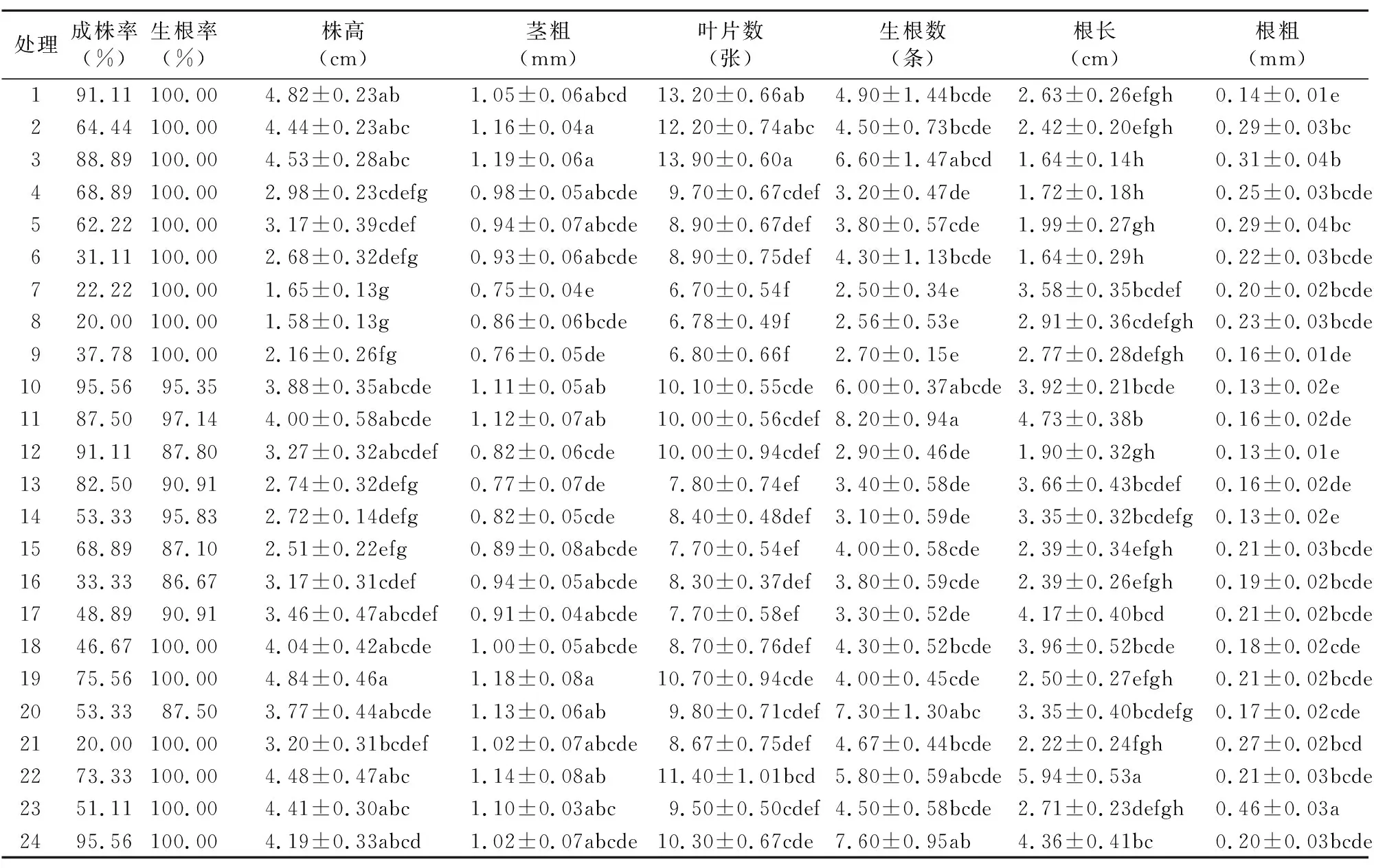
表5 不同處理對盆栽菊花香草水晶生根培養中植株的生長量和生根量的影響
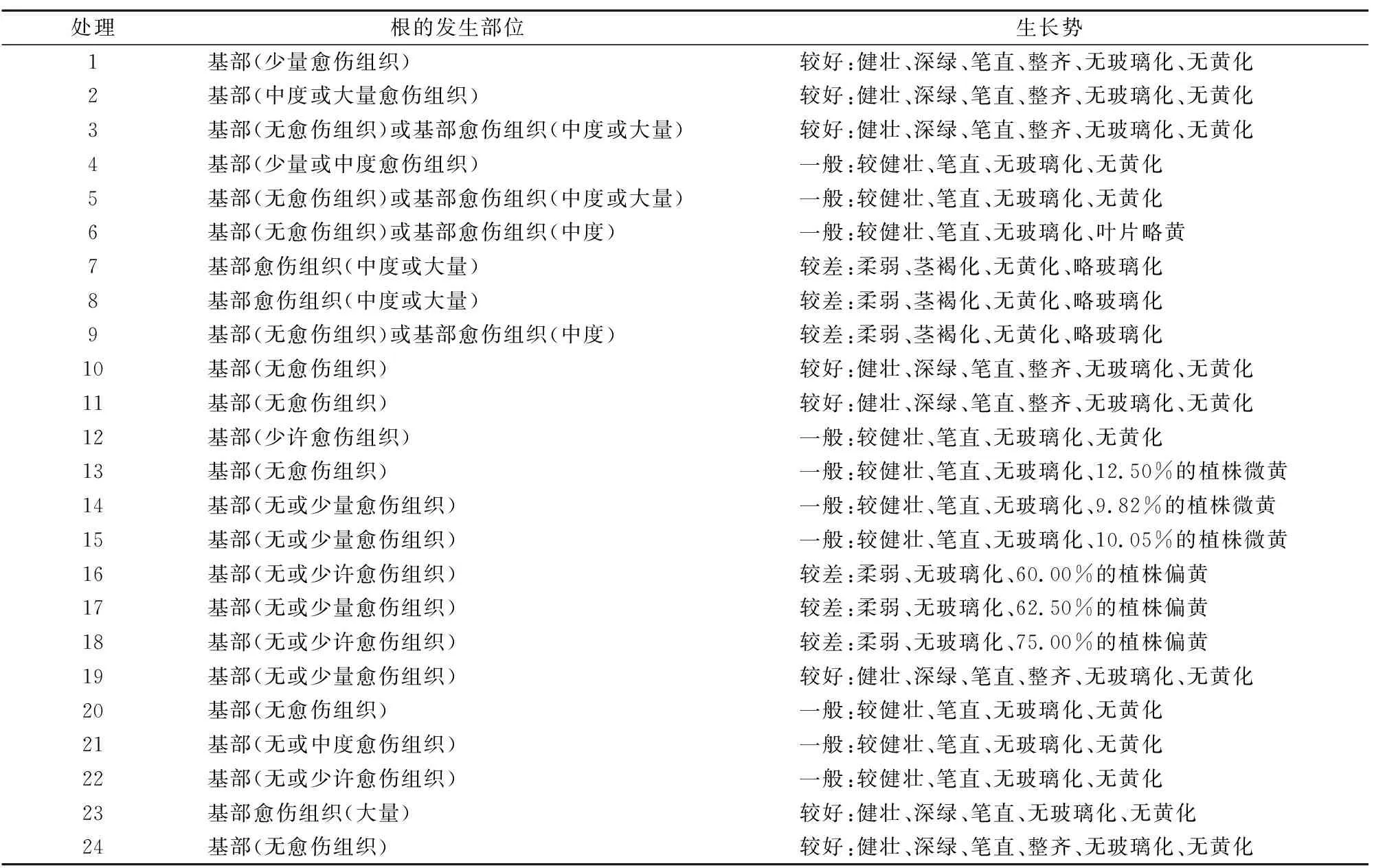
表6 不同處理對盆栽菊花香草水晶生根培養中植株的根發生和生長勢的影響

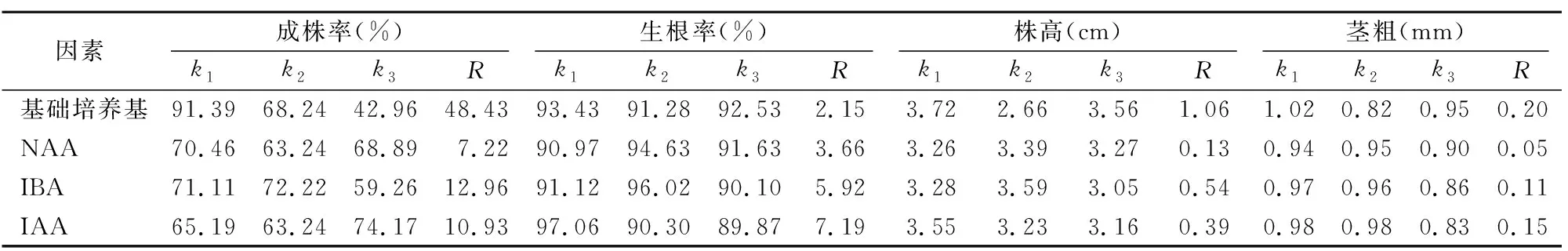
表7 不同因素對盆栽菊花香草水晶生根培養中4個主要指標的極差分析

