鱘魚腸道微生物多樣性的研究
李小義, 張效平, 趙 鳳, 孔 杰, 趙 飛, 周 洲, 王艷艷
(貴州省農業科學院水產研究所,貴州貴陽 550025)
腸道微生物是人體及動物腸道的正常組成部分,對宿主的營養和健康有重要影響。研究表明,腸道微生物可參與宿主的營養物質消化吸收、能量代謝、過敏、自身免疫疾病等多方面調節過程[1-3],對宿主的年齡亦有指示作用[4]。近年來,腸道微生物與水產動物的聯系受到了越來越多的關注。Kan等將金魚暴露在0~100 μg/L的五氯苯酚中,對金魚腸道微生物變化進行了分析,結果表明,擬桿菌屬豐度與五氯苯酚濃度呈正相關,擬桿菌門、擬桿菌屬及厚壁菌門/擬桿菌門之比對金魚在五氯苯酚環境中的體質量和肝質量均有重要影響[5]。Rolig等對斑馬魚腸神經系統進行缺失突變處理,結果發現腸道發炎個體中促炎性細菌菌群較多,而在同樣做缺失突變的腸道正常個體中具有抗炎作用的細菌菌群較多,研究表明腸道微生物對斑馬魚腸道健康具有重要作用[6]。此外,動物體腸道始終處于動態變化,攝食方式和腸道微生物種類、數量及占例均有影響,動物體內腸道菌群結構合理有助于加快宿主的生長和改善肉質[7]。唐楊等在凡納濱對蝦飼料中添加蠟樣芽孢桿菌,試驗組凡納濱對蝦生長速度比空白組平均快15.2%,且試驗組中菌群豐度變化明顯,相對不添加蠟樣芽孢桿菌的對照組,試驗組中變形菌門豐度有所下降,而擬桿菌門豐度有所增加[8]。
鱘魚為高蛋白、多脂肪性魚類,是世界上優良的淡水魚品種,也是現存于世界上最珍奇古老的冷水性生物魚群之一,有“活化石”之稱,其肉厚骨軟,同時鱘魚卵可以加工成鱘魚子醬,具有“黑色黃金”之稱。魚體含有人體必需的多種氨基酸,具有很高的經濟價值和藥用價值。本研究對10月齡鱘魚苗腸道微生物多樣性進行了初步分析,獲得對鱘魚健康有利的微生物菌群信息,對益生菌在鱘魚類飼料添加劑中的應用及減少抗生素使用具有重要意義。
1 材料與方法
1.1 材料
2016年5月,從貴州省水產研究所惠水試驗基地采集10月齡鱘魚苗數條、養殖水體3 L(標記為S)及飼料20 g(標記為SL)。迅速帶回實驗室,不投餌暫養3 d。
1.2 試劑與儀器
DNA Marker、細菌DNA提取純化等試劑,購自上海生工生物工程股份有限;Gel-Doc2000凝膠成像分析儀,購自 BIO-RAD公司;電泳儀,購自北京市六一儀器廠。
1.3 鱘魚腸道采集
待鱘魚腸糞便排空后,在超凈臺中對鱘魚進行解剖取樣。用75%乙醇對鱘魚體表消毒后用解剖剪沿肛門朝前對鱘魚進行解剖。清理出腸道,75%乙醇擦拭消化道外壁,無菌PBS緩沖液沖洗,5 mL滅菌離心管分別收集前、中、后腸并作標記,Q4、Q5為前腸樣品,Z4、Z5為中腸樣品,H4、H5為后腸樣品。
1.4 腸道微生物DNA提取
對解剖取得的鱘魚腸道樣品,使用天根試劑盒提取DNA,具體方法見試劑盒說明書。用1.5%瓊脂糖凝膠對提取獲得的DNA樣品質量進行檢測,并將合格樣品干冰保存寄送北京諾禾致源生物信息科技有限公司進行測序分析。
1.5 16S rDNA文庫構建及多樣性分析
利用16S V4區引物(515F:5′-GTGCCAGCMGCCGCGG TAA-3′和806R:5′-GGACTACHVGGGTWTCTAAT-3′)對腸道微生物DNA進行擴增。采用Illumina Hiseq平臺對擴增獲得的測序結果進行分析。截去Barcode和引物序列后使用FLASH對每個樣品的reads進行拼接,后去除嵌合體序列,得到最終有效數據。利用Uparse軟件(Uparse v7.0.1001)對所有樣品全部有效數據進行聚類,默認以97%的一致性將序列聚類成為OTU。對OTUs代表序列進行物種注釋,用Mothur方法與SILVA的SSUrRNA數據庫進行物種注釋分析(設定閾值為0.8~1.0),獲得分類學信息并分別在各分類水平:kingdom(界)、phylum(門)、class(綱)、order(目)、family(科)、genus(屬)、species(種)統計各樣本的群落組成。使用PyNAST軟件(Version 1.2)與GreenGene數據庫中的“Core Set”數據信息進行快速多序列比對,得到所有OTUs代表序列的系統關系。最后以樣品數據量最少的為標準對各樣品數據進行均一化處理。使用Qiime軟件(Version 1.7.0)計算Observed-species、Shannon指數、Goods-coverage、Unifrac距離及構建UPGMA樣品聚類樹,使用R軟件(Version 2.15.3)繪制稀釋曲線,Rank abundance曲線,物種累積曲線,進行Alpha多樣性指數組間差異分析并繪制PCA、PCoA、NMDS圖。
2 結果
2.1 細菌16S rRNA基因測序結果分析
以序列相似性97%一致性(identity)的原則將序列聚類成為1個OTU(operational taxonomic unit)。鱘魚腸道微生物樣品共獲得8 239個OUT,其中Q4、Q5樣品分別含有 1 432、1 771個OUTs,Z4、Z5樣品分別含有1 702、1 064個OUTs,H4、H5樣品分別包含165、847個OUTs(表1)。從養殖水體S樣品和飼料SL樣品中分別獲得861、602個OUTs。覆蓋率(good’s coverage)是測序獲得的序列占整個基因組的比例,用以評估抽樣完整性。本研究中所有樣品的覆蓋率為97.7%~99.7%,表明本次檢測結果具有較好的覆蓋性。通過單樣本的多樣性分析(Alpha多樣性)可以反映樣品內的微生物群落的豐富度和多樣性,Shannon是用來估算樣品中微生物多樣性指數之一,其值越大表明群落多樣性越高,本研究中鱘魚腸道前腸樣品Shannon指數最高,表明鱘魚前腸細菌多樣性豐富,后腸樣品Shannon指數最低,為0.365。結果表明,養殖水體中細菌多樣性較飼料高,而鱘魚腸道細菌微生物多樣性表現為:前腸>中腸>后腸(表1)。稀釋曲線是從樣品中隨機抽取一定測序量的數據,統計它們所代表物種數目(即OTUs數目),以抽取的測序數據量與對應的物種數來構建曲線。稀釋曲線可直接反映測序數據量的合理性,并間接反映樣品中物種的豐富程度,本研究各樣品稀釋曲線較為平緩(圖1),說明測序數據量逐漸趨于合理。
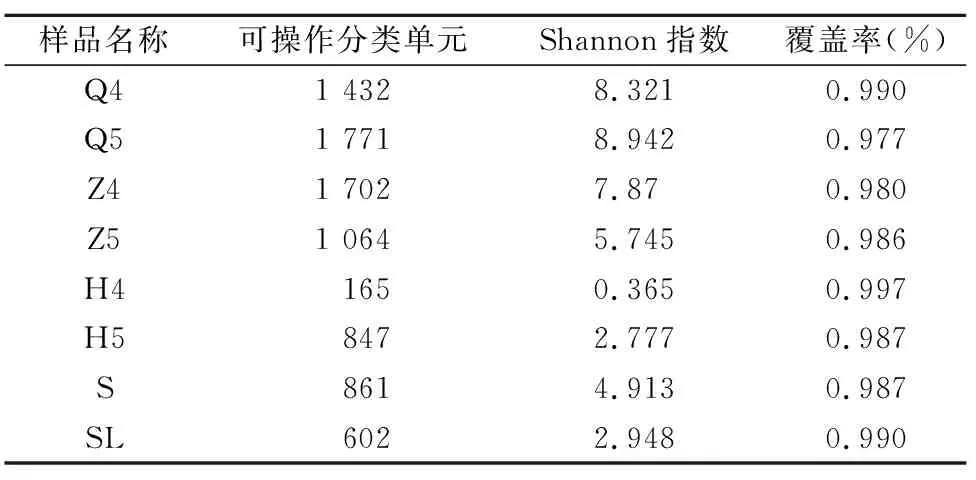
表1 基于16S rRNA基因序列的細菌多樣性指數
2.2 細菌多樣性分析
根據物種注釋結果在門水平對物種相對豐度進行統計分析,由圖2可知,其中相對豐度排前10的物種包括變形菌門(Proteobacteria)、藍細菌門(Cyanobacteria)、梭桿菌門(Fusobacteria)、放線菌門(Actinobacteria)、擬桿菌門(Bacteroidetes)、厚壁菌門(Firmicutes)、綠彎菌門(Chloroflexi)、酸桿菌門(Acidobacteria)、芽單胞菌門(Gemmatimonadetes)及硝化螺旋菌門(Nitrospirae)。前腸樣品組G6中變形菌門相對豐度最高,為 75.0%,其次為擬桿菌門(12.9%)、厚壁菌門(5.2%)、放線菌門(2.3%)、酸桿菌門(1.3%)。中腸樣品組G7中亦包含較多的變形菌門(57.4%),其次為擬桿菌門(18.6%)、厚壁菌門(10.2%)、放線菌門(4.3%)、酸桿菌門(3.5%)。后腸樣品組G8中,除了變形菌門(66.0%)豐度較高以外,梭桿菌門(30.7%)明顯高于前腸組(0.71%)和中腸組(0.77%)。水體樣品G4(S)中,豐度較高的物種包括變形菌門(50.8%)、放線菌門(26.2%)、梭桿菌門(11.7%)、擬桿菌門(7.7%)、厚壁菌門(1.8%)。飼料樣品G5(SL)中豐度較高的物種包括藍細菌門(59.5%)、變形菌門(29.8%)、厚壁菌門(8.1%)、擬桿菌門(1.1%)。前中后腸、水樣及飼料樣品中變形菌門均為主要優勢物種。前中腸細菌在門水平物種類型及豐度差異不大,后腸細菌和前中腸內細菌差異明顯。
在菌屬水平上對每個樣品的菌群結構及分布進行統計分析,由圖3可知,5個樣品組豐度前10的菌屬包括:假單胞菌屬(Pseudomonas)、氣單胞菌屬(Aeromonas)、不動桿菌屬(Acinetobacter)、黃桿菌屬(Flavobacterium)、unidentified Marinilabiaceae、Sedimenticola、地桿菌屬(Geobacter)、Polynucleobacter、unidentified Chloroplast及unidentified Mitochondria。前腸樣品組G6中,假單胞菌屬豐度最高,為23.18%,其次為氣單胞菌屬(7.23%)、不動桿菌屬(3.73%)、黃桿菌屬(2.47%)、unidentified Marinilabiaceae(2.43%)、Sedimenticola(2.20%)。中腸樣品組G7中,豐度排名前6的菌屬分別為unidentified Marinilabiaceae(4.22%)、Sedimenticola(3.13%)、地桿菌屬(2.60%)、假單胞菌屬(2.37%)、不動桿菌屬(1.74%)、氣單胞菌屬(1.40%)。后腸樣品組G8中,主要包括氣單胞菌屬(0.52%)、假單胞菌屬(0.47%)、不動桿菌屬(0.13%)、Sedimenticola(0.07%)、unidentified Marinilabiaceae(0.06%)、unidentified Chloroplast(0.03%)。養殖水體樣品組G4中,Polynucleobacter豐度最高為4.06%,其次為黃桿菌屬(1.27%)、unidentified Chloroplast(0.70%)、假單胞菌屬(0.51%)、unidentified Marinilabiaceae(0.43%)、氣單胞菌屬(0.29%)。飼料樣品組G5中,unidentified Chloroplast豐度最高(59.50%),其次為unidentified Mitochondria(21.33%)、假單胞菌屬(1.35%)、氣單胞菌屬(0.77%)、unidentified Marinilabiaceae(0.27%)、不動桿菌屬(0.21%)。不同來源樣品組中細菌豐度各不相同,后腸樣品組G8細菌多樣性與其他組相差較大,不含unidentified Mitochondria、Polynucleobacter及Geobacter等3個屬的細菌。



2.3 核心微生物菌落分析
繪制成韋恩圖對不同樣品(組)之間共有、特有的OUT進行分析,由圖4可知,其中前腸2個克隆共有OUTs 980個,前腸2個克隆樣本及養殖水體和飼料樣品共有OUTs 307個,優勢菌屬包括Marinifilum(2.61%)、假單胞菌屬(2.28%)、黃桿菌屬(1.63%)。中腸2個克隆樣本共有OUTs 852個,中腸2個克隆樣本及養殖水體和飼料樣品共有OUTs315個,主要包括Marinifilum(2.54%)、假單胞菌屬(2.22%)、黃桿菌屬(1.59%)、芽孢桿菌屬(1.27%)、unidentified_Marinilabiaceae(1.27%)及Bacteroides(1.27%)等菌屬。后腸2個克隆樣本共有OUTs 79個,后腸樣品及養殖水體和飼料共有OUTs 26個,在門水平上主要為變形菌門(73.08%)和厚壁菌門(15.38%)。

3 討論
近年來,研究者對人體[9-10]、斑馬魚[11]、虹鱒魚[12]、果蠅[13]及蝴蝶[14]等脊椎和非脊椎動物腸道微生物多樣性均進行了研究。Ni等對24條草魚腸道微生物多樣性進行了研究,共發現1 228種細菌(116種古細菌和1 112種細菌),其中大部分屬于厚壁菌門、變形桿菌門及梭桿菌門,此外筆者還發現,以黑麥草為飼料喂養的草魚腸道微生物在草魚腸道碳代謝、氨基酸代謝及脂肪酸代謝過程中作用顯著[15]。Tzeng等研究發現,變形桿菌門是日本沼蝦腸道微生物豐度最高的細菌門類,其次為厚壁菌門和放線菌門[16]。李建柱等研究發現魚菜共生模式下的草魚、鯽、鰱及鳙4種鯉科魚類腸道微生物優勢菌均為鯨桿菌屬、梭狀芽孢桿菌屬、擬桿菌屬及芽孢桿菌屬,表明魚類腸道微生物組成不完全由食性決定[17]。蘭阿峰等研究發現大鯢腸道微生物以變形菌門為主,其次還包含梭菌門、芽孢桿菌門及衣原體門[18]。
目前,對鱘魚腸道微生物的研究較少。Ghorbani等對閃光鱘胃腸道可培養細菌進行了分離鑒定, 其中分離獲得的細菌以腸桿菌科中的氣單胞菌、假單胞菌及沙門氏菌為主[19]。Zahra等人從西伯利亞鱘腸道中分離純化獲得129株單菌,并利用5種致病菌對這129株單菌的益生效果進行了研究,其中乳酸球菌屬(7株)、芽孢桿菌屬(2株)及檸檬酸桿菌屬(1株)對致病菌的抵抗作用效果明顯[20]。
采用高通量測序分析方法,本研究對鱘魚腸道微生物多樣性進行了分析。門水平分析,前中腸樣品組主要包括變形菌門(Proteobacteria)、擬桿菌門(Bacteroidetes)、厚壁菌門(Firmicutes)及放線菌門(Actinobacteria),該結果與王純等研究的草魚腸道微生物組成相似[21]。后腸樣品組中,主要以變形菌門(Proteobacteria)和梭桿菌門(Fusobacteria)為主。有研究表明,宿主健康狀況及發育階段的不同均會對腸道微生物組成產生影響[22-23]。本研究中,前中后腸微生物差異原因可能與食物在前中后腸中處于不同狀態有關,具體原因有待進一步研究。

