響應面法優化乳酸乳球菌電轉化效率研究
韋云瑩,王立峰,熊智強,王世杰,趙林森,艾連中
(1.上海理工大學 醫療器械與食品學院,上海 200093;2.南京財經大學 食品科學與工程學院,南京 210046;3.石家莊君樂寶乳業有限公司,石家莊 050221;4.河北一然生物科技有限公司,石家莊 050800)
乳酸乳球菌(Lactococcus lactis,L. Lactic)是被公認為安全的食品級微生物,具有較強的分解蛋白和產酸能力,能夠抑制葡萄球菌、球菌和芽孢桿菌等微生物,所以被廣泛應用于食品發酵工業[1-2]。作為益生菌,乳酸乳球菌不僅可以維持腸道菌群平衡,還可以刺激腸道免疫組織分泌免疫因子,從而提高機體免疫力[3]。乳酸乳球菌是乳酸菌屬中一種重要的模式菌,具有生長迅速快、代謝相對簡單、基因組小、操作容易和安全性高等特點[4]。此外,由于乳酸乳球菌抗原性較弱,自身蛋白分泌少,不在腸道中定值[5],不僅不會引起機體強烈的免疫應答和干擾目的蛋白的表達,還可以避免產生免疫耐受性。這些優點使得乳酸乳球菌成為食品級表達宿主的最佳選擇[6]。近年來,利用分子生物學手段可以對乳酸乳球菌的生物學特性進行改造,使得乳酸乳球菌不僅可以用于乳制品的制備,提高食品的營養價值,還可以用于抗原的生產和人類疾病的治療[7-8]。
乳酸乳球菌NZ9000 是乳酸菌中調控基因表達使用最廣泛的一種宿主菌株[9],在食品和藥品等工業生產中具有廣闊的應用前景,因此獲得高效的電轉化效率至關重要。本研究首先單因素優化了乳酸乳球菌的電轉化方法,接著利用響應面法對影響電轉化效率的關鍵因素進一步優化,為發掘乳酸乳球菌感受態潛力奠定基礎,為提高乳酸乳球菌感受態效率提供新思路。
1 材料與方法
1.1 材料與試劑
1.1.1 質粒
試驗所用的質粒pNZ44 為乳桿菌穿梭質粒。
1.1.2 培養基
GM17 培養基:用于乳酸乳球菌NZ9000 的活化、培養和活菌計數。配方為:胰蛋白胨5 g/L、大豆蛋白胨5 g/L、牛肉膏5 g/L、葡萄糖5 g/L、酵母浸出粉2.5 g/L、β?磷酸甘油二鈉19 g/L、維生素C 0.5 g/L、MgSO40.25 g/L。固體培養基另加瓊脂粉20 g/L。
復蘇培養基I:GM17 液體培養基。
復蘇培養基II:含有CaCl22 mmol/L 和 MgCl220 mmol/L 的GM17 液體培養基。
復蘇培養基III:含有蔗糖0.5 mol/L,CaCl22 mmol/L 和 MgCl220 mmol/L 的GM17 液 體 培養基。
復蘇培養基IV:含有山梨醇0.5 mol/L,CaCl22 mmol/L 和MgCl220 mmol/L 的GM17 液 體 培養基。
大腸桿菌(LB)培養基:用于大腸桿菌的培養。配方為:胰蛋白胨10 g/L、酵母粉5 g/L、NaCl 10 g/L。121℃滅菌15 min。固體培養基另加瓊脂粉20 g/L。
1.1.3 洗滌緩沖液溶液I:體積分數為10%的甘油、蔗糖0.5 mol/L。溶液II:體積分數為10%的甘油、蔗糖0.5 mol/L和乙二胺四乙酸(EDTA)0.05 mol/L 。
溶液III:乙酸鋰二水100 mmol/L、二硫蘇糖醇(DTT)10 mmol/L、蔗 糖0.6 mol/L、pH7.5 的
Tris-HCl 1 mol/L。
1.1.4 儀器與試劑
質粒提取試劑盒購自Axygen; Nanodrop 2000c 購 自Thermo 公 司; 冷 凍 離 心 機 購 自Sigma 公司;厭氧培養箱購自Ruskinn 公司。
1.2 乳酸乳球菌NZ9000 感受態制備方法
挑取平板劃線后的單菌落至5 mL GM17 液體培養基中,30℃靜置培養12~16 h;5%接種至50 mL GM17 液體培養基中,30℃靜置培養12~16 h;8%接種至含有0.5 mol/L 蔗糖和25 g/L 甘氨酸的GM17 液體培養基中,30℃靜置培養至吸光值OD600為0.3~0.4,離心棄上清,溶液III 重懸細胞,室溫靜置30 min,離心棄上清,先用溶液I 洗滌細胞,再用溶液II 洗滌,最后重懸于溶液I 中。每管100 μL 保存至?80℃,電轉化備用。以上所有離心條件均為4℃,6 000 r/min,10 min[10]。
1.3 乳酸乳球菌NZ9000 感受態效率檢測
取一定量質粒與100 μL 感受態細胞混勻,迅速轉入預冷無菌的2 mm 的電轉杯中,設置好電轉參數后進行電擊。電擊完畢后,立即加入900 μL液體復蘇培養基,并在30℃靜置保溫2~3 h,然后取100 μL 涂布于抗性平板,30℃靜置培養24~48 h 后,觀察并記錄轉化子個數。
以上試驗均重復做3 次。根據加入質粒的量,計算每μg 質粒所得轉化子的數目即為電轉化效率,其公式如下:
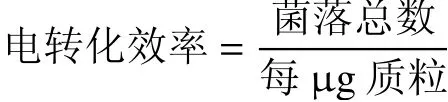
1.4 單因素試驗
將液體活化后的菌液接種至含有25 g/L 甘氨酸和0.5 mol/L 蔗糖的GM17 培養基中,分別培養至OD600為0.2,0.4,0.6,0.8 收集菌體并制備感受態。其他步驟不改變的情況下,比較電轉化效率,尋找合適生長階段。
在獲得最優OD600的情況下,將液體活化后的菌液分別接種至含有甘氨酸濃度5,10,15,20,25 g/L 和蔗糖0.5 mol/L 的GM17 培養基來培養細胞并制備感受態。其他步驟不變的情況下,比較電轉化效率,找到合適的甘氨酸濃度。
在獲得上述最優條件的情況下制備感受態,分 別 將50,200,500,800,1 100 ng 的pNZ44質粒電轉到乳酸乳球菌NZ9000 感受態中,觀察不同質粒濃度對電轉化效率的影響,找到最佳質粒濃度。
將制備好的感受態,分別在電場強度為7.5,10,12.5,15 kV/cm 下電擊轉化,比較電轉化效率,獲得最優電場強度。
在獲得上述最優條件的情況下,比較不同復蘇培養基I,II,III,IV 對電轉化效率的影響,確定最佳復蘇培養基。
在獲得上述最優條件的情況下,比較不同復蘇時間1,2,3,4,5,6 h 對電轉化效率的影響,確定復蘇時間。
1.5 響應面優化試驗設計
在單因素試驗的基礎上,采用Box-Behnken 響應面設計法,對乳酸乳球菌NZ9000 電轉化條件的關鍵因素作進一步研究和探討,以獲得其最佳電轉化效率。Box-Behnken 試驗設計見表1。其中,A,B,C 分別表示甘氨酸濃度、吸光值和電場強 度。
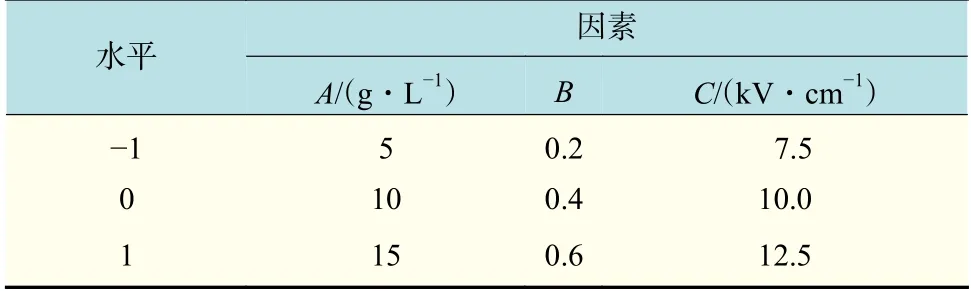
表1 Box-Behnken 響應面試驗因素和水平Tab.1 Factors and levels of Box-Behnken test
2 結果與討論
與乳酸乳球菌商業化感受態制備的過程相比,本課題組前期借鑒Papagianni 等[11]預處理細胞的方法,使用乙酸鋰二水和DTT 處理細胞[10],電轉化效率可達1.5×107CFU/μg DNA。但是使用含有甘氨酸濃度25 g/L 和蔗糖0.5 mol/L 的GM17 培養細胞,由于高濃度甘氨酸對細胞生長壓力大,細胞生長緩慢,培養時間長,大大影響了試驗效率。在此基礎上,本研究對其電轉化條件展開優化。
2.1 生長階段對電轉化效率的影響
目前關于乳酸菌電轉化的研究表明,不同生長階段的乳酸菌對電擊的敏感程度不同[12]。選取4 個生長階段的乳酸乳球菌NZ9000 制備成感受態并電轉化,其結果如圖1 所示。在細胞培養至OD600為0.4 左右時,電轉化效率最高,可達4.81×106CFU/μg DNA。相比于穩定期的細胞,處于對數生長前期的細胞電轉化效率更好。這可能是因為該時期細胞活性較好,細胞壁結構相對疏松 ,有利于外源DNA 的進入[13]。
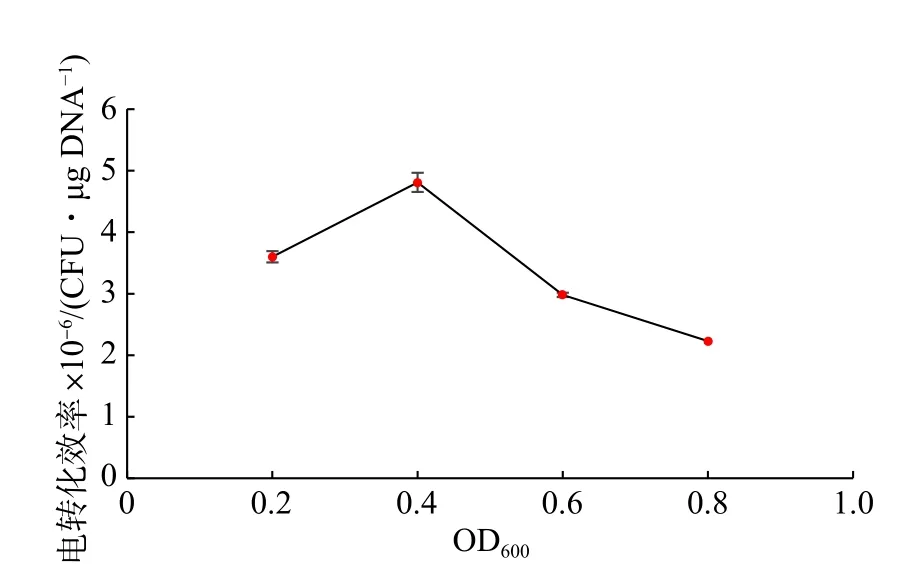
圖1 生長階段對乳酸乳球菌NZ9000 電轉化效率的影響Fig.1 Effect of growth phase on the electrotransformaion efficiency of L.lactis NZ9000
2.2 甘氨酸濃度對電轉化效率的影響
乳酸乳球菌是革蘭氏陽性菌,其較厚的細胞壁是影響轉化效率的關鍵因素。在培養基中添加一些細胞壁弱化劑有利于外源質粒進入細胞。甘氨酸作為常見的細胞弱化劑,已經廣泛用于乳酸菌感受態的制備。但是,甘氨酸濃度過高可能會抑制菌體的生長,引起細胞裂解[14]。因此,選擇合適濃度的甘氨酸至關重要。分別選取甘氨酸5,10,15,20,25 g/L 和蔗糖0.5 mol/L 的GM17 培養基,處理細胞至OD600約0.4 時制備感受態并電轉化,其結果如圖2 所示。在甘氨酸濃度為10 g/L時,電 轉 化 效 率 達 到 最 高,為2.17×107CFU/μg DNA,隨著甘氨酸的濃度升高,轉化效率反而下降 。這與楊涓等[15]的研究結果一致。

圖2 甘氨酸濃度對乳酸乳球菌NZ9000 電轉化效率的影響Fig.2 Effect of glycine content on the electrotransformation efficiency of L.lactis NZ9000
2.3 質粒濃度對電轉化效率的影響
外源質粒濃度會影響電轉化效率,當細胞濃度一定時,添加不同濃度的外源質粒得到的轉化子數目不同。質粒濃度過大,電轉化產生的電阻較大,易于擊穿電轉杯[16]。本研究選擇添加不同濃度的pNZ44 質粒進行電轉化,考察其對NZ9000 電轉化效率的影響,其結果如圖3 所示。質粒濃度在500 ng 左右時,電轉化效率最高達2.89×107CFU/μg DNA。質粒濃度再升高時,轉化效率反而下降。
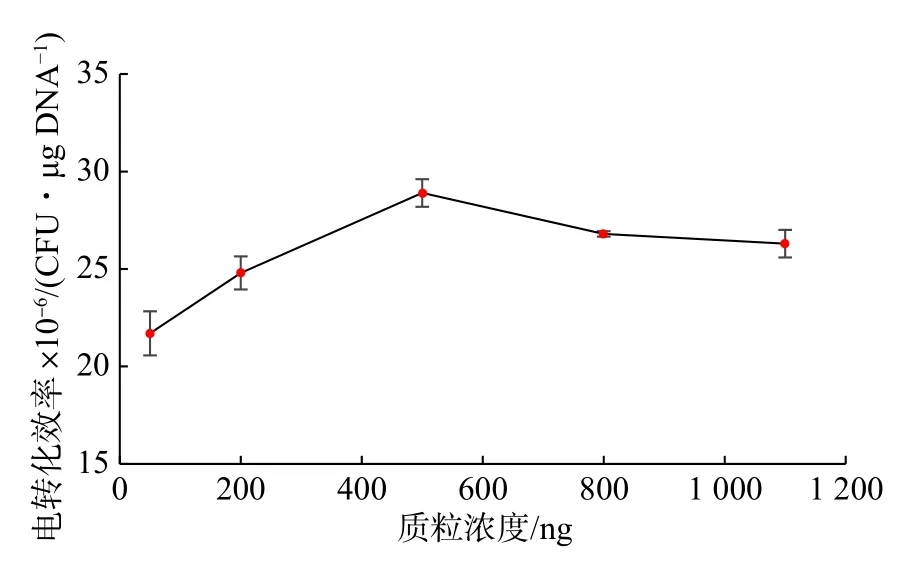
圖3 質粒濃度對乳酸乳球菌NZ9000 電轉化效率的影響Fig.3 Effect of plasmid content on the electrotransformation efficiency of L.lactis NZ9000
2.4 電場強度對電轉化效率的影響
電轉化的原理就是利用瞬時高壓電擊細胞膜形成孔洞,使DNA 分子進入細胞[17]。電場強度過低時,細胞膜難以形成孔洞;場強過高又可能會損傷細胞膜,影響存活率。只有在合適的場強范圍內,電場強度越強,細胞膜上產生的孔洞越多,通透性越好,這樣才更有利于外源DNA 分子的進入[18]。電場強度對電轉化效率的影響如圖4 所示,乳酸乳球菌NZ9000 的電轉化效率在10 kV/cm 時達到最好,為2.95×107CFU/μg DNA。
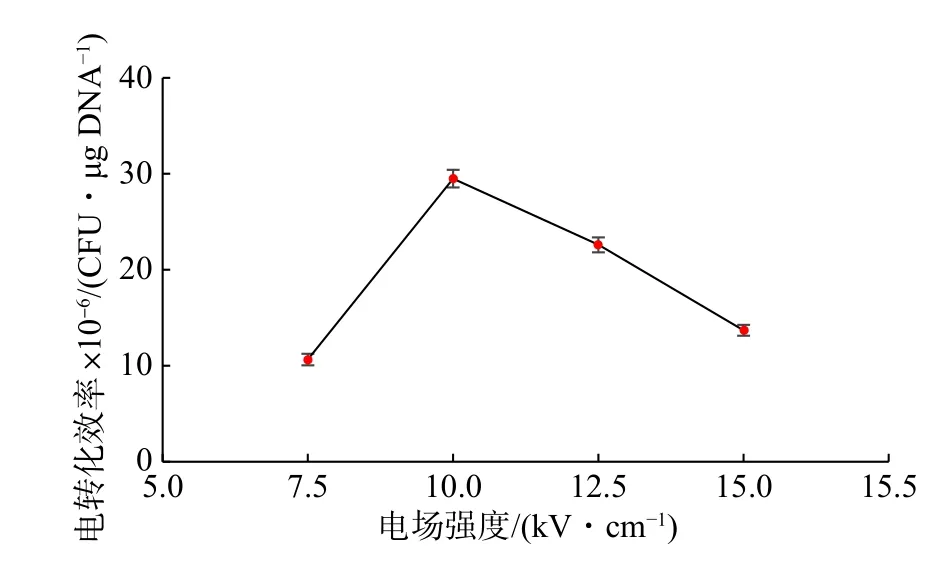
圖4 電場強度對乳酸乳球菌NZ9000 電轉化效率的影響Fig.4 Effect of electric filed strength on the electrotransformation efficiency of L.lactis NZ9000
2.5 復蘇培養基對電轉化效率的影響
研究表明,細胞電擊后很容易大量死亡。在培養基中添加一些物質如蔗糖、山梨醇等可能會有利于細胞膜孔洞的復原[19]。選擇4 種培養基來復蘇電轉化后的NZ9000 細胞,結果如圖5 所示。在GM17 培養基中電轉化效率最低,而其他3 種培養基復蘇后轉化效率相差不大。復蘇培養基II 比復蘇培養基I 的轉化效率更高,可能是由于CaCl2和MgCl2的存在能夠促進外源DNA 的吸收 ,獲得更多的轉化子。
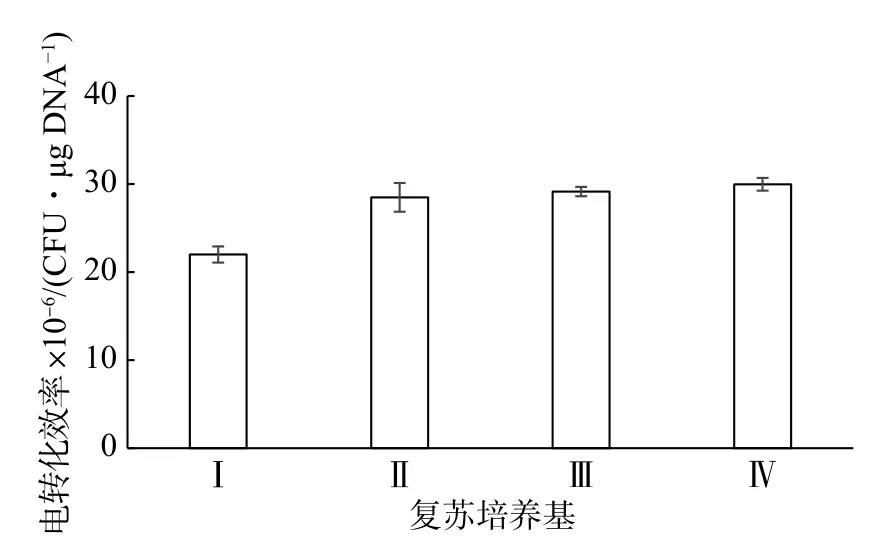
圖5 復蘇培養基對乳酸乳球菌NZ9000 電轉化效率的影響Fig.5 Effect of incubation medium on the electrotransformation efficiency of L.lactis NZ9000
2.6 復蘇時間對電轉化效率的影響
細胞電擊后一定的復蘇時間有利于抗性基因的表達[18]。相比于直接涂布抗性平板,電轉后先在不含抗生素的培養基中復蘇一段時間可以獲得更多轉化子。分別將電擊后的細胞復蘇1,2,3,4,5,6 h 涂布抗性平板,結果如圖6 所示。細胞復蘇時間為2h時電轉化效率較高,2h之后隨著復蘇時間的增加,電轉化效率變化不大。因此復蘇時間選擇2h為宜。

圖6 復蘇時間對乳酸乳球菌NZ9000 電轉化效率的影響Fig.6 Effect of incubation time on the electrotransformation efficiency of L.lactis NZ9000
2.7 響應面優化乳酸乳球菌NZ9000 電轉化條件結果分析
通過單因素試驗可以發現生長階段、甘氨酸濃度和電場強度對電轉化效率的影響較為顯著,因此采用Box-Behnken 響應面試驗對對甘氨酸濃度(A)、OD600(B)和電場強度(C)這3 個因素進行優化,得到的試驗方案和數據結果見表2。
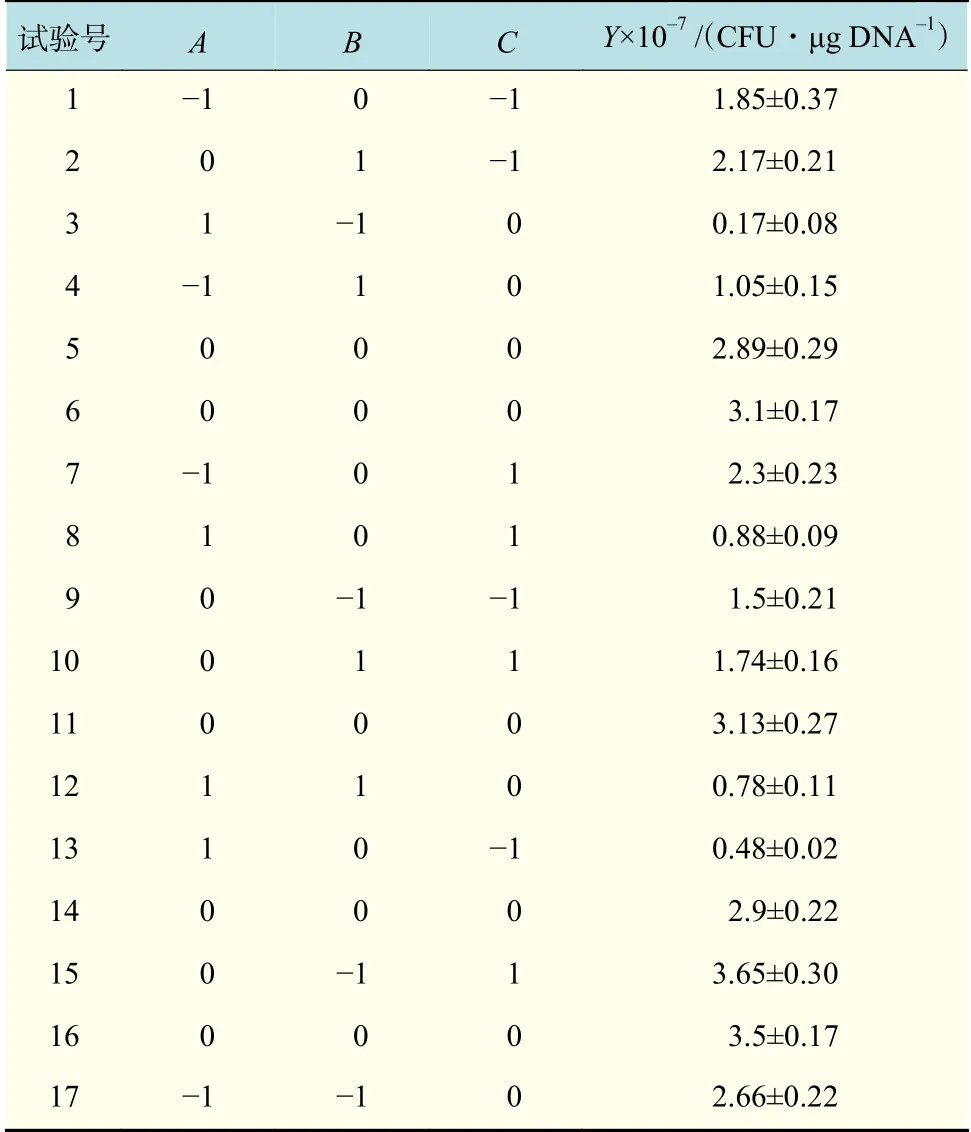
表2 Box-Behnken 試驗設計及結果Tab.2 Box-Behnken test design and results
利用Design Expert 軟件對試驗結果進行方差分析及二次多項回歸擬合,得到乳酸乳球菌NZ9000 電轉化效率Y 對甘氨酸濃度、OD600和電場強度的多元回歸方程為
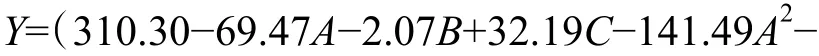
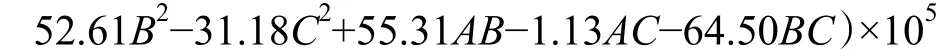
模型的方差和顯著性分析結果如表3 所示。可見,模型概率值P(<0.000 1)小于0.01,表明該模型極顯著,模型失擬項的P 值為0.674 4,大于0.05,所以該模型的擬合度較高。決定系數R2=0.982 0,調整決定系數R2adj=0.958 9,說明此模型與實際擬合較好,誤差較小,可以用此模型對乳酸乳球菌NZ9000 電轉化效率進行預測。由回歸系數檢驗值F 可知,各因素對乳酸乳球菌NZ9000 電轉化效率的影響程度為:甘氨酸濃度>電場強度>OD600。3 個因素對響應值都有極為顯著的影響;交互項BC 影響最顯著,其次分別是交互項AB 和AC;各因素的平方項對響應值也都具有顯著影響,其中A2和B2的影響極顯著,說明各影響因素對電轉化效率的影響不是簡單的線性關系。
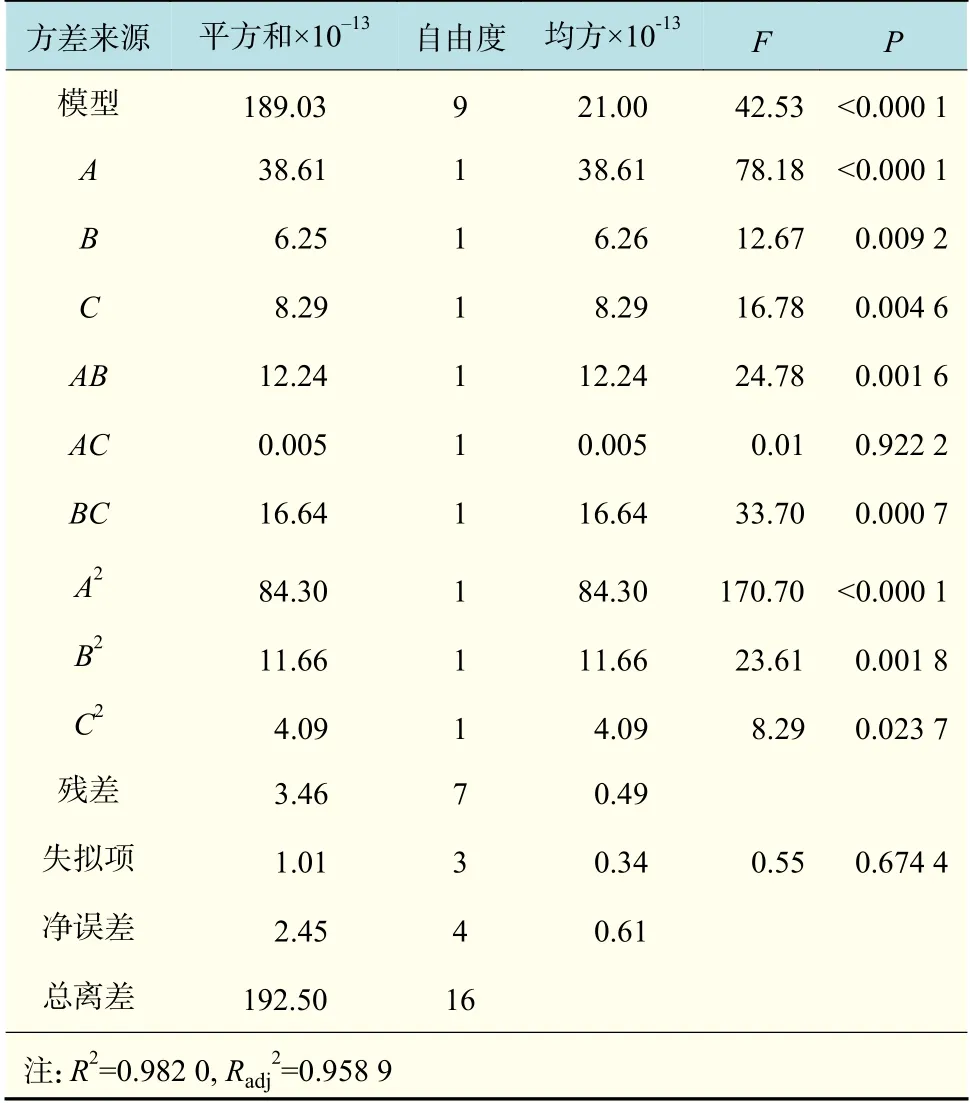
表3 回歸方程模型顯著性分析Tab.3 Significance test for cofficients of the regression model developed
運用Design Expert 軟件分析,得到乳酸乳球菌NZ9000 最優電轉化條件為:電場強度12.5 kV/cm,OD6000.2,甘氨酸濃度7.77 g/L,預測在此條件下乳酸乳球菌 NZ9000 的電轉化率達到 3.8×107CFU/μg DNA。為了方便操作,將上述預測的參數修改為:電場強度12.5 kV/cm,OD6000.2,甘氨酸濃度8 g/L。按此電轉化條件得到乳酸乳球菌NZ9000 的電轉化效率為(3.76±0.26)×107CFU/μg DNA,與理論值非常接近。這說明條件參數可靠,能夠較好地預測乳酸乳球菌NZ9000 的電轉化效率。與目前報道相比,優化后乳酸乳球菌NZ9000 的電轉化效率提高了250%,并且縮短了培養時間,提高了試驗效率。
3 結 論
通過單因素試驗,對影響乳酸乳球菌NZ9000 電轉化效率的各因素:生長階段、甘氨酸濃度、質粒濃度、電場強度、復蘇培養和復蘇時間進行優化,并在此基礎上建立了響應面模型,確定出乳酸乳球菌NZ9000 的最佳電轉化條件,使電轉化效率高達3.76×107CFU/μg DNA。本研究不僅為提高電轉化效率提供了新思路,還促進人們對乳酸乳球菌的感受態潛力進行更深入的挖掘,以提高其工業性能和發酵產品的質量。

