體外受精與體外培養對小鼠囊胚發育潛能的影響
郭翔宇,陳書強,李博
(空軍醫大學唐都醫院生殖醫學中心,西安 710038)
臨床上,為了提高輔助生殖的成功率及避免多胎妊娠,很多時候會選擇單囊胚進行胚胎移植[1-3]。目前已經有研究表明單囊胚移植在不降低妊娠率的同時能夠顯著降低多胎妊娠率[4]。因此,臨床上一直在努力建立篩選健康胚胎的新方法。另外,無論在臨床上還是在動物模型上所觀察到的輔助生殖技術(ART)對植入后胎盤、胎兒以及出生后個體的影響,都是ART對早期胚胎影響的延續。因此,評估體外受精對囊胚期胚胎的影響,是非常必要的。
資料和方法
一、動物來源
小鼠品系為ICR清潔級小鼠,購買自北京維通利華實驗動物技術有限公司。雌鼠4~6周齡,雄鼠3~6月齡。
二、主要儀器和試劑
孕馬血清促性腺釋放激素(PMSG)、HCG(Prospec Protein Specialists,以色列)、KSOM(Millipore,美國)、戊巴比妥鈉(Sigma,德國)、多聚甲醛(Sigma,德國)、RNeasy Plus Micro Kit(Qiagen,德國)、Quanti TectReverse Transcription Kit(Qiagen,德國)、SYBR(Sigma,德國)。
實體解剖鏡(Motic,中國),電子天平AA-160(Denver Instrument Company,美國),CO2培養箱(Thermo,美國)、培養皿(35 mm)/四孔板(Nunc,丹麥)、超凈臺(Labconco,美國)、熒光顯微鏡(Leica,德國)。
三、研究方法
1.獲取囊胚:以下胚胎操作實驗方法均來自《Manipulating the Mouse Embryo-A Laboratory Manual,3rdedition》[5]。
(1)獲取自然交配形成的囊胚(in vivo組):取24 g左右的雌性小鼠,腹腔注射7.5 U PMSG,46~48 h后腹腔注射7.5 U HCG;與雄鼠合籠,次日檢查陰栓。在見栓后72 h,將雌鼠處死,剪取雙側子宮和部分輸卵管,將吸有mHTF培養液(自制)的針頭插入子宮角,將囊胚沖出,收集囊胚,在mHTF培養液中洗滌,待用。
(2)體內受精-體外培養獲取的囊胚(IVC組):超排卵及交配處理同前。次日檢查陰栓,在注射HCG 20 h 后,處死雌鼠,取MⅡ卵獲取受精卵團,用0.3%透明質酸酶消化卵團,然后用吸管將消化分離的卵母細胞轉入4~5 滴100 μl的mHTF培養液,以洗去透明質酸酶和顆粒細胞,待繼續培養至囊胚。
(3)體外受精獲取囊胚(IVF組):①獲取MII卵:雌鼠促排卵處理同前。注射HCG 14~16 h 后斷頸處死小鼠,剪取輸卵管,置于平皿中,在100 μl 的mHTF培養液中清洗1次,轉入另一100 μl的mHTF培養液滴,用尖頭鑷子撕開輸卵管呈半透明狀的膨大部位,輕壓撕開處,令卵母細胞和顆粒細胞的復合體流出,用鑷子將流出的復合體轉入4~5 滴100 μl的mHTF培養液中洗滌,待用。②精子的準備與獲能:取5日內未交配過的3~6月齡雄性小鼠,斷頸處死后剪取雙側附睪尾,置入300 μl 37℃、5%CO2條件下預平衡4 h以上的HTF培養液中,剪開數段,37℃、5%CO2條件下培養20 min使精子自行游出后取出附睪尾,繼續培養1.5 h使精子獲能。③卵母細胞的準備與體外受精:MII卵丘團置于500 μl 預平衡過的HTF培養液中,加入30 μl獲能精子上層懸液,37℃、5%CO2條件下繼續培養4 h以使卵母細胞受精。④體外培養:將含有兩個原核的受精卵以每20 μl 10個受精卵的密度培養于石蠟油覆蓋的KSOM溶液中。分別在24、48、84 h后檢查胚胎發育至2-cell、4-cell和囊胚的比率。
2.胚胎移植:取6周齡以上雌鼠,與結扎雄鼠合籠過夜,次日晨檢查陰栓,見陰栓當日記作假孕0.5 d(D 0.5),作為假孕鼠備用。取3.5 d(D 3.5)假孕鼠,按0.01 ml/g體重進行腹腔注射1%(w/v)濃度的戊巴比妥鈉麻醉劑,待小鼠麻醉后,背側正中開一小口,鈍性分離皮膚和皮下組織層,于子宮角對應肌肉層開一小口,拉出脂肪墊固定,用1 ml注射針頭于子宮角無血管處順子宮方向扎一小口后,同位置插入口吸管,將囊胚(每側8 枚)輕吹入子宮腔,取出口吸管后還納子宮卵巢,縫合傷口。
3.囊胚的細胞計數:免疫殺傷法計算總細胞數及內細胞團細胞和總細胞數的比值。
選取不同組別形態相似的擴張期囊胚(Grade II),用酸性臺氏液將囊胚透明帶去除,之后用含0.1% PVA的PBS(PBSA)緩沖液清洗3遍;將囊胚轉移到含10 mmol/L TNBS(Baomanbio,中國)的PBSA中,冰上放置10 min;之后,將囊胚轉移到含30%的anti-DNP-BSA(Thermo,美國)的PBSA中,37℃放置30 min;將囊胚轉移至含20%的豚鼠補體(Sigma,美國)及10 μg/ml PI(Sigma,美國)的PBSA中,37℃放置20 min;用4%多聚甲醛固定胚胎,同時加入10 μg/ml的Hoechst 33258(MCE,美國)進行染色,4℃放置2 h;囊胚轉移到載玻片上進行封片,然后在熒光顯微鏡下觀察。
分別在380 nm和460 nm(或535 nm)激發波長下觀察拍照,前者觀察到的為總細胞,后者為TE(滋養層)細胞,分別計數進行統計,細胞總數減去TE細胞數即為內細胞團(ICM)細胞數,由此可計算出內細胞團細胞和總細胞數比值。
4.胚胎植入和活產的判定:胚胎移植后第11天,即孕14.5 d,斷頸處死代孕母鼠后剪取雙側子宮,浸泡在4℃預冷的PBS緩沖液中,用解剖鑷鈍性剝離胎兒胎盤,去除羊膜及其他胚外組織,以PBS緩沖液清洗。
活產包括形態學正常的胚胎;植入包括:①活產;②肉眼可見的已經機化的黑色植入點。
5.囊胚qRT-PCR:(1)囊胚mRNA抽提:每200個囊胚為一組,以PBS清洗3遍后置于RNAse-free的EP管中,盡量吸走多余的PBS,采用RNeasy? Plus Micro Kit(Qiagen,德國)抽提總RNA,具體步驟參見產品說明。(2)cDNA合成:以囊胚總RNA為材料,采用QuantiTect? Reverse Transcription Kit(Qiagen,德國)合成總cDNA,具體步驟參見產品說明。(3)囊胚期細胞命運決定因子檢測:采用Bio-Rad CFX96 Real-Time PCR檢測系統配套軟件進行反應模塊排版,基于SYBR? Green進行實時熒光檢測,以H2afz為內參基因進行相對定量,檢測囊胚期細胞命運決定因子的表達。引物序列查詢自Primerbank,詳見表1。(4)實時定量PCR:采用Sigma公司SYBR? Green JumpStartTMTaqReadyMixTMq-PCR反應液。反應總體系25 μl:SYBR 12.5 μl、Primer pair 1 μl、cDNA 1.5 μl、ddH2O 10 μl。擴增條件:95℃ 3 min;95℃ 15 s、56℃ 30 s、72℃ 30 s,50個循環;72℃ 2 min,65℃~95℃(每15 s升高0.5℃)。以上在每個PCR循環的延伸期采集熒光信號,PCR反應完成后利用溫度梯度變性獲得熔解曲線供PCR產物定性分析。

表1 目的基因引物序列
四、統計學分析
使用SPSS19.0對實驗數據進行統計學分析。計量資料采用單因素-ANOVA進行分析,胚胎植入率等計數型對比資料采用χ2進行分析,P<0.05為差異有統計學意義。
結 果
一、體外受精對囊胚細胞總數、TE和ICM細胞數目的影響
囊胚期細胞總數以及TE/ICM比值和胚胎質量相關[6]。因此我們對in vivo、IVC和IVF三組不同來源的囊胚進行了細胞差別染色,以便識別TE和ICM細胞(圖1)。
為了避免胚胎級別對實驗結果的影響,我們所有的實驗均選擇二級囊胚即擴張期囊胚進行實驗。發現:in vivo組(n=23)、IVC組(n=24)、IVF組(n=26)囊胚細胞總數分別為(75.05±6.76)、(58.21±3.66)、(58.96±3.75),TE細胞總數分別為(54.5±5.59)、(40.95±4.29)、(42.88±3.67),ICM細胞總數分別為(28.29±5.11)、(17.35±2.96)、(16.04±2.72);與in vivo組相比,IVF組和IVC組囊胚細胞總數、TE細胞數、ICM細胞數均顯著降低(P<0.01)(圖1)。in vivo組、IVC組、IVF組TE/ICM比值分別為(0.38±0.08)、(0.43±0.11)、(0.38±0.09),三組之間無顯著差異(P>0.05)。
二、體外受精對囊胚期細胞命運決定因子表達的影響
我們進一步對in vivo、IVC和IVF三組不同來源的囊胚進行了細胞譜系決定重要因子表達的相對定量,結果顯示:IVC和IVF來源的囊胚多潛能因子Nanog、Sox2表達水平顯著上調(P<0.05),但是維持滋養外胚層(trophectoderm,TE)存活、調控原始外胚層(Primitive endoderm,PE)分化的、由上胚層(Epiblast)分泌的因子Fgf4的表達水平卻顯著下調(P<0.05);IVF和IVC導致PE分化的轉錄調控因子Gata4、Sox17的表達水平顯著下調(P<0.05);IVF和IVC導致TE分化的轉錄調控因子Eomes和Elf5的表達量顯著下調(P<0.05);IVF和IVC還導致調控重要信號通路的內分泌因子Lif的表達水平顯著下調(P<0.05)(圖2)。
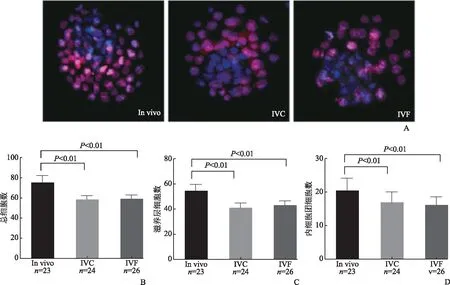
A:囊胚的細胞差別染色(藍色代表ICM,紅色代表TE);B:三組總細胞數比較;C:三組TE細胞數比較;D:三組ICM細胞數比較。與in vivo組相比,IVC和IVF組的總細胞數、ICM、TE細胞數均顯著減少(P<0.01),IVC組與IVF組相比無顯著差異(P>0.05)圖1 體外受精對囊胚細胞總數、TE和ICM細胞數量的影響

與In vivo組相比,*P<0.05圖2 體外受精對囊胚期細胞命運決定因子表達的影響
三、體外受精對胚胎植入率及成活率的影響
胚胎植入率以及植入后成活率是評估胚胎質量的關鍵指標[6]。我們選擇in vivo、IVC、IVF來源的擴張期囊胚,進行了胚胎移植實驗,在孕14.5 d時比較胚胎植入率以及植入后胚胎成活率。結果顯示:in vivo組 (n=96)、IVC組(n=95)和IVF組(n=93)的胚胎植入率分別為(74.00±4.34)%、(73.67±2.08)%和(71.96±5.17)%,這表明體外受精和體外培養均不影響胚胎的植入率(P>0.05)。但我們進一步發現,體外受精來源的胚胎植入后胚胎的成活率顯著低于in vivo組和IVC組(P<0.05),表明體外受精會影響胚胎植入之后的進一步發育,導致胚胎成活率降低(表2)。
表2 比較三組囊胚植入率、成活率、活產率與流產率 (-±s)
注:與In vivo組和IVC組相比,*P<0.05
討 論
近年來,ART囊胚移植率逐漸升高,其優勢在于囊胚移植能夠與子宮內膜發育程度相符,減少了促排卵過程中大量使用激素對子宮內膜的影響,使胚胎更易于著床;同時,整個囊胚培養過程是對胚胎的一個篩選過程,能夠淘汰大部分非整倍體以及具有遺傳缺陷的胚胎[7]。無論是在臨床上還是動物模型上觀察到的輔助生殖技術對植入后胎盤、胎兒、及出生后個體的影響,都是輔助生殖技術對早期胚胎操作影響的延續。因此,為了更好地改善ART的臨床結局,對體外受精過程中囊胚發生的改變進行評估是非常必要的。
囊胚由ICM和TE組成,TE細胞主要功能是胚胎與外界進行物質交換,以支持ICM的發育分化。ICM/TE以及總細胞數常用于評估囊胚質量[8]。臨床上用于移植的胚胎均為優質囊胚,因此我們為了更貼近臨床實際,選取了擴張期二級囊胚作為研究對象。盡管不同組別胚胎發育速度會有所差異,會導致同一時期的胚胎細胞數有所不同,但是同一級別的囊胚形態相同,三組之間囊胚細胞數是有可比性的。我們發現,即使是同樣形態的擴張期囊胚,體外受精來源的囊胚以及體內受精-體外發育的囊胚相對于體內發育的囊胚在細胞總數、TE細胞數以及ICM細胞數方面均顯著減少。有研究表明,體外培養會影響植入前胚胎發育率,具體表現為ICM細胞數以及ICM/TE比值的降低[9],而暴露在不良環境中也會使ICM細胞數和ICM/TE比值顯著下降[10]。這與本研究結果基本相符。雖然本實驗中ICM/TE比值無顯著差異,原因可能是ICM與TE細胞數量均減少,導致比值無顯著改變;但是考慮到三組同級別的囊胚比較,IVF組細胞總數、TE細胞數,ICM細胞數均顯著減少,綜合評估體外受精的胚胎質量低于體內發育的囊胚。
有研究表明,囊胚的形態和發育率與胚胎整倍性相關[17],所有整倍體胚胎植入率相似,與囊胚的形態和發育率無關。我們檢測了體外受精對胚胎植入率及植入后胚胎存活率的影響,發現體外培養組和體內自然發育組相比雖然植入率等有所降低,但是并無統計學差異;而體外受精雖不影響胚胎的植入率,但植入后胚胎的存活率顯著降低。提示與體外培養相比,體外受精這一操作更容易影響胚胎質量,是導致胚胎質量下降、不良妊娠結局的主要原因。
目前有報道表明,H19的ICR區域甲基化水平的降低和臨床上自發性流產相關,并且在動物模型上也得到了驗證[18-21]。我們觀察到體外受精的小鼠胚胎植入后存活率的降低可能和體外受精導致的印記基因ICR區域印記丟失相關。進一步澄清體外受精導致小鼠胚胎植入后存活率降低的原因,將有助于確定表觀遺傳紊亂與胚胎質量的關系,為臨床上完善輔助生殖技術提供理論依據。
本研究發現,IVF會導致小鼠囊胚胚胎質量和移植后成活率下降,初步揭示了囊胚質量的相關分子水平的改變。后期還需實驗繼續研究IVF胚胎的表觀遺傳學是否發生改變,以及導致囊胚質量下降的分子機制,才能進一步為臨床上改善ART結局和預防ART嬰兒出生后遠期安全性問題提供理論依據。
[1] Stillman RJ,Richter KS,Banks NK,et al.Elective single embryo transfer:a 6-year progressive implementation of 784 single blastocyst transfers and the influence of payment method on patient choice[J].Fertil Steril,2009,92:1895-1906.
[2] Adashi EY,Gleicher N.Is a blanket elective single embryo transfer policy defensible?[J].Rambam Maimonides Med J,2017,8.
[3] Wang X,Du M,Guan Y,et al.Comparative neonatal outcomes in singleton births from blastocyst transfers or cleavage-stage embryo transfers:a systematic review and meta-analysis[J].Reprod Biol Endocrinol,2017,15:36.
[4] 薛俠,施文浩,師娟子,等.D5選擇性的單囊胚移植和雙囊胚胎移植妊娠結局比較[J].生殖醫學雜志,2014,23:276-279.
[5] Richard B,Marina G,Kristina VN,et al.Manipulating the mouse embryo[M].New York:Cold Spring Harbor Laboratory Press,2014:1-795.
[6] Lane M,Gardner DK.Nonessential amino acids and glutamine decrease the time of the first three cleavage divisions and increase compaction of mouse zygotes in vitro[J].J Assist Reprod Genet,1997,14:398-403.
[7] Cardellicchio L,Reschini M,Paffoni A,et al.Frozen-thawed blastocyst transfer in natural cycle:feasibility in everyday clinical practice[J].Arch Gynecol Obstet,2017,295:1509-1514.
[8] Qu P,Qing S,Liu R,et al.Effects of embryo-derived exosomes on the development of bovine cloned embryos[J/OL].PLoS One,2017,12:e174535.
[9] 王保壘,趙禹,劉軍,等.共培養對小鼠囊胚質量及其表觀遺傳修飾的影響[J].生物工程學報,2009,25:733-738.
[10] Maluf M,Perin PM,Foltran Januário DA,et al.In vitro fertilization,embryo development,and cell lineage segregation after pre-and/or postnatal exposure of female mice to ambient fine particulate matter[J].Fertil Steril,2009,92:1725-1735.
[11] Whitmill A,Liu Y,Timani KA,et al.Tip110 deletion impaired embryonic and stem cell development involving downregulation of stem cell factors Nanog,Oct4,and Sox2[J].Stem Cells,2017,35:1674-1686.
[12] Guo G,Huss M,Tong GQ,et al.Resolution of cell fate decisions revealed by single-cell gene expression analysis from zygote to blastocyst[J].Dev Cell,2010,18:675-685.
[13] Soma M,Iha M,Kihara Y,et al.Preferential emergence of cell types expressing markers for primitive endoderm lineages in mouse embryonic stem cells expressing exogenous EGAM1 homeoprotein[J].J Biosci Bioeng,2012,114:342-346.
[14] HosseinNia P,Hajian M,Tahmoorespur M,et al.Expression profile of developmentally important genes in pre and peri-implantation goat embryos produced in vitro[J].Int J Fertil Steril,2016,10:310-319.
[15] Veraguas D,Gallegos PF,Velasquez AE,et al.FSH stimulation of anestrous cats improves oocyte quality and development of parthenogenetic embryos[J].Theriogenology,2017,87:25-35.
[16] Rodríguez-Alvarez L,Cox J,Tovar H,et al.Changes in the expression of pluripotency-associated genes during preimplantation and peri-implantation stages in bovine cloned and in vitro produced embryos[J].Zygote,2010,18:269-279.
[17] Majumdar G,Majumdar A,Verma IC,et al.Relationship between morphology,euploidy and implantation potential of cleavage and blastocyst stage embryos[J].J Hum Reprod Sci,2017,10:49-57.
[18] Pathak S,Kedia-Mokashi N,Saxena M,et al.Effect of tamoxifen treatment on global and insulin-like growth factor 2-H19 locus-specific DNA methylation in rat spermatozoa and its association with embryo loss[J].Fertil Steril,2009,91:2253-2263.
[19] Ankolkar M,Patil A,Warke H,et al.Methylation analysis of idiopathic recurrent spontaneous miscarriage cases reveals aberrant imprinting at H19 ICR in normozoospermic individuals[J].Fertil Steril,2012,98:1186-1192.
[20] Liu Y,Tang Y,Ye D,et al.Impact of abnormal DNA methylation of imprinted loci on human spontaneous abortion[J].Reprod Sci,2017,1:1933719117704906.
[21] Carrell DT.Aberrant methylation of the H19 imprinting control region may increase the risk of spontaneous abortion[J].Epigenomics,2013,5:23-24.

