阿帕替尼治療肺鱗癌影像學進展后維持治療獲益1例
患者男,65歲。因“頻繁刺激性干咳1個月余”于2016年2月就診于海南省人民醫院。CT掃描見右肺門區占位,伴下肺不張,雙肺多發結節,右側胸腔積液,考慮肺癌伴雙肺多發性轉移;顱腦、腹部掃描未見異常。纖支鏡活檢病理示:(右肺)低分化鱗癌。診斷為右肺鱗癌Ⅳ期。于2016年3月至2016年4月行NP方案化療2個周期,化療后出現4度骨髓抑制,評效為疾病穩定(stable disease,SD)。為提高患者療效于2016年5月行GP方案,但再次出現4度貧血伴粒缺性發熱。考慮到患者無法耐受聯合化療,于2016年7月行多西他賽單藥化療,但骨髓抑制仍然較為嚴重,患者因此拒絕繼續化療,末次化療后評效為SD。2016年9月返院復查CT提示右肺門區病灶明顯增大(圖1A),患者仍拒絕化療,EGFR及ALK基因檢測結果均為野生型,在充分告知出血風險并經患者同意后于2016年9月開始試用小劑量阿帕替尼治療250 mg/d,治療1個月后復查CT示:右肺門區病灶明顯退縮,病灶內出現厚壁空洞(圖1B),余病灶略縮小,評效為部分緩解(partial re?sponse,PR),患者咳嗽明顯緩解,無出血征象,不良反應為1度口腔黏膜炎,對癥治療可緩解,遂繼續小劑量阿帕替尼治療。右肺門區病灶保持穩定7個月(圖1C,1D)。2016年12月復查發現右肺上葉尖段新出現一團塊影,其內亦存在空洞(圖2A),PPD試驗陰性,考慮右上肺新發轉移瘤,評效為疾病進展(progression of disease,PD)。考慮到患者新發轉移病灶內空洞形成意味著抗腫瘤血管生成效應可能仍在持續,且患者癥狀控制較好,遂繼續口服阿帕替尼治療并將劑量上調至500 mg/d。患者于2017年3月復查見右肺上葉轉移病灶空洞壁變薄(圖2B),余病灶穩定,無新發病灶。患者生存質量佳,評效為治療獲益,目前仍繼續口服阿帕替尼治療。加量后不良反應為1度血壓升高。
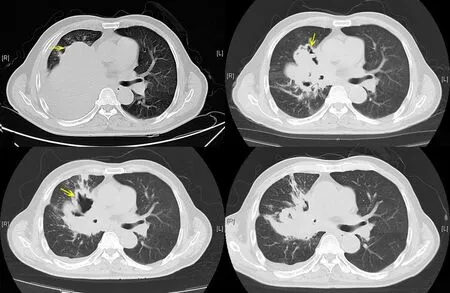
圖1 原發病灶CT
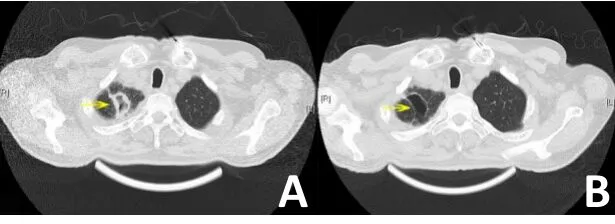
圖2 右肺新發轉移灶CT
小結 阿帕替尼為中國自主研發的一種新型小分子口服酪氨酸激酶抑制劑,其特異性可結合血管內皮生長因子受體2(VEGFR2)抑制下游信號轉導,從而抑制腫瘤生長[1]。1篇發表于2012年ASCO年會的Ⅱ期前瞻性隨機對照研究中(摘要號7508),90例多線化療失敗的非鱗非小細胞肺癌患者口服阿帕替尼治療750 mg/d,有效率顯著優于安慰劑組(12.2%vs.0,P=0.015 8),阿帕替尼降低了PD風險達70%以上,中位無進展生存期(median progression-free surival,mPFS)為4.7個月vs.1.9個月,HR為0.278,P<0.000 1),且無嚴重不良反應。一項發表于2017年ASCO年會的Ⅱ期單臂研究中,納入33例晚期2~3線治療后肺癌患者口服阿帕替尼單藥治療250 mg/d,其中9例鱗癌患者的mPFS為5.5個月(95%CI:0~13.9),與腺癌患者相當(mPFS:4.0個月,P=0.245)。本例患者在口服阿帕替尼治療3個月后出現新發轉移病灶,依據RECIST 1.1實體瘤評價標準評估為PD,但考慮到新發的轉移病灶內亦可見空洞形成,提示抗血管生效成治療可能持續有效,維持阿帕替尼并上調劑量后患者疾病保持穩定,生存質量良好,總體評效為治療獲益。同為靶向腫瘤血管生成的貝伐珠單抗已被證實在PD后繼續服用可獲益[2],提示抗腫瘤血管生成藥物可能有其獨特的作用模式,對傳統細胞毒性藥物臨床試驗制定的RECIST 1.1標準可能不適用于抗腫瘤血管生成治療,需要深入研究。根據早期貝伐珠單抗臨床研究經驗,肺鱗癌患者接受抗血管生成藥物治療發生嚴重出血的風險較大,口服阿帕替尼亦應警惕嚴重出血的不良反應。
[1]Zhang H.Apatinib for molecular targeted thera py in tumor[J].Drug Des Devel Ther,2015,9(1):6075-6081.
[2]Masi G,Salvatore L,Boni L,et al.Continuation or reintroduction of bevacizumab beyond progression to first-line therapy in metastatic colorectal cancer:final results of the randomized BEBYP trial[J].Ann Oncol,2015,26(4):724-730.

