原料配比對合成一氧化錳/碳微球結構和性能的影響*
龔顯年 ,黃榮榕 ,謝永純 ,喻 航 ,蘇 靜 ,龍云飛 ,吳曉丹 ,文衍宣
(1.廣西大學化學化工學院,廣西南寧530004;2.中信大錳礦業有限責任公司)
鋰離子電池因具有能量密度高、壽命長和安全穩定等特點而被廣泛應用于手機、攝像機、筆記本電腦等便攜式電子設備領域,且有望成為電動汽車的動力源[1-3]。隨著人們生活水平的提高以及對環保重視程度的提高,人們對鋰離子電池的需求和要求也在不斷提升,迫切希望容量更高循環性能更好的鋰離子電池出現。然而目前傳統商業化鋰離子電池負極材料石墨的理論容量(372 mA·h/g)較低,限制了其在高性能設備以及其他能量儲存領域的應用[4-5]。所以,研發一種更高比容量、更長壽命、更優異倍率性能的鋰離子電池負極材料至關重要。
在眾多負極材料中,過渡金屬氧化物因比容量高(通常大于700 mA·h/g,幾乎是石墨理論比容量的2倍)而倍受重視[6]。而在過渡金屬氧化物中,MnO具有相對較低的電壓滯后(<0.8 V)、適宜的可逆電位(~1.032 V vs.Li+/Li)、高達 755 mA·h/g的理論比容量、較低的市場價格以及環境友好等優點,使之成為有可能替代石墨的負極材料[7-9]。但較差的電子電導率和鋰離子嵌入脫嵌時的巨大體積變化導致MnO 的循環性能和倍率性能都不盡如人意[1,4,6]。 目前顆粒細化和碳包覆是改善MnO電化學性能比較常見的方法[10-12]。
MnO材料的合成方法主要有沉淀法[13]、水熱法[14]、模板法[15]等,其中沉淀法具有適合大規模生產的優點而成為制備MnO的最常用方法。沉淀法制備 MnO 主要以水為溶劑[13,16-18],采用其他溶劑制備MnO的研究較少。低共熔溶劑是指由氫鍵供體和氫鍵受體按照一定化學計量比組合而成的兩組分或多組分在低溫或常溫下呈液態的混合物[19],一般其熔點顯著低于各個組分純物質的熔點。低共熔溶劑因熔點低、熱穩定性好、溶解度高、不易揮發和電導率高等特點而被稱作綠色溶劑,在實際應用中凸顯出許多傳統溶劑無法比擬的優點[20]。
筆者在氯化膽堿-乙二醇低共熔溶劑中,以MnCl2·4H2O和NH4HCO3為原料,用化學沉淀法合成MnO/C多孔微球,并用X射線衍射、掃描電鏡、場發射掃描電鏡(FE-SEM)、比表面積及孔徑測試、恒電流充放電測試、循環伏安測試等研究了原料配比對MnO/C材料形貌、結構及電化學性能的影響。
1 實驗部分
1.1 材料制備
將氯化膽堿和乙二醇按物質的量比為1∶2混合,邊攪拌邊加熱至80℃,保溫2 h,自然冷卻至室溫,得到無色透明液體,裝瓶封口,放在干燥器中備用。將MnCl2·4H2O加入低共熔溶劑中配成0.4mol/L的MnCl2低共熔溶液;配制一定濃度的NH4HCO3低共熔溶液。將兩種溶液加入反應容器中恒溫35℃攪拌反應4 h,過濾、洗滌得到淺粉色MnCO3粉末。將MnCO3與蔗糖溶液按質量比為10∶4超聲混合,在60℃干燥得到MnCO3/蔗糖前驅體。將MnCO3/蔗糖前驅體在650℃氮氣氣氛中恒溫焙燒6 h,得到黑色MnO/C復合材料粉末。
1.2 材料表征
用X′Pert PRO型XRD儀分析材料的組成和晶體結構;用S-3400N型SEM和SU8010型FE-SEM觀察樣品的形貌和顆粒大小;用V-Sorb X800比表面測試儀測量樣品的比表面積和孔徑。
1.3 電化學測試
MnO/C活性材料、乙炔黑和黏結劑聚丙烯酸鋰(PAA-Li)按質量比為 8∶1∶1 在水溶劑中混合均勻,調成漿料并均勻涂在銅箔上,在120℃真空干燥箱中干燥12 h,最后切成直徑為14 mm的圓片制成正極片。將正極片、金屬鋰負極、隔膜(Celgard 2400聚丙烯微孔膜)和電解液[1 mol/L的LiPF6的EC(碳酸乙烯酯)/DMC(碳酸二甲酯)/EMC(碳酸甲乙酯)溶液,體積比為 1∶1∶1]在充滿氬氣的手套箱中裝配成CR2032型鈕扣電池。采用CT-3008電池測試系統測量材料的循環性能和倍率性能,電壓范圍為0.01~3.0 V。交流阻抗和循環伏安采用PCI4750型電化學工作站進行測試。交流阻抗的交流電壓為5 mV,頻率測試范圍為10-3~105Hz。循環伏安的電壓范圍為0.01~3.0 V,掃描速率為0.1 mV/s。
2 結果與討論
2.1 原料配比對材料形貌、結構的影響
2.1.1 XRD分析
圖1 為不同 n(NH4HCO3)∶n(MnCl2)合成 MnO/C的XRD譜圖。從圖1看出,不同原料配比條件下制得MnO/C的衍射峰均與MnO的標準譜圖(PDF#78-0424)相吻合,均屬于立方晶系;無其他雜峰和碳的衍射峰存在,說明得到的樣品是單一晶型的MnO材料,而且其中的碳是以無定形的形式存在。
2.1.2 SEM分析
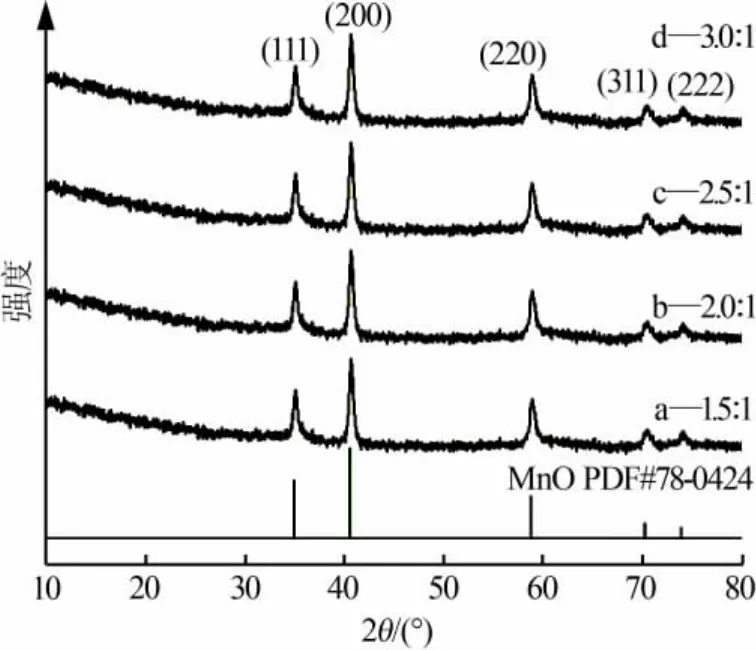
圖1 不同 n(NH4HCO3)∶n(MnCl2)合成 MnO/C 的 XRD 譜圖
圖2 、圖3 分別為不同 n(NH4HCO3)∶n(MnCl2)合成MnCO3和MnO/C的SEM照片。由圖2看出,前驅體MnCO3顆粒直徑為0.5~2.5 μm。隨著NH4HCO3加入量增加,顆粒直徑逐漸變小,顆粒大小分布趨于均勻,顆粒球體形狀越趨完整。在n(NH4HCO3)∶n(MnCl2)為 2.0∶1 時,MnCO3顆粒大小較為均勻,顆粒形狀基本呈球形,顆粒直徑平均在1 μm左右。隨著NH4HCO3加入量進一步增加,MnCO3顆粒形狀又偏離球體形狀,多為形似立方體或多面體形狀。圖3中MnO/C的顆粒大小和形狀與圖2中MnCO3的顆粒大小和形狀基本保持一致,且在n(NH4HCO3)∶n(MnCl2)為 2.0∶1 時 MnO/C 的顆粒大小分布較為均勻,顆粒的球體形狀較為完整,表明經過650℃高溫焙燒后材料的形貌沒有發生顯著的變化。

圖2 不同 n(NH4HCO3)∶n(MnCl2)合成 MnCO3的 SEM 照片

圖3 不同 n(NH4HCO3)∶n(MnCl2)合成 MnO/C 的 SEM 照片
2.1.3 氮氣吸附-脫附等溫線分析
圖4 為不同 n(NH4HCO3)∶n(MnCl2)合成 MnO/C的氮氣吸附-脫附等溫線及其孔徑分布曲線。由圖4看出,不同原料配比合成MnO/C的氮氣吸附-脫附等溫線都具有典型的H2型滯后環,說明合成的樣品均屬于介孔結構材料。這主要是由于焙燒過程中MnCO3分解為MnO和CO2,CO2氣體的產生并從反應體系中逸出從而形成了相互連通的多孔結構[21]。
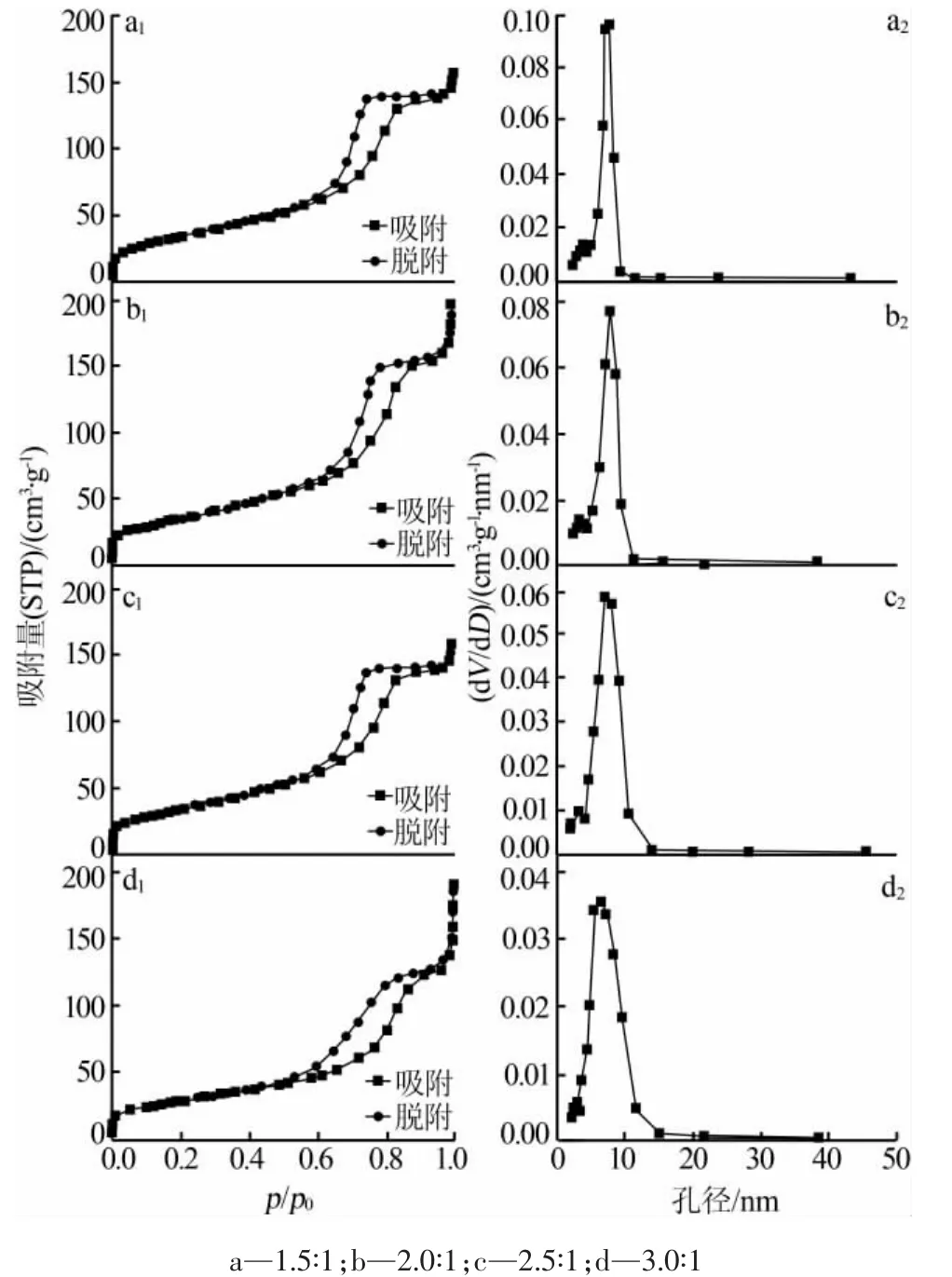
圖4 不同 n(NH4HCO3)∶n(MnCl2)合成 MnO/C 的氮氣吸附-脫附等溫線及其孔徑分布曲線
表1 為不同 n(NH4HCO3)∶n(MnCl2)合成 MnO/C的氮氣吸附-脫附曲線分析結果。從表1看出,MnO/C的比表面積、孔徑和孔體積均隨著n(NH4HCO3)∶n(MnCl2)的提高先增大后減小,在 n(NH4HCO3)∶n(MnCl2)為 2.0∶1 時 MnO/C 的比表面積、孔徑和孔體積最大,與SEM照片相吻合。
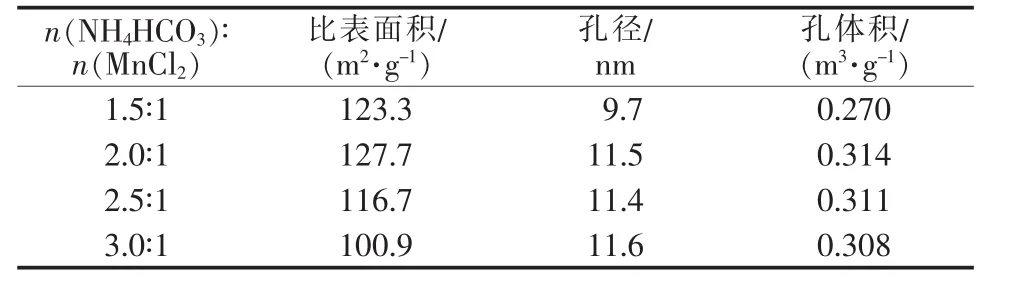
表1 不同 n(NH4HCO3)∶n(MnCl2)合成 MnO/C 的氮氣吸附-脫附曲線分析結果
2.2 原料配比對材料電化學性能的影響
2.2.1 循環性能和充放電比容量-電壓曲線
圖5a 為不同 n(NH4HCO3)∶n(MnCl2)合成 MnO/C在1C(755 mA/g)測試條件下的循環性能。由圖5a看出,不同原料配比合成的MnO/C首次比容量均高于理論比容量(755 mA·h/g),這主要是由于形成了不可逆的SEI膜,從而造成了首次放電比容量偏高。隨著n(NH4HCO3)∶n(MnCl2)增大,MnO/C 比容量呈現先增大后減小的趨勢,循環穩定性趨勢也是如此。當n(NH4HCO3)∶n(MnCl2)為 2.0∶1 時,MnO/C 第二次循環放電比容量為830 mA·h/g,循環50次后容量保持率接近100%,具有較高的比容量和較好的循環性能。 主要是由于 n(NH4HCO3)∶n(MnCl2)為 2.0∶1時,顆粒分布比較均勻,粒徑較小,具有較高的比表面積、孔徑和孔體積,從而增大了電極/電解液界面接觸面積,減小了鋰離子擴散距離,有利于鋰離子遷移和嵌入,從而具有較好的循環性能。圖5b為不同n(NH4HCO3)∶n(MnCl2)合成 MnO/C 的充放電比容量-電壓曲線。由圖5b可知,不同原料配比合成MnO/C的充放電比容量-電壓曲線都在0.35 V左右有一個放電平臺,對應Mn2+還原為Mn過程。與放電曲線相比充電曲線沒有出現明顯的電壓平臺,但在1.0~1.5 V有一個較緩斜坡,主要是金屬錳氧化生成MnO的反應,而在2.0 V左右的另一個較小斜坡則是由于 Mn2+被進一步氧化為更高價態[4,6,22]。
2.2.2 倍率性能和充放電比容量-電壓曲線
圖6a、b 分別為 n(NH4HCO3)∶n(MnCl2)為 2.0∶1時合成MnO/C的倍率性能和充放電比容量-電壓曲線。從放電循環曲線和充放電比容量-電壓曲線可知,隨著電流密度增大,材料的比容量呈階梯狀下降、電壓平臺變窄,說明電流增大會引起電極極化增大,導致充放電比容量下降。由放電循環階梯倍率性能曲線可知,在 0.5、1.0、2.0、3.0、0.5C 放電倍率下對應的放電比容量分別為 885.7、794.0、725.1、670.2、920.5 mA·h/g,當電流恢復到小倍率時,容量也恢復到原來的高水平,說明制備的MnO/C負極材料具有優異的倍率性能。
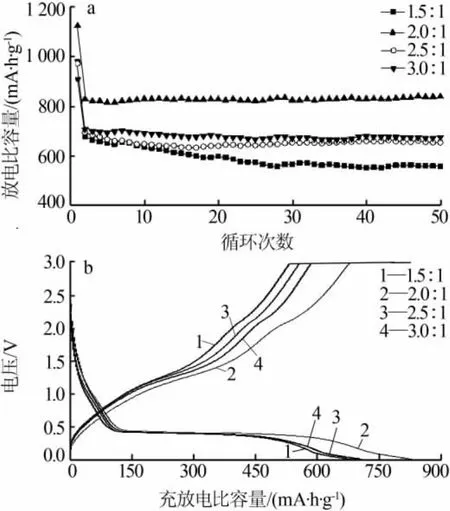
圖5 不同 n(NH4HCO3)∶n(MnCl2)合成 MnO/C 的循環性能曲線(a)和充放電比容量-電壓曲線(b)
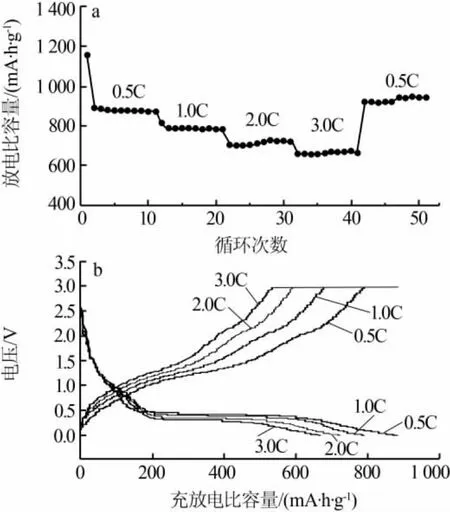
圖6 n(NH4HCO3)∶n(MnCl2)為 2.0∶1 時合成 MnO/C 的倍率性能曲線(a)和充放電比容量-電壓曲線(b)
2.2.3 循環伏安曲線
圖7 為 n(NH4HCO3)∶n(MnCl2)為 2.0∶1 時合成MnO/C的循環伏安曲線。從圖7看出,第一圈曲線的陰極掃描出現一個細長尖銳的還原峰,峰電壓為0.02 V,這個尖銳峰的出現主要是由于第一圈材料放電時形成了不可逆的固態SEI膜,同時對應于MnO還原生成金屬錳。從第二圈開始還原峰電壓變成了0.3 V,并且電壓位置不再發生變化,這表明從第二圈開始MnO+2Li→Mn+Li2O是一個可逆反應。再看閉合曲線上半部分,很容易發現從第一圈到第五圈都出現了一高一低2個氧化峰,第一個氧化峰電壓均為1.3 V對應Mn+Li2O→MnO+2Li反應,而第二個氧化峰電壓均為2.05 V,這個多出來的氧化峰已經被廣泛證實,經過優良制備的氧化錳由于快速Li反應動力提升,電極中Mn2+可以進一步氧化為更高的氧化態(大于2價)[22-24]。 也正是Mn2+可以進一步氧化為更高的氧化態,因此使得最優材料的放電比容量比理論比容量要高。從圖7看出,自第二圈起,循環伏安曲線基本重疊在一起,這說明制備的材料具有優良的電化學性能,這與循環性能圖相對應。
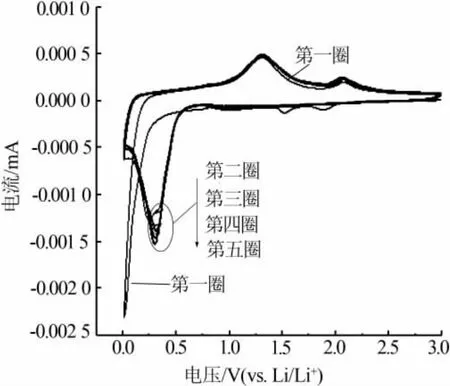
圖7 n(NH4HCO3)∶n(MnCl2)為 2.0∶1合成MnO/C的循環伏安曲線
2.2.4 交流阻抗擬合譜圖及等效電路
圖8 為不同 n(NH4HCO3)∶n(MnCl2)合成 MnO/C的交流阻抗擬合譜圖及其等效電路。由交流阻抗擬合譜圖可知,各個樣品的曲線都是由高頻區半圓、中頻區半圓和低頻區斜線組成,高頻區半圓與SEI膜電阻和歐姆電阻有關,中頻區半圓與電荷轉移電阻和雙電層電容有關,而低頻區斜線對應鋰離子在界面擴散引起的 Warburg 阻抗[25]。
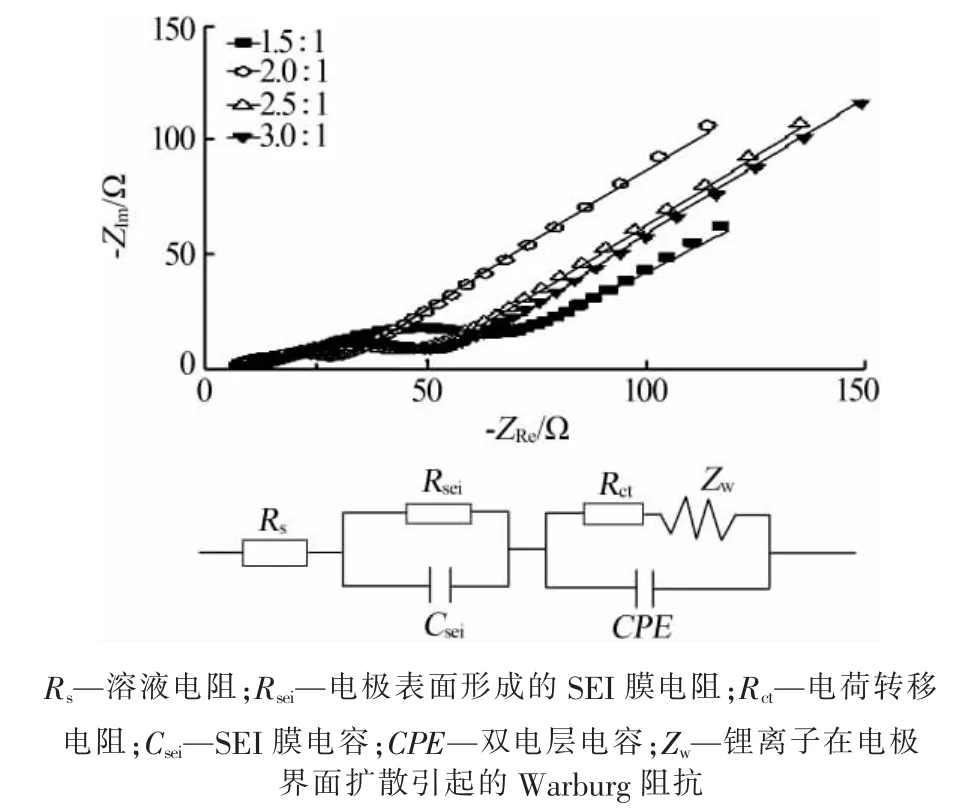
圖8 不同 n(NH4HCO3)∶n(MnCl2)合成 MnO/C 的交流阻抗譜圖及其等效電路
表2 給出不同 n(NH4HCO3)∶n(MnCl2)合成 MnO/C交流阻抗譜圖等效電路參數。從表2看出,隨著n(NH4HCO3)∶n(MnCl2)增大,Rs、Rsei、Rct先減小后增大,而鋰離子擴散系數則先增大后減小,但Rs變化幅度較小。 當 n(NH4HCO3)∶n(MnCl2)為 2.0∶1 時,MnO/C 具有較低 Rs、Rsei、Rct以及較大的鋰離子擴散系數。主要是該條件合成的MnO/C具有較大的比表面積、孔徑、孔體積以及較小的粒徑,從而具有較大的電極/電解液界面接觸面積和較短的鋰離子擴散距離,有利于鋰離子遷移和嵌入,從而具有較好的循環性能和倍率性能,與圖5和圖6結果一致。
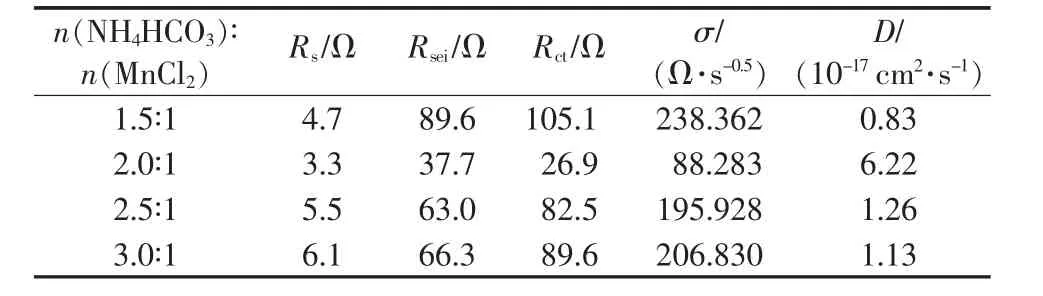
表2 不同 n(NH4HCO3)∶n(MnCl2)合成MnO/C的交流阻抗擬合結果
3 總結
在低共熔溶劑中用沉淀法制備了鋰離子電池MnO/C多孔微球負極復合材料,并研究了n(NH4HCO3)∶n(MnCl2)對材料形貌、結構和電化學性能的影響。得出如下結論:1)MnO/C比表面積、孔徑、孔體積、比容量、循環性能和倍率性能均隨著 n(NH4HCO3)∶n(MnCl2)增加先增大后減小;2)n(NH4HCO3)∶n(MnCl2)為2.0∶1時制備的MnO/C多孔球體顆粒直徑為0.5~2.5μm,平均孔徑為11.5nm,比表面積高達127.7m2/g;3)MnO/C多孔球體顆粒在1C測試條件下放電比容量為830 mA·h/g,循環50次后容量保持率接近100%,具有較高的比容量和較好的循環性能。
[1]Zhu C,Han C G.Facile synthesis of MnO/carbon composites by a single-step nitrate-cellulose combustion synthesis for Li ion battery anode[J].Journal of Alloys& Compounds,2016,689:931-937.
[2]Dunn B,Kamath H,Tarascon J M.Electrical energy storage for the grid:a battery of choices[J].Science,2011,334(6058):928-935.
[3]Roy P.Nanostructured anode materials for lithium ion batteries[J].Journal of Materials Chemistry A,2015,3(6):2454-2484.
[4]Liu B,Li D,Liu Z,et al.Carbon-wrapped MnO nanodendrites interspersed on reduced graphene oxide sheets as anode materials for lithium-ion batteries[J].Applied Surface Science,2016,394:1-8.
[5]Yoo H D,Markevich E,Salitra G,et al.On the challenge of developing advanced technologies for electrochemical energy storage and conversion[J].Materials Today,2014,17(3):110-121.
[6]Liu D H,Lü H Y,Wu X L,et al.Constructing the optimal conductive network in MnO-based nanohybrids as high-rate and long-life anode materials for lithium-ion batteries[J].Journal of Materials Chemistry A,2015,3(39):19738-19746.
[7]Zhang K,Han P,Gu L,et al.Synthesis of nitrogen-doped MnO/graphene nanosheets hybrid material for lithium ion batteries[J].ACS Applied Materials& Interfaces,2012,4(2):658-664.
[8]Xia Y,Xiao Z,Dou X,et al.Green and facile fabrication of hollow porous MnO/C microspheres from microalgaes for lithium-ion batteries[J].ASC Nano,2013,7(8):7083-7092.
[9]Jiang H,Hu Y,Guo S,et al.Rational design of MnO/carbon nanopeapods with internal void space for high-rate and long-life Li-ion batteries[J].ACS Nano,2014,8(6):6038-6046.
[10]SunX,XuY,DingP,etal.Thecompositesphereofmanganeseoxide and carbon nanotubes as a prospective anode material for lithiumionbatteries[J].JournalofPowerSources,2014,255(6):163-169.
[11]Zhong K,Xia X,Zhang B,et al.MnO powder as anode active materials for lithium ion batteries[J].Journal of Power Sources,2010,195(10):3300-3308.
[12]ChaeC,ParkH.ALi-ionbatteryusingLiMn2O4cathodeand MnOx/C anode[J].Journal of Power Sources,2013,244(4):214-221.
[13]Liu Y,Zhao X.Facile synthesis of MnO/C anode materials for lithium-ion batteries[J].Electrochimica Acta,2011,56 (18):6448-6452.
[14]Park H,Yeom D H.MnO/C nanocomposite prepared by one-pot hydrothermal reaction for high performance lithium-ion battery anodes[J].Korean Journal of Chemical Engineering,2015,32(1):178-183.
[15]Wang T,Peng Z P,Wang Y,et al.MnO nanoparticle@mesoporous carbon composites grown on conducting substrates featuring highperformance lithium-ion battery,supercapacitor and sensor[J].Scientific Reports,2013,3(9):2693-2701.
[16]Zhong K,Zhang B,Luo S,et al.Investigation on porous MnO microsphere anode for lithium ion batteries[J].Journal of Power Sources,2011,196(16):6802-6808.
[17]Li K,Shua F,Guo X,et al.High performance porous MnO@C composite anode materials for lithium-ion batteries[J].Electrochimica Acta,2016,188(3):793-800.
[18]Wang S,Xing Y.MnO nanoparticles interdispersed in 3D porous carbon framework for high performance lithium-ion batteries[J].ACS Applied Materials& Interfaces,2014,6(15):12713-12718.
[19]韋露,樊友軍.低共熔溶劑及其應用研究進展[J].化學通報,2011,74(4):333-339.
[20]Welton T.Room-temperature ionic liquids.solvents for synthesis and catalysis[J].Chemical Reviews,1999,99(8):2071-2083.
[21]Yang Z,Zhang W,Wang Q,et al.Synthesis of porous and hollow microspheres of nanocrystalline Mn2O3[J].Chemical Physics Letters,2006,418(1/2/3):46-49.
[22]Sun Y.Reconstruction of conformal nanoscale MnO on graphene as a high-capacity and long-life anode material for lithium ion batteries[J].Advanced Functional Materials,2013,23(19):2436-2444.
[23]Wang H,Cui L F,Yang Y,et al.Mn3O4-graphene hybrid as a highcapacity anode material for lithium ion batteries[J].Journal of the American Chemical Society,2010,132(40):13978-13980.
[24]Guo J,Liu Q.Interdispersed amorphous MnOx-carbon nanocomposites with superior electrochemical performance as lithium-storage material[J].AdvancedFunctionalMaterials,2012,22(4):803-811.
[25]莊全超,徐守冬,邱祥云,等.鋰離子電池的電化學阻抗譜分析[J].化學進展,2010,22(6):1044-1057.

