水稻類病斑突變體spl34的鑒定與基因精細定位
劉寶玉 劉軍化 杜 丹 閆 萌 鄭麗媛 吳 雪 桑賢春 張長偉
?
水稻類病斑突變體的鑒定與基因精細定位
劉寶玉 劉軍化 杜 丹 閆 萌 鄭麗媛 吳 雪 桑賢春 張長偉*
西南大學水稻研究所 / 轉基因植物與安全控制重慶市重點實驗室, 重慶 400716
利用化學誘變劑EMS處理秈型水稻恢復系“縉恢10號”, 從其后代中篩選到1個遺傳穩定的類病斑突變體。該突變體于分蘗后期在下部葉片的葉鞘上開始出現褐色的類病斑, 隨后沿著中脈擴散至整個葉片, 成熟期擴散至整個植株。相比于野生型, 該突變體的株高顯著變矮, 穗長顯著變短, 穗粒數、結實率和千粒重極顯著降低。遮光試驗和組織化學分析表明, 突變體類病斑的形成受光誘導, 在類病斑形成部位發生大量過氧化氫沉積和細胞程序性死亡。熒光顯微鏡觀察發現, 在紫外光照射下突變體產生的熒光較野生型弱。與野生型相比, 突變體的H2O2和O2-含量較高, 而CAT、POD和T-SOD等保護酶的活性顯著降低; 稻瘟病抗性無明顯差異或略顯降低。遺傳分析表明, 突變體的表型受1對隱性核基因控制。基因定位結果表明, 該基因定位于第4染色體的LR49和LR52兩個分子標記之間, 物理距離為200 kb。測序分析發現該區間內的候選基因的第3449位堿基發生突變(G3449T), 導致色氨酸替換為半胱氨酸。qRT-PCR結果表明該基因在突變體內表達量降低, 而部分病程相關基因的表達量則升高。
水稻; 類病斑突變體;; 基因; 精細定位
植物類病斑突變體是指植物在未受到外界逆境脅迫、傷害或病原菌侵染的情況下, 在其葉片、葉鞘等部位自發形成各種類似于壞死病斑的一類突變體[1]。根據類病斑突變體表型特征及類病斑分布情況, 可將其分為起始型和擴散型, 起始型具有大小及分布位置較穩定的斑點, 而擴散型的斑點在形成后會擴散到葉片其他部位甚至葉鞘和莖稈[2-3]。類病斑突變體的發生機制主要有抗病抗逆相關基因的突變或缺失、活性氧及羥自由基在植物體內的積累、正常代謝途徑的紊亂和外界條件(如光照、溫度)的影響等[4]。植物類病斑的產生與植物受到環境脅迫或病原菌侵害時的應激反應類似, 都取決于植物的基因型和所處的環境條件, 因此可用于研究植物對環境脅迫和病原菌入侵的反應[5]。
迄今在擬南芥[6]、玉米[7]、番茄[8]、水稻[9]等植物中均有類病斑突變體報道。水稻中已報道的類病斑突變體很多與其抗性有關[10-11], 如突變體[12]、[13][14]、[15]等對稻瘟病和白葉枯病的抗性均增強; 突變體[16]對稻瘟病的抗性增強, 對白葉枯病的抗性則無影響; 突變體[17]和[18]對白葉枯病的抗性增強, 對稻瘟病的抗性影響則尚不明確; 而[19]對稻瘟病的抗性降低或不變。在這些水稻類病斑突變體中, 第一個被克隆的類病斑突變基因是[2,19], 該基因位于第5染色體上, 編碼一個熱激轉錄因子蛋白; 其余已克隆的水稻類病斑突變體基因有[15]、[20][21]、[22]、[23]、[24]、[25]、[26]、[27]、[12]、[16]、[14]、[28]、[29]、[13]、[30]、[31]、[32]和[33], 但相比于發現的突變體數, 目前已被克隆的類病斑體基因數還比較少。
我們通過EMS誘變秈稻“縉恢10號”, 從其后代中篩選出1個遺傳性狀穩定的類病斑突變體。與野生型相比, 該突變體苗期和分蘗前期表型正常, 從分蘗后期開始倒三、倒四葉的葉鞘出現褐色斑點, 隨后斑點先沿著中脈向上部擴散, 再由中脈向葉片兩側擴散, 至成熟期褐色斑點分布于整個植株的葉片及葉鞘, 這與已報道的水稻類病斑突變體表型不同。因此, 本文從遺傳特性、農藝性狀、組織化學分析、稻瘟病抗性鑒定及基因定位等方面對類病斑突變體進行系列試驗, 以期為研究和應用控制該突變體性狀的相關基因奠定基礎。
1 材料與方法
1.1 供試材料
利用EMS化學誘變劑誘變秈型水稻恢復系“縉恢10號”獲得突變體, 經過連續4代種植, 發現該突變體表型穩定遺傳。將與秈稻不育系“西農1A”雜交獲得F1和F2種子用于遺傳分析, 利用F2群體對突變體基因進行分子定位。用于稻瘟病菌生理小種鑒別的7個供試品種分別為Tetep、珍龍13、四豐43、東農363、關東51、合江18和麗江新團黑谷。供試穗頸瘟標樣采集自四川省的敘永縣、冕寧縣, 及重慶市的黔江、合川、南川、永川等地的一些主栽或新推廣品種。
1.2 農藝性狀考察
將野生型“縉恢10號”和突變體種植于田間小區, 3次重復, 每個重復10行, 每行10株。至成熟期, 隨機從小區中央選取10株考察株高、有效穗數、穗長、穗粒數、結實率、千粒重等農藝性狀, 并作檢驗統計分析。
1.3 遮光試驗
在田間條件下, 用約2 cm長的錫箔紙分別對處于抽穗期即將出現表型的野生型和突變體葉片進行包裹遮光處理, 1周后揭掉錫箔紙對葉片進行復光處理, 復光處理時間也為1周; 期間分別對遮光處理和復光處理的葉片跟蹤拍照記錄。
1.4 光合色素含量測定
參考Lichtenthaler[34]的方法, 分別測定野生型和突變體抽穗期的倒一、倒二和倒三葉的光合色素含量。8:30—9:00在小區中間選取長勢相對一致的野生型和突變體植株各5株, 稱取0.05 g葉片將其剪碎后浸泡于25 mL體積比為乙醇∶丙酮=1∶1的溶液中, 設置3個重復, 暗處理24 h, 期間振蕩數次; 然后用分光光度計測定663、645和470 nm波長下的吸光值, 計算光合色素含量, 并作檢驗統計分析。
1.5 葉綠體的熒光顯微鏡觀察
抽穗期, 分別剪取野生型和突變體倒二葉中部約1 cm長葉片包埋于包埋劑(Tissue-Tek, SAKURA)中, 然后-20°C冷凍至包埋劑凝固后用冷凍切片機切成8 μm厚的切片, 取沖洗干凈的載玻片粘取切片, 用生理鹽水將切片清洗3次, 把切片周圍的包埋劑清洗干凈后蓋上蓋玻片, 最后在熒光顯微鏡下觀察葉綠體的熒光現象。
1.6 突變體的組織化學分析
為檢測突變體在類病斑形成過程中是否存在細胞死亡和過氧化氫積累, 在抽穗期分別取野生型和突變體相同部位的葉片, 參照Bowling等[35]的方法進行臺盼藍染色和參照Thordal-Christensen等[36]的方法進行DAB染色。
1.7 生理指標測定
在抽穗期, 分別取野生型和突變體各3株, 用南京建成科技有限公司提供的試劑盒, 按其說明書測定倒一、倒二、倒三葉過氧化氫、羥自由基和超氧陰離子的含量, 以及過氧化氫酶(CAT)、過氧化物酶(POD)、總超氧化物歧化酶(T-SOD)的活性等生理生化指標, 并進行檢驗。
1.8 稻瘟病菌抗譜測定和抗性鑒定
在西南大學水稻研究所歇馬基地溫室內進行抗譜測定和苗瘟抗性鑒定, 在四川省農業科學院水稻高粱研究所敘永稻瘟病病圃進行葉瘟和穗頸瘟抗性鑒定。參照黃富等[37]的方法, 進行單孢分離純化、產孢培養和制備孢子懸浮液, 共分離了56個單孢菌株。參照張長偉等[38]的方法進行稻瘟病菌抗譜測定和苗瘟、葉瘟、穗頸瘟的抗性鑒定。按全國稻瘟病菌生理小種聯合試驗組[39]的方法和標準對供試菌株進行生理小種劃分和命名。以抗病頻率作為野生型和突變體的抗譜評價指標, 抗病頻率越高, 表明該材料對稻瘟病菌群體的抗譜范圍越寬, 廣譜抗性越強。
抗病頻率(%) = (對該供試材料非致病菌株數/測試有效菌株總數)×100
按國際水稻研究所(IRRI)水稻標準評級系統(0~9級)標準(IRRI, 2002)[40], 以苗瘟病情指數、葉瘟病情指數分別作為野生型和突變體的苗瘟、葉瘟抗性評價指標。
病情指數(%) = ∑(病害某一級別的植株數×病害的相對病級數值)/(病害的最高病級數值×調查總株數)×100。
另外, 以病穗率作為野生型和突變體的穗頸瘟抗性評價指標。
1.9 基因定位
根據F2群體中正常植株和突變體植株的比值, 選取F2中突變體植株用于基因定位, 采用CTAB法[41]提取親本和基因定位群體的基因組DNA。首先隨機選取F2中正常植株和突變體植株各10株, 剪取葉片等量混勻構建正常基因池和突變體基因池。用本實驗室已備好的96對均勻分布于水稻12條染色體上的多態性分子標記對基因池進行擴增, 將具有偏態的標記用單株進行驗證, 以確定分子標記與突變位點是否連鎖。再在連鎖標記位點兩側自行設計InDel標記對突變位點進行初步定位。分子標記由上海英駿生物技術有限公司合成。PCR體系為12.5 μL, 含1.25 μL 10 × PCR buffer、0.5 μL 2.5 mmol L–1dNTPs、正反引物各0.5 μL、1.0 μL模板DNA、0.1 μL 5 U rDNA聚合酶、8.65 μL ddH2O。PCR程序為預變性94°C 5 min; 變性94°C 30 s, 退火55°C 30 s, 延伸72°C 30 s, 35個循環; 再延伸72°C 10 min。PCR產物經聚丙烯酰胺凝膠電泳及銀染后記錄帶型。
1.10 候選基因分析及測序
利用GRAMENE、國家水稻數據中心和NCBI等網站查閱定位區間內的基因注釋并分析, 遴選候選基因。為候選基因設計引物, 以野生型和突變體基因組DNA為模板進行PCR, 產物用于測序。用VectorNTI軟件比對測序結果。
1.11 總RNA提取及qRT-PCR
抽穗期取野生型的正常葉片、葉鞘和突變體有類病斑的葉片和葉鞘, 按試劑盒說明書提取總RNA, 試劑盒由北京普洛麥格生物技術有限公司提供。參照TAKARA的PrimeScript RT reagent Kit with gDNA Eraser (Perfect Real-time)試劑盒反轉錄。qRT-PCR反應體系為20 μL, 含10 μL 2 × SYBR Premix ExII, 0.4 μL 50 × ROX Reference Dye, 2 μL cDNA模板, 正、反引物(10 μmol L–1)各0.6 μL, 6.4 μL RNase-free H2O。在Bio-Rad熒光定量PCR儀上擴增后, 利用CFX-Manager軟件收集和整理數據, 并進行檢驗。
2 結果與分析
2.1 突變體表型及主要農藝性狀
整個生育期野生型植株未出現類病斑, 而在分蘗后期突變體下部葉片的葉鞘上開始出現褐色斑點, 隨后褐色斑點向植株上部擴散, 至成熟期整個植株的葉片和葉鞘均分布有褐斑(圖1-A, B, C)。成熟期突變體的株高、穗長較野生型顯著降低, 每穗粒數、結實率和千粒重較野生型極顯著降低, 但兩者的有效穗數則無顯著差異(表1)。
2.2 對遮光處理的響應
對野生型的葉片和突變體即將出現類病斑的葉片用錫箔紙進行遮光處理1周后顯示, 突變體被錫箔紙遮蓋的部位不出現或只出現極少量的類病斑, 而葉片其他部位出現大量的類病斑。遮光處理的部位復光1周后出現明顯的類病斑(圖2)。說明突變體的類病斑受光誘導。
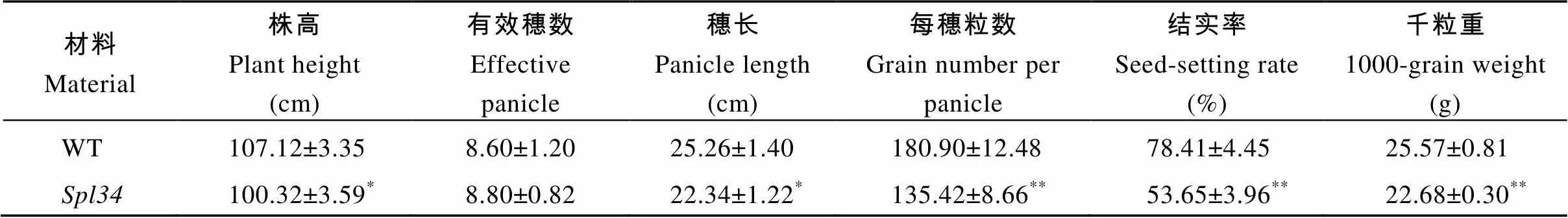
表1 野生型(WT)和spl34的主要農藝性狀
*在0.05水平上差異顯著;**在0.01水平上差異顯著。
*Significantly different at<0.05;**significantly different at<0.01.

圖1 分蘗期、成熟期野生型(WT)和突變體spl34的表型
A: 分蘗期野生型(WT)和突變體植株; B: 成熟期野生型(WT)和突變體植株; C: 成熟期野生型(WT)和突變體的葉片。
A: plants of the wild type (WT) and themutant at tillering stage; B: plants of the wild type (WT) and themutant at mature period; C: leaves of the wild type (WT) and themutant at mature period.

圖2 遮光對野生型和突變體spl34葉片的影響
A: 野生型遮光處理后; B: 野生型遮光處理后復光1周; C: 突變體遮光后; D: 突變體遮光處理后復光1周后。
A: leaf of the wild type after shading; B: leaf of wild type regained normal light for one week after shading; C: leaf ofafter shading; D: leaf ofregained normal light for one week after shading.
2.3 光合色素含量的變化
抽穗期突變體的倒一葉光合色素含量均略高于野生型, 但未達到顯著差異水平; 而倒二葉和倒三葉光合色素含量均較野生型低, 且分別達到了顯著和極顯著差異水平(圖3), 這與突變體在抽穗期倒一葉還未出現類病斑, 倒二葉出現類病斑但較倒三葉少有關。
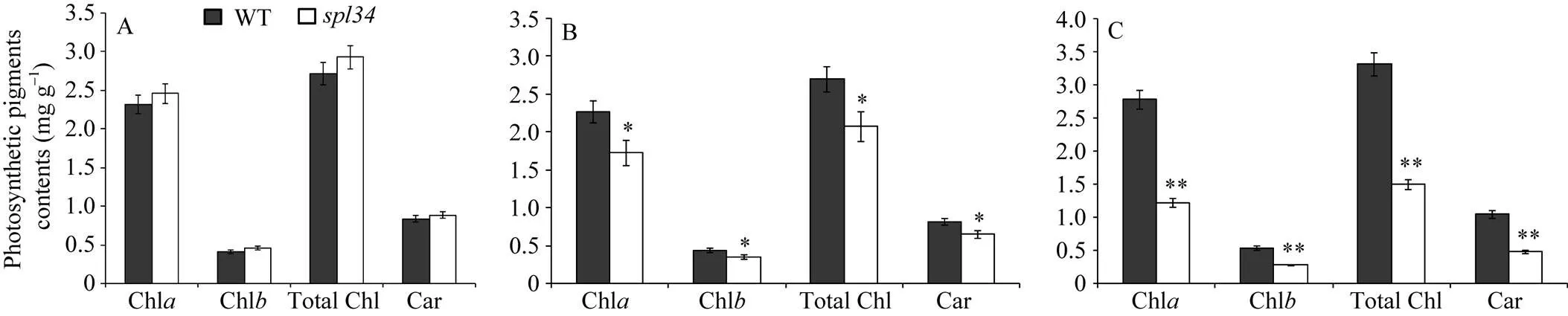
圖3 野生型(WT)和突變體spl34抽穗期光合色素含量
*在0.05水平上差異顯著; **在0.01水平上差異顯著。A~C: 抽穗期野生型(WT)和突變體的倒一葉(A)、倒二葉(B)和倒三葉(C)光合色素含量。
A-C: photosynthetic pigments contents of the flag leaves, second leaves, third leaves respectively in the wild type and themutant at heading stage. * Significantly different at<0.05; ** significantly different at<0.01.
2.4 突變體熒光顯微鏡觀察結果
抽穗期取野生型的葉片及突變體有類病斑的葉片制作冷凍切片, 于熒光顯微鏡下觀察顯示, 突變體的葉綠體產生的紅色熒光弱于野生型, 且突變體中出現類病斑的部位(圖4-D中白色箭頭處)葉綠體產生的紅色熒光也較未出現類病斑的部位弱(圖4-D中黃色箭頭處), 說明突變體產生類病斑的部位發生了葉綠素降解。
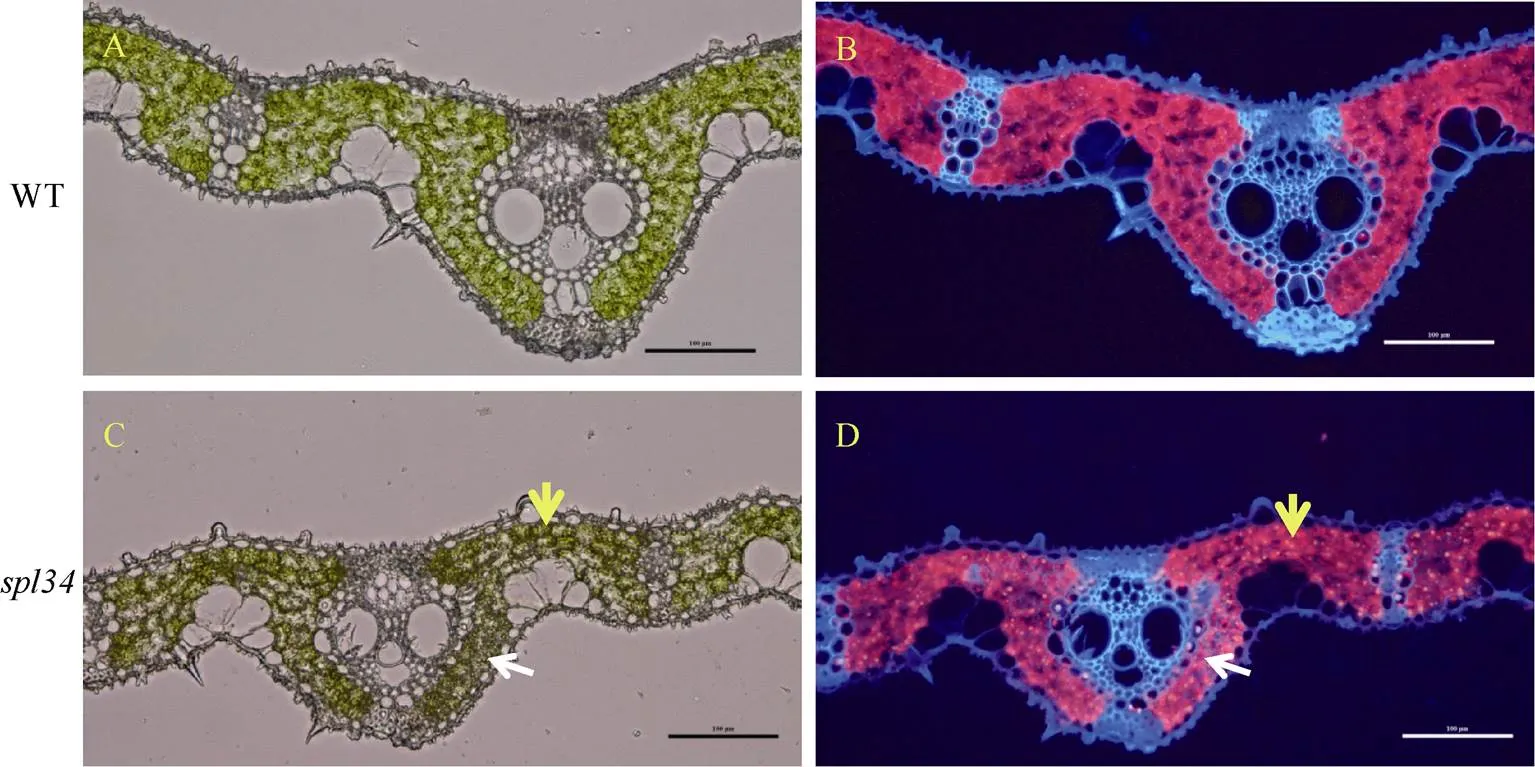
圖4 野生型和突變體spl34葉片的自發熒光
A, B: 野生型在自然光和紫外光下葉片橫切顯微結構; C, D: 突變體在自然光和紫外光下葉片橫切顯微結構; 標尺: 100 μm。白色箭頭所指部位為類病斑形成部位, 黃色箭頭所指部位為未形成類病斑部位。
A, B: microstructure in cross section of wild type under natural light and UV light; C, D: microstructure in cross section ofmutant under natural light and UV light; Bar=100 μm. The positions pointed by white arrows are the lesion formation sites, those with yellow arrows are the sites without lesion mimic.
2.5 突變體葉片的細胞程序性死亡和H2O2積累
臺盼藍染色結果顯示, 突變體的葉片有類病斑的部位及其周圍被染成深藍色, 說明該部位存在細胞程序性死亡, 而野生型的葉片被染成均勻的淺藍色, 說明其葉片上未發生細胞程序性死亡(圖5-A, B)。這可能是產生類病斑的部位發生了過敏性反應而導致細胞死亡。DAB染色結果顯示, 突變體的葉片上有大量紅褐色斑點, 而野生型的葉片上并未出現類似的斑點(圖5-C, D), 說明突變體在類病斑產生的過程中伴隨著H2O2的積累。

圖5 野生型(WT)和突變體spl34的組織化學分析
A, B: 野生型(WT)和突變體葉片的臺盼藍染色; C, D: 野生型(WT)和突變體葉片的DAB染色。
A, B: leaves of the wild type (WT) and themutant stained by trypan blue; C, D: leaves of the wild type (WT) and themutant stained by DAB.
2.6 突變體生理指標的變化
抽穗期突變體的H2O2含量極顯著高于野生型, 而其O2-含量只有倒三葉較野生型極顯著升高, 倒一、倒二葉的O2-含量與野生型相比無顯著差異, 這可能與突變體孕穗期倒一葉無類病斑, 倒二葉剛出現類病斑, 倒三葉類病斑較明顯有關; 突變體的?OH含量與野生型相比無顯著差異(圖6-A~C)。對CAT、POD、SOD等抗氧化酶活性測定結果顯示, 突變體的抗氧化酶活性顯著或極顯著低于野生型(圖6-D~F), 說明植株體內的抗氧化酶活性降低使得突變體清除自由基能力下降, 導致突變體體內的H2O2和O2-含量升高, 而?OH因其氧化能力很強, 產生后便立刻與其他分子發生反應, 不需要專門的酶來清理, 因此突變體體內的抗氧化酶活性降低對其含量影響不大。
2.7 突變體的稻瘟病菌抗譜測定和稻瘟病抗性鑒定
56個供試單孢菌株中有54個菌株對麗江新團黑谷嚴重侵染, 為有效菌株。54個有效菌株經7個中國鑒別品種鑒定劃分為6個中國生理群19個生理小種。ZB 群為優勢種群, 小種出現頻率為61.11%; ZA群為重要種群, 小種出現頻率為20.37%; ZC、ZD、ZE和ZG等種群的小種出現頻率均較低, 分別為3.7%、3.7%、1.86%和12.96%。
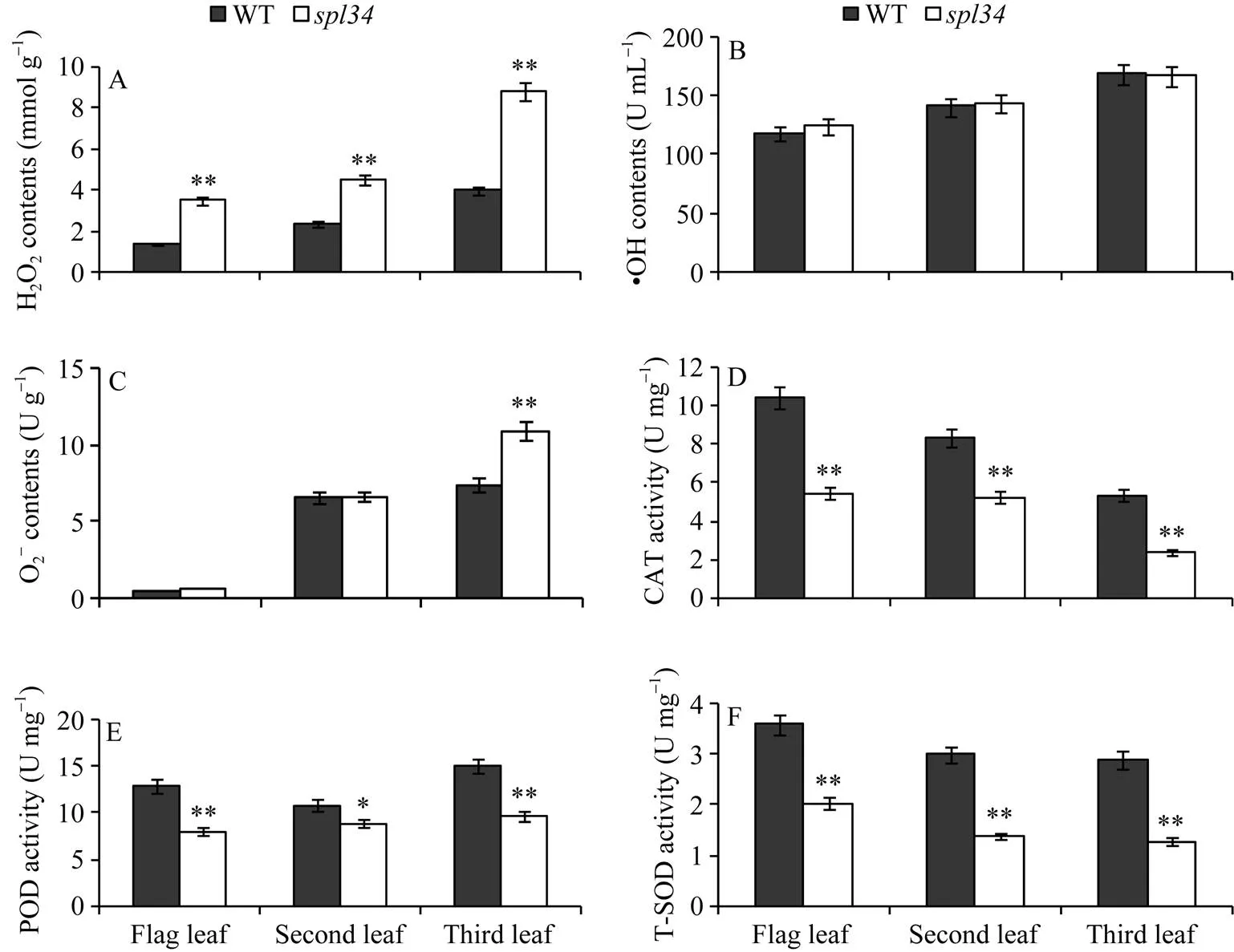
圖6 抽穗期野生型(WT)和突變體spl34的生理指標
*在0.05水平上差異顯著; **在0.01水平上差異顯著。
* Significantly different at<0.05; ** significantly different at<0.01.
表2顯示, 突變體對ZA生理群的抗病頻率比野生型升高15.38%, 而對ZB生理群的抗病頻率比野生型降低3.63%, 對ZC、ZD、ZE和ZG生理群的抗病頻率則與野生型相同, 特別是對總群的抗病頻率也與野生型相同。說明與野生型相比, 突變體的抗譜并未明顯拓寬。
苗瘟、葉瘟和穗頸瘟的抗性鑒定結果(表3)顯示, 突變體苗瘟、葉瘟病情指數和穗頸瘟的病穗率均比野生型略高, 但差異并不顯著。說明突變體與野生型的稻瘟病抗性差異也不明顯或略顯降低。
2.8 突變體的遺傳分析
以表型正常的“西農1A”為母本, 突變體為父本雜交得到的F1表型正常, F1自交得到的F2出現性狀分離, 正常株1774株, 突變株562株, 經卡方分析c2=1.06 4) 遙控停車。當主機運行、控制部位在集控臺時,將集控臺上的車鐘手柄扳至停車位置,系統向電噴控制系統發出停車指令,由電噴控制系統控制主機停機。 表2 野生型(WT)與突變體spl34對稻瘟病菌的抗譜 表3 野生型(WT)與突變體spl34的稻瘟病病情指標 將F2群體中的突變體植株用于基因定位。用本實驗室已準備好的96對均勻分布于12條染色體上的具有多態的引物對正常基因池和突變體基因池進行擴增, 發現位于第4染色體編號為ID40的分子標記與突變基因連鎖, 在該分子標記兩側開發新的具有多態的InDel分子標記(表4), 將目標基因定位于LR7和LR14兩個分子標記之間, 為了進一步確定目標基因的位置在LR7和LR40之間又開發5對具有多態的InDel分子標記(表4), 最終將目標基因定位在LR49和LR52兩個分子標記之間, 遺傳距離分別為1.07 cM和0.09 cM, 區間大小約為200 kb。 表4 新開發的InDel標記 利用GRAMENE、國家水稻數據中心和NCBI等網站查閱定位區間內的基因注釋, 發現區間內共包含了32個候選基因, 與類病斑突變有一定相關性的有:編碼富含半胱氨酸的類受體蛋白激酶前體編碼類受體激酶編碼pelota蛋白編碼過氧化物酶前體編碼AAA-ATP酶, 因此對這5個候選基因進行測序分析。測序結果顯示, 突變體中的基因發生了單堿基突變, 該基因的第3449位堿基, 即第5外顯子的第9位堿基由G突變為T, 導致氨基酸替換, 由色氨酸突變為半胱氨酸(圖7), 因此初步推測該基因可能為控制類病斑產生的候選目的基因。根據GRAMENE的預測, 該基因在植株的各個部位均有表達, 其全長7701 bp, 有2個轉錄, 第一轉錄本長為2772 bp, 編碼1個長為131 aa的蛋白; 第二轉錄本長為1691 bp, 編碼1個長為252 aa的蛋白。 利用qRT-PCR對野生型和突變體抽穗期的葉片和葉鞘進行表達分析。結果顯示, 與野生型相比, 突變體的基因在葉片和葉鞘中表達量均降低(圖8)。說明突變體類病斑的出現可能是由于該基因的表達量降低引起的。 圖7 突變體spl34的基因定位 圖8 目的基因spl34相對表達量分析 對病程相關基因和稻瘟病抗性基因的表達分析結果(圖9)顯示, 突變體的病程相關基因和的表達量顯著或極顯著高于野生型, 這可能是由于突變體類病斑的產生激發這些病程相關基因的表達量上升。但其余病程相關基因和稻瘟病抗性基因的表達量卻均未出現上升, 這也許是突變體的稻瘟病抗性并未增強的原因。 圖9 病程相關基因和稻瘟病抗性基因的表達分析 病程相關基因為、、、、、和; 稻瘟病抗性基因為、、、、和。 The pathogenesis-related genes:,,,,,,; the rice blast resistance genes:,,,,,. 類病斑突變體是研究植物細胞程序性死亡和植物對環境脅迫、病原菌入侵反應的理想材料。目前已定位的類病斑突變體基因在水稻12條染色體上均有分布。在已報道的類病斑突變基因中主要編碼的蛋白有熱激轉錄因子蛋白、U-box/Armadillo 重復蛋白、假定糞卟啉原Ⅲ氧化酶、鋅指蛋白、酰基轉移酶、RAF-絲裂原活化蛋白激酶、細胞色素P450單加氧酶家族的CYP71P1蛋白等。本研究報道的編碼pelota蛋白, 根據NCBI的預測, 它是一個蛋白釋放因子(eRF1), 通過識別終止密碼和促進肽酰-tRNA鍵的水解從而終止蛋白質的翻譯過程。該蛋白包含3個保守結構域, 其三維結構與tRNA相似。測序結果顯示, 在突變體的第5外顯子的第9個堿基發生突變, 由原來的G突變為T, 導致該位置的一個氨基酸被替換, 即由原來的色氨酸突變為半胱氨酸, 但是否就是控制突變體類病斑產生的目的基因還有待進一步的功能互補驗證。qRT-PCR結果表明, 與野生型相比,在突變體內表達量降低。 表型特征方面, 突變體從分蘗后期開始在下部葉片的葉鞘上出現類病斑, 隨后先沿著葉片中脈向上擴散, 最后再由中脈向葉片兩側擴散, 至成熟期類病斑分布于整個植株的葉片和葉鞘上。雖然突變體與之前報道的[42]在定位區間上有重疊, 但它們的表型特征及出現時期并不完全相同,在播種后10 d便在第1張葉片的葉尖部位出現類病斑。此外,的分蘗數與野生型相比并沒有顯著變化, 而的分蘗數與野生型相比極顯著地減少, 但在株高、穗長及千粒重方面突變體和一樣均較野生型顯著降低, 這可能是兩個突變體發生突變的位點不同導致的。 類病斑突變體上的類病斑產生受光照、溫度和濕度的影響, 且在類病斑產生部位及其周圍通常會伴隨著細胞程序性死亡。Noutoshi等[43]報道的擬南芥類病斑突變體在低溫低濕的條件下才會出現類病斑; Arase等[44]在水稻中發現一類病斑突變體, 該突變體在氣溫高于25°C時不出現類病斑, 而當氣溫低于20°C時類病斑明顯。Yamanouchi等[19]報道的突變體類病斑的產生與高溫和紫外光有關; 邱潔華等[45]通過遮光試驗證明水稻類病斑突變體的褐斑產生受光的誘導。在已報道的類病斑突變體中如[23][46]、[12]等, 均出現局部細胞程序性死亡; 而[22][15]、[20]等突變體則出現葉片早衰現象。本研究中的類病斑突變體在其類病斑產生部位也存在細胞程序性死亡。同時遮光試驗結果也表明,上的類病斑產生受光照的誘導。此外, 在研究過程中發現上類病斑的產生還可能與溫度有關, 當溫度低于20°C時類病斑產生的數量急劇減少甚至不產生, 即使有少量類病斑產生, 其產生的時期也有推遲現象, 具體情況還有待進一步的試驗驗證。 植物的類病斑突變有時還會誘發其抗性的改變。稻瘟病抗性鑒定結果顯示, 突變體的稻瘟病抗性并未增強, 抗譜并未拓寬。qRT-PCR結果顯示, 突變體中稻瘟病抗性基因的相對表達量與野生型相比并未明顯升高, 稻瘟病抗性基因的表達是水稻對稻瘟病抗性的主要影響因素, 雖然在突變體中的和3個病程相關基因的相對表達量顯著或極顯著高于野生型, 但病程相關基因不僅與水稻的稻瘟病抗性有關, 而且還與水稻對其他逆境脅迫的抗性有關, 其相對表達量升高可能誘導突變體對其他逆境脅迫的抗性增強, 而對水稻的稻瘟病抗性增強影響不大或無影響。生理指標測定結果表明, 突變體中的H2O2和O2-含量比野生型高, 且已經產生類病斑部位的H2O2和O2-含量要比未產生類病斑的部位高, 說明這兩類活性氧是隨著類病斑的產生而積累的。 研究植物類病斑突變體對了解植物的細胞程序性死亡和抗病機理有重要意義, 為育種方面抗病材料的篩選提供理論基礎。本研究從農藝性狀、生理生化特性以及突變基因的定位和表達等方面對水稻類病斑突變體進行系統地研究, 所得結果可為進一步研究類病斑突變體的產生機制提供理論依據。 水稻類病斑突變體表型受1對隱性核基因控制, 苗期和分蘗前期無類病斑, 從分蘗后期開始在其下部葉片的葉鞘上出現類病斑, 隨后逐漸擴散, 至成熟期分布于整個植株的葉片和葉鞘上。突變體的株高變矮, 產量降低, 葉綠素的熒光現象減弱, 對稻瘟病的抗性無明顯變化或略顯降低; 其體內的H2O2和O2–含量在出現類病斑的部位顯著升高, 而?OH的含量變化不大; 保護酶CAT、POD和T-SOD的活性較野生型低。被定位于第4染色體LR49和LR52兩個分子標記之間, 物理距離為200 kb; 突變體中的基因的編碼框發生單堿基替換突變, 導致編碼蛋白的氨基酸被替換, 初步推測該基因可能為候選目的基因。 重慶市黔江區農業委員會王海翔高級農藝師提供部分穗頸瘟標樣, 在此感謝。 [1] Hu G, Richter T E, Hulbert S H, Pryor T. Disease lesion mimicry caused by mutations in the rust resistance gene., 1996, 8: 1367–1376 [2] 黃奇娜, 楊楊, 施勇烽, 陳潔, 吳建利. 水稻斑點葉變異研究進展. 中國水稻科學, 2010, 24: 108–115 Huang Q N, Yang Y, Shi Y F, Chen J, Wu J L. Recent advances in research on spotted-leaf mutants of rice ()., 2010, 24: 108–115 (in Chinese with English abstract) [3] Lorrain S, Vailleau F, Balagué C, Roby D. Lesion mimic mutants: keys for deciphering cell death and defense pathways in plants., 2003, 8: 263–271 [4] 孫惠敏, 張春嬌, 李保同, 潘曉華. 水稻類病斑突變體的研究進展. 上海農業學報, 2014, 30(3): 142–147 Sun H M, Zhang C J, Li B T, Pan X H. Advances of study on rice lesion mimic mutants., 2014, 30(3): 142–147 (in Chinese with English abstract) [5] Walbot V, Hoisington D A, Neuffer M G. Disease lesion mimic mutations. In: Kosuge T, Meredith C, eds. Genetic Engineering of Plants. Plenum, New York, 1983. pp 431–442 [6] Dietrich R A, Richberg M H, Schmidt R, Dean C, Dangl J L. A novel zinc finger protein is encoded by the Arabidopsisgene and functions as a negative regulator of plant cell death., 1997, 88: 685–694 [7] Shi L Y, Lv X L, Weng J F, Zhu H Y, Liu C L, Hao Z F, Zhou Y, Zhang D G, Li M S, Ci X K, Li X H, Zhang S H. Genetic characterization and linkage disequilibrium mapping of resistance to gray leaf spot in maize (L.)., 2014, 2: 132–143 [8] Spassieva S, Hille J. A lesion mimic phenotype in tomato obtained by isolating and silencing an, homologue., 2002, 162: 543–549 [9] Xiao G Q, Zhang H W, Lu X Y, Huang R F. Characterization and mapping of a novel light-dependent lesion mimic mutantin rice (L.).2015, 14: 1687–1696 [10] 潘璐琪, 陸雯, 李小白, 吳殿星, 王雪艷. 秈稻93-11類病斑突變體的特征研究. 核農學報, 2015, 29: 413–420 Pan L Q, Lu W, Li X B, Wu D X, Wang X Y. Characteristics of lesion mimic mutants fromrice 93-11., 2015, 29: 413–420 (in Chinese with English abstract) [11] Yin Z, Chen J, Zeng L, Goh M, Leung H, Khush G S, Wang G L. Characterizing rice lesion mimic mutants and identifying a mutant with broad-spectrum resistance to rice blast and bacterial blight., 2000, 13: 869–876 [12] Chen X F, Hao L, Pan J W, Zheng X X, Jiang G H, Jin Y, Gu Z M, Qian Q, Zhai W X, Ma B J., a cell death and defense-related gene, encodes a putative splicing factor 3b subunit 3 (SF3b3) in rice., 2012, 30: 939–949 [13] Zeng L R, Qu S H, Bordeos A, Yang C W, Baraoidan M, Yan H Y, Xie Q, Nahm B H, Leung H, Wang G L., a negative regulator of plant cell death and defense, encodes a U-box/armadillo repeat protein endowed with E3 ubiquitin ligase activity., 2004, 16: 2795–2808 [14] Mori M, Tomita C, Sugimoto K, Hasegawa M, Hayashi N, Dubouzet J G, Ochiai H, Sekimoto H, Hirochika H, Kikuchi S. Isolation and molecular characterization of amutant by modified activation-tagging in rice., 2007, 63: 847–860 [15] Qiao Y, Jiang W, Lee J H, Park B S, Choi M S, Piao R, Woo M O, Roh J H, Han L, Paek N C, Seo H S, Koh H J.encodes a clathrin-associated adaptor protein complex 1, medium subunit μ1 (AP1M1) and is responsible for spotted leaf and early senescence in rice ()., 2010, 185: 258–274 [16] Wang L J, Pei Z Y, Tian Y C, He C Z. OsLSD1, a rice zinc finger protein, regulates programmed cell death and callus differentiation., 2005, 18: 375–384 [17] 陳紅霖, 向陽海, 趙紀瑩, 尹德東, 梁國華, 翟文學, 江光懷. 水稻類病變突變體的遺傳分析與目標基因的精細定位. 作物學報, 2013, 39: 1148–1154 Chen H L, Xiang Y H, Zhao J Y, Yin D D, Liang G H, Zhai W X, Jiang G H. Genetic analysis and gene fine mapping of rice lesion mimic mutant, 2013, 39: 1148–1154 (in Chinese with English abstract) [18] 鐘振泉, 羅文龍, 劉永柱, 王慧, 陳志強, 郭濤. 一份新的水稻斑點葉突變體的鑒定和基因定位. 作物學報, 2015, 41: 861–871 Zhong Z Q, Luo W L, Liu Y Z, Wang H, Chen Z Q, Guo T. Characterization of a novel spotted leaf mutantand mapping ofgene in rice ()., 2015, 41: 861–871 (in Chinese with English abstract) [19] Yamanouchi U, Yano M, Lin H, Ashikari M, Yamada K. A rice spotted leaf gene,, encodes a heat stress transcription factor protein., 2002, 99: 7530–7535 [20] Jiao B B, Wang J J, Zhu X D, Zeng L Z, Li Q, He Z H. A novel protein RLS1 with NB-ARM domains is involved in chloroplast degradation during leaf senescence in rice., 2012, 5: 205–217 [21] Tong X H, Qi J F, Zhu X D, Mao B Z, Zeng L J, Wang B H, Li Q, Zhou G X, Xu X J, Lou Y G, He Z H. The rice hydroperoxide lyase OsHPL3 functions in defense responses by modulating the oxylipin pathway., 2012, 71: 763–775 [22] Undan J R, Tamiru M, Abe A, Yoshida K, Kosugi S, Takagi H, Yoshida K, Kanzaki H, Saitoh H, Fekih R, Sharma S, Undan J, Yano M, Terauchi R. Mutation in, a gene encoding a protein with two double-stranded RNA binding motifs, causes lesion mimic phenotype and early senescence in rice (L.)., 2012, 87: 169–179 [23] Kim J A, Cho K, Singh R, Jung Y H, Jeong S H, Kim S H, Lee J, Cho Y S, Agrawal G K, Rakwal R, Tamogami S, Kersten B, Jeon J S, An G, Jwa N S. Rice(, accelerated cell death and resistance 1) is a potential positive regulator of fungal disease resistance., 2009, 28: 431–439 [24] Lin A H, Wang Y Q, Tang J Y, Xue P, Li C L, Liu L C, Hu B, Yang F Q, Loake G J, Chu C C. Nitric oxide and protein S-nitrosylation are integral to hydrogen peroxide-induced leaf cell death in rice., 2012, 158: 451–464 [25] Sun C H, Liu L C, Tang J Y, Lin A H, Zhang F T, Fang J, Zhang G F, Chu C C., encoding a putative coproporphyrinogen III oxidase, is involved in lesion initiation in rice., 2011, 38: 29–37 [26] Takahashi A, Agrawal G K, Yamazaki M, Onosato K, Miyao A, Kawasaki T, Shimamoto S, Hirochika H. Rice Pti1a negatively regulates-dependent defense responses., 2007, 19: 2940–2951 [27] Fekih R, Tamiru M, Kanzaki H, Abe A, Yoshida K, Kanzaki E, Saitoh H, Takagi H, Natsume S, Undanet J R, Undan J, Terauchi R. The rice (L.) LESION MIMIC RESEMBLING, which encodes an AAA-type ATPase, is implicated in defense response., 2015, 290: 611–622 [28] Sakuraba Y, Rahman M L, Cho S H, Kim Y S, Koh H J, Yoo S C, Paek N C. The rice faded green leaf locus encodes protochlorophyllide oxidoreductase B and is essential for chlorophyll synthesis under high light conditions., 2013, 74: 122–133 [29] Tang J Y, Zhu X D, Wang Y Q, Liu L C, Xu B, Li F, Fang J, Chu C C. Semi-dominant mutations in the CC-NB-LRR-type R, gene,, lead to constitutive activation of defense responses in rice., 2011, 66: 996–1007 [30] Fujiwara T, Maisonneuve S, Isshiki M, Mizutani M, Chen L T, Wong H L, Kawasaki T, Shimamoto K. Sekiguchi lesion gene encodes a cytochrome P450 monooxygenase that catalyzes conversion of tryptamine to serotonin in rice., 2010, 285: 11308–11313 [31] Chern M, Fitzgerald H A, Canlas P E, Navarre D A, Ronald P C. Overexpression of a ricehomolog leads to constitutive activation of defense response and hypersensitivity to light., 2005, 18: 511–520 [32] Zhao J Y, Liu P C, Li C R, Wang Y Y, Guo L Q, Jiang G H, Zhai W X.and, two eukaryotic translation elongation factor 1A-like gene family members, negatively affect cell death and disease resistance in rice., 2017, 44: 107–118 [33] Wang S, Lei C L, Wang J L, Ma J, Tang S, Wang C L, Zhao K J, Tian P, Zhang H, Qi C Y, Cheng Z J, Zhang X, Guo X P, Liu L L, Wu C Y, Wan J M., encoding an eEF1A-like protein, negatively regulates cell death and defense responses in rice., 2017, 68: 899–913 [34] Lichtenthaler H K. Chlorophylls and carotenoids: Pigments of photosynthetic biomembranes., 1987, 148: 350–382 [35] Bowling S A, Clarke J D, Liu Y D, Klessig D F, Dong X N. Themutant of Arabidopsis expresses both NPR1-dependent and NPR1-independent resistance., 1997, 9: 1573–1584 [36] Thordal-Christensen H, Zhang Z G, Wei Y D, Collinge D B. Subcellular localization of H2O2in plants. H2O2accumulation in papillae and hypersensitive response during the barley-powdery mildew interaction., 1997, 11: 1187–1194 [37] 黃富, 程開祿, 彭國亮, 羅慶明, 陳國華, 朱永昌. 四川省水稻品種抗稻瘟病性規范化鑒定評價體系. 中國農業大學學報, 1998, 3(增刊-1): 23–26 Huang F, Cheng K L, Peng G L, Luo Q M, Chen G H, Zhu Y C. The standard evaluating system of rice resistance to blast in Sichuan province., 1998, 3(suppl-1): 23–26 (in Chinese with English abstract) [38] 張長偉, 凌英華, 桑賢春, 李平, 趙芳明, 楊正林, 李云峰, 方立魁, 何光華. 轉苦瓜幾丁質酶基因水稻及其稻瘟病抗性. 作物學報, 2011, 37: 1991–2000 Zhang C W, Ling Y H, Sang X C, Li P, Zhao F M, Yang Z L, Li Y F, Fang L K, He G H. Transgenic rice lines harboringgene from Balsam Pear (L.) and their blast resistance., 2011, 37: 1991–2000 (in Chinese with English abstract) [39] 全國稻瘟病菌生理小種聯合試驗組. 我國稻瘟病菌生理小種研究. 植物病理學報, 1980, 10: 71–82 All China Coorporation of Research on Physiological Races of. Research on physiological races of rice blast fungus in China., 1980, 10: 71–82 (in Chinese with English abstract) [40] International Rice Research Institute. Standard Evaluation System for Rice (SES). Los Ba?os, Philippines: IRRI, 2002. pp 14–18 [41] Rogers S O, Bendich A J. Extraction of DNA from milligram amounts of fresh, herbarium and mummified plant tissues., 1985, 5: 69–76 [42] Feng B H, Yang Y, Shi Y F, Shen H C, Wang H M, Huang Q N, Xu X, Lu X G, Wu J L. Characterization and genetic analysis of a novel rice spotted-leaf mutantwith broad-spectrum resistance topv.., 2013, 55: 473–483 [43] Noutoshi Y, Ito T, Seki M, Nakashita H, Yoshida S, Marco Y, Shirasu K, Shinozaki K. A single amino acid insertion in the WRKY domain of the Arabidopsis TIR-NBS-LRR-WRKY-type disease resistance protein SLH1 (sensitive to low humidity 1) causes activation of defense responses and hypersensitive cell death., 2005, 43: 873–888 [44] Arase S, Zhao C M, Akimitsu K, Yamamoto M, Ichii M. A recessive lesion mimic mutant of rice with elevated resistance to fungal pathogens., 2000, 66: 109–116 [45] 邱結華, 馬寧, 蔣漢偉, 圣忠華, 邵高能, 唐紹清, 魏祥進, 胡培松. 水稻類病斑突變體的鑒定及其基因定位. 中國水稻科學, 2014, 28: 367–376 Qiu J H, Ma N, Jiang H W, Sheng Z H, Shao G N, Tang S Q, Wei X J, Hu P S. Identification and gene mapping of a lesion mimic mutantin rice., 2014, 28: 367–376 (in Chinese with English abstract) [46] Liu G, Wang L, Zhou Z, Leung H, Wang G L, He C. Physical mapping of a rice lesion mimic gene,, to a 70-kb segment of rice chromosome 12., 2004, 272: 108–115 Identification and Gene Mapping of a Lesion Mimic Mutantin Rice (L.) LIU Bao-Yu, LIU Jun-Hua, DU Dan, YAN Meng, ZHENG Li-Yuan, WU Xue, SANG Xian-Chun, and ZHANG Chang-Wei* Rice Research Institute of Southwest University / Chongqing Key Laboratory of Application and Safety Control of Genetically Modified Crop, Chongqing 400716, China A mutant() was screened from the progeny ofrestorer line Jinhui 10 treated with ethyl methane sulfonate (EMS). Brown lesions inexhibit on the sheath of lower leaves at the late tillering stage, then spred from the midrib to entire leaf and finally throughout the whole plant at maturity stage. Compared with the wild type, the plant height, ear length, grain number per panicle, seed setting rate and thousand-grain weight as well as the activities of protective enzymes (CAT, POD, and T-SOD) were all significantly decreased while the content of reactive oxygen species (ROS) increased in. The shading assay showed that the formation of lesions inwas induced by light. Histochemical analysis showed thathad excessive hydrogen peroxide (H2O2) deposition and programmed cell death in the position of lesions. In addition, the chlorophyll fluorescence was weaker inthan in the wild type under the fluorescence microscopy. There was no significant difference in blast resistance betweenand the wild type. Genetic analysis suggested that the phenotype ofwas controlled by a single recessive nuclear gene, which was mapped between InDel markers LR49 and LR52 on chromosome 4 with an interval of 200 kb. Sequencing analysis revealed that a single base substitution (G to T) occurred at 3449 bp in the DNA sequence of, resulting in an amino acid change from tryptophane to cysteine. The qRT-PCR results showed that the transcriptional level ofwas down-regulated in, while that of some pathogenesis-related genes was highly up-regulated when compared with the wild type. rice; lesion mimic mutant;; gene; fine mapping 2017-05-22; 2017-11-21; 2017-12-04. 10.3724/SP.J.1006.2018.00332 本研究由國家轉基因生物新品種培育重大專項(2016ZX08001002-002)資助。 This study was supported by the National Major Project for Developing New GM Crops (2016ZX08001002-002). Corresponding author張長偉, E-mail: 603519375@qq.com E-mail: 673325435@qq.com http://kns.cnki.net/kcms/detail/11.1809.S.20171203.1645.002.html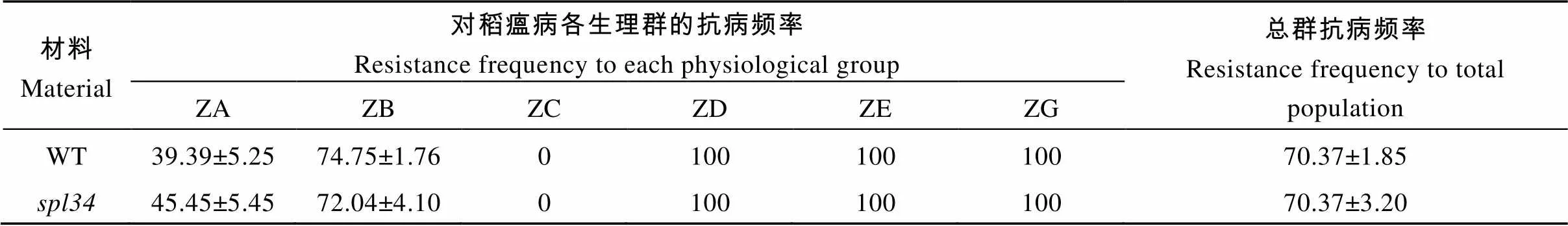

2.9 突變體的基因定位、候選基因分析及測序

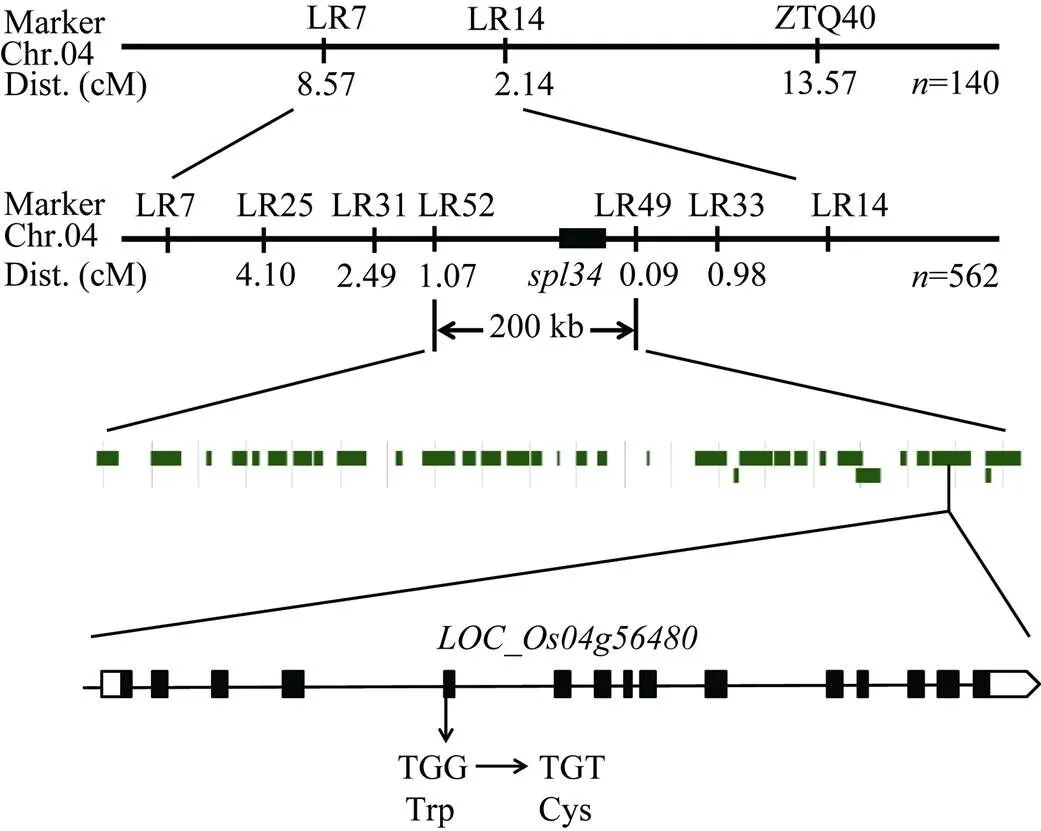
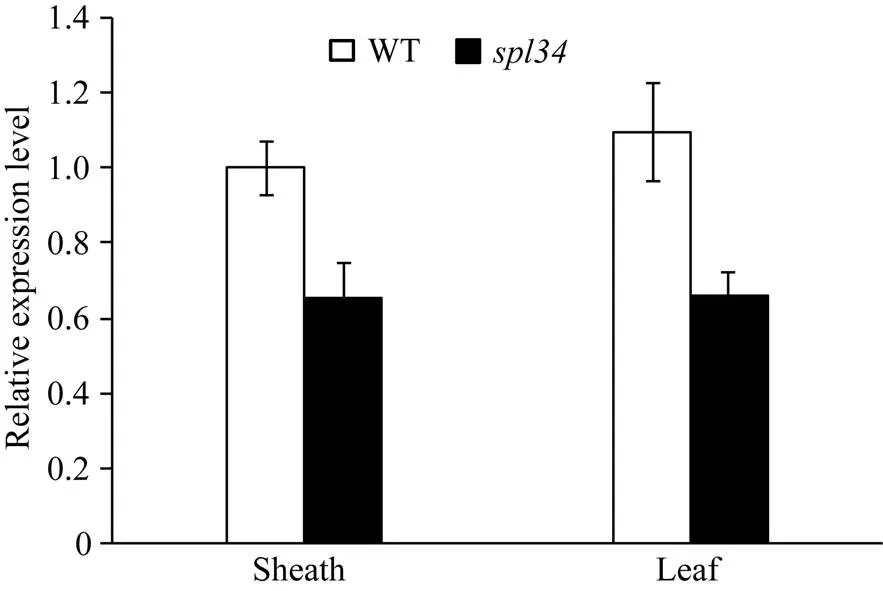
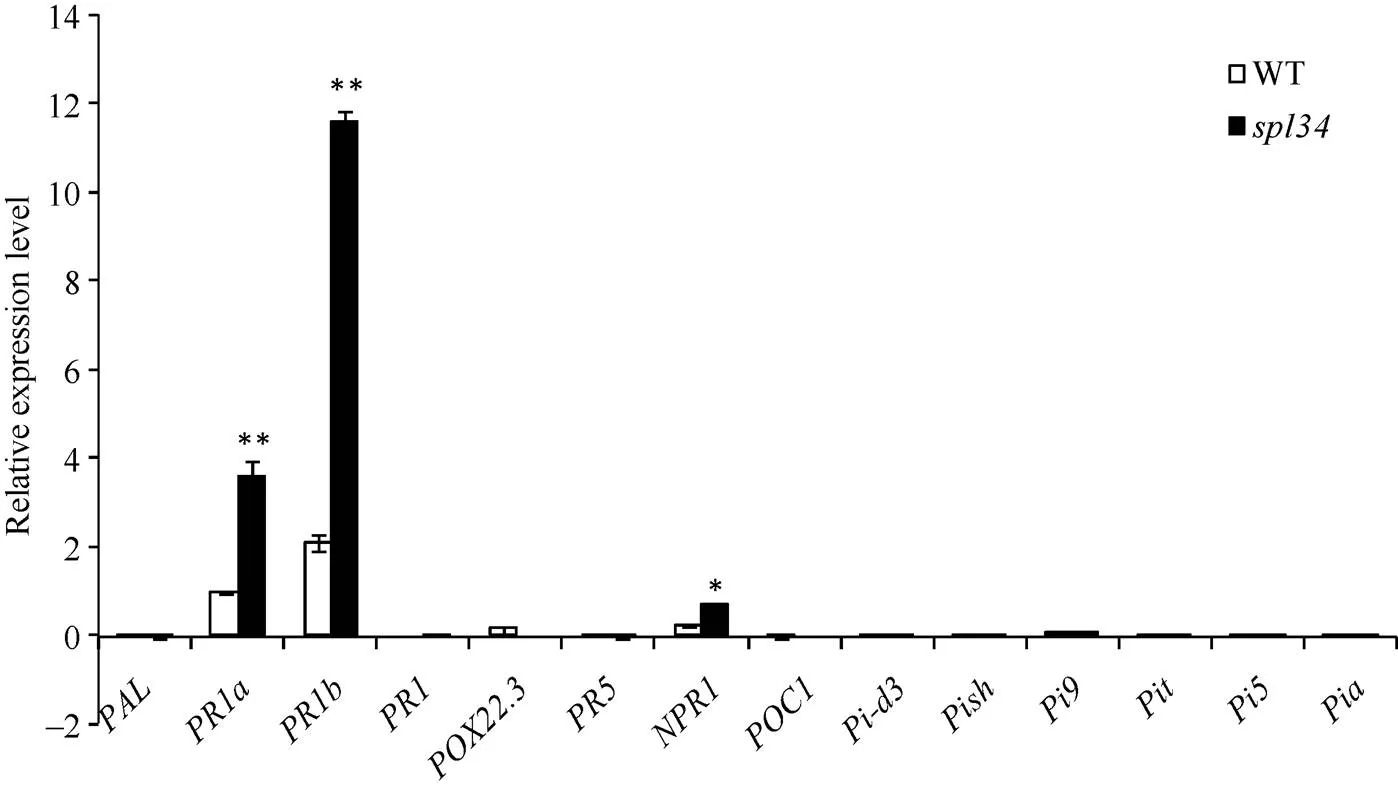
2.10 目的基因、病程相關基因和稻瘟病抗性基因的表達分析
3 討論
4 結論
致謝:

