基于電化學方法研究豬糞堆肥過程溶解性有機物電子轉移能力演變規律
唐朱睿 黃彩紅 檀文炳 何小松 張 慧 李 丹 席北斗*,4
1(桂林理工大學環境工程學院, 桂林 541006) 2(中國環境科學研究院地下水與環境系統工程創新基地, 北京 100012) 3(中國環境科學研究院環境基準與風險評估國家重點實驗室, 北京 100012) 4(蘭州交通大學環境與市政工程學院, 蘭州 730070)
1 引 言
近年來,隨著我國居民生活水平的提高,肉制品需求日益增大,導致畜禽養殖業規模也不斷擴大,畜禽養殖有機廢棄物的回收利用已成了當前備受關注的問題[1]。豬糞中含有的大量有機質,含氮量較高,且易被微生物利用,是一種優質營養源,但若處置不當可能會造成諸多的環境問題,甚至會污染水體[2]。堆肥是一種將有機廢物再利用的有效方法,被廣泛用于處理畜禽糞便,在消除污染的同時生產出有價值的堆肥產品。
由于堆肥過程中大部分生化反應發生在固-液交界面,因此水溶性有機物(Dissolved oganic mtter, DOM)是堆肥有機質中最活躍的部分,所以DOM變化可以反映堆肥有機質的轉化進程和堆肥穩定性[3]。堆肥DOM的結構和組成復雜,不僅含有低分子量的游離態氨基酸、糖類等物質,還含有各種大分子量組分,如酶、多酚、腐殖酸和其它化合物,因此很難確定DOM具體的化學結構[4,5]。DOM的組成元素主要有C、H、O、N和S,DOM的不同組分中各個元素含量差異顯著[4]。此外,DOM中也含有大量具有電子轉移能力的高活性位點官能團,如酚基、羥基、羧基、硫醇和酰胺類等基團,因此具有氧化還原能力[5~7]。
厭氧條件下,DOM的氧化還原能力使其可作為電子穿梭體,促進電子在電子供體(微生物、硫化氫等)和電子受體(鐵礦物、污染物)之間傳遞。首先DOM可作為電子受體接受從微生物自身代謝傳遞出的電子,同時還原后的DOM又可作為電子供體,將電子傳遞給受體污染物,降低污染物的環境風險。有研究表明,DOM既可為電子穿梭體促進Cr和Fe的還原,又可強化微生物降解硝基苯[8~11]。因此研究豬糞堆肥過程中DOM結構和成分變化對電子轉移能力的影響,進而了解堆肥過程自身的穩定化、無害化過程,同時也為調控生產出具有良好環境效應的堆肥產品提供科學支撐。然而,目前對豬糞堆肥過程中DOM電子轉移能力的演變規律報道較少。
本研究通過電化學分析方法,添加不同介導劑測定DOM的電子供給能力(Electron donating capacities, EDCs)和電子接受能力(Electron accepting capacities, EACs), 再利用三維熒光光譜表征堆肥DOM的組分演變規律,在之前的研究基礎上[5]增加DOM元素分析和紅外光譜測定,分別探究DOM的結構和官能團的變化,以期探討豬糞堆肥過程中DOM化學結構和組分變化對其電子轉移能力演變的影響。
2 實驗部分
2.1 儀器與試劑
CHI-660e型電化學工作站(上海辰華公司),所有實驗電極均購自上海辰華公司; TENSOR II傅里葉紅外光譜儀(德國布魯克公司); Hitachi F-7000 型熒光光譜儀(日本日立公司); VARIO EL cube型元素分析儀(德國Elementar 公司); Analytik Jena Multi N/C 2100 型TOC 分析儀(德國耶拿公司)。
KBr(光譜純)、NaH2PO4(分析純)、Na2HPO4(分析純))和KCl(優級純)均購于國藥集團化學集團有限公司; ABTS(2,2'-聯氮雙(3-乙基苯并噻唑啉-6-磺胺)二銨鹽)(純度>98%,東京化成工業株式會社); DQ(敵草快農藥)(純度>99.9%,中國計量科學研究院); 實驗用水通過美國Millipore公司Milli-Q型超純水機處理。直徑25 mm 孔徑0.45 μm濾膜(天津津騰公司); 0.05 μm氧化鋁拋光粉(上海楚兮實業有限公司)。
2.2 樣品采集與DOM提取
豬糞堆肥樣品采集自西北農林科技大學,堆肥原始物料是豬糞和秸稈按照2∶1的比例混合,采用反應器強制通風堆肥,反應器中堆體總質量約100 kg。在堆肥的第1、4、8、15、22、29、36、43天共采集8個階段的堆肥樣品。采得樣品經冷凍運輸至北京,于-20℃封存。
DOM的提取按照參考文獻[12]的方法,首先用冷凍干燥機,在-54℃冷凍干燥48 h,以去除堆肥樣品中水分。將干燥后的樣品經研缽研磨后過100目篩,得到樣品粉末。將超純水與樣品粉末按照10 mL∶1 g比例混勻后,在振蕩器中按照250 r/min的速率振蕩24 h,得到的混合液經11000 r/min冷凍離心10 min,上清液過0.45 μm濾膜,得到豬糞堆肥樣品DOM母液。DOM母液用超純水稀釋100倍,用TOC分析儀測定DOM中溶解性有機碳濃度(Dissolved organic carbon, DOC),并計算出DOM母液的DOC濃度。
2.3 DOM電子轉移能力測定
堆肥樣品DOM的電子轉移能力采用電化學工作站測定(圖1),參考文獻[8,13]的方法,采用三電極體系作為電化學反應體系,其中Ag/AgCl電極作為參比電極,鉑絲電極作為對電極,工作電極采用直徑3 mm玻璃碳電極,測定堆肥DOM的EDC和EAC,所設定的氧化還原電位分別為0.61 V和-0.49 V,添加的介導劑分別為ABTS和DQ。測定時先加入2.5 mL磷酸鹽緩沖溶液(pH=7.0)和2.5 mL 0.2 mol/L KCl,再通氮氣5 min以排空氧氣,同時在拋光絨布上加入氧化鋁粉末并用超純水潤濕,將工作電極豎直放于拋光絨布上,研磨底部5 min,去除其氧化薄膜。電極經研磨后先放入超純水超聲振動30 s,再浸入甲醇中超聲振動30 s,之后將各個電極與電化學工作站的電線連結,選擇“Amperometrici-tcurve parameters”模式,工作電壓設置為0.61/-0.49 V,實驗時間設置為4000 s,開始電化學反應實驗。在反應穩定后加入介導劑(ABTS濃度為4 g/L; DQ濃度為2 g/L),反應穩定后再加入堆肥DOM樣品,使反應液DOC濃度保持為50 mg/L。DOM電子轉移能力的計算采用下列公式:

(1)
其中EAC和EDC單位是μmol e-/(g C),Ap是DOM氧化曲線積分庫侖或DOM還原曲線積分庫侖,單位是庫侖(C)。NA是阿伏加德羅常數6.02×1023mol-1, e是單位電子的電荷量1.6×10-19C,MC是反應體系中碳的含量3.5×10-4g。堆肥樣品DOM的電子轉移能力(Electron transfer capability, ETC)為EDC與EAC之和。

圖1 (A)電化學工作模型; (B)ABTS和DQ介導DOM氧化還原; (C)電化學工作站測試圖Fig.1 (A) Eletrochemical workstation model; (B) Redox reaction of 2, 2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) (ABTS)/ Diquat dibro-mide monohydrate (DQ) with dissolved oganic mtter (DOM); (C) Interface of eletrochemical workstation
2.4 DOM三維熒光測定
三維熒光激發-發射(Excitation-emission matrix, EEM)光譜采用熒光光度計測定。激發光源150-W 氙弧燈; PMT電壓:700 V; 信噪比>110; 激發波長(λex)掃描范圍:200~450 nm,發射波長(λem)掃描范圍:280~550 nm; 狹縫寬帶: 5 nm; 掃描速度2400 nm/min; 響應時間:自動。掃描DOM樣品時用超純水稀釋樣品,使DOC濃度調節至5 mg/L,同時以純水作為空白對照。
將豬糞堆肥DOM的EEM譜圖轉為三維數據矩陣進行平行因子分析[14](8個樣品×50 Ex×55 Em)。平行因子分析采用MATLAB7.11(Mathworks, Natick, MA)中DOMFluor工具包(www.models.life.ku.dk)將三維數據矩陣分解為組分值、Ex負荷與Em負荷,并計算各個組分的百分比。
2.5 DOM傅里葉變換紅外光譜(Fourier transform infrared spectrum, FTIR)測定
DOM母液經-54℃冷凍干燥后得到DOM固體粉末,將DOM固體粉末與KBr 固體按照質量比1∶100~5∶100的比例混勻。在紅外燈下用瑪瑙研缽研磨樣品并混勻,在100 MPa的壓強下壓制成均勻、透明玻片放入傅里葉紅外光譜儀測定。掃描范圍為4000~450 cm-1,掃描次數14次。
2.6 DOM元素分析
DOM母液經-54℃冷凍干燥后得到DOM固體粉末,再用元素分析儀測定DOM的C、N、H和S的含量。O含量則按照以下公式計算[15]:
[O](%)=[1-[S]+[H]+[C]+[N]]×100
(2)
3 結果與討論
3.1 DOM電子轉移轉移能力的演變
豬糞堆肥樣品DOM電子轉移能力包括電子供給能力和電子接受能力, DOM的電子轉移能力如圖2所示,從堆肥初期至堆肥末期,堆肥樣品EDC增大,EAC略微減小,其中EDC從堆肥初期的16.850 μmol e-/(g C)增至末期的22.077 μmol e-/(g C),增幅為131.0%。EAC從堆肥初期的1.866 μmol e-/(g C)降至末期的1.779 μmol e-/(g C),降幅為4.6%。雖然整體上堆肥DOM的EDC增大, EAC減小,但在堆肥的前期(1~8 d)、中期(15~22 d)和后期(29~43 d)3個階段兩者變化趨勢一致。在堆肥前期(第1~8 d),EDC與EAC均呈增長趨勢,堆肥DOM電子轉移能力增強。在堆肥中期(第8~22 d),EDC和EAC均先增大后減小,EAC波動幅度要大于EDC波動幅度。在堆肥后期(第22~43 d),兩者均呈增長趨勢,但EDC增幅大于EAC增幅,說明在堆肥后期DOM的EDC迅速增長,而EAC增長較慢。堆肥DOM的ETC與EDC變化一致,這是因為在堆肥過程中EDC的數值比EAC高約10倍,ETC的數值主要受EDC數值影響。

圖2 堆肥DOM各階段的電子轉移能力圖:(A)電子供給能力和電子接受能力;(B)電子轉移能力詳圖Fig.2 Electron transfer capacitiy (ETCs) of different stages compost-derived DOM: (A) Electron donating capacity (EDCs) and electron accepting capacity (EACs); (B) Electron transfer capacity (ETCs) clear figure
3.2 DOM元素含量的演變
堆肥樣品DOM的C、N、H、S和O含量如表1所示,在堆肥過程中C、N和H含量均下降,而S和O含量增加。其中C降幅最大,從堆肥初期的31.57%降至末期的18.56%;其次是N含量,從堆肥第1 d的6.72%降至第43 d的4.28%; H含量的降幅最小,從堆肥初期的4.61%降至末期的3.24%,而S則從0.39%增加至末期的1.57%,O含量增幅明顯從堆肥初期的56.71%增至末期的72.35%。除各元素含量變化外,N、H、S與C的原子比也能反映出DOM化學結構變化[16]。由表1可見,N/C、H/C和S/C從堆肥初期至末期均增大,其中N/C和H/C原子比增加較緩,分別增加了8%和19%; S/C原子比增幅較大,增加了約6.9倍。
堆肥的前期、中期和后期3個階段,每個階段元素變化趨勢不同,在堆肥前8天DOM的N和H含量迅速下降,H含量在堆肥第8 d時降至3.17%,C含量降低速率相對較為緩慢,而S和O含量上升速率相對較快,N/C、H/C、S/C原子比變化趨勢與對應的元素含量變化一致,說明在堆肥前期,蛋白類物質和其它含氮有機質被迅速降解,而一些含硫有機質的降解速率較慢。在堆肥中期,N和C含量持續降低,但N含量降幅減緩,同時N/C原子比略微上升,S含量變化有波動,S/C原子比首次降低后升高,而H含量增加,H/C原子比增幅明顯。由此可知,在堆肥中期堆體內反應劇烈,含N、S有機質均活躍參與堆體內的生化反應,而含氮有機物的降解轉化速率慢于含硫有機物。堆肥末期C含量迅速降低,H含量略降低,S含量則呈增加趨勢,S/C原子比迅速增加。N含量在末期反而變化劇烈,N/C原子比的波動幅度較大。O含量緩慢升高, 同時在堆肥第43d 達到最高值,這表明在堆肥后期含硫有機質降解速率較慢。
表1 堆肥樣品元素組成分析
Table 1 Elemental analysis of compost-derived DOM
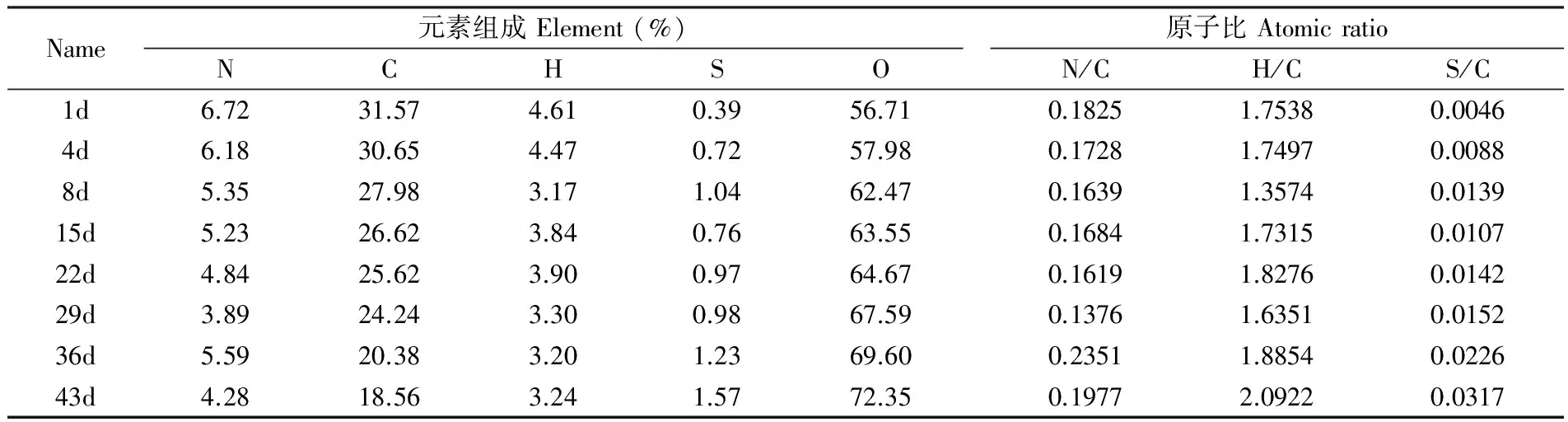
Name元素組成Element(%)NCHSO原子比AtomicratioN/CH/CS/C1d6.7231.574.610.3956.710.18251.75380.00464d6.1830.654.470.7257.980.17281.74970.00888d5.3527.983.171.0462.470.16391.35740.013915d5.2326.623.840.7663.550.16841.73150.010722d4.8425.623.900.9764.670.16191.82760.014229d3.8924.243.300.9867.590.13761.63510.015236d5.5920.383.201.2369.600.23511.88540.022643d4.2818.563.241.5772.350.19772.09220.0317
3.3 基于熒光光譜的DOM化學組分演變
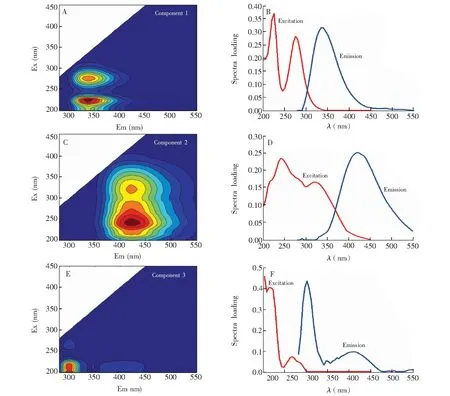
圖3 三維熒光平行因子解析出各個組分: (A)組分1峰位圖; (B)組分1的峰值圖; (C)組分2峰位圖; (D)組分2的峰值圖; (E)組分3峰位圖; (F)組分3峰位圖Fig.3 Three dimensional fluorescence components identified by parallel factor analysis and their loadings: (A) peak position of component 1; (B) peak value of component 1; (C) peak position of component 2; (D) peak value of component 2; (E) peak position of component 3; (F) peak value of component 3

圖4 不同堆肥階段HA的組分百分數變化Fig.4 Percentage of component change of HA in different composting stages
堆肥是有機質降解和腐殖化的過程,DOM作為堆肥有機質中最活躍部分,其有機組分在堆肥過程中變化劇烈,而三維熒光光譜能揭示堆肥過程中DOM有機組分的變化。本研究采用平行因子分析的方法解析DOM三維熒光光譜,以清晰展示堆肥過程中DOM有機組分的演變。如圖3所示,平行因子分析將DOM有機組分劃分為3個組分,分別是組分1、組分2和組分3。組分1出現兩個明顯的峰(λex=225, 275 nm,λem=335 nm),這兩個峰的出現是由于堆體中出現類蛋白物質,這些類蛋白物質與堆肥中微生物殘體及其代謝產物有關聯[1]。組分2也呈現一強一弱的雙峰(λex=240, 320 nm,λem=420 nm),這兩個峰是由于堆肥有機質中類腐殖質組分的貢獻[17]。類腐殖質物質是堆肥有機質中相對穩定的有機組分,其含量與堆肥穩定程度有密切聯系。組分3所在的區域(λex=200 nm,λem=300 nm)是堆肥源生類蛋白物質[17],在堆肥物料中,豬糞是一種含有大量粗蛋白的原料,其中的粗蛋白也是堆肥過程可轉化利用的重要有機組分。
堆肥過程中DOM的3個有機組分含量變化如圖4所示,在堆肥過程中組分1的含量一直高于組分2和組分3。在堆肥的前中期,組分1的含量一直呈現增加的趨勢,在第22天出現最大值68.02%,隨后組分1含量開始略微下降。組分1含量的變化與微生物活動密切相關,在堆肥前中期堆體中富含易被微生物降解利用的小分子有機質,因此微生物活性較強。而組分1和微生物代謝產物及其殘體有關,在堆肥前中期微生物為實現自身的增殖生長,其代謝產物也逐漸增加。在堆肥后期組分1含量的降低,表明堆肥中微生物活性不及前中期活躍。組分2含量在堆肥過程中一直增加,表明在DOM中類腐殖質物質含量隨著堆肥進行而逐漸增加。而組分3的變化趨勢與組分2相反,其含量隨著堆肥進行而逐漸降低,這意味著DOM中堆肥源生類蛋白物質隨著堆肥的進行在逐漸減少。而相關性分析(圖5)結果表明類蛋白物質和類腐殖質物質變化對DOM的ETC有顯著影響。
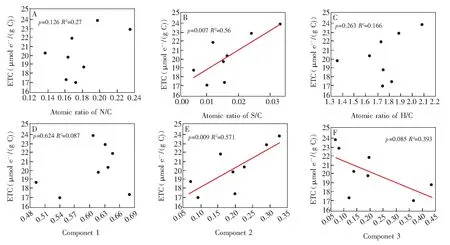
圖5 相關性分析:(A)電子轉移能力與N/C原子比相關性;(B)電子轉移能力與S/C原子比相關性;(C)電子轉移能力與H/C原子比相關性;(D)電子轉移能力與組分1相關性;(E)電子轉移能力與組分2相關性;(F)電子轉移能力與組分3相關性Fig.5 Index correlation analysis:(A)correlation between electron transfer capacitiy and N/C ratio;(B) correlation between electron transfer capacitiy and S/C ratio;(C) correlation between electron transfer capacitiy and H/C ratio;(D) correlation between electron transfer capacitiy and componet 1;(E) correlation between electron transfer capacitiy and componet 2; (F) correlation between electron transfer capacitiy and componet 3
3.4 基于紅外光譜的DOM官能團演變


圖6 堆肥不同階段DOM的紅外光譜和典型峰值Fig.6 Fourier transform infrared (FTIR) spectra of composting DOM
3.5 DOM化學結構演變機制
平行因子分析結果(圖4)表明,堆肥過程中源生類蛋白物質隨著堆肥進行而逐漸減少。在堆肥前期,源生類蛋白物質含量迅速下降,微生物代謝產物及其殘體類物質逐漸增多,類腐殖質物質含量增長不明顯。同時, 元素分析結果表明, 在前期含氮有機物逐漸減少。這是因為豬糞作為堆肥原料,其中含有豐富的粗蛋白物質,所以堆肥初期源生類蛋白物質含量高。微生物利用這些類蛋白物質促進自身繁殖,因此DOM中微生物代謝及其殘體類物質增多,而源生類蛋白物質減少。在堆肥初期主要是小分子有機物如糖類、蛋白類、脂類等快速降解,并不產生腐殖質,因此類腐殖質物質的含量變化不明顯。在堆肥中期,源生類蛋白物質含量降低了約1倍,而微生物代謝產物及其殘體物質在第22 d之前一直增加,至22 d后開始減少。這可能是在堆肥中期堆體中類蛋白物質減少,這些容易被微生物利用的類蛋白物質減少使得微生物的增殖速率減慢。同時微生物殘體也會被微生物利用,導致在22 d后微生物代謝產物及其殘體物質含量減少。類腐殖質物質含量在堆肥中期變化幅度較小,總體呈增加趨勢,比堆肥前期增加了約1倍。相對前期而言,DOM的腐殖質化反應已經逐漸增強。元素分析結果表明堆肥含氮有機物減少,這也佐證了類蛋白物質減少的現象。與堆肥前期不同,堆肥中期類蛋白物質含量少,降幅較小,同時微生物代謝產物及殘體類物質在增加至最大值后開始下降。在堆肥后期,類蛋白物質含量進一步降低,而類腐殖質物質含量明顯升高,微生物代謝產物及殘體物質則持續略微降低。這一階段堆肥中能被微生物利用的有機質減少,堆體溫度降低,堆體進入腐熟階段。

3.6 DOM化學結構對ETC的影響
堆肥DOM之所以具有電子轉移能力主要歸因于其化學結構中包含大量具有氧化還原能力的官能團。Scott等[23]通過電子自旋共振波譜分析直接證明了醌基團是接受電子的主要官能團。核磁共振和熱解氣相色譜-質譜法也指出醌基團是重要的氧化還原功能基團[24,25]。酚類物質含量與電子供給量之間呈現強線性相關[26,27], 說明酚基團可能是電子供給能力的主要貢獻者。而醌基團和酚基團都屬于芳香族化合物,因此芳香碳含量與DOM的ETC可能存在關聯。此外,一些含S、N有機物也是電子轉移能力的貢獻者。

4 結 論
堆肥DOM的EDC總體比EAC高約10倍,在堆肥過程中ETC呈增大趨勢。紅外光譜顯示堆肥過程中DOM的羥基和羧基等官能團對ETC沒有明顯的貢獻。元素分析結果說明DOM中的含硫基團對ETC增加有貢獻,而含氮物質中蛋白類物質含量較高,因此不能體現含氮基團對電子轉移能力的貢獻。三維熒光分析結果表明,在堆肥過程中類蛋白組分減少,類腐殖質組分增多。類腐殖質組分芳香性高,其中含有大量具有電子轉移能力的酚基團和醌基團,因此類腐殖質組分增多會促進ETC增強。
1 Cui H Y, Zhao Y, Chen Y N, Zhang X, Wang X Q, Lu Q, Jia L M, Wei Z M.J.Hazard.Mater.,2017, 326: 10-17
2 Wang Q, Li R, Cai H, Awasthi M K, ZhangZ, Wang J J, Ali A, Amanullah M.Ecol.Eng.,2016, 87: 157-161
3 Wei Z, Wang X, Zhao X, Xi B, Wei Y, Zhang X, Zhao Y.Int.Biodeter.Biodegr.,2016, 113: 187-194
4 LI Dan, HE Xiao-Song, XI Bei-Dou, GAO Ru-Tai, ZHANG Hui, HUANG Cai-Hong, DANG Qiu-Ling.Environ.Sci.,2016, 37(9): 3660-3669
李 丹, 何小松, 席北斗, 高如泰, 張 慧, 黃彩紅, 黨秋玲. 環境科學,2016, 37(9): 3660-3669
5 YANG Chao, HE Xiao-Song, GAO Ru-Tai, XI Bei-Dou, HUANG Cai-Hong, ZHANG Hui, TAN Wen-Bing, LI Dan.ChineseJ.Anal.Chem.,2017, 45(4): 579-586
楊 超, 何小松, 高如泰, 席北斗, 黃彩紅, 張 慧, 檀文炳, 李 丹. 分析化學,2017, 45(4): 579-586
6 Wei Z, Zhang X, Wei Y, Wen X, Shi J, Wu J, Zhao Y, Xi B .BioresourceTechnol.,2014, 161(6): 179-185
7 CUI Dong-Yu, HE Xiao-Song, XI Bei-Dou, TAN Wen-Bing, YUAN Ying, GAO Ru-Tai.ChineseJ.Anal.Chem.,2015, 43(2): 218-225
崔東宇, 何小松, 席北斗, 檀文炳, 袁 英, 高如泰. 分析化學,2015, 43(2): 218-225
8 Yuan T, Yuan Y, Zhou S, Li F, Liu Z, Zhuang L.J.SoilSediment,2011, 11(3): 467-473
9 Zhu Z, Tao L, Li F.Chemosphere,2013, 93(1): 29-34
10 Tan W, Zhang Y, Xi B, He X, Gao R, Huang C, Zhang H, Li D, Zhao X, Li M.Sci.TotalEnviron.,2017, 610-611: 333-341
11 Tan W, Xi B, Wang G, Jiang J, He X, Mao X, Gao R, Huang C, Zhang H, Li D.Environ.Sci.Technol.,2017, 51(6): 3176
12 Song C H, Li M X, Xi B D, Wei Z M, Yue Z, Xuan J, Hui Q, Zhu C W.Int.Biodeter.Biodegr.,2015, 103: 38-50
13 Bi R, Lu Q, Yu W, Yuan Y, Zhou S.J.SoilSediment,2013, 13(9): 1553-1560
14 MA Li-Na, ZHANG Hui, TAN Wen-Bing, YU Min-Da, HUANG Zhi-Gang, GAO Rui-Tai, XI Bei-Dou, HE Xiao-Song.Spectros.Spect.Anal.,2016, 36(1): 206-212
馬麗娜, 張 慧, 檀文炳, 虞敏達, 黃智剛, 高如泰, 席北斗, 何小松. 光譜學與光譜分析,2016, 36(1): 206-212
15 Drosos M,Jerzykiewicz M, Deligiannakis Y.J.ColloidInterf.Sci.,2009, 332(1): 78-84
16 He X S, Xi B D, Cui D Y, Liu Y, Tan W B, Pan H W, Li D.J.Hazard.Mater.,2014, 268(3): 256-263
17 He X S, Xi B D, Wei Z M, Jiang Y H, Yang Y, An D, Cao J L, Liu H L.J.Hazard.Mater.,2011, 190(1-3): 293-299
18 Soobhany N, Gunasee S, Rago Y P, Joyram H, Raghoo P, Mohee R, Garg V K.BioresourceTechnol.,2017, 236: 11
19 Jia H, Li L, Fan X, Liu M, Deng W, Wang C.J.Hazard.Mater.,2013, s256-257(7): 16-23
20 Yuan Y, Xi B, He X, Tan W, Gao R, Zhang H, Yang C, Zhao X, Huang C, Li D.J.Hazard.Mater,2017, 339: 378-384
21 Peltre C, Gregorich E G, Bruun S, Jensen L S, Magid J.SoilBiol.Biochem.,2017, 104: 117-127
22 He X, Xi B, Wei Z, Guo X, Li M, An D, Liu H.Chemosphere,2011, 82(4): 541-548
23 Scott D T, Mcknight D M, Blunt-Harris E L, Kolesar S E, Lovley D R.Environ.Sci.Technol.,1998, 32(19): 372
24 Herzsprung P, Von TüMpling W, Hertkorn N, Harir M, BüTtner O, Bravidor J, Friese K, Schmitt-Kopplin P.Environ.Sci.Technol.,2012, 46(10): 5511-5518
25 Aeschbacher M, Sander M, Schwarzenbach R P.Environ.Sci.Technol.,2009, 44(1): 87-93
26 Aeschbacher M, Graf C, Schwarzenbach R P, Sander M.Environ.Sci.Technol.,2012, 46(9): 4916-4925
27 Walpen N, Schroth M H, Sander M.Environ.Sci.Technol.,2016, 50(12): 6423-6432

