水培實驗中不同粒徑納米TiO2對金魚藻種子發芽和植株生長和生理的影響
文雙喜,王毅力
1. 北京林業大學環境科學與工程學院,北京 100083 2. 貴陽學院生物與環境工程學院,貴陽 550005
納米二氧化鈦(TiO2-NPs)是一種人工金屬氧化物納米材料,因具有優異的吸收紫外線能力、高效的光催化效果、良好的抗光化學腐蝕能力及導電能力,而被大量應用在醫療、食品、化妝品、廢水處理、能量儲存、油漆及建筑材料等關系到國計民生的各行各業中[1-4],預計其全球年產量在2025年將達到2.5×106t[5]。據澳大利亞政府官方報告顯示,在澳大利亞注冊的含TiO2-NPs的防曬化妝品已經高達300多種[6],甚至人類在工作場所呼吸的空氣中都會有納米顆粒的存在[7]。
納米材料在生產、消費和處置過程中不可避免地會通過污水廠尾水和工業廢水排放、大氣沉降、地表/地下徑流等方式進入水體,影響水生生態系統[8]。近期研究表明,TiO2-NPs已經在城市污水處理廠的出水、污泥以及地表水體中均有檢出。付佳露等[9]研究發現,長江口外取水點水樣中的納米顆粒形態的鈦濃度達89.0 μg·L-1;劉志遠等[10]報道,曲陽污水處理廠水體中的鈦濃度達到768 μg·L-1;Kiser等[11]研究發現亞利桑那州生活污水廠中鈦濃度在0.1~3.0 mg·L-1的范圍內波動。
自然水體是經多種途徑釋放到環境介質中的納米顆粒的最終受納體,因此進入到天然濕地和人工濕地中的TiO2-NPs會在濕地生物、基質、水體之間進行遷移轉化和歸趨。已有的研究表明,植物是納米材料進入環境及其在食物鏈中的向上傳遞和生物富集的重要通道之一[12]。因此,研究納米材料對濕地植物的影響特征可以揭示該材料在環境中的歸趨、生態毒理效應及其去除機制。金魚藻是濕地中常見的植物,目前關于納米材料對金魚藻污染生態效應方面的文獻還比較缺乏。因此,本研究選取金魚藻作為研究對象,考察不同粒徑TiO2-NPs對金魚藻種子發芽、植株生長形態和生理特征的影響,同時研究金魚藻植株對不同粒徑TiO2-NPs的吸收、累積及TiO2-NPs進入植株后的分布特征。
1 材料與方法(Materials and methods)
1.1 實驗材料
實驗所用金魚藻種子購自南京景香園有限公司,所用金魚藻植株(展葉期,采于當年5月)采自圓明園九州景區池塘。SOD試劑盒購于南京建成生物工程研究所,培養植物所用1/4濃度的霍格蘭氏植物培養液按照文獻[13]中的方法配制。
4 nm、20 nm、50 nm的TiO2-NPs購于北京安特普納科貿責任有限公司(含量:≥99.5%;銳鈦礦∶金紅石=71∶29),本研究中對3種粒徑TiO2-NPs的TEM圖像、各粒徑不同濃度TiO2-NPs在25 ℃、pH=6.5±0.1的1/4濃度的霍格蘭氏植物培養液中的Zeta電位值及XRD圖譜(20 nm)進行了表征或觀察。
主要儀器:帶能譜儀的透射電鏡(TEM-EDX, JEM-2100, JEOL, 日本);Reichert超薄切片機(Ultracut,米力光國際貿易有限公司,英國);X射線衍射儀(XRD, BruckerD-8 Diffractometer, 德國);Zeta電位分析儀(Zetasizer 2000, Malvern, 英國);光照培養箱(MGC-300B, 上海一恒科學儀器有限公司);電感耦合等離子體質譜(ICPS-1000IV, Shimadzu, 日本);氣浴恒溫振蕩器(RH-8811,常州潤華電器有限公司);7230型分光光度計(上海精密儀器儀表有限公司);立式高速冷凍離心機(GL-25MS, 匡貝實業有限公司)。
1.2 種子發芽試驗
為了保證發芽試驗的準確性,挑選形態豐滿、品相良好的金魚藻種子(百粒重0.0334 g)進行發芽試驗,考察不同濃度的TiO2-NPs對金魚藻種子的發芽影響。
種子和實驗器材消毒滅菌,TiO2-NPs處理濃度分別為0、20、100、200、500、1 000、2 000 mg·L-1,按文獻[14]中的方法進行種子暴露處理,按文獻[15]中的方法進行發芽試驗,每天(共6 d)記錄種子發芽數,發芽結束測定種子發芽重量,所有發芽試驗均設置3次重復。按照文獻[16]中的公式計算金魚藻種子的發芽指數、發芽率、發芽勢及活力指數等發芽指標。
1.3 植株暴露培養
為了保證試驗結果的可靠性,所有金魚藻植株從圓明園取回后都先放入裝有1/4濃度的霍格蘭氏植物培養液的50 cm×40 cm×35 cm玻璃水族箱中25 ℃下馴化培養15 d。
取馴化后生長情況相當的金魚藻植株放入裝有含不同濃度TiO2-NPs的1/4濃度霍格蘭氏植物培養液的1 000 mL燒杯中進行TiO2-NPs暴露培養。把裝有植株的燒杯放入光照培養箱中培養,培養條件:白天/黑夜溫度(26/22±1) ℃;光照/黑暗周期16 h/8 h;光照強度300 μE·m-2·s-1,培養時間為10 d。
TiO2-NPs的濃度梯度設置為0、1、10、100、200和500 mg·L-1,每個燒杯放入約10 g金魚藻植株,每個濃度設置3次重復,每天記錄植株生長情況。
1.4 植株生長指標的測定
每2天取1.3中經不同濃度TiO2-NPs溶液培養的金魚藻樣品進行丙二醛(MDA)、葉綠素含量測定。培養結束取樣進行超氧化物歧化酶(SOD)活性測定,SOD活性和MDA含量取根進行測定。
其中,SOD酶活性按南京建成生物工程研究所的SOD試劑盒的說明書進行測定;MDA和葉綠素含量分別按照文獻[17]和[18]中的方法進行測定。
1.5 TiO2-NPs在植株體內的分布與累積
培養結束,取1.3中經不同濃度TiO2-NPs溶液培養的金魚藻植株按文獻[19]中的方法進行TEM-EDX觀察。另取適量樣品按文獻[20]中的方法利用ICP-MS測定樣品中的Ti含量。同時,由于鎂(Mg)是植物正常生長所必需的微量元素之一,是構成葉綠素的中心分子,有促進植物光合碳同化的作用,考慮到Mg含量和葉綠素之間的關系,在測定Ti含量的同時也測定樣品中Mg的含量。
1.6 數據分析
本試驗所有處理均設3次重復,以3個平行組數據計算平均值±標準差(Mean±SD),采用ANOVA(Analysis of variance, LSD檢驗法)對試驗數據進行差異顯著性分析(檢驗標準為P<0.05),采用origin8.0對數據進行繪圖。
2 結果與討論(Results and discussion)
2.1 TiO2-NPs表征結果
3種粒徑TiO2-NPs的TEM圖像、不同濃度TiO2-NPs在25 ℃、pH=6.5±0.1的1/4濃度的霍格蘭氏植物培養液中的Zeta電位值及XRD圖譜(20 nm)如圖1所示。
圖1a~c中的TEM圖像顯示各粒徑的TiO2-NPs均呈圓形、橢圓形或長方形顆粒,平均粒徑與商家所標基本吻合;TiO2-NPs(20 nm)的XRD圖譜如圖1d所示,在25.24°、37.7°、48.0°、55.04°、62.76°、70.22°和75.06°檢測到了峰的存在,其中25.24°到48.0°之間的峰為區分特征峰,與粉體衍射標準卡聯合委員會(JCPDS)數據庫No.21-1272號卡片吻合,表明本試驗所用TiO2-NPs的主要成分為銳鈦礦,滿足試驗需求。從圖1e中可以看出:各粒徑不同濃度的TiO2-NPs在1/4濃度的霍格蘭氏植物培養液中的Zeta電位整體數值范圍在±10.0~±30.0之間,說明分散體系不太穩定[21],因此,在培養實驗中需要每天定時對培養液進行攪動數次,保證TiO2-NPs顆粒在溶液中保持良好的分散狀態。
2.2 TiO2-NPs對金魚藻種子發芽的影響
不同粒徑、不同濃度TiO2-NPs溶液處理后的金魚藻種子發芽率及發芽重量見圖2,主要發芽指數如表1所示。
從圖2a中可以看到,3種粒徑的TiO2-NPs處理均對金魚藻種子的發芽有一定的抑制作用,且TiO2-NPs粒徑越小、濃度越高抑制作用越明顯。4 nm、20 nm和50 nm的TiO2-NPs對金魚藻種子發芽的半數有效濃度(EC50)分別為1 180、1 520和1 810 mg·L-1,當濃度為2 000 mg·L-1時,3種粒徑TiO2-NPs處理后金魚藻種子的發芽率分別由空白處理的88.33%下降到27.67%(4 nm)、31.67%(20 nm)和39.67%(50 nm)。

圖1 TiO2-NPs的TEM表征(a-4 nm;b-20 nm;c-50 nm)以及XRD圖譜(d-20 nm)和25 ℃下不同濃度的TiO2-NPs在1/4濃度的霍格蘭氏植物培養液中的Zeta電位Fig. 1 TEM images (a-4 nm; b-20 nm; c-50 nm) and physical properties of TiO2-NPs (d-20 nm) XRD patterns; (e) zeta potential vs. different TiO2-NPs concentrations in 25% strength Hoagland nutrient solution at 25 ℃
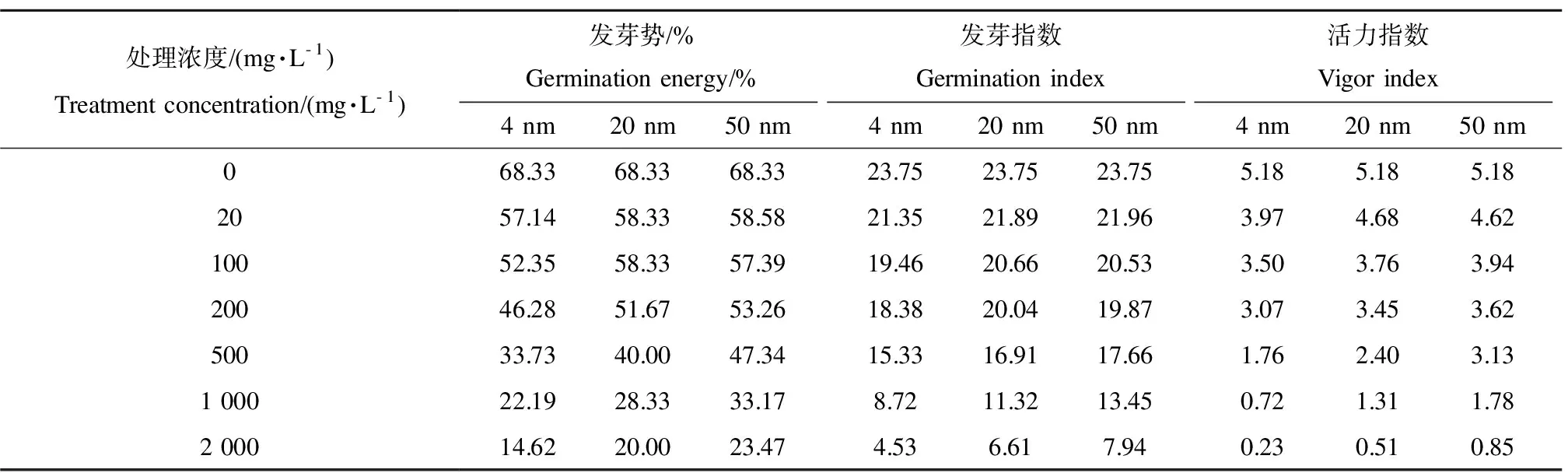
表1 TiO2-NPs處理對金魚藻種子發芽的影響Table 1 The effects on the germination of Ceratophyllum demersum seeds treated with TiO2-NPs

圖2 TiO2-NPs處理后金魚藻種子的發芽率(a)和發芽重量(b)注:*代表不同處理與空白對照之間存在顯著性差異(P<0.05)。Fig. 2 Germination rates (a) and seedling masses (b) of Ceratophyllum demersum seeds under TiO2-NPs treatmentNote: * indicates a significant difference between the treatment and the control groups (P<0.05).

圖3 不同粒徑的TiO2-NPs處理下金魚藻植株的生長形態Fig. 3 Ceratophyllum demersum cultured under different TiO2-NPs sizes
從圖2b中可以看出,TiO2-NPs處理后金魚藻種子發芽幼苗重量的變化趨勢基本與發芽率的變化趨勢一致,當TiO2-NPs濃度為2 000 mg·L-1時,3種粒徑TiO2-NPs處理的金魚藻種子的發芽幼苗重量由空白處理的0.218 g分別下降到0.051 g(4 nm)、0.077 g(20 nm)和0.107 g(50 nm)。可能是因為高濃度的TiO2-NPs處理后進入金魚藻種子的TiO2-NPs量增加,對金魚藻種子的生理機能造成損傷,并且隨著顆粒尺度變小,TiO2-NPs表面晶格破損程度更高,產生活性位點更多,形成超氧自由基及其他活性氧化物質(ROS)更多,氧化壓力(OS)提高,導致種子內脂質過氧化,破壞種子細胞膜,因此對金魚藻種子發芽產生更明顯的抑制作用[22]。
由表1可以看出,各粒徑TiO2-NPs處理后金魚藻種子的各項發芽指標均有不同程度的下降,且TiO2-NPs粒徑越小、濃度越高降低幅度越大,說明粒徑越小、濃度越高,TiO2-NPs對金魚藻種子發芽的抑制作用越強。導致這種現象的原因可能是粒徑小的TiO2-NPs更加容易穿透金魚藻種子的種皮進入到種子體內,從而對種子的發芽產生影響。常見的生物大分子和活性物質其粒徑基本都處于納米級,細胞當中的細胞膜上的孔徑、核膜上的孔徑和離子通道等通常也在納米級別[23],當納米材料的粒徑小到一定的程度時,納米顆粒就可以直接穿過細胞膜進入細胞,從而對細胞正常的新陳代謝產生影響。
2.3 TiO2-NPs對金魚藻植株生長與生理的影響
2.3.1 植株生長形態
不同粒徑的TiO2-NPs處理下金魚藻植株的生長形態如圖3所示。從圖中可以看出,經過10 d的培養后,空白對照(0 mg·L-1)處理的金魚藻植株整體生長狀況良好,顏色呈青綠色;各粒徑TiO2-NPs處理隨著濃度的升高金魚藻的生長均受到不同程度的抑制,表現為葉片失綠發黃、脫落,植株呈萎焉狀,且TiO2-NPs的粒徑越小,上述影響越明顯。已有研究表明TiO2-NPs可以通過植物根部進入細胞,通過物理阻塞作用使植物細胞細胞壁孔徑變小,從而影響植物細胞的正常生理功能,致使植物生長受到抑制[24]。

圖4 不同濃度TiO2-NPs處理后金魚藻植株葉綠素含量(a-4 nm; b-20 nm; c-50 nm)和Mg(d)含量的影響Fig. 4 Chlorophyll (a-4 nm; b-20 nm; c-50 nm) and Mg (d) content of Ceratophyllum demersum cultured under different TiO2-NPs concentrations
2.3.2 葉綠素與Mg含量
不同粒徑、不同濃度的TiO2-NPs處理對金魚藻植株葉綠素含量的影響結果如圖4所示。培養10 d后,空白處理(0 mg·L-1)下的金魚藻葉片的總葉綠素含量在10 d的培養期間基本穩定在同一濃度水平;而不同粒徑TiO2-NPs處理下金魚藻葉綠素含量均隨處理濃度的升高而下降,且粒徑越小下降幅度越大。在經過濃度為500 mg·L-1的不同粒徑的TiO2-NPs暴露培養10 d后,金魚藻葉片的總葉綠素含量從剛移栽的3.43 mg·g-1分別下降到1.01(4 nm)、1.16(20 nm)和1.86 mg·g-1(50 nm)。
從圖4d中可以看出,隨著暴露培養時間的延長和TiO2-NPs處理濃度的升高金魚藻植株體內不同組織部位的Mg含量均出現不同程度的減少,整體變化趨勢與葉片總葉綠素含量的變化趨勢相仿。說明TiO2-NPs處理影響了金魚藻植株對Mg的吸收,進而影響到植株葉綠素的合成。
2.3.3 SOD活性和MDA含量
各種酶活性的調節是植物自我保護的體現,SOD則是生物體內清除自由基保護細胞免受損傷的首要物質,它可阻止氧自由基對細胞造成的損害并修復受損細胞[25]。不同粒徑、不同濃度的TiO2-NPs處理對金魚藻植株SOD酶活性和MDA含量的影響結果如圖5所示。從圖5a中可知,當TiO2-NPs濃度低于100 mg·L-1時,各粒徑TiO2-NPs處理后金魚藻體內的SOD活性隨TiO2-NPs濃度的升高不斷增強,且TiO2-NPs的粒徑越小金魚藻植株體內的SOD活性越高,可能是因為TiO2-NPs更容易進入金魚藻體內,從而對金魚藻植株產生更強的毒害作用,致使對金魚藻的氧化脅迫水平升高,表明3種粒徑TiO2-NPs對金魚藻都具有一定的毒害作用,金魚藻體內SOD活性升高以清除納米脅迫產生的ROS。4 nm和20 nm TiO2-NPs處理在濃度為100 mg·L-1時金魚藻體內SOD活性達到最大值,分別為39.57 U·g-1FW(4 nm)和37.37 U·g-1FW(20 nm)。當TiO2-NPs濃度超過100 mg·L-1時,4 nm和20 nm TiO2-NPs處理的金魚藻體內SOD活性隨濃度升高而下降,而50 nm TiO2-NPs處理的金魚藻體內SOD活性則隨著濃度的升高繼續上升,并在濃度為500 mg·L-1時達到最大值32.96 U·g-1FW,產生這種現象的原因可能是4 nm和20 nm的TiO2-NPs由于粒徑更小,更加容易進入金魚藻體內,當TiO2-NPs濃度超過100 mg·L-1時,由于大量的TiO2-NPs進入金魚藻植株體內,對金魚藻植株產生毒害作用,金魚藻植株體內的抗氧化機制運作遭到抑制和破壞,因而SOD活性開始隨著濃度的升高而持續下降。
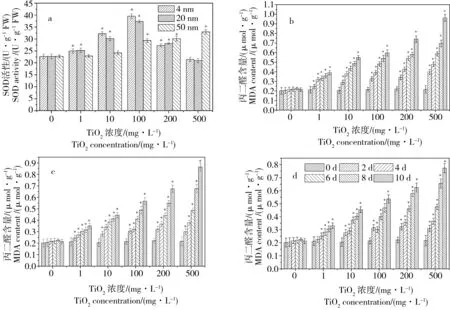
圖5 不同濃度處理對金魚藻體內超氧化物歧化酶(SOD)酶活性(a)和丙二醛(MDA)(b-4 nm; c-20 nm; d-50 nm)含量的影響Fig. 5 Superoxide dismutase (SOD) activity (a) and malondialdehyde (MDA) content (b-4 nm; c-20 nm; d-50 nm) of Ceratophyllum demersum

圖6 500 mg·L-1 TiO2-NPs處理金魚藻的TEM-EDX觀察(a-4 nm; b-20 nm; d-50 nm)以及EDX掃描表明Ti的存在(f)Fig. 6 TEM analysis of TiO2-NPs distribution in Ceratophyllum demersum exposed to 500 mg L-1 of TiO2-NPs (a-4 nm; b-20 nm; d-50 nm) and EDX analysis of the bright zone showing the presence of Ti (f)
圖5b~d表明了金魚藻體內MDA含量與不同粒徑、不同濃度TiO2-NPs暴露培養處理的關系,由圖中可以看到,空白處理下的金魚藻根系的MDA含量在整個培養期間(0~10 d)內都保持在一個穩定的水平,沒有出現大幅波動;但當各粒徑TiO2-NPs濃度為1~500 mg·L-1時,金魚藻體內的MDA水平隨著培養時間的推進而不斷升高,隨著TiO2-NPs濃度的升高而快速上升,并且粒徑越小上升幅度越大。不同粒徑TiO2-NPs在濃度為500 mg·L-1時金魚藻體內的MDA含量由移栽時的0.25 μmol·g-1分別上升到0.97(4 nm)、0.85(20 nm)和0.75 μmol·g-1(50 nm),分別出現了高達388%、340%和300%的增長。這表明TiO2-NPs對金魚藻有一定的毒害作用,能迫使金魚藻植株體內脂質發生過氧化反應而產生大量MDA,且TiO2-NPs的粒徑越小對金魚藻的毒害作用越強。
2.4 TiO2-NPs顆粒在金魚藻植株體內的分布
經500 mg·L-1不同粒徑TiO2-NPs暴露培養10 d后,金魚藻植株切片的TEM-EDX分析結果如圖6所示。
從圖中可以看出,3種粒徑TiO2-NPs處理的金魚藻植株中都發現了顆粒沉積物的存在,且粒徑越小金魚藻根中的沉積物越多。這些顆粒沉積物很有可能是被金魚藻吸收轉運進來的TiO2-NPs顆粒。為了確認這些沉積顆粒的成分,利用能譜分析儀對顆粒物沉積區域進行掃描,通過顆粒沉降物的EDX光電子能譜圖(圖6f)發現這些顆粒沉積物中含有很高含量的Ti元素,因此,這些沉積顆粒應該就是被金魚藻吸收轉運進入體內的TiO2-NPs顆粒。
納米材料要進入植物體內必須通過植物細胞的細胞壁,資料顯示一般植物的細胞壁上的孔徑尺寸大約為5~20 nm[26],小于細胞壁孔徑的納米顆粒可以直接穿過細胞壁進入植物細胞體內,而大于細胞壁孔徑的納米顆粒則須通過內吞和主動運輸等方式才能進入植物體內[27],因而本研究中4 nm的TiO2-NPs處理后金魚藻體內觀察到沉積顆粒物最多,20 nm的TiO2-NPs處理次之,50 nm的TiO2-NPs處理后金魚藻內的顆粒沉積物最少。
2.5 Ti在金魚藻體內的累積量
經過ICP-MS檢測經不同粒徑、不同濃度TiO2-NPs暴露培養后金魚藻植株體內的Ti元素累積量,結果如圖7所示。

圖7 ICP-MS測定Ti在金魚藻體內的累積量Fig. 7 ICP-MS observations of Ti accumulation in Ceratophyllum demersum
從圖中可以看到,經不同粒徑、不同濃度TiO2-NPs培養處理后的金魚藻體內的Ti含量隨著TiO2-NPs處理濃度的升高而不斷上升,且TiO2-NPs的粒徑越小上升幅度越大。3種粒徑的TiO2-NPs在處理濃度為500 mg·L-1時金魚藻體內的Ti含量由空白處理時的1.47 μg·g-1分別上升到996 μg·g-1(4 nm)、866 μg·g-1(20 nm)和529 μg·g-1(50 nm)。巴翠蘭[20]研究發現20 nm的TiO2-NPs顆粒能進入黃瓜的根系,Ti元素在黃瓜根系內的累積量為960 μg·g-1左右。本研究證明4 nm、20 nm和50 nm的TiO2-NPs顆粒均能進入金魚藻植株體內,但是粒徑越大進入金魚藻體內的難度越大,金魚藻體內的Ti含量越低。

