廣東省HER?2基因檢測室間質控存在的問題分析
李淑華 鄭曉克 王芳 李麗 孫世珺 何丹 彭燕 周建文 何瓊 朱宇辛 王連唐★ 柯尊富★
乳腺癌是嚴重威脅女性健康的最常見的惡性腫瘤,盡管現有的研究已經取得一定進展,其發病率和死亡率仍逐年上升[1?3]。在乳腺癌中,HER?2基因的表達與腫瘤的侵襲轉移、預后和整體生存率密切相關[4?7],對于接受傳統的化療與內分泌治療方法耐受或耐藥的患者[8?9],針對HER?2基因的靶向藥物赫賽汀(Herceptin)更是為其治療提供了新思路。研究表明20%~30%的浸潤性乳腺癌患者尤其是浸潤性導管癌患者中發現HER?2基因的擴增和/或 HER?2 蛋白的過表達[10?11],因此正確檢測和評價乳腺癌HER?2狀態至關重要。美國食品藥品監督管理局(Food and Drug Administra?tion,FDA)準許臨床上進行HER?2檢測的熒光原位雜交(fluoresecencein situhybridization,FISH)檢測用于檢查17號染色體著絲粒(CEP17)和HER?2基因擴增情況,FISH的敏感性和特異性較高,是目前國際公認的HER?2基因檢測的“金標準”[10]。
開展HER?2室間質控的目的是為了實現各檢測實驗室對同一病例檢測結果保持一致性和可重復性,進而反映患者HER?2基因的真實表達情況。乳腺癌靶向藥物赫賽汀主要應用于HER?2基因過表達的乳腺癌患者,因此患者用藥前必須測定腫瘤組織中的HER?2基因狀態,只有通過嚴格的標準化檢測,乳腺癌患者的靶向治療才能達到最佳效果。
廣東省的三甲醫院已相繼運用FISH技術開展臨床上乳腺癌HER?2基因的檢測,為了對我省HER?2基因檢測的基本情況進行摸底,發現和解決各實驗室檢測中存在的共性及個性的問題,保證不同實驗室間檢測的一致性,廣東省病理質控中心2015年6月舉行了廣東省HER?2室間質控項目(external quality assessment,EQA),對我省廣州、深圳、汕頭等市的26家醫院及檢測機構進行了評估,本文將對本次質控的情況及存在的問題進行總結。
1 材料與方法
1.1 材料
此次質控使用的樣本為甲醛固定的乳腺癌石蠟包埋的手術樣本,選擇HER?2不同陽性模式的石蠟切片作為質控片標本,共設立3個質控品,樣本①、②為HER?2基因擴增陽性樣本,樣本③為HER?2基因擴增陰性樣本。此次供片單位分別為中山大學附屬第一醫院、中山大學附屬腫瘤醫院、廣東省中醫院3家單位。每家供片單位提供1個樣本,該樣本提供90張切片,切片厚度均為3~5 μm,保證參與質控的各實驗室每個樣本有3張玻片,一張用于組織學染色,一張用于HER?2檢測,一張備用,供片單位將同一病例的首尾2張各做FISH檢測以確保質控片質量的一致性。供片單位于質控活動正式開展15日前將切片及參考結果上交廣東省臨床病理醫療質量控制中心分子病理質控小組,供片單位提供的質控品在發放前需由一家分子病理質控小組成員確定的醫院再次檢測驗證。質控結果由質控小組成員采取雙盲形式進行結果判讀。質控樣本統一寄發給各參與實驗室,每家參評單位在收到質控玻片一個月內完成檢測后,將“室間質評活動回報表”和檢測的原始玻片在低溫狀態下快遞郵寄到省臨床病理醫療質量控制中心,質評成績在實驗室上報結果2周后下發。
1.2 方法
1.2.1 檢測方法
本次質控各實驗室采用熒光原位雜交(FISH)檢測方法。基本程序包括組織切片、脫蠟至水化、預處理、酶消化、脫水、變性和雜交、洗滌復染、復染閱片。操作流程按照每家單位臨床檢測的標準操作程序(standard operating procedure,SOP)進行。主要步驟如下:室溫下進行組織切片,切片厚度為4 μm;100%乙醇、85%乙醇、70%乙醇梯度酒精進行脫水,然后將玻片放至去離子水中;將玻片放入(95±5)℃的去離子水中煮片20~30 min或者將玻片放入80℃的預處理試劑中,恒溫處理10 min;將組織切片用蛋白酶K或胃蛋白酶工作液中浸泡或滴染消化;依次置于70%乙醇、85%乙醇和100%乙醇中進行脫水;自然干燥或置45~50℃烤片機上干燥玻片,加探針后蓋上蓋玻片并用封片膠密封后放于原位雜交儀中變性雜交,也可利用水浴箱等設定好的溫度條件進行人工變性雜交,變性溫度一般為73~83℃,變性5 min,雜交溫度為37℃或42℃,雜交時間16~20 h;雜交完成后移去蓋玻片,按照試劑盒說明書中要求的NP40及2×SSC的濃度進行雜交后洗滌;70%乙醇處理 5 min,玻片自然干燥后滴加 4′,6?二脒基?2?苯基吲哚(4′,6?diamidino?2?phenylindole,DAPI)復染封片,避光熒光顯微鏡下進行閱片。
1.2.2 判讀標準
判讀標準按照《乳腺癌HER?2檢測指南(2014版)》,選擇細胞核大小一致、核邊界完整、DAPI染色均一、細胞核無重疊、信號清晰的細胞。隨機計數至少20個浸潤癌細胞核中的雙色信號,判讀標準:①當HER?2/CEP17比值≥2.0時,為HER?2陽性;HER?2/CEP17比值<2.0,但平均HER?2拷貝數/細胞≥6.0時也為HER?2陽性。②HER?2/CEPl7比值<2.0且平均HER?2拷貝數/細胞<4.0時為HER?2陰性。③HER?2/CEP17比值<2.0且平均HER?2拷貝數/細胞<6.0,但HER?2拷貝數/細胞>4.0時HER?2為結果不確定[12]。
1.2.3 質評考核參數
根據各參評單位上交的資料,質控小組各成員從檢測試劑的種類、消化液種類、消化液的濃度及消化時間、紅綠信號比值、檢測玻片的背景及信號強度、浸潤癌所占的細胞比例、玻片是否水煮及水煮時間、變性及雜交的溫度及時間、是否有異質性等參數進行結果評定。
2 結果
2.1 檢測試劑種類
本次參控單位使用的檢測試劑共有雅培(美國)、北京金菩嘉醫療科技有限公司、廣州安必平醫藥科技股份有限公司3家公司的試劑,從匯報的結果看,3種試劑探針本身對質控結果的影響無明顯差異。
2.2 消化液種類及時間
本次質控中,消化液使用了胃蛋白酶和蛋白酶K 2種消化酶,12家使用了蛋白酶K,其中11家使用的蛋白酶K濃度為200 μg/mL,消化時間為0.5~19 min,1家醫院使用的蛋白酶K濃度為150 μg/mL,消化時間為10 min。14家使用了胃蛋白酶,濃度為4 mg/mL,消化時間為5~40 min。通過鏡下觀察信號雜交情況,2種酶的消化效果無特別明顯差異。
2.3 其它參數情況
26家參評單位,除3家未采用水煮的處理方式之外,其余23家均進行了水煮的步驟,水煮時間17~30 min,其中1家用EDTA修復液進行水煮,其余均采用雙蒸水水煮。總體變性溫度為73~85℃,變性時間 5~8 min;雜交溫度 37~42℃,雜交時間12~20 h。在本次質控中,標本①有2家醫院的檢測報告中提及標本存在腫瘤異質性問題,標本②有1家醫院檢測報告提及異質性問題。
2.4 結果吻合率
乳腺癌標本①結果吻合率96.15%,HER?2/CEP17比值介于 3.29~8.52,HER?2/CEP17平均值為4.12(圖1),有1家單位結果報成簇狀擴增,鏡下觀察其玻片的紅色背景下存在非特異雜交信號,簇狀擴增應為誤判;乳腺癌標本②結果吻合率84.62%,4家實驗室報點擴增,HER?2/CEP17比值介于7.49~10.27,其余實驗室均報HER?2基因紅色信號點成簇(圖2);標本③結果吻合率100%。HER?2/CEP17 比值介于 1.00~1.79,HER?2/CEP17平均值為1.18(圖3)。
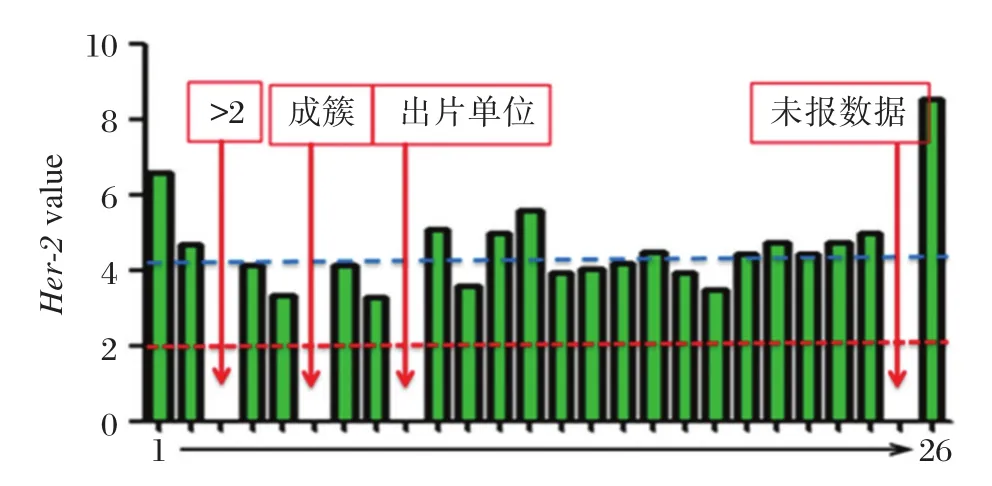
圖1 各參評實驗室標本①的HER?2/CEP17比值情況Figure 1 The HER?2/CEP17 ratio of specimen ① in each participating laboratory
2.5 背景及信號強度
在熒光顯微鏡下觀察26家參評單位的玻片,DAPI通道下觀察輪廓消化過度的有2家,紅色信號強度較弱有2家,綠色信號強度較弱有1家。背景及信號強度結果不合格者與規范實例的典型對照如圖4,該圖像是使用OLYMPUS BX51熒光顯微鏡在100×油鏡下觀察FISH檢測的玻片后采集并合成的。參評單位中有2家單位DAPI輪廓顯示不清,甚至可見紅色與綠色信號定位于細胞外(圖4A1,4A2)。紅色信號強度較弱者2家(圖4B1,4B2),綠色信號強度較弱者 1 家(圖 4C1,4C2),通過改進和完善制片方法可以避免類似結果發生。
3 討論

圖2 各參評實驗室標本②的HER?2/CEP17比值情況Figure 2 The HER?2/CEP17 ratio of specimen ② in each participating laboratory
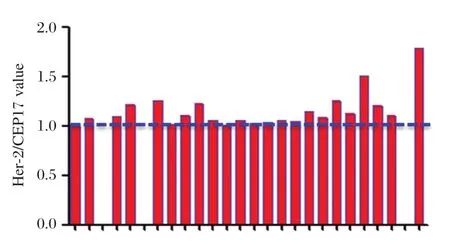
圖3 各參評實驗室標本③的HER?2/CEP17比值情況Figure 3 The HER?2/CEP17 ratio of specimen ③ in each participating laboratory
FISH技術操作中影響染色質量的因素較多,如果實驗過程中操作不當會嚴重影響最終染色結果,因此只有準確地檢測HER?2基因的表達才能確保患者可以從靶向治療中獲益。筆者結合本次質控中存在的問題及實驗室在實際檢驗中的情況,針對在FISH操作過程中一些關鍵操作步驟進行探討。
FISH操作對組織的前期處理要求比較嚴格,要求標本盡量在離體0.5 h內用10%中性甲醛進行及時、有效的固定,由于甲醛可以使DNA或蛋白質的氨基團間形成亞甲基網橋,這種交聯作用使細胞質或細胞核內的各種生物大分子形成網絡,利于維持細胞結構和組織形態,但這樣會影響細胞膜的通透性,阻礙核酸探針的摻入[13]。為了解石蠟組織標本經甲醛固定后蛋白質分子發生交聯造成的抗原封閉問題,目前參加質評的各實驗室采用了高溫預處理的方法,常見的預處理的方式主要包括水煮法、硫氫化鈉法、亞硫酸氫鈉法等。在上述操作過程中水煮法最為簡便易行,本次質控中88%的醫院采用了水煮的處理方式,該步驟主要通過高溫或化學處理消除甲醛固定所致的蛋白交聯,水煮的液體可以是去離子水、超純水或者雙蒸餾水,時間一般為15~30 min。臨床檢測中,對于一些軟組織肉瘤等類型的標本及一些抗原封閉嚴重不利于探針雜交的組織可以嘗試用檸檬酸(pH 6.0)或EDTA(pH 9.0)抗原修復液進行煮沸或高壓修復。在實際操作中應結合實驗室使用的試劑盒、不同的組織標本及探針類型采取不同的處理方式來摸索合適的高溫預處理條件。

圖4 FISH背景及信號強度檢測結果Figure 4 FISH test of background and signal intensity results
在FISH操作中,為了增加組織的通透性,使探針更好地與組織內的DNA進行雜交,一般采用酶消化的方法以去掉包圍靶核酸的蛋白質。之前研究報道,一般脫落細胞用胃蛋白酶消化,活檢組織用蛋白酶K,且所有標本在摸索條件之前應該在顯微鏡下確定其標本和形態類型以便靈活掌握酶的消化程度[14]。但在實際操作中,也有很多試劑盒推薦用胃酶來消化組織,胃酶比較溫和,用于消化組織也可以起到很好的效果。酶消化的時間會因酶種類的不同而有所改變,且由于標本固定、組織結構、性質不同,即便在相同的熱水浴預處理、酶消化時間條件下,其組織細胞消化的程度也不一致,產生的背景熒光、信號熒光強度也不同,即信噪比也會不同[15]。此次質控中,由于各實驗室酶的儲存及效價不同,還有酶的消化方式不同,有些單位將玻片放入考普林瓶用浸泡法進行消化,有些單位將消化液滴在玻片的組織上進行消化,因此同種類且同濃度的酶在不同醫院間存在消化時間上的差異。為避免本次質控中一些實驗室出現消化過度的問題,可在玻片消化后置于熒光顯微鏡下的DAPI通道觀察細胞核是否清晰完整來判定消化效果,如果消化不足,鏡下細胞邊緣呈云霧狀,會影響雜交效率使信號降低甚至無法完成正常雜交造成無信號;但如果消化過度,鏡下觀察細胞核內出現空洞、核膜不完整甚至消失,引起靶核酸減少使雜交效率降低甚至無法雜交。
乳腺癌是一種典型存在異質性的腫瘤,并且腫瘤的組織學和遺傳特性都具有異質性[16?17],因此,現有臨床數據表明并不是所有的HER?2陽性患者都能從抗HER?2靶向治療中獲益[18]。腫瘤異質性是影響靶向藥物療效和復發的重要因素,靶向藥物選擇性殺傷依賴靶分子的腫瘤細胞,采用曲妥珠單抗治療后,如果腫瘤主要由HER?2高表達的腫瘤這類型細胞組成,靶向藥物殺滅大多數腫瘤細胞,獲得較好的短期療效,但不依賴此途徑的腫瘤細胞則可能存活而逐漸形成耐藥細胞群[19]。在日常檢測中,為避免異質性的問題一定要規范地閱片,病理醫生在對至少20個細胞計數之前應該掃描整張玻片,如果存在第二群細胞有更高的HER?2信號數/細胞,并且這群細胞由切片上超過10%的腫瘤細胞組成,應另對這群細胞中至少20個不重疊的細胞進行計數并報告,同時要對該群細胞占所有浸潤性腫瘤細胞的比例進行報告[20]。此次質控中出現參評單位的結果存在對異質性的報告不統一、報告中紅綠信號比例不同以及浸潤癌占腫瘤細胞比例不同的問題,分析原因一方面是因為石蠟質控標本在連續切片過程中,隨著切片數量的增加,組織中的腫瘤細胞含量及結構發生變化所致,一方面是該質控樣本的確本身存在異質性問題,如選擇不同區域閱片會存在差異。因此,在臨床檢測中,一旦發現腫瘤異質性,應規范地在報告中指出。
綜上所述,要保證HER?2檢測的準確性和可重復性,實驗室應嚴格按照各實驗室操作流程,保證染色過程中的溫度、緩沖液及清洗液的濃度和pH值、探針的配制等參數準確,確保樣本處理、各檢測流程及判讀等各個步驟均規范化操作,只有通過不斷健全室間質控系統,科學設計基礎與臨床實驗流程步驟和評價標準,配合孰知各項實驗內容的檢測團隊,定期進行監查活動,才能確保臨床乳腺癌HER?2基因的檢測持續準確、可靠,從而更好地為臨床診療服務。
[1]Siegel RL,Miller KD,Jemal A.Cancer statistics[J].CA Cancer J Clin,2015,65(1):5?29.
[2]Siegel R,Ma J,Zou Z,et al.Cancer statistics[J].CA Cancer J Clin,2014,64(1):9?29.
[3]Torre LA,Bray F,Siegel RL,et al.Global cancer sta?tistics[J].CA Cancer J Clin,2015,65(2):87?108.
[4]Bramwell VH,Doig GS,Tuck AB,et al.Changes over time of extracellular domain of HER2(ECD/HER2)serum levels have prognostic value in metastat?ic breast cancer[J].Breast Cancer Res Treat,2009,114(3):503?511.
[5]Cheng HT,Huang T,Wang W,et al.Clinicopatho?logical features of breast cancer with different molecu?lar subtypes in Chinese women[J].J Huazhong Univ Sci Technolog Med Sci,2013,33(1):117?121.
[6]Kong Y,Dai S,Xie X,et al.High serum HER2 ex?tracellular domain levels:correlation with a worse dis?ease?free survival and overall survival in primary opera?ble breast cancer patients[J].J Cancer Res Clin On?col,2012,138(2):275?284.
[7]Papila C,Uzun H,Balci H,et al.Clinical signifi?cance and prognostic value of serums HER?2/neu lev?els in patients with solid tumors[J].Med Oncol,2009,26(2):151?156.
[8]Leung YK,Lee MT,Lam HM,et al.Estrogen recep?tor?beta and breast cancer:translating biology into clin?ical practice[J].Steroids,2012,77(7):727?737.
[9]Wu X,Zhang X,Zhang H,et al.Progesterone recep?tor downregulates breast cancer resistance protein ex?pression via binding to the progesterone response ele?ment in breast cancer[J].Cancer Sci,2012,103(5):959?967.
[10] Press MF,Slamon DJ,Flom KJ,et al.Evaluation of HER ?2/neu gene amplification and overexpression:comparison of frequently used assay methods in a mo?lecularly characterized cohort of breast cancer speci?mens[J].J Clin Oncol,2002,20(14):3095?3105.
[11] Demonty G,Bernard?Marty C,Puglisi F,et al.Prog?ress and new standards of care in the management of HER?2 positive breast cancer[J].Eur J Cancer,2007,43(3):497?509.
[12]《乳腺癌HER2檢測指南(2014版)》編寫組.乳腺癌HER2檢測指南(2014版)[J].中華病理學雜志,2014,43(4):262?267.
[13] Chin SF,Daigo Y,Huang HE,et al.A simple and re?liable pretreatment protocol facilitates fluorescent in si?tu hybridization on tissue microarrays of paraffin wax embedded tumor samples[J].Mol Pathol,2003,56(5):275?279.
[14] Yang JL,Zhou XY.The apply fluorescence of situhy?bridization technique on paraffin?embedded tissues of cartilage cancer[J].Chinese Journal of Clinic and Ex?perimental Pathology,2006,22(3):373?374.
[15] 陳慧,陳淳,王華,等.相差顯微鏡觀察FISH檢測石蠟包埋組織切片的理想酶消化程度[J].臨床與實驗病理學雜志,2013,29(7):809?811.
[16] Kuukasj?rvi T,Karhu R,Tanner M,et al.Genetic heterogeneity and clonal evolution underlying develop?ment of asynchronous metastasis in human breast can?cer[J].Cancer research,1997,57(8):1597?1604.
[17] Aubele M,Mattis A,Zitzelsberger H,et al.Intratu?moral heterogeneity in breast carcinoma revealed by la?ser?microdissection and comparative genomic hybrid?ization[J].Cancer genetics and cytogenetics,1999,110(2):94?102.
[18] Vogel CL,Cobleigh MA,Tripathy D,et al.Efficacy and safety of trastuzumab as a single agent in first?line treatment of HER2?overexpressing metastatic breast cancer[J].J Clin Oncol,2002,20(3):719?726.
[19] 薛麗,白玉杰.乳腺癌腫瘤異質性及靶向藥物治療[J].廣東醫學,2012,33(16):2529?2531.
[20] Wolff AC,Hammond ME,Hicks DG,et al.Recom?mendations for human epidermal growth factor recep?tor 2 testing in breast cancer:American Society of Clinical Oncology/College of American Pathologists clinical practice guideline update[J].J Clin Oncol,2013,31(31):3997?4013.