加熱溫度及時間對牛肉膠原蛋白特性及嫩度的影響
劉晶晶,雷元華,李海鵬,謝鵬,萬紅兵,黃彩燕,孫寶忠,張松山
?
加熱溫度及時間對牛肉膠原蛋白特性及嫩度的影響
劉晶晶,雷元華,李海鵬,謝鵬,萬紅兵,黃彩燕,孫寶忠,張松山
(中國農業科學院北京畜牧獸醫研究所,北京 100092)
【目的】通過研究不同加熱溫度和加熱時間來探究膠原蛋白特性對嫩度的影響,為中國高熟度牛肉嫩度特性研究提供參考。【方法】將牛半腱肌肉在60、70、80、90和100℃水浴溫度下分別加熱30、60、90、120和150 min,通過測定剪切力、蒸煮損失、水分含量、質構特性、結締組織機械強度、膠原蛋白含量及熱溶解性、膠原蛋白共價交聯以及掃描電鏡等指標探究嫩度的變化規律,通過相關性分析得出影響嫩度的關鍵因素。【結果】隨著加熱溫度的升高和加熱時間的延長,牛半腱肌肉剪切力降低,蒸煮損失增大,水分含量降低;總膠原蛋白和不溶性膠原蛋白隨著加熱溫度的升高其相對含量明顯增加,隨著加熱時間的延長其相對含量變化不顯著,可溶性膠原蛋白含量及熱溶解性增加、羥賴氨酸吡啶啉(HP)相對含量上升、賴氨酸吡啶啉(LP)相對含量下降,黏著性增大,膠黏性、咀嚼性、凝聚性和回彈性減小。隨著加熱時間的延長,牛肉剪切力與蒸煮損失呈顯著負相關(<0.05);與水分含量、硬度、凝聚性、膠黏性、咀嚼性以及回彈性呈極顯著正相關(<0.01);與總膠原蛋白、可溶性膠原蛋白、不溶性膠原蛋白含量、膠原蛋白熱溶解性以及羥賴氨酸吡啶啉含量呈極顯著負相關(<0.01)。總膠原蛋白、不溶性膠原蛋白的含量與蒸煮損失呈極顯著正相關(<0.01);羥賴氨酸吡啶啉與肌肉的黏著性和總膠原蛋白含量呈極顯著正相關(<0.01),與彈性、可溶性膠原蛋白以及不溶性膠原蛋白含量呈顯著正相關(<0.05),與膠黏性和咀嚼性呈顯著負相關(<0.05),賴氨酸吡啶林與彈性呈顯著負相關(<0.05),與凝聚性呈顯著正相關(<0.05),與回彈性呈極顯著正相關(<0.01)。與加熱溫度相比,加熱時間對牛肉嫩度的影響更為顯著。牛肉嫩度與膠原蛋白含量及熱溶解性、HP、蒸煮損失、水分含量、硬度、凝聚性、膠黏性、回彈性和咀嚼性有關;膠原蛋白含量及熱溶解性與蒸煮損失和水分含量有關。肌肉的黏著性、彈性、回彈性、凝聚性、膠黏性和咀嚼性等均與共價交聯有關,膠原蛋白熱溶解性與共價交聯無關。【結論】高熟度牛肉的食用品質很大程度上取決于加熱時長與膠原蛋白特性,膠原蛋白特性對嫩度的影響隨著加熱時間的延長而增加。膠原蛋白含量與熱溶解性以及共價交聯量通過影響肉的質構特性來改善嫩度。隨著加熱時間的延長,膠原蛋白和共價交聯相對含量增加,結締組織強度增加從而削弱了肌纖維對嫩度的影響,使嫩度得到改善。
牛肉;加熱;嫩度;膠原蛋白;共價交聯
0 引言
【研究意義】近年來,隨著東西方文化的碰撞滲透、交匯融合,西餐文化在中國不斷發展。西餐重營養而輕美味,多數西方人喜歡半熟偏生的牛排;而中國傳統烹飪要求原料入味,多數菜肴完全成熟后才會食用,肉制品更會達到高熟度的要求。高熟度牛肉是獨具中國特色的肉制品,產品加工時間長,終點溫度高,具有獨特的嫩度特性。中國傳統烹飪下的高熟度牛肉加工時間至少1 h,其中心溫度接近100℃,甚至更高。本研究根據中國特色高熟度牛肉,通過提高加熱溫度、延長加熱時間來探究膠原蛋白特性對嫩度的影響,探討高熟度牛肉嫩度特性的形成原因,為中國傳統烹飪文化提供理論基礎。【前人研究進展】牛肉一直以來在中國倍受青睞,但牛肉的品質問題一直是影響消費者選擇的關鍵因素[1]。肉的食用品質包括風味、嫩度和多汁性。其中嫩度是消費者在評估飲食可接受性時最重要的因素[2]。影響嫩度的因素有很多,目前認為肌纖維、結締組織、肌內脂肪是影響牛肉嫩度的首要因素[3]。有學者將影響肉嫩度的因子進行了排序,分別是肌纖維強度、肌節長度、pH和結締組織特性,該次序并不受肌肉類型、動物種類、年齡和性別影響。加熱對肉嫩度的影響一直以來是學者的研究重點,DYMIT[4]在178℃下將牛肋骨肉加熱1.5 h,然后在60℃下保持3—48 h,牛肉的風味、嫩度和多汁度均有所改善。CHRISTENSEN等[5]在53℃下加熱老年母牛肉和幼年公牛肉,老年母牛剪切力明顯較高。在63℃下加熱15 h后,二者嫩度相當。顯然,老年母牛需要更高的溫度和更長的加熱時間才能和年輕公牛達到一樣的嫩度水平。兩者的一個明顯區別是結締組織耐熱強度不同,這是膠原蛋白分子不同程度的共價交聯造成的。幼年公牛從53℃到55℃增加溫度2℃或在53℃的加熱溫度下延長加熱時間5 h,結締組織強度顯著降低。由于延長了加熱時間、提高了加熱溫度,膠原蛋白溶解度隨之增加。這表明長時間加熱對于肉嫩度的改善涉及到了膠原蛋白的溶解。SáNCHEZ等[6]利用組織學分析研究了60℃和80℃長時間加熱下豬臉肉膠原纖維的變化情況,研究表明在60℃下加熱12 h,組織大多被破壞,與在80℃加熱12 h相比膠原纖維沒有完全變性。由此說明加熱溫度和時間均會對肉嫩度產生一定的影響,尤其是長時間加熱導致肉嫩度的改善主要涉及到結締組織膠原蛋白特性的變化。結締組織的主要存在形式肌內膜和肌束膜是由鑲嵌在蛋白多糖基質中膠原蛋白和彈性纖維構成的復合網狀結構形成的[7]。一些研究認為隨著動物年齡的增長,肉嫩度降低、剪切力增加的原因有很多,其中包括膠原蛋白含量增加以及肌束膜變厚[8-9]。GIRARD等[10]認為肌原纖維和肌束膜、肌內膜的結構完整性是影響熟肉嫩度的主要原因。膠原蛋白和嫩度的復雜關系引起了廣大學者的關注,早期的研究表明嫩度主要由膠原蛋白決定[11]。然而,也有報道稱,膠原蛋白的作用力遠不及肌纖維[12]。有學者研究瑞士布朗公牛得出,在生肉中,剪切力與總的膠原蛋白含量有很高的相關性[13]。DRANSFIELD等[14]研究也得出在生肉中嫩度與膠原蛋白的含量有極高的相關性。TORRESCANO[13]在研究中發現,膠原蛋白總量和剪切力在生肉中呈現很強的正相關,然而在熟肉中,相關性很低。KIM等[15]研究得出,膠原蛋白熱溶解性越大,肉質越嫩。越來越多的研究證實,嫩度與膠原蛋白的空間結構也有一定的關系。膠原蛋白分子主要形成兩種類型的交聯,一種是基于半胱氨酸的二硫鍵[16],另一種是基于賴氨酸和羥賴氨酸的吡啶交聯,分別形成羥賴氨酸吡啶啉(HP)與賴氨酸吡啶啉(LP)[17]。膠原蛋白之間的成熟交聯為結締組織提供其所需的物理化學性質和生物學穩定性[18]。縱觀動物的生命周期,膠原纖維之間的共價交聯數目會逐漸增加,并會反過來提高膠原蛋白的熱穩定性,不同類型的交聯或多或少都具有一定的熱穩定性,共價交聯成熟度與膠原蛋白含量協同影響牛肉嫩度。ROY等[19]提出了膠原蛋白的橡膠理論,經研究發現每單位體積熟肉中膠原蛋白交聯數量的增加與肉嫩度降低的比例接近一致,也就是說膠原蛋白共價交聯總量越少,牛肉越嫩。【本研究切入點】加熱是將肉從不可食變到可食的過程,通過破壞肉的完整性使肉更容易被腸胃消化[20],在加熱過程中牛肉發生了一系列感官特性的變化,通過人的感知可以被一些與風味、口感和質地有關的描述詞描述出來,那就是多汁性、嫩度、質構特性。這些“感官特性”受到了內在因素和外在因素的影響,外在因素受到一些技術參數的影響,對于熱處理來說,主要技術參數便是加熱時間和溫度。加熱溫度和加熱時間都會影響到肉的最終嫩度。加熱過程中結締組織特性起到了很大的作用,但是以往的眾多研究中,大多只是加熱溫度恒定,或者加熱時間恒定,因此不能實際動態反映膠原蛋白對肉質變化的影響。加熱過程中膠原蛋白會發生一系列變化如變性溶解凝膠化等,但這些變化究竟是如何影響嫩度的還未知。【擬解決的關鍵問題】本研究通過測定牛半腱肌肉的剪切力、蒸煮損失、質構特性、結締組織機械強度、膠原蛋白含量及熱溶解性、共價交聯等指標來探究牛肉膠原蛋白特性以及食用品質的變化,擬解決不同加熱溫度和加熱時間如何通過膠原蛋白特性影響肉的最終嫩度,以及膠原蛋白的特性變化如何影響嫩度這兩個問題。
1 材料與方法
試驗于2017年在北京畜牧獸醫研究所畜產品質量安全研究室進行。
1.1 試驗材料
牛半腱肌,選自同一牛場、品種和飼養管理均一致的河南夏南牛6頭,24月齡。屠宰后牛半胴體在4℃冷庫中倒掛成熟48 h后取樣,從半胴體上取下整條左側半腱肌,所選胴體其大理石花紋、生理成熟度和背標厚度等指標水平一致。真空包裝,-20℃貯運。
1.2 試劑與儀器
濃硫酸、一水檸檬酸、氫氧化鈉、無水乙酸鈉、正丙醇、異丙醇、氯胺T、對二甲基氨基苯甲醛、4-羥基-α-吡咯甲酸、戊二醛、乙醇、丙烯酰胺、過硫酸銨、四甲基乙二胺均為分析純,購于國藥集團化學試劑北京有限公司。
數顯恒溫水浴鍋,江蘇省金壇市榮華儀器制造有限公司;TA-XT plus物性測試儀,英國Stable Micro System公司;電熱恒溫鼓風干燥箱,上海森信實驗儀器有限公司;DHP-9052型電熱恒溫培養箱,上海一恒科技有限公司,上海益恒實驗儀器有限公司;FJ-200高速分散均質機,上海標本模型廠制造;電子天平,北京賽多利斯儀器系統有限公司;TGL16MB高速冷凍離心機,湘智離心機儀器有限公司;6100型紫外可見分光光度計,上海元析儀器有限公司。
1.3 試驗設計
1.3.1 加熱處理 在4℃條件下將凍存肉樣解凍24 h,去掉肉塊表面的脂肪和肌外膜,切割成大小為2.5 cm×5.0 cm×5.0 cm的肉塊若干并稱重,用蒸煮袋包裝,分組,在60、70、80、90和100℃不同溫度水浴鍋中加熱,分別加熱30、60、90、120和150 min,當達到時間后,立即取出流水冷卻至室溫,用吸水紙吸干肉塊表面汁液,稱重,待分析。
1.3.2 蒸煮損失測定 參照Li等[21]的方法。蒸煮前后的肉重分別是12。

1.3.3 剪切力值測定 用直徑為1.27 cm的圓柱形空心取樣器沿肌纖維方向取5個長條肉柱,使用TA.XY Plus物性測試儀的HDP/BS刀具進行檢測,使肌纖維與刀口運動方向垂直。
1.3.4 質構剖面分析 將1.5 cm×1.5 cm×1.5 cm的肉丁按肌纖維垂直于托板的方向放置,對肉丁進行二次壓縮模式質地剖面分析。對硬度、彈性、凝聚性、黏著性、膠黏性、咀嚼性和回彈性等7個指標進行測定。
質構分析參數設定如下:
測前速度:2.00 mm?s-1,測試速度:1.00 mm?s-1,測后速度:1.00 mm?s-1,壓縮率:50%,兩次壓縮間隔時間:5.0 s,觸發力:0.98 N,活塞:P/50,溫度:20℃,數據獲取率:200 PPS。
1.3.5 膠原蛋白熱溶解性測定
1.3.5.1 可溶性膠原蛋白和不溶性膠原蛋白的分離 可溶性膠原蛋白和不溶性膠原蛋白的分離采用Ringer’s試劑溶解法。配制Ringer’s試劑(1.8 g NaCl、0.25 g KCl、0.06 g CaCl2·6H20、0.05 g NaHCO3、0.186 g碘乙酸,溶于1 L蒸餾水),精確稱量樣品5 g(0.0001 g),加入8 mL Ringer’s試劑,用高速分散器將肉樣打碎,混勻溶脹60 min后在77℃水浴中加熱60 min。加熱后冷卻至室溫,3 300×離心20 min,收集上清液(此過程重復兩次),分離沉淀。
1.3.5.2 水解 按照GB/T9695.23—2008/ISO 3496:1994測定可溶性膠原蛋白和不溶性膠原蛋白中羥脯氨酸的含量。將上清和沉淀分別放入燒瓶中,稱取30mL硫酸加入燒瓶,于105℃干燥箱內恒溫16 h。趁熱將水解產物用濾紙過濾至250 mL容量瓶中,取10 mL硫酸洗滌燒瓶和濾紙,合并至上述容量瓶中,用水定容,搖勻。
1.3.5.3 測定 用移液管移取一定體積(上清液40 mL,沉淀10 mL)的水解產物至250 mL容量瓶中,定容。移取4.00 mL上述溶液于比色管中,加入2 mL氯胺T(緩沖液配制:26.0 g一水檸檬酸,14.0 g氫氧化鈉,78 g無水乙酸鈉,用500 mL水溶解上述試劑后轉入1 L的容量瓶中,加入250 mL正丙醇,用水定容;稱取1.41 g三水·對甲苯磺酰胺鈉鹽,用100 mL上述緩沖液溶解后即得氯胺T),混合后在室溫下放置20 min。加入2.00 mL顯色劑(用35 mL高氯酸溶液溶解10.0 g對二甲氨基苯甲醛后緩慢加入65 mL異丙醇)于比色管中,搖勻封口。將比色管迅速放入60℃水浴中,加熱20 min后用流動水冷卻比色管至少3 min,在室溫下放置30 min。用水做參比,于(558±2)nm處用分光光度計測定吸光度值。
將測得的羥脯氨酸含量乘以系數7.25換算為膠原蛋白含量,沉淀中羥脯氨酸換算為不溶性膠原蛋白,上清中羥脯氨酸換算為可溶性膠原蛋白,兩者相加即為膠原蛋白總量。
1.3.6 肌內結締組織機械強度測定 按照NISHIMURA等[22]的方法,取1.0 cm×1.0 cm×1.5 cm肉柱,用2.5%戊二醛溶液固定3 d,再在10% NaOH溶液中浸泡5 d(每天換水2次),用蒸餾水充分沖洗肉塊,最后將樣品浸入7.5%丙烯酰胺(含過硫酸銨(1.5 mg?mL-1)、TEMED(0.75 μL?mL-1))聚合3 h,用質構儀檢測丙烯酰胺包埋的結締組織機械強度。
1.3.7 HP和LP的測定 用預冷的PBS(0.1 mol?L-1,pH 7.4)沖洗組織,稱重后將組織破碎,后加入對應體積的PBS于玻璃勻漿器中充分研磨,最后將勻漿液于5 000×離心8 min,留取上清檢測。從室溫平衡20 min后的鋁箔袋中取出板條,設置標準品孔和樣品孔,標準品孔各加不同濃度的標準品50 μL,樣品孔中加入待測樣本50 μL,除空白孔不加外,標準品孔和樣本孔中每孔各加入辣根過氧化物(HPR)標記的檢測抗體100 μL,用封板膜封住反應孔,于37℃恒溫箱溫育60 min,甩去液體,吸水紙上拍干,每孔加滿洗滌液,靜置1 min,棄去洗滌液,吸水紙拍干,如此重復洗板5次。每孔加入底物A、B(試劑盒自帶)各50 μL,37℃避光孵育15 min,每孔加入終止液50 μL,15 min內,在450 nm波長處測定各孔的OD值。
1.4 數據處理和統計分析
所有試驗數據采用SPSS 22統計軟件進行統計分析,處理組之間差異顯著性分析采用鄧肯氏多重比較法,數據采用平均值±標準差的表示方法,相關性分析采用Spearman相關系數分析法。
2 結果
2.1 不同加熱時間下蒸煮損失及水分含量的變化
在不同的水浴溫度下加熱,延長加熱時間,牛半腱肌肉的蒸煮損失和水分變化如圖1所示。隨著加熱溫度的升高和時間的延長,蒸煮損失呈上升趨勢。60℃下加熱90和120 min蒸煮損失差異不顯著,其余各加熱時間蒸煮損失差異均顯著(<0.05);80℃下加熱30 min、60 min與120 min和150 min差異均顯著(<0.05);100℃下加熱60—150 min變化較穩定。隨著加熱時間的延長,蒸煮損失逐漸增加,這一現象與Zielbauer等[23]的研究結果一致。水分含量隨著加熱溫度時間的延長呈下降趨勢,在60℃下加熱30—90min與120—150 min牛肉水分含量差異顯著(<0.05);在80℃下加熱30—60 min與90—150 min差異顯著(<0.05);在90℃下加熱30—90 min與120 min、150 min牛肉水分含量差異顯著(<0.05)。除了在70℃和80℃下加熱30 min水分含量差異不顯著外,其他不同溫度組間水分含量差異均顯著(<0.05)。
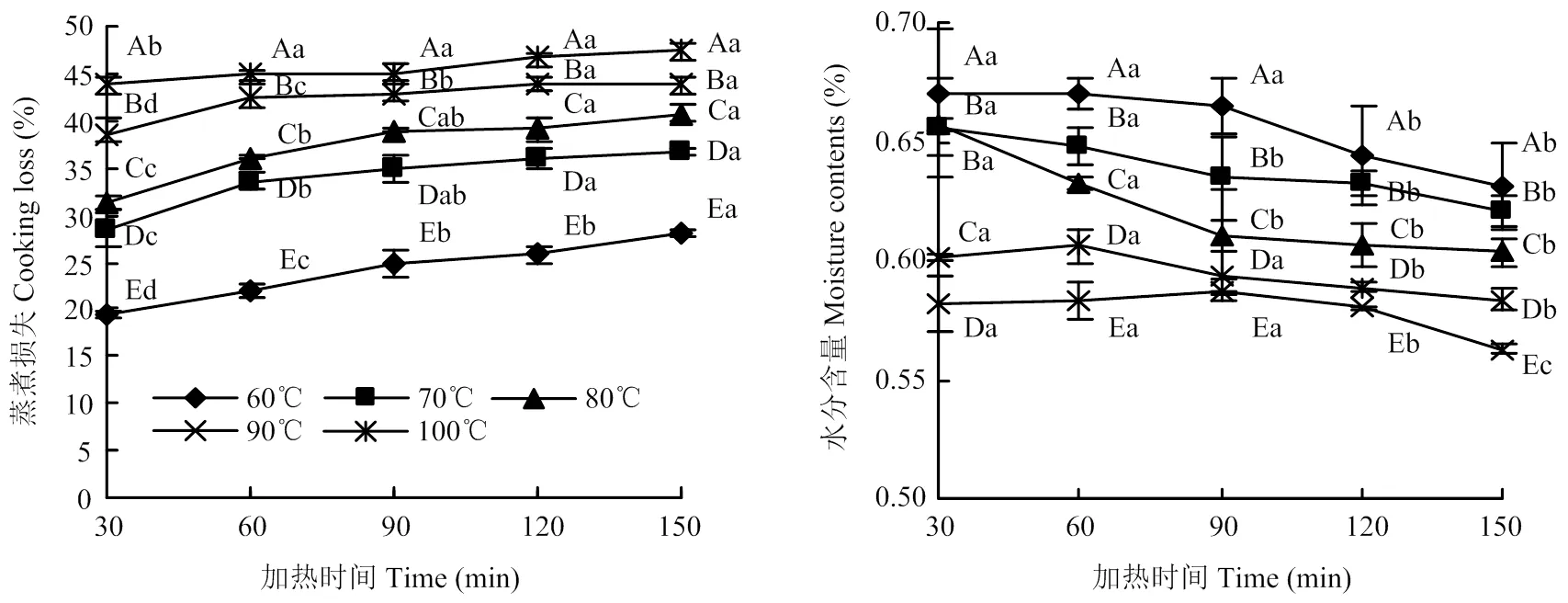
不同大寫字母表示相同加熱時間不同加熱溫度間差異顯著(P<0.05);不同小寫字母表示相同加熱溫度不同加熱時間差異顯著(P<0.05)。下同Different capital letters indicate significantly differences among different heating temperatures and the same heating time (P<0.05); Different lowercase letters indicate significantly differences among same heating temperature and different heating time (P<0.05). The same as below
2.2 不同加熱時間下剪切力的變化
如圖2所示,隨著加熱時間的延長,剪切力呈下降趨勢。100℃加熱30 min和60—150 min呈顯著性差異(<0.05),70℃加熱各時間點間差異不顯著(>0.05),60℃加熱30 min、90 min和60 min、120 min、150 min之間差異顯著(<0.05)。
2.3 不同加熱時間牛肉質構特性的變化
對牛半腱肌肉進行質構特性分析,結果如圖3所示。TPA質地多面分析法可以直觀反映加熱過程中牛肉半腱肌肉質構特性的變化情況,除彈性變化不明顯外,硬度、凝聚性、回彈性、膠黏性和咀嚼性均大體呈下降趨勢,黏著性呈上升趨勢。
2.4 不同加熱時間下牛半腱肌肉中膠原蛋白的變化情況
圖4分別反映了不同加熱溫度與時間下牛半腱肌中總膠原蛋白、可溶性膠原蛋白、不溶性膠原蛋白含量以及膠原蛋白熱溶解性的變化情況。在100℃時,隨著加熱時間延長到90 min后,可溶性膠原蛋白的含量和膠原蛋白的熱溶解性顯著上升(<0.05);其他溫度下隨著加熱時間的延長,可溶性膠原蛋白的含量以及熱溶解性變化不明顯,大體上呈上升趨勢。總膠原蛋白和不溶性膠原蛋白的含量隨著加熱時間的延長,變化不明顯,大體呈輕微下降趨勢。
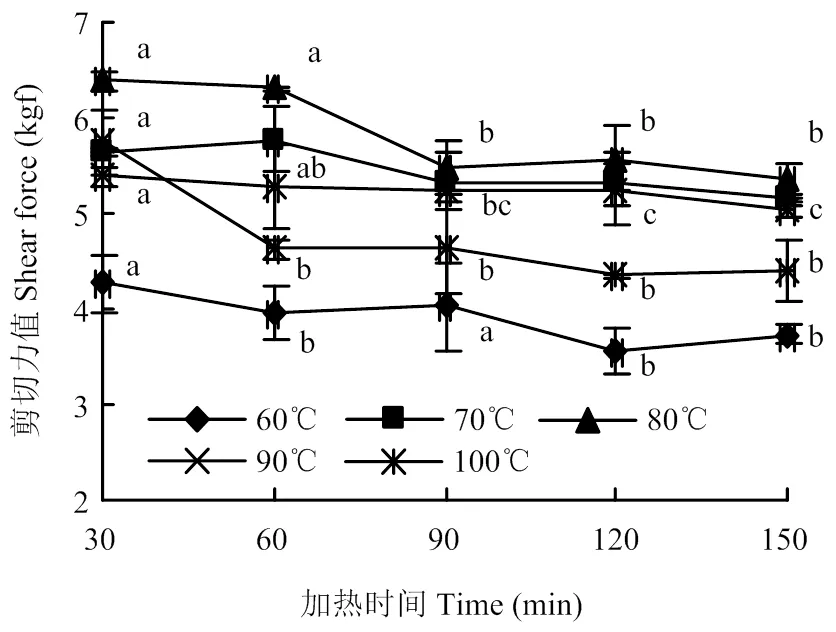
圖2 不同加熱溫度和時間下剪切力的變化
2.5 不同加熱時間下牛半腱肌肉結締組織機械強度的變化情況
由圖5可以看到,隨著加熱時間的延長,牛半腱肌肉結締組織機械強度大體呈3階段變化。在30—60 min,機械強度明顯下降,60—120 min,機械強度顯著增加(<0.05),120—150 min,機械強度又顯著降低(<0.05)。有研究認為結締組織機械強度與每單位熟肉中交聯鏈的數目成正比,并具有很高的相關性。
2.6 不同加熱時間下膠原蛋白共價交聯的變化情況
從圖6可以看出,各個溫度下,隨著加熱時間的延長,羥賴氨酸吡啶啉的含量呈上升趨勢,賴氨酸吡啶啉的含量大體呈下降趨勢。牛肉在70℃、80℃和100℃下延長加熱時間,HP的含量呈現部分組內差異顯著(<0.05);LP的含量在60℃下加熱30 min與90、150 min,70℃下加熱30 min與60、150 min,90℃下加熱90 min與30、60、150 min差異顯著(<0.05)。說明加熱時間對牛肉共價交聯量有顯著影響(<0.05)。
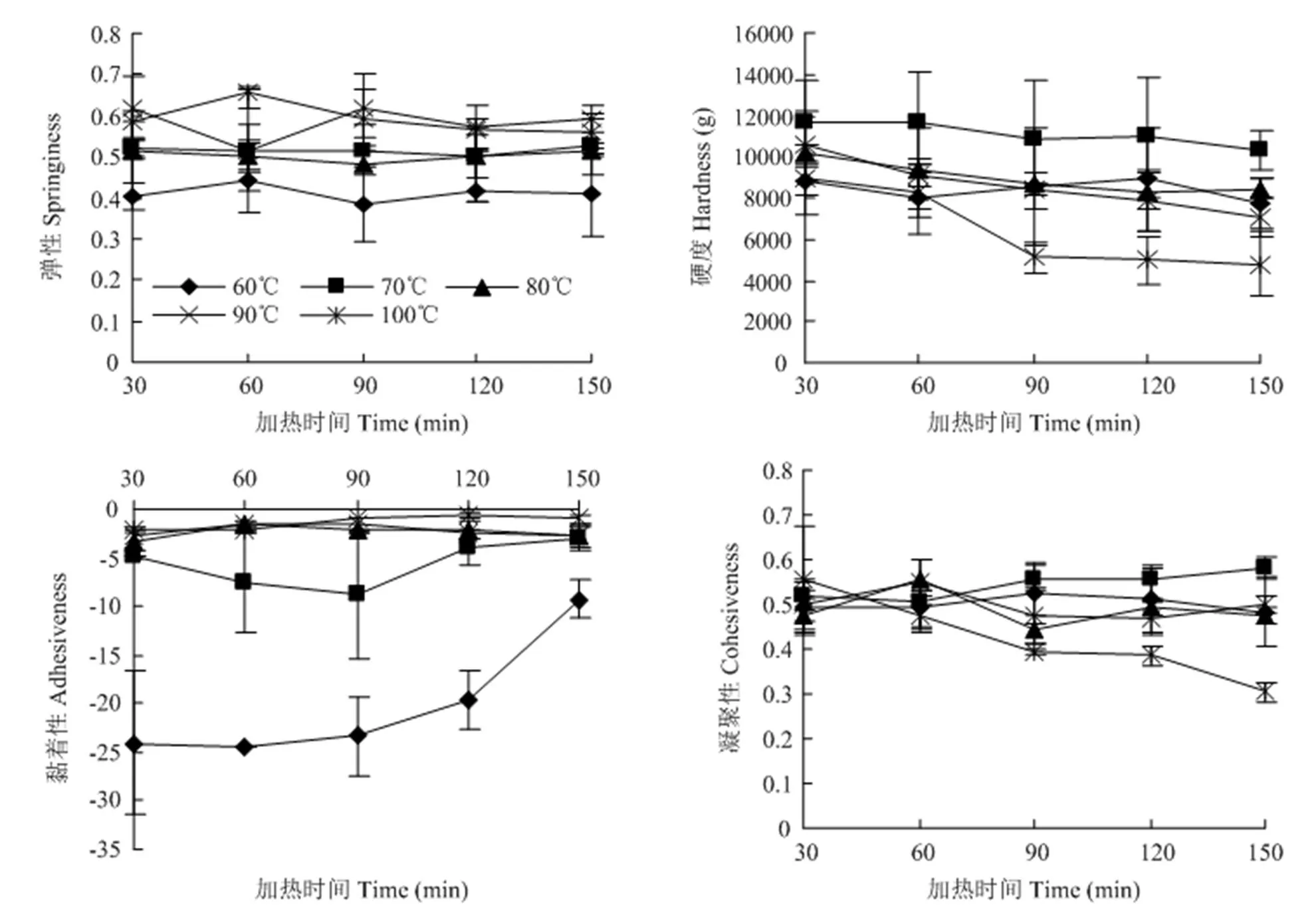
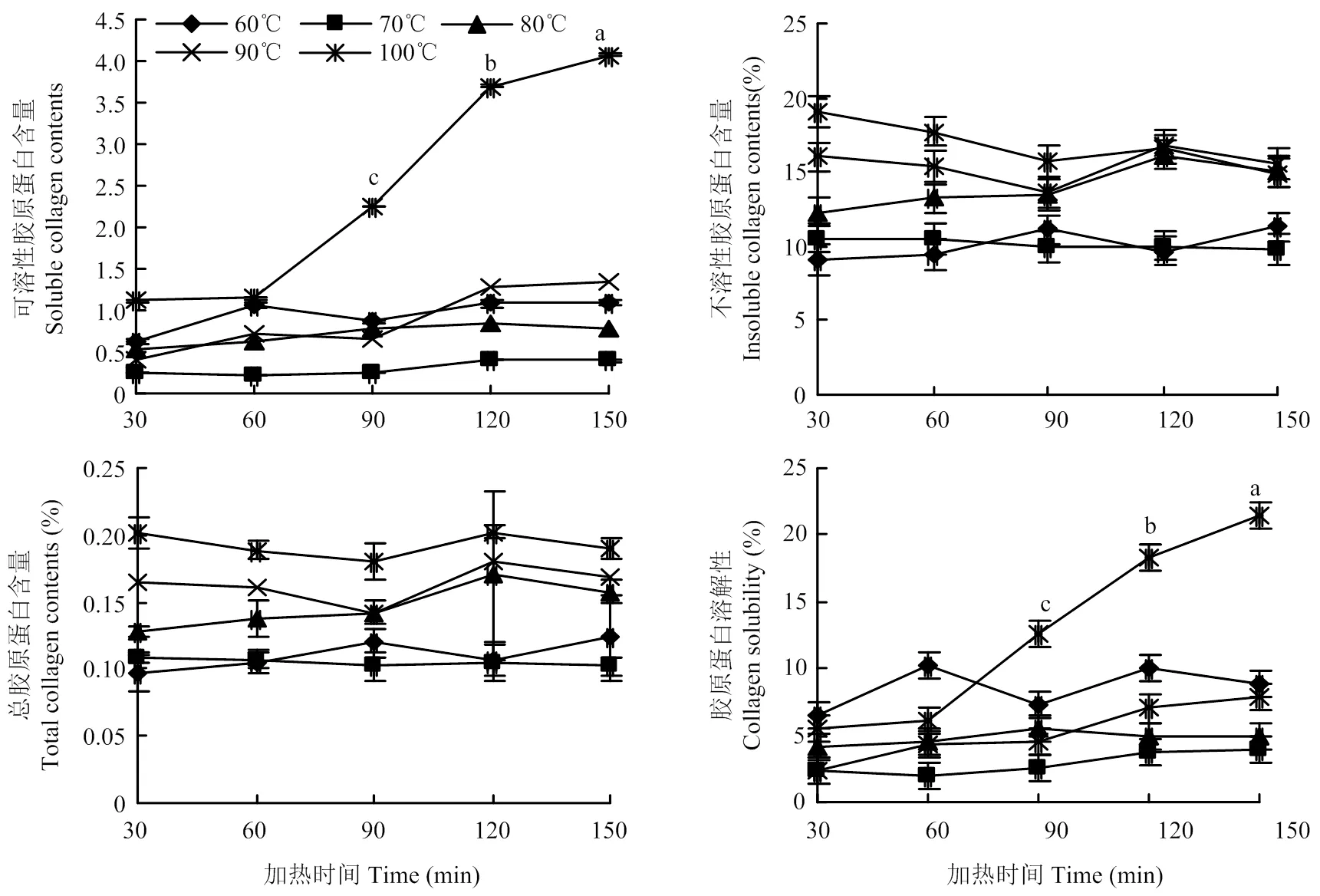
圖4 不同加熱時間下膠原蛋白的變化
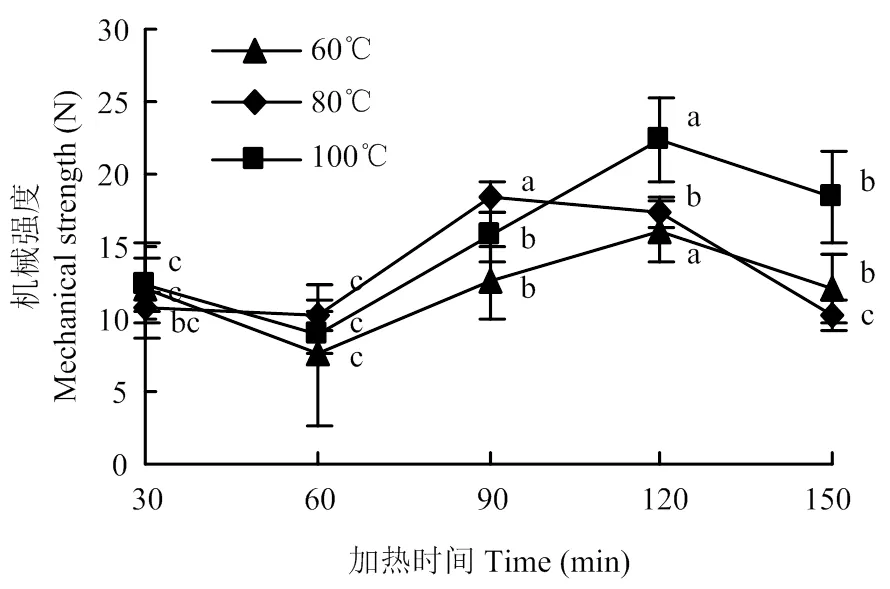
圖5 不同加熱溫度時間下結締組織機械強度的變化
2.7 掃描電鏡觀察
從圖7可以看出不同溫度、不同時間下結締組織的變化情況,發現結締組織的破損情況比肌纖維嚴重得多。60℃下加熱30—60 min,肌束膜和肌內膜結構相對規則清晰,肌束膜將肌纖維緊密束在一起,肌纖維和肌內膜貼合較緊密;從縱截面圖中可以看到此時肌束膜和肌內膜發生了較為輕微的破裂。延長加熱時間至90—120 min時,肌束膜收縮,肌纖維束間出現細小空隙;從縱截面來看,肌內膜破損程度較之前嚴重。加熱至150 min,肌束膜收縮程度變大,肌纖維束間空隙變大,單根肌纖維間仍然較為緊密;觀察縱切面可以看到肌纖維與肌內膜剖離,肌纖維表面略微斑駁。
當加熱溫度為100℃時,加熱30 min可以看到肌束膜輕微收縮,各肌纖維束間出現間隙,但觀察其縱截面肌纖維束則排列緊密,肌內膜結構較為完整;加熱60 min,肌束膜進一步收縮,肌束間空隙增大,肌內膜破損,單根肌纖維之間出現空隙;加熱至90—120 min,各肌纖維之間空隙持續增大,肌內膜的完整性完全破壞;繼續加熱至150 min時,肌束膜肌內膜破損嚴重,肌纖維束之間、肌纖維之間空隙很大,各肌纖維連接松散,從縱截面也可以看到單根肌纖維斷裂,肌內膜破碎呈絲狀。
2.8 相關性分析
2.8.1 不同加熱時間下剪切力與牛肉品質相關性 由表1可以看出,牛肉剪切力與蒸煮損失呈顯著負相關(<0.05);與水分含量、硬度、凝聚性、膠黏性、咀嚼性和回彈性呈極顯著正相關(<0.01);與總膠原蛋白、可溶性膠原蛋白、不溶性膠原蛋白、膠原蛋白熱溶解性及羥賴氨酸吡啶啉含量呈極顯著負相關(<0.01)。然而CHAMBAZ[24]以及BERGE[25]等均研究發現肉嫩度與膠原蛋白的熱溶解性相關性很低(=0.17;=019),也有學者研究得出膠原蛋白間的共價交聯與熟肉的嫩度并沒有很強的相關性[26],該現象可能與加熱時間的長短有關。
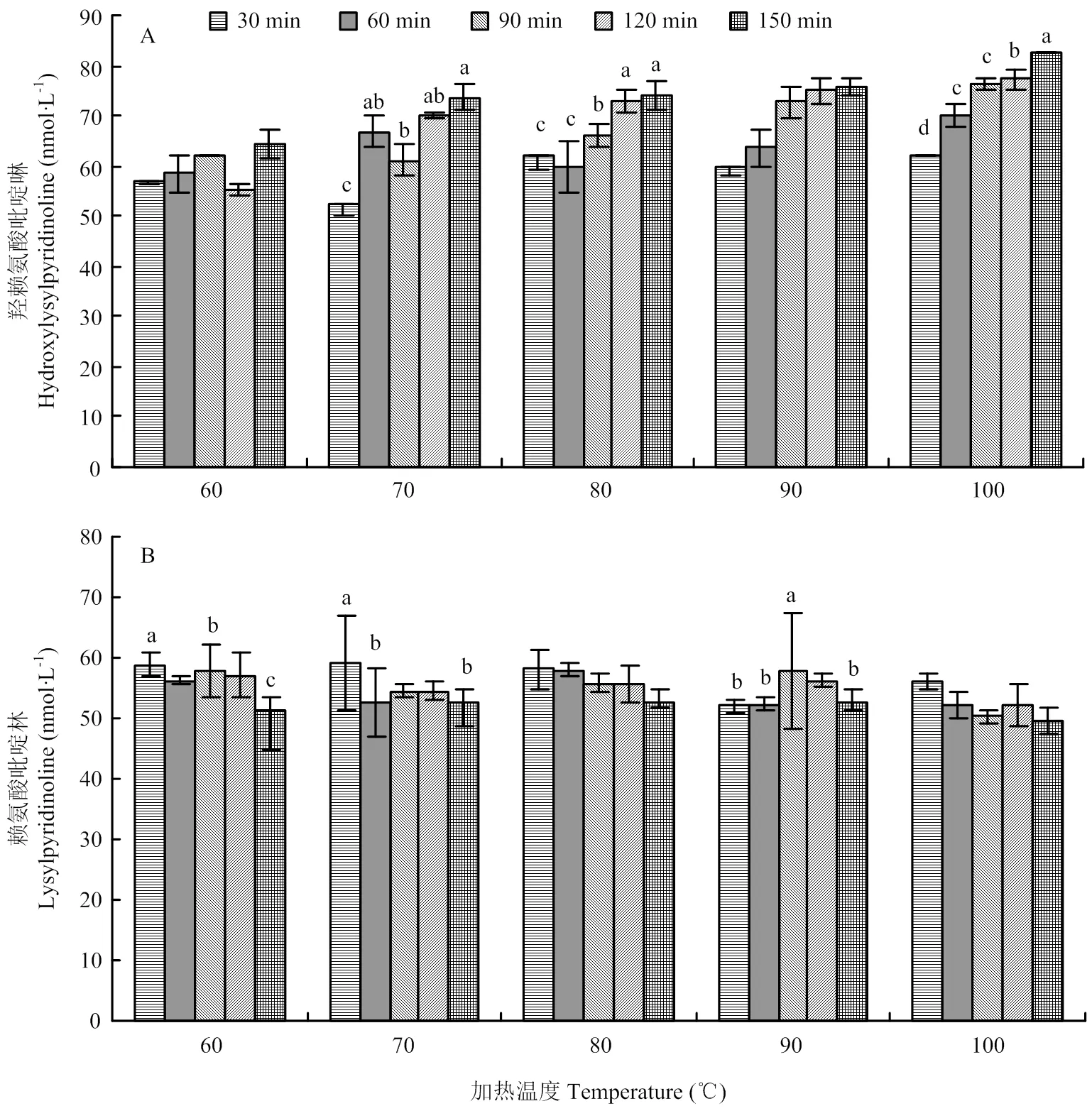
圖6 不同加熱溫度和時間下膠原蛋白共價交聯的變化

表1 不同加熱時間下剪切力與牛肉品質相關性分析
*表示相關性顯著<0.05;**表示相關性極顯著<0.01。下同
*Correlation is significant at<0.05;** Correlation is significant at<0.01. The same as below
2.8.2 不同加熱時間下膠原蛋白特性與牛肉品質相關性 由表2可以看到,總膠原蛋白、不溶性膠原蛋白的含量與蒸煮損失呈極顯著正相關(<0.01),可溶性膠原蛋白含量、膠原蛋白熱溶解性與蒸煮損失呈顯著正相關(<0.05)。這與MODZELEWSKA-KAPITULA等[27]研究結果相一致,報道稱在蒸煮損失和膠原蛋白熱溶解性之間存在顯著正相關。總膠原蛋白與牛肉硬度、凝聚性、膠黏性、咀嚼性和回彈性呈極顯著負相關(<0.01),與黏著性、彈性呈極顯著正相關(<0.01);可溶性膠原蛋白與牛肉硬度、凝聚性、膠黏性、咀嚼性、回彈性呈極顯著負相關(<0.01);不溶性膠原蛋白與牛肉硬度呈顯著負相關(<0.05),與膠黏性、咀嚼性呈極顯著負相關,與黏著性和彈性呈極顯著正相關(<0.01)。
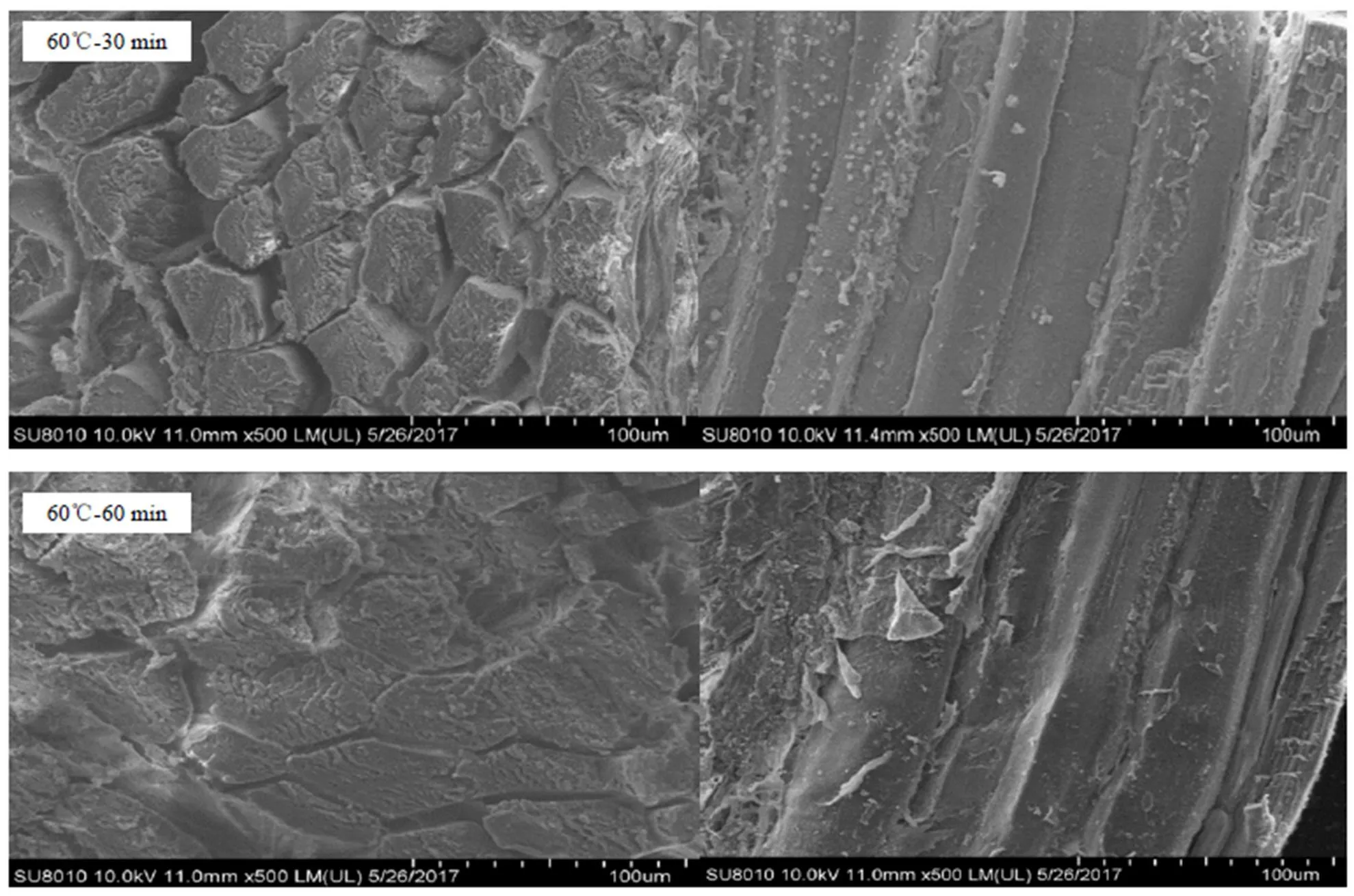

左列為橫截面,右列為縱截面 The left column show cross section, the right column show longitudinal section
圖7 不同加熱時間下牛肉微觀結構變化(×500)
Fig. 7 Micro-structural changes of beef at different heating times (×500)
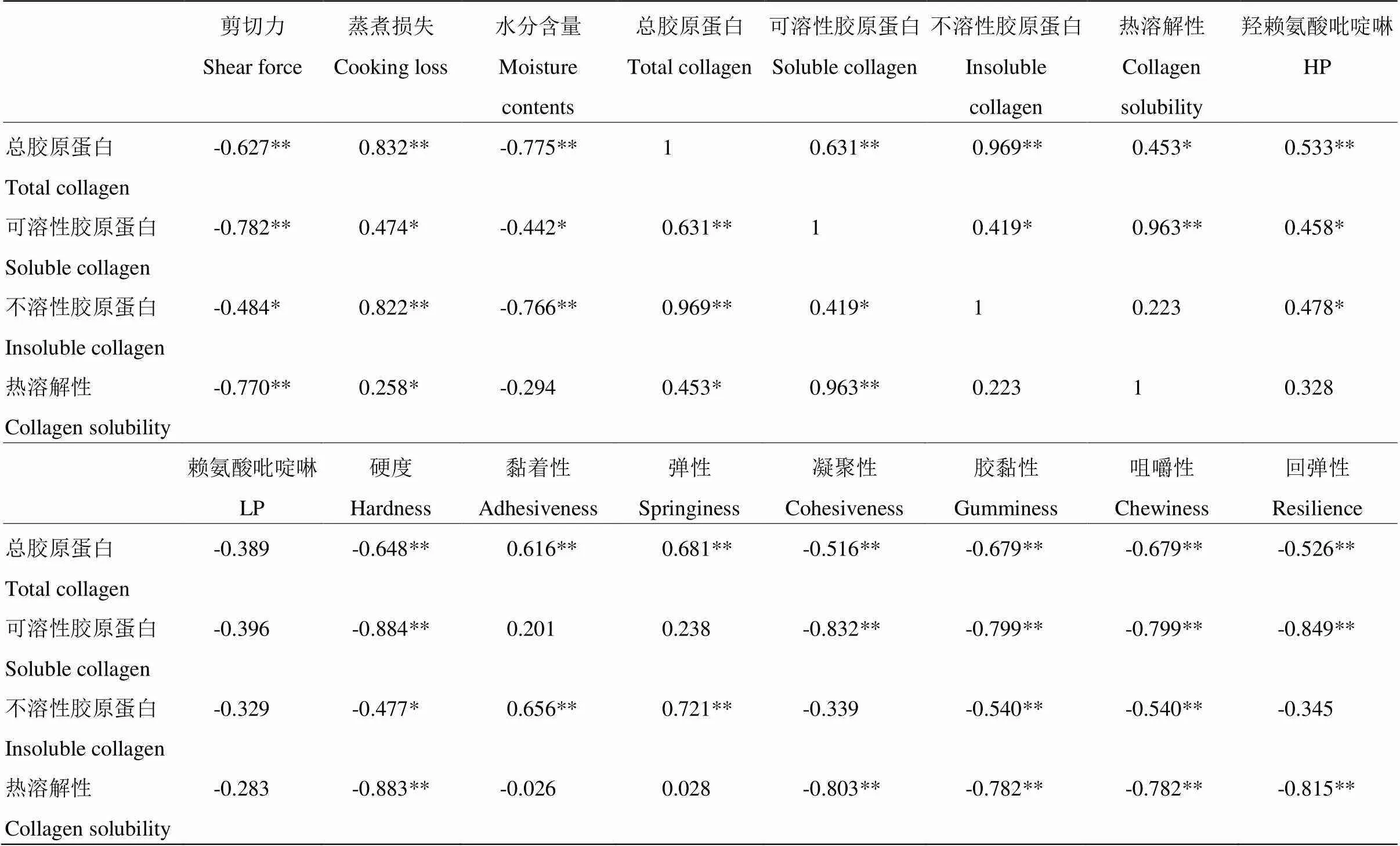
表2 不同加熱時間下膠原蛋白特性與牛肉品質相關性分析
2.8.3 不同加熱時間下膠原蛋白共價交聯與牛肉品質相關性 由表3可以看出,HP與剪切力呈極顯著負相關(<0.01),與蒸煮損失、總膠原蛋白含量以及黏著性呈極顯著正相關(<0.01);與可溶性膠原蛋白含量、不溶性膠原蛋白含量及彈性呈顯著正相關(<0.05);與膠黏性和咀嚼性呈顯著負相關(<0.05)。LP與蒸煮損失、彈性呈顯著負相關(<0.05),與凝聚性呈顯著正相關(<0.05),與回彈性呈極顯著正相關(<0.01)。ROY等[19]認為膠原蛋白的熱溶解性與共價交聯的密度之間沒有相關性,與本研究結果一致。
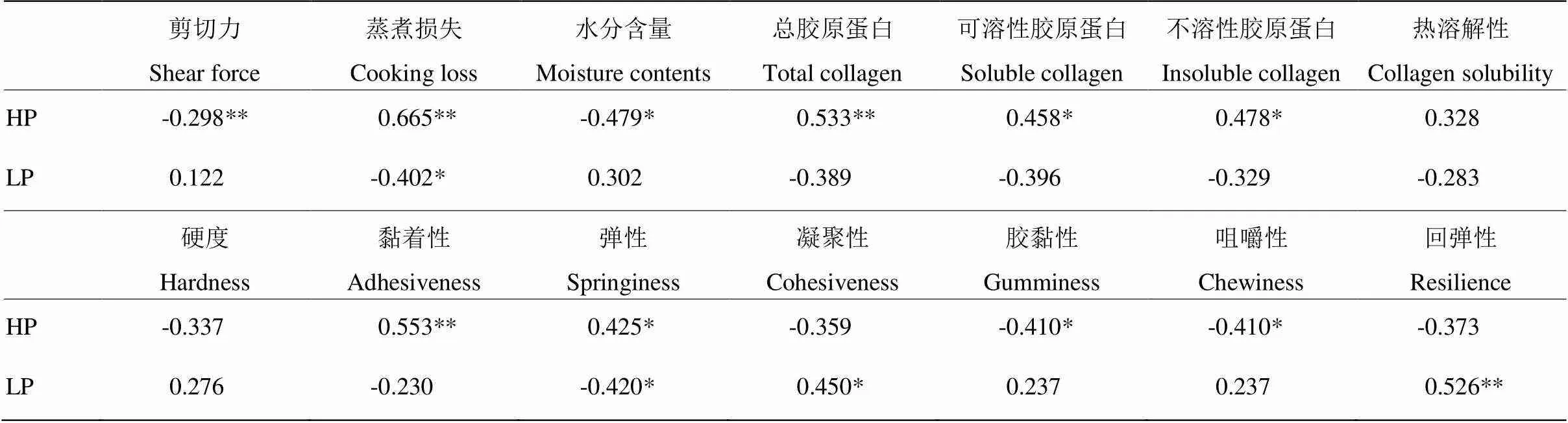
表3 不同加熱時間下膠原蛋白共價交聯與牛肉品質相關性分析
3 討論
3.1 加熱過程中肉品質變化分析
在加熱過程中,隨著加熱時間的延長,牛肉半腱肌肉蒸煮損失隨著中心溫度的升高、加熱時間的延長而增加,肌內水分含量隨著中心溫度的升高、時間的延長而降低。肉中的蛋白質組織分為肌原纖維(50%—55%)、肌質(30%—34%)和結締組織(10%—15%)。加熱使這些蛋白質熱變性,從而使肌肉的化學物理特性發生變化。加熱過程中,肌漿蛋白膨脹并形成凝膠,肌原纖維和結締組織收縮[28]。變性程度主要取決于溫度和時間,加熱溫度超過60℃,隨著加熱時間的延長,肌漿蛋白、肌動蛋白和肌球蛋白逐步變性,由于以上蛋白的變性凝固收縮,肌纖維完整性被破壞,致使纖維間的水分儲存空間減少,同時變性導致蛋白疏水基團暴露,使蛋白自身的親水能力下降,肉內水分流失。而也有一些研究指出,將牛肉組織研磨至肌束膜完全破裂,其蒸煮損失并沒有比相同條件下完整肌肉的蒸煮損失低很多。
嫩度是最重要的適口性指標之一,剪切力是衡量嫩度的常用指標之一,在本研究的加熱過程中,隨著時間的延長,剪切力隨著加熱時間的延長而降低,肉的質構也發生了一系列的變化,除彈性變化不大以外,硬度、凝聚性、回彈性、膠黏性和咀嚼性均大體呈下降趨勢,黏著性呈上升趨勢。由相關性分析可知,質構特性包括硬度、凝聚性、膠黏性、咀嚼性和回彈性等均與膠原蛋白特性顯著相關,所以肉的質構特性與結締組織的含量以及結構有關不無道理。本研究前期探究了不同中心溫度下牛肉質構特性與膠原蛋白特性的關系,發現只有彈性與膠原蛋白的含量有關,由此可見延長加熱時間會凸顯膠原蛋白特性對肉嫩度的貢獻。肌束膜、肌內膜等結締組織在結構上是彈性十足粘連在一起的網狀結構,通過其網狀結構將肌纖維連接起來,當膠原蛋白共價交聯程度比較大的時候,肉更不容易嚼爛,肉質偏老。
加熱過程中肌纖維的收縮不僅會造成其直徑和長度的縮短,還會增加膠原纖維熱收縮的幅度,有研究表明肌纖維對肉嫩度的貢獻之一是調節結締組織的機械強度[29]。TORNBERG等[28]研究表明,肉的嫩度與60℃以上的彈性呈正相關,強調了結締組織收縮,彈性與嫩度之間的聯系。更準確地說,60℃以上的膠原蛋白的收縮使得結締組織具有高彈性,造成肉嫩度降低的原因可能是收縮導致肌纖維對外的抵抗力增加。
3.2 加熱過程中膠原蛋白特性變化分析
本研究中膠原蛋白的含量以及熱溶解性變化均不大。而在100℃下延長加熱時間,可溶性膠原蛋白的含量及其熱溶解性顯著增加,這種現象與高溫長時加熱下蒸煮損失的增加、肌漿蛋白的流失等造成的肌肉干物質含量下降有關。常海軍等[30]采用水浴和微波加熱牛肉,兩種方法下蒸煮損失有顯著性差異,對應的膠原蛋白含量也呈顯著性差異,說明膠原蛋白含量的變化主要原因就是蒸煮損失。前人研究認為剪切力值與膠原蛋白含量以及溶解性具有較強的相關性[31],而根據前文的相關性分析可以看出,剪切力值與總膠原蛋白的含量以及膠原蛋白的熱溶解性呈顯著正相關,除此之外,膠原蛋白的含量越大,肉的彈性也越大。
膠原分子由3條左旋的蛋白質α-鏈組成,α-鏈進一步纏繞形成右旋的三重超螺旋結構。對于可溶性膠原,是由于加熱導致分子的三重螺旋解旋成單股,膠原分子的棒狀結構就會變為線圈狀結構,而相鄰膠原分子間的共價交聯就會限制這種轉變[32],這些共價交聯是由賴氨酸或羥賴氨酸的殘基及它們的醛類物質縮合形成。在生肉中吡啶啉的數量與剪切力的大小無關,本研究中隨著加熱時間的延長,羥賴氨酸吡啶啉的含量呈遞增趨勢,而賴氨酸吡啶啉的含量呈下降趨勢,原因可能是由于醛基酮途徑形成的HP的熱穩定性要比醛亞胺途徑形成的LP的熱穩定性高。值得注意的是,經過相關性分析可知,剪切力與HP的含量呈極顯著負相關,說明膠原蛋白中羥賴氨酸吡啶啉的含量越高,剪切力越低,而HP具有較強的熱穩定性,所以隨著加熱時間的延長,HP的相對含量增加,剪切力隨之下降。有學者研究得出膠原蛋白的熱溶解性與共價交聯的密度之間并沒有相關性[19],與本研究結果相一致。HP與肌肉黏著性呈極顯著正相關,與彈性呈顯著正相關,與膠黏性和咀嚼性呈顯著負相關,說明肉的質構特性在很大程度上與膠原蛋白的分子間共價交聯有關。本研究中的LP與彈性呈顯著負相關,與凝聚性呈顯著正相關,與回彈性呈極顯著正相關,而短時加熱過程中LP的含量與肉的若干質構特性并沒有相關性,說明加熱時間的確會加重膠原蛋白特性對肉嫩度的影響。
4 結果
加熱時間越長,膠原蛋白對牛肉的嫩度影響越大,因此,牛肉的食用品質很大程度上取決于加熱時長與膠原蛋白特性,膠原蛋白含量以及共價交聯量通過影響肉的質構來改善嫩度。隨著膠原蛋白逐步熱溶解,可溶性膠原蛋白含量增加,牛肉硬度、凝聚性、膠黏性、咀嚼性、回彈性隨之降低,說明牛肉質地改善與膠原蛋白特性有關。羥賴氨酸吡啶啉(HP)與賴氨酸吡啶啉(LP)的形成使膠原蛋白具有很高的機械強度,由于HP具有熱穩定性,隨著加熱時間延長,其占干物質的比重上升,相對含量增加。HP含量與剪切力和膠原蛋白含量有關,與膠原蛋白熱溶解性無關。HP相對含量增加,牛肉黏著性和彈性增大,膠黏性和咀嚼性減小,剪切力降低,原因可能是結締組織強度的增加降低了肌纖維對外的抵抗力度,從而使嫩度得到改善。
[1] 周光宏, 徐幸蓮. 肉品學. 北京: 中國農業科技出版社, 1999.
ZHOU G H, XU X L.Beijing: China Agricultural Science and Technology Press,1999. ( in chinese)
[2] MILLER M F, CARR M A, RAMSEY C B, CROCKETT K L, HOOVER L C. Consumer thresholds for establishing the value of beef tebderness., 2001, 79(12): 3062.
[3] GONZALEZ J M, JOHNSON D D, ELZO M A. Effect of brahman genetic influence on collagen enzymatic crosslinking gene expression and meat tenderness., 2014, 25: 165-178.
[4] DYMIT J M. Cook now, serve later., 1961, 49(11): 174.
[5] CHRISTENSEN L, ERTBJERG P, L?JE H, RISBO J, YAN DEN BERG F W, CHRISTENSEN M. Relationship between meat toughness and properties of connective tissue from cows and young bulls heat treated at low temperatures for prolonged times., 2013, 93(4): 787-795.
[6] SáNCHEZ D P J, GAZQUEZ A, RUIZ-CARRASCAL J. Physico- chemical, textural and structural characteristics of sousvide cooked pork cheeks as affected by vacuum, cooking temperature, and cooking time., 2012, 90(3): 828.
[7] LEPETIT J. A theoretical approach of the relationships between collagen content, collagen cross-links and meat tenderness., 2007, 76(1): 147-159.
[8] PURSLOW P P. Intramuscular connective tissue and its role in meat quality., 2005, 70(3): 435-447.
[9] SCHONFELDT H C, STRYDOM P E. Effect of age and cut on tenderness of South African beef.,2011, 87(3): 206-218.
[10] GIRARD I, BRUCE H L, BASARAB J A, LARSEN I L, AALHUS J L. Contribution of myofibrillar and connective tissue components to the Warner-Bratzler shear force of cooked beef.,2012, 92(4): 775- 782.
[11] MCCORMICK R J. The flexibility of the collagen compartment of muscle., 1994, 36(1): 79-91.
[12] WHEELER T L, SHACKELFORD S D, KOOHMARAIE M. Technical note: Sampling methodology for relating sarcomere length, collagen concentration, and the extent of postmortem proteolysis to beef and pork longissimus tenderness.,2002, 80(4): 982-987.
[13] TORRESCANO G, SANCHEZ-ESCALANTE A, GIMENEZ B, RONCALES P, BELTRAN J A. Shear values of raw samples of 14 bovine muscles and their relation to muscle collagen characteristics.,2003, 64(1): 85-91.
[14] DRANSFIELD E, MARTIN J F, BAUCHART D, ABOUELKARAM S, LEPETIT J, CULIOLI J. Meat quality and composition of three muscles from French cull cows and young bulls., 2003, 76(3): 387-399.
[15] KIM H W, CHOI Y S, CHOI J H, KIM H Y, LEE M A, HWANG K E, Kim H W, Choi Y S, Choi J H, Kim H Y, Lee M A, Hwang K E. Tenderization effect of soy sauce on beef M. biceps femoris.,2013, 139(1/4): 597- 603.
[16] BOUDKO S P, ENGEL J. Structure formation in the C terminus of type III collagen guides disulfide cross-linking., 2004, 335(5): 1289-1297.
[17] MCCORMICK R J. Extracellular modifications to muscle collagen: implications for meat quality., 1999, 78(5): 785-791.
[18] LEPETIT J. Collagen contribution to meat toughness: Theoretical aspects.,2008, 80(4): 960-967.
[19] ROY B C, SEDGEWICK G, AALHUS J L, BASARAB J A, BRUCE H L. Modification of mature non-reducible collagen cross-link concentrations in bovine m. gluteus medius and semitendinosus with steer age at slaughter, breed cross and growth promotants., 2015, 110: 109-117.
[20] BOBACK S M, COX C L, OTT B D, CARMODY R, WRANGHAM R W, SECOR S M. Cooking and grinding reduces the cost of meat digestion.,2007, 148(3): 651-656.
[21] LI C B, CHEN Y J, XU X L, HUANG M, HU T J, ZHOU G H. Effects of low-voltage electrical stimulation and rapid chilling on meat quality characteristics of Chinese Yellow crossbred bulls., 2010, 72(1): 9.
[22] NISHIMURA T, HATTORI A, TAKAHASHI K. Structural changes in intramuscular connective tissue during the fattening of Japanese black cattle: effect of marbling on beef tenderization., 1999, 77(1): 93-104.
[23] ZIELBAUER B I, FRANZ J, VIEZENS B, VILGIS T A. Physical aspects of meat cooking: time dependent thermal protein denaturation and water loss.,2016, 11(1): 34-42.
[24] CHAMBAZ A, SCHEEDER M R L, KREUZER M, DUFEY P A. Meat quality of Angus, Simmental, Charolais and Limousin steers compared at the same intramuscular fat content., 2003, 63(4): 491.
[25] BERGE P, SANUDO C, SANCHEZ A, ALFONSO M, STAMATARIS C, THORKELSSON G. Comparison of mussle composition and meat quality traits in diverse commercial lamb types., 2003, 14(4): 281-300.
[26] DUBOST A, MICOL D, MEUNIER B, LETHIAS C, LISTRAT A. Relationships between structural characteristics of bovine intramuscular connective tissue assessed by image analysis and collagen and proteoglycan content., 2013, 93(3): 378-386.
[27] MODZELEWSKA-KAPITULA M, KWIATKOWSKA A, JANKOWSKA A, DABROWSKA E. Water holding capacity and collagen profile of bovine m. infraspinatus during postmortem ageing.,2015, 100: 209-216.
[28] TORNBERG E. Effects of heat on meat proteins-Implications on structure and quality of meat products., 2005, 70(3): 493-508.
[29] MORTENSEN L M, FROST M B, SKIBSTED L H, RISBO J. Long-time low-temperature cooking of beef: Three dominant time- temperature behaviours of sensory properties., 2015, 4(1): 1-10.
[30] 常海軍. 不同加工條件下牛肉肌內膠原蛋白特性變化及其對品質影響研究[D]. 南京: 南京農業大學, 2010.
CHANG H J. Studies on effects of different processing conditions on characteristics changes of collagen and meat quality of beef muscle [D]. Nanjing: Nanjing Agricultral University, 2010. ( in Chinese)
[31] 常海軍, 唐翠, 牛曉影, 唐春紅. 超高壓處理對牛肉肌內結締組織膠原蛋白熱力特性的影響. 食品科學, 2013(23): 28-31.
CHANG H J, TANG C, NIU X Y, TANG C H. Effect of high pressure processing on thermal characteristics of connective tissue collagen of beff., 2013(23): 28-31. (in Chinese)
[32] SCHROEPFER M, MEYER M. DSC investigation of bovine hide collagen at varying degrees of crosslinking and humidities., 2017, 103: 120-128.
(責任編輯 趙伶俐)
Effects of Heating Temperature and Time on Collagen Properties and Tenderness in Beef
Liu JingJing, Lei YuanHua, Li HaiPeng, Xie Peng, Wan HongBing, Huang CaiYan, Sun BaoZhong, Zhang SongShan
(Institute of Animal Science of Chinese Academy of Agricultural Sciences, Beijing 100092)
【Objective】 The purpose of this study is to explore the effect of collagen on the beef tenderness by increasing the heating temperature and prolonging the heating time, which provided the theoretical basis for the tenderness characteristics of high maturity beef in China. 【Method】 The bovine semitendinosus muscle was heated at 60, 70, 80, 90 and 100℃ water bath temperature, and prolong heating time to 30, 60, 90, 120 and 150 min. The shear force, cooking loss, moisture content, texture characteristics, mechanical strength of connective tissue, collagen content and thermal solubility of cooked samples were measured, and the treated muscle samples were observed using scanning electron microscopy. The changes in tenderness under different heat temperatures and times were analyzed and the key factors influencing the tenderness are obtained through the correlation analysis. 【Result】 With the increase of heating temperature and heating time, the shear force and the water moisture of bovine semitendinosus decreased, the cooking loss increased. The total collagen and insoluble collagen increased with the increase of heating temperature, the change of relative total collagen and insoluble collagen content was not significant with the increase of heating time. The content of soluble collagen and the solubility of the soluble collagen increased with the increase of the heating time, and the relative content of the hydroxy-lysine pyridine and the adhesion all increased, but the relative content of lysine pyridine, gumminess, chewiness, cohesion and resilience all reduced. With the increase of heating time, the shear force of beef was negatively correlated with the cooking loss (<0.05), extremely positively correlated with the water content, hardness, cohesion, adhesiveness, resilience and chewiness (<0.01).the shear force was extremely significant negatively correlated with the content of HP, total collagen, soluble collagen, insoluble collagen and collagen thermal solubility (<0.01). The total collagen and insoluble collagen content were extremely significantly positively related with cooking loss (<0.01). Hydroxy-lysine pyridine (HP) was extremely positively correlated with the adhesiveness and total collagen content (<0.01), and significantly positively correlated with the elasticity, soluble collagen and insoluble collagen content (<0.05), and significantly negatively correlated with gumminess and chewiness (<0.05). There was a significant negative correlation between lysine pyridine (LP) and elasticity (<0.05), and a significant positive correlation with cohesion (<0.05), and an extremely positively correlation with resilience (<0.01). Compared with the heating temperature, the heating time on beef tenderness showed more effect. Beef tenderness is dependent on collagen content and thermal solubility, HP, cooking loss, moisture content, hardness, cohesion, adhesion, resilience and chewiness; collagen content and thermal solubility are dependent on cooking loss and moisture content. Muscle gumminess, elasticity, resilience, cohesion, adhesiveness and chewiness are all related to covalent cross-linking, only except the thermal solubility of collagen. 【Conclusion】The edible quality of high maturity beef is largely dependent on heating time and collagen properties. Collagen effects on tenderness increased as heating time increased. The content of collagen, the collagen thermal solubility and the concentration of covalent cross-linking affected the tenderness by affecting texture characteristics of beef. The tenderness was improved with the prolonging of heating time, which was because the increase of content of collagen, covalent cross-linking, connective tissue strength weakened the effect of muscle fiber on tenderness.
beef; heat; tenderness; collagen; crossing-linking
2017-07-12;
2017-10-10
國家肉牛牦牛產業體系(CARS-38)
劉晶晶,E-mail:liujingjing1003@126.com。
張松山,E-mail:zhangsongshan_1997@163.com。通信作者孫寶忠,E-mail: baozhongsun@163.com

