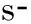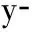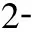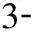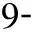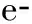脊柱轉移性腫瘤的介入微創治療現狀
孫飛虎,何仕誠,杜瑞杰,虞文輝
(1.東南大學 醫學院,江蘇 南京 210009;2.東南大學附屬中大醫院 介入與血管外科,江蘇 南京 210009)
脊柱是晚期惡性腫瘤常見的轉移部位之一,其中胸椎最常見(約70%),其次為腰椎(20%),頸椎、骶椎少見[1]。大約10%的腫瘤患者會因椎體轉移而產生疼痛、病理性骨折、脊髓受壓等癥狀,其中40%~70%的患者表現為多節椎體受累,嚴重影響患者生存質量及遠期生存率[2]。Wibmer等[3]報道脊柱轉移腫瘤患者平均生存時間為7個月(3~16個月),對于出現硬膜外轉移患者生存時間為3~6個月。
脊柱轉移腫瘤的首發癥狀多為疼痛,其特點多是局限、持續、進行性加重,根據腫瘤侵犯椎體部位不同,大致可分為3種機制,(1) 腫瘤膨脹生長致骨膜牽拉延展引起的局限性骨痛,(2) 腫瘤局部壓迫或侵犯引起的神經根性痛,(3) 脊柱不穩引起的機械性痛[4]。目前對脊柱轉移腫瘤的治療目標是緩解疼痛、保護神經功能、預防病理性骨折、保持脊柱穩定性,以提高患者生存質量。其治療方案的選擇取決于椎體轉移的類型、位置及程度。常用的治療方法有放療、化療、微創介入以及開放性手術等[5]。放化療為姑息治療手段,其中放療的疼痛緩解率約為60%,一般兩周后起效,但不能加強因腫瘤破壞而造成的脊柱不穩,甚至延緩骨的愈合,Sahgal等[6]研究發現對于病理性壓縮骨折的患者行脊柱立體定向放療(spine stereotactic body radiotherapy,SBRT),一年累計再發骨折或骨折進展的發生率約為12.35%。雙磷酸鹽類化合物能夠減弱破骨細胞活動,減少腫瘤相關性溶骨,對乳腺、前列腺癌等椎體轉移有較好的鎮痛效果,但其并不能控制局部病灶,保持脊柱穩定性,因此,在臨床實踐中雙磷酸鹽多作為骨轉移瘤的基礎輔助治療方法。開放性外科手術方式多為病灶刮除聯合內固定,對出現惡性脊髓壓迫綜合征的患者,具有一定的優勢,但其因創傷大、并發癥率高、恢復時間長等缺點難以廣泛應用。介入微創技術因創傷小、并發癥少、疼痛緩解率高以及局部控制好等優點,已經廣泛應用于臨床,并逐漸成為脊柱轉移腫瘤的重要治療手段[5]。Tokuhashi等[7]根據病灶特點、累及范圍將椎體轉移腫瘤分為3種類型7個亞別,即局限型(1~3型)、侵襲型(4~6型)、多發混合型(7型)。對于不同分型的脊柱轉移腫瘤,其適用的微創技術也是不同的,以下簡單介紹不同的介入微創技術及其特點。
1 經皮椎體成形術
經皮椎體成形術(percutaneous vertebroplasty,PVP)是指在影像導向下,向骨腫瘤破壞區注入骨水泥聚甲基丙烯酸甲酯(polymethylmethacrylate, PMMA),從而快速緩解疼痛,加固病變椎體,防止椎體進一步壓縮塌陷,并有效控制局部腫瘤進展的一種技術[5]。自1987年Galibert等首次報道應用PVP治療頸椎血管瘤獲得成功后,經過近30年的發展,該技術已成為脊柱轉移腫瘤的重要微創治療手段。Calmels 等[8]報告PVP治療椎體轉移腫瘤52例(103節),術后1月疼痛緩解率為86%。王宏偉等[9]報告PVP治療椎體轉移腫瘤163例(266節),術后1月、6月和12個月疼痛緩解率分別為91.4%(149/163)、78.3%(108/138)和77.2%(71/92)。Martin等[10]報告PVP治療合并椎弓根轉移的復雜性椎體轉移瘤32例,術后雖獲得較好療效,但術中很難判斷PMMA是否漏入椎管。此外,Saliou等[11]通過PVP治療合并硬膜外侵犯的椎體轉移瘤,術后雖同樣獲得良好療效,但結果顯示椎管的骨水泥滲漏率增加,其中一例術后2天新出現馬尾神經受壓癥狀。因此,結合Barr等[12]觀點,認為PVP的最佳適應證是椎體內轉移病灶局限,未累及硬膜外,患者疼痛明顯伴或不伴有脊柱不穩。
2 經皮椎體成形術聯合其他微創治療
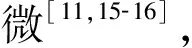
2.1 聯合125I粒子植入術(PV 125ISI)
125I 粒子是一種可釋放γ射線的低劑量微型放射源,組織內有效輻射半徑約1.7 cm,半衰期60.2 d,可累積持續照射,植入瘤體內可有效控制腫瘤生長,已廣泛地應用于人體各部位實體腫瘤的治療[17]。聯合125I粒子植入術是指在影像導向及三維治療計劃系統(TPS) 的支持下,利用13G骨穿針建立穿刺通道,18G粒子針同軸將125I 粒子植入到椎體附件的腫瘤病灶內,而后將骨穿針穿至椎體骨質破壞區,透視下緩慢注入骨水泥[18]。PVP與其聯合治療的優勢在于125I 粒子可殺傷骨水泥充填區外的腫瘤,延緩或阻止腫瘤侵犯脊髓,保護脊髓神經功能完整,尤其是累及椎體附件和伴有早期脊髓壓迫癥狀的復雜性脊柱轉移患者,可達到更好的效果[17]。Yang等[19]報告隨機接受125I粒子植入聯合PVP或單純PVP治療脊柱轉移腫瘤共80例,兩組各40例,療效分析顯示兩組臨床整體效益相當,但聯合組術后VAS評分和卡氏評分明顯優于單純組。謝小西等[18]報告125I粒子植入術聯合PVP治療累及椎管的轉移瘤23例,術后疼痛緩解率86.9%(20/23),長期隨訪硬膜囊受壓癥狀得到緩解。但值得注意的是,采用PVP聯合125I粒子植入術治療伴有早期脊髓壓迫癥狀的脊柱轉移瘤時,術后應積極應用激素、營養神經類藥物,及時脫水消腫,從而緩解脊髓壓力,促進神經功能恢復。同樣,對于腫瘤體積較大的病灶,應結合患者經濟情況,對不同個體進行有針對性的選擇。
2.2 聯合經血管內(化療)栓塞術(PV TAE/TACE)
經血管內(化療)栓塞術是指經皮選擇性動脈插管,通過局部化療、栓塞腫瘤血管等作用來控制局部病灶,從而達到殺傷腫瘤的效果,常應用于實體富血供腫瘤,如肝癌、腎癌等[16]。PVP聯合TAE/TACE治療是指擇期先后行血管內(化療)栓塞術及PVP。血管內化療栓塞術對于富血供且體積較大的脊柱轉移腫瘤,在減輕疼痛,縮小瘤體,緩解局部神經壓迫癥狀等方面療效肯定[16,20]。Wang等[21]報告PVP聯合TAE治療合并有椎旁轉移的椎體轉移瘤25例,結果顯示聯合治療可穩定脊柱,明顯減輕患者疼痛,并在一定程度上控制椎旁腫瘤進展。但對于術中DSA示脊髓動脈顯影,且不能避開的,應視為禁忌證,同時,對于高位胸椎及以上椎體,由于風險更高,術前應嚴格把握適應證及禁忌證[15]。
2.3 聯合射頻消融術(PV RFA)
2.4 聯合IORT術(PV IORT)
3 其他方法
高強度聚焦超聲(high intensity focused ultrasound,HIFU)可準確定位于骨腫瘤,在腫瘤內形成高能量焦點,通過高溫、空化及機械等效應,以達到殺死腫瘤的目的。臨床上常與骨成形術(Osteoplasty)聯合治療骨盆轉移腫瘤。Hurwitz等[31]報告試驗樣本量分組(采取3∶1)接受HIFU或安慰劑治療骨轉移腫瘤共147例,實驗組112例(其中骶尾椎轉移12例),對照組35例,三期試驗結果顯示HIFU治療骨轉移腫瘤是安全、有效的,同時為放療失敗或放療不敏感的患者提供了一項有效的無創性選擇手段。由于超聲波自身特性的限制,目前HIFU治療椎體轉移腫瘤報道很少,并缺乏長期隨訪。但HIFU治療時能促進腫瘤抗原釋放,提高機體對腫瘤的免疫殺傷能力,同時對放療不敏感的患者起到增敏作用,故HIFU仍是研究重點。仍需大樣本循證醫學證據。
此外,放射性骨水泥、載藥微球骨水泥等新型骨水泥也在研究及研制當中,前期基礎動物研究顯示新型骨水泥組術后骨水泥周邊腫瘤細胞壞死范圍明顯大于單純骨水泥組,但由于缺乏活體椎體腫瘤模型模擬臨床治療,目前該研究尚停留于動物實驗研究階段。
4 結 語
經皮椎體成形術已成為單純椎體轉移性腫瘤的重要治療方法,對于復雜性脊柱轉移腫瘤則需采用PVP聯合其它介入微創技術方可獲得顯著療效。但對于不同Tokuhashi分型脊柱轉移腫瘤的介入微創治療方案目前尚未形成統一標準,需根據每例患者具體病情、術者對現有介入技術的熟練程度來制定出合適個體化診療方案,從而緩解患者疼痛、提高其生活質量。
[參考文獻]
[5] STEPHENSON M B,GLAENZER B,MALAMIS A.Percutaneous minimally invasive techniques in the treatment of spinal metastases.[J].Curr Treat Options Oncol,2016,17(11):56.