活性干酵母對不同粗飼料瘤胃降解的影響
康 坤,胡駿鵬*,張翔飛,王之盛,廖漢江,張小麗
(1.安琪酵母股份有限公司,湖北宜昌 443000;2.四川農業大學動物營養研究所,四川成都 610000)
粗飼料是反芻動物日糧的重要組成部分,可為瘤胃微生物和宿主提供重要的營養物質,保障動物機體健康。不同的粗飼料所含營養成分有所不同,其物理化學性質也不同,因此在瘤胃中的降解率也有差異。青貯玉米秸稈、苜蓿顆粒、黑麥干草是反芻動物養殖常用的優質粗飼料,其對反芻動物的營養作用已有報道,而近年來,為提高反芻動物生產性能,生產中精料使用比例逐漸升高,高精料條件下瘤胃中的粗飼料纖維降解會受到抑制(王海榮,2006),活性干酵母是否會對高精料條件下不同種類粗飼料的瘤胃降解產生效果報道較少。尼龍袋法密切結合動物的消化過程,具有較好的重復性和易操作性,近年來被廣泛應用于各種飼料營養成分在瘤胃中的降解特性研究。因此,本試驗擬采用瘤胃尼龍袋法評定活性干酵母對青貯玉米秸稈、苜蓿顆粒、黑麥干草及TMR日糧的DM、CP、ADF、NDF瘤胃降解率,探索活性干酵母對高精料條件下不同種類粗飼料在肉牛瘤胃中的降解效率的影響。
1 材料與方法
1.1試驗材料活性干酵母:由安琪酵母股份有限公司提供,活菌數≥200億/g;
苜蓿顆粒(豆科牧草)、黑麥干草(禾本科牧草)、青貯玉米秸桿(秸稈類)、TMR日糧(配方如表1所示),65℃干燥,粉碎過40目篩備用。
1.2試驗動物本試驗選取6頭年齡相近、體況良好,安裝有永久性三位點瘺管的去勢宣漢黃牛作為試驗動物,平均體重為(457.80±18.15)kg。每天8:00、20:00定時定量飼喂(按1.3倍維持需要的干物質飼喂量),自由飲水。其他飼養方式按照常規進行。
1.3試驗設計按體重及年齡相近原則將試驗牛隨機分為2組,酵母組和對照組,每個處理3個重復,每個重復1頭牛。對照組飼喂基礎日糧,酵母組在基礎日糧中添加0.1% DM的活性干酵母,將活性干酵母均勻混合于精料中進行飼喂。預飼10 d,正式期 3 d。

表1 日糧組成及營養水平(風干樣基礎)
1.4試驗方法本試驗采用尼龍袋法,將待測飼料樣品65℃干燥,用粉碎機粉碎,過40目篩(2.5 mm篩)。稱取5 g飼料樣品于尼龍袋中,每個時間點每種樣品設置4個重復,每一組固定在50 cm左右的半軟質塑料管上。晨飼后2 h將尼龍袋放入瘤胃中,采取同時放入,分時取出的原則,分別于 6、12、24、36、48、72 h 時間取出尼龍袋。取出的尼龍袋在室溫下用自來水沖洗干凈,直至水清為止,過程中盡量避免外力擠壓尼龍袋,以免造成樣品消失量增加。洗凈的尼龍袋經65℃干燥72 h,并稱重記錄。將同一時間點重復的尼龍袋內殘渣取樣測定DM、CP、ADF、NDF,并計算降解率。
1.5測定指標及計算方法參照張麗英(2003)的方法測定各尼龍袋殘渣中的干物質(DM)和粗蛋白質(CP)含量,參照 Van Soest等(1991)方法測定酸性洗滌纖維(ADF)及中性洗滌纖維(NDF)含量。
原料營養物質瘤胃實時降解率/%= [原料中營養物質質量(g)-殘渣中營養物質質量(g)]/原料中營養物質質量(g)×100。
應用Orskov和McDonald(1979)提出的方程:飼料營養物質在瘤胃內某一時間點的尼龍袋消失率P=a+b(1-e-c*t)確定降解常數a,b,c。a為待測飼料樣品快速降解部分;b為慢速降解部分;c為慢速降解部分的降解速率。
原料營養物質瘤胃有效降解率(ED)=a+[bc/(c+k)],k為瘤胃流通速率常數。粗飼料瘤胃流通速度k=0.025(顏品勛等,1996),精飼料取 k=0.05(Sinclair,1995),按照 TMR 日糧的精粗比5∶5,計算出TMR的瘤胃流通速率k=0.0375。
2 數據統計與分析
試驗數據經Excel(2013)初步分析,采用SPSS 18.0統計軟件對結果進行獨立樣本t檢驗分析,P<0.05表示差異顯著,結果以“平均數±標準差”表示。
3 結果與分析
3.1活性干酵母對不同粗飼料在肉牛瘤胃中DM降解率的影響試驗結果見表2,各種飼料的DM降解率均隨飼料在瘤胃中停留時間延長而增加,各組粗飼料及TMR日糧的酵母組DM降解率在各時間點內都高于對照組,且各組飼料的酵母組DM有效降解率(ED)與對照組相比,分別上升了9.50%(P < 0.05)、10.92%(P < 0.05)、12.35%(P<0.05)、11.90%(P<0.05)。苜蓿顆粒的酵母組在降解第6、12、24、48 h及72 h顯著高于對照組(P<0.05);對于玉米秸稈青貯、黑麥干草、TMR,其酵母組的 DM 降解率在 6、12、24、36、48 h及72 h均分別顯著高于對照組(P<0.05)。各種飼料酵母組的快速降解參數(a)均顯著高于對照組(P<0.05);苜蓿顆粒酵母組的慢速降解參數(b)顯著高于對照組(P<0.05)。
3.2活性干酵母對不同粗飼料在肉牛瘤胃中CP降解率的影響苜蓿顆粒、玉米秸稈青貯、黑麥干草、TMR的CP降解率隨其停留時間增加而逐漸增加(表3),同時,各組飼料的酵母組CP有效降解率(ED)相比對照組分別上升了 5.74%(P< 0.05)、8.55%(P < 0.05)、6.66%(P < 0.05)、7.15%(P<0.05)。各時間點的玉米秸稈青貯酵母組均顯著高于對照組(P<0.05),酵母組(苜蓿顆粒)在降解第 6、12、24、48 h及 72 h顯著高于對照組(P<0.05),對于黑麥干草、TMR,其酵母組的 CP 降解率在 6、12、36、48 h及 72 h均分別顯著高于對照組(P<0.05)。各種飼料酵
母組的快速降解參數(a)均顯著高于對照組(P<0.05);酵母組黑麥干草的慢速降解參數(b)顯著高于對照組(P<0.05)。

表2 活性干酵母對不同粗飼料在肉牛瘤胃中DM降解率的影響 %

表3 活性干酵母對肉牛瘤胃粗飼料CP降解率的影響 %
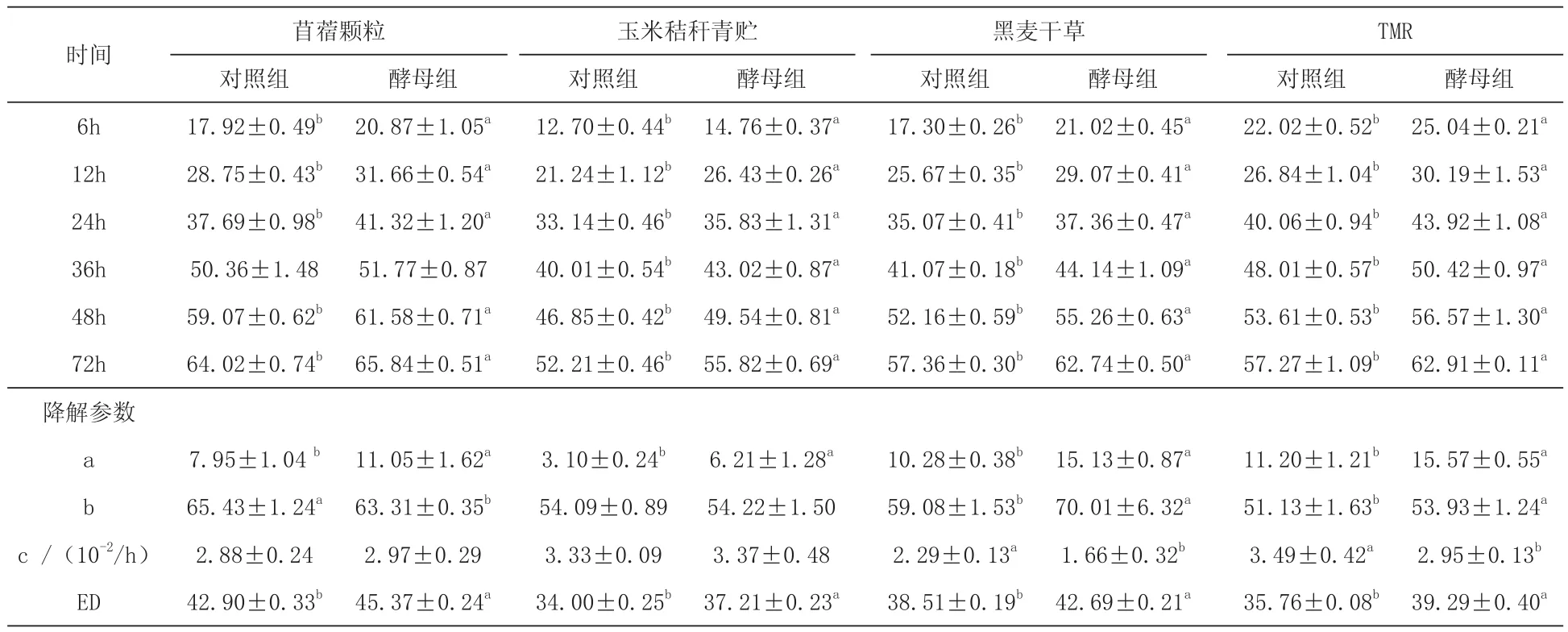
表4 活性干酵母對肉牛瘤胃粗飼料NDF降解率的影響 %
3.3活性干酵母對不同粗飼料在肉牛瘤胃中NDF降解率的影響由表4可知,苜蓿顆粒、玉米秸稈青貯、黑麥干草、TMR的NDF降解率隨飼料在瘤胃中降解時間延長而增加,且各種飼料酵母組的NDF有效降解率(ED)與對照組相比分別上升了 5.76%(P< 0.05)、9.44%(P< 0.05)、10.85%(P< 0.05)、9.87%(P< 0.05)。 除 苜蓿顆粒降解36 h的酵母組與對照組無顯著差異(P>0.05)外,各時間點的酵母組(苜蓿顆粒、玉米秸稈青貯、黑麥干草、TMR)降解率均顯著高于對照組(P<0.05)。對于快速降解參數(a),各種飼料的對照組均顯著低于酵母組(P<0.05);黑麥干草和TMR的酵母組分別顯著高于對照組(P< 0.05)。
3.4活性干酵母對不同粗飼料在肉牛瘤胃中ADF降解率的影響各種飼料的ADF降解率隨其在瘤胃中的停留時間增加而逐漸升高(表5),同時,各組飼料(苜蓿顆粒、玉米秸稈青貯、黑麥干草、TMR)酵母組的ADF有效降解率(ED)顯著高于對照組(P<0.05),分別上升了 7.85%、10.98%、6.90%、7.04%。各時間點的玉米秸稈青貯和TMR酵母組ADF降解率均顯著高于對照組(P<0.05),酵母組苜蓿顆粒在降解第6、12、48 h及72 h顯著高于對照組(P<0.05),對于黑麥干草,其酵母組的 ADF降解率在 6、12、24、36 h及72 h均分別顯著高于對照組(P<0.05)。各種飼料酵母組的快速降解參數(a)均顯著高于對照組(P<0.05);酵母組玉米秸稈青貯的慢速降解參數(b)顯著高于對照組(P<0.05)。
4 討論
粗飼料對于反芻動物而言具有十分重要的作用,由于反芻動物瘤胃中復雜的厭氧微生物菌群(細菌、原蟲及真菌)能夠對纖維物質進行發酵消化,將其降解為乙酸、丙酸、丁酸等揮發性脂肪酸,而揮發性脂肪酸是反芻動物主要的能量來源。尼龍袋法是評價飼料養分在瘤胃中降解效率的一種簡易方法,并且能夠反映瘤胃實際發酵狀態(王雅晶等,1999)。因此本試驗通過尼龍袋法研究酵母添加對苜蓿顆粒、玉米秸稈青貯、黑麥干草及TMR日糧DM、CP、NDF、ADF在瘤胃中72 h動態降解率的影響。
足量的干物質攝入是動物獲得必需養分滿足維持及生長的基礎,而干物質在瘤胃中的降解率是影響日糧營養成分消化吸收的重要因素(張海波,2012)。苜蓿顆粒、玉米秸稈青貯、黑麥干草及TMR日糧的DM在瘤胃中降解率隨其在瘤胃中停留時間延長而逐漸升高,酵母添加對各時間點不同種類粗飼料及TMR日糧的DM降解率有提高作用,從有效降解率看,各種飼料DM降解率分別因酵母的添加分別提高了9.50%(P<0.05)、10.92%(P < 0.05)、12.35%(P < 0.05)、11.90%(P< 0.05)。Paryad等(2009)和 Kim等(2006)分別研究了酵母添加對綿羊和奶牛日糧DM降解率的影響,結果顯示酵母能顯著提高飼料DM降解率,與本試驗結果一致。

表5 活性干酵母對肉牛瘤胃粗飼料ADF降解率的影響 %
反芻動物日糧中飼料蛋白質在瘤胃中的降解具有十分重要的地位,飼料蛋白質降解產生的肽、氨基酸和氨氮為瘤胃微生物蛋白的合成提供了底物。不同粗飼料及TMR日糧的瘤胃實時降解率隨降解時間延長而逐漸升高,72 h內降解率均隨酵母添加而較對照組有所升高,同時各種飼料的有效降解率都顯著提高,表明活酵母的添加能促進粗飼料及TMR飼料蛋白質降解效率。添加酵母組快速降解參數(a)顯著高于對照組,說明酵母提高了飼料蛋白質在瘤胃中的快速降解比例,提高了降解速率。Wohlt等(1991)在泌乳早期奶牛日糧中添加酵母后得到類似結果,可能原因是酵母刺激了蛋白分解菌(溶纖維丁酸弧菌)生長,增強了其活性,從而提高了飼料蛋白質的消化率(Paryad等,2009)。Yoon等(1996)也報道了釀酒酵母產生的代謝因子可提高奶牛瘤胃中蛋白分解菌數量。
粗飼料中纖維物質的含量一般相比其他飼料高,而纖維物質對反芻動物瘤胃發酵功能、采食量、機體健康和維持生產等具有重要意義。本試驗結果顯示,活性干酵母的添加顯著提高了不同粗飼料及TMR日糧NDF快速降解參數,分別上升了 38.99%、100.3%、47.18%、39.02%;同時提高了ADF快速降解參數,分別上升了40.40%、123.63%、26.55%、10.74%。酵母提高了高精料條件下不同種類粗飼料在瘤胃中的快速降解比例,有利于提高纖維物質的降解速率。
此外,日糧中添加活性酵母可以提高不同種類粗飼料及TMR日糧NDF、ADF在瘤胃中的降解率,苜蓿顆粒、玉米秸稈青貯、黑麥干草及TMR的NDF有效降解率從42.90%、34.00%、38.51%、35.76% 增 加 至 45.37%、37.21%、42.69%、39.29%;ADF有效降解率因酵母添加 從 43.43%、37.63%、45.19%、38.62% 升 高 至46.84%、41.76%、48.31%、41.34%。這高于已報道的苜蓿顆粒的NDF有效降解率34.99%(夏科等,2012)、與玉米秸稈青貯39.67%(王雅晶等,1999)、黑麥干草46.21%(薩其仍貴,2009)相近,對于ADF有效降解率,高于已報道的苜蓿顆粒39.77%(夏科等,2012)和玉米秸稈青貯33.15%(薩其仍貴,2009),與黑麥草44.26%相近(薩其仍貴,2009),其差異可能受原料品種、加工貯存方式影響。研究表明,瘤胃ADF降解率與乙酸濃度具有較高的正相關(陳喜斌和馮仰廉,1996),本試驗結果顯示酵母能提高瘤胃中ADF的降解率,與乙酸濃度的提高結果相符。Zain等(2011)研究了活酵母對氨化稻草秸稈體外發酵降解率的影響,結果顯示NDF降解率從32.7%提高到45.8%,ADF降解率從30.9%提高到42.9%,與本試驗結果一致。Elseed等(2007)在努比亞山羊中也有類似的結果。NDF和ADF瘤胃降解率的提高可能是酵母提供了穩定的瘤胃pH,為瘤胃微生物尤其是纖維降解微生物的增殖創造適宜的環境,更有利于纖維組分的降解(Miller等,2002);另一方面,酵母促進作用可能與酵母的某些代謝物有關,對微生物有較強的促生長作用。Chaucheyras等(2001)研究發現酵母產品可以提高瘤胃中多糖酶和糖苷水解酶活性,而黃色瘤胃球菌和白色瘤胃球菌正是這些酶類的產生者。Mosoni等(2007)進一步研究發現活性干酵母提高了綿羊瘤胃中白色和黃色瘤胃球菌的16S rRNA基因拷貝數。而黃色瘤胃球菌、白色瘤胃球菌等是瘤胃內的主要纖維分解菌。
5 小結
活性干酵母可顯著提高高精料條件下粗飼料及TMR日糧NDF、ADF、DM、CP在肉牛瘤胃中的快速發酵比例及72 h內有效降解率。活性干酵母作為一種天然的微生態制劑,在改善粗飼料利用效率方面具有廣闊的使用價值。
[1]陳喜斌,馮仰廉. 瘤胃 VFA 產量與瘤胃可發酵有機物質關系的研究 [J]. 動物營養學報,1996,8(2):32 ~ 36.
[2]高義彪,閆素梅,趙天章,等. 奶牛主要飼料原料纖維物質瘤胃降解率的研究 [J]. 中國飼料,2008,(8):14 ~ 17,23.
[3]薩其仍貴. 奶牛主要飼料原料纖維物質和蛋白質瘤胃降解特性的研究[D]. 內蒙古農業大學,2009.
[4]薩其仍貴,李九月,喬永明,等. 奶牛幾種常用粗飼料干物質和纖維物質瘤胃降解率的研究[J]. 當代畜禽養殖業,2009,4:18~22.
[5]王海榮. 不同日糧精粗比及氮源對綿羊瘤胃纖維降解菌群和纖維物質降解的影響[D].內蒙古農業大學,2006.
[6]王雅晶,李勝利,左奎. 常規粗飼料干物質、NDF、ADF降解率的評定及評定方法間相關關系[J]. 中國奶牛,1999,3:31~33.[7]夏科,姚慶,李富國,等. 奶牛常用粗飼料的瘤胃降解規律[J].動物營養學報,2012,4:769~777.
[8]顏品勛,馮仰廉,楊雅芳,等. 青粗飼料蛋白質及有機物瘤胃降解規律的研究[J]. 中國畜牧雜志,1996,32(4):42~44.
[9]張海波. 能量水平對瘤胃發酵特性及微生物菌群的影響[D].四川農業大學,2012.
[10]張麗英. 飼料分析及飼料質量檢測技術[M]. 中國農業大學出版社,2003.
[11]Chaucheyras-Durand F,Fonty G. Establishment of cellulolytic bacteria and development of fermentative activities in the rumen of gnotobiotically-reared lambs receiving the microbial additive Saccharomyces cerevisiae CNCM I-1077[J]. Reproduction Nutrition Development,2001,41(1):57~ 70.
[12]Elseed A,Abusamra R M A. Effects of supplemental yeast(Saccharomyces cerevisiae)culture on NDF digestibility and rumen fermentation of forage sorghum hay in Nubian goat’s kids [J].Research Journal of Agricultural and Biological Science,2007,3(3):133~137.
[13]Kim H S,Ahn B S,Chung S G,et al. Effect of yeast culture,fungal fermentation extract and non-ionic surfactant on performance of Holstein cows during transition period [J]. Animal Feed Science and Technology,2006,126(1):23~ 29.
[14]Miller-Webster T,Hoover W H,Holt M,et al. Influence of yeast culture on ruminal microbial metabolism in continuous culture[J]. Journal of Dairy Science,2002,85(8):2009 ~ 2014.
[15]Mosoni P,Chaucheyras-Durand F,Béra-Maillet C,et al.Quantification by real-time PCR of cellulolytic bacteria in the rumen of sheep after supplementation of a forage diet with readily fermentable carbohydrates:effect of a yeast additive[J]. Journal of Applied Microbiology,2007,103(6):2676~ 2685.
[16]?rskov E R,McDonald I. The estimation of protein degradability in the rumen from incubation measurements weighted according to rate of passage [J]. The Journal of Agricultural Science,1979,92(2):499~503.
[17]Paryad A,Rashidi M. Effect of yeast(Saccharomyces cerevisiae)on apparent digestibility and nitrogen retention of tomato pomace in sheep [J]. Pakistan Journal of Nutrition,2009,8(3):273 ~ 278.
[18]Sinclair L A,Garnsworthy P C,Newbold J R,et al. Effect of synchronizing the rate of dietary energy and nitrogen release in diets with a similar carbohydrate composition on rumen fermentation and microbial protein synthesis in sheep[J]. Journal of Agricultural Science-Cambridge,1995,124:463~ 472.
[19]Van Soest P J,Robertson J B,Lewis B A. Methods for dietary fiber,neutral detergent fiber,and nonstarch polysaccharides in relation to animal nutrition [J]. Journal of Dairy Science,1991,74(10):3583~3597.
[20]Wohlt J E,Finkelstein A D,Chung C H. Yeast culture to improve intake,nutrient digestibility,and performance by dairy cattle during early lactation [J]. Journal of Dairy Science,1991,74(4):1395~1400.
[21]Yoon I K,Stern M D. Effects of Saccharomyces cerevisiae and Aspergillus oryzae Cultures on Ruminal Fermentation in Dairy Cows[J]. Journal of Dairy Science,1996,79(3):411~ 417.
[22]Zain M,Jamarun N,Arnim A,et al. Effect of yeast(Saccharomyces cerevisiae)on fermentability,microbial population and digestibility of low quality roughage in vitro[J]. Archiva Zootechnica,2011,14(4):51~58.

