Foxp3在AOM/DSS誘導小鼠結腸癌模型中的表達及其意義
郭亞榮,柴 寶,劉近春,崔香麗
(1山西醫科大學第一醫院腫瘤科,太原 030001;2山西大醫院消化科;3山西醫科大學第一醫院消化科;4山西醫科大學生理學系;*通訊作者,E-mail:cuixlcxl@sina.com)
結腸癌是消化系常見的惡性腫瘤之一。近年來,結腸癌發病率及死亡率仍然持續升高[1]。結腸癌動物模型在臨床前研究工作中發揮著重要的作用。其中,氧化偶氮甲烷(azoxymethane,AOM)/葡聚糖硫酸鈉(dextran sodium sulfate,DSS)小鼠模型是一種在致癌劑AOM和致炎劑DSS協同作用基礎上,由炎癥性腸病(inflammatory bowel disease,IBD)逐步發展為結直腸癌的炎癥相關性癌癥的研究模型。AOM/DSS模型能很好地模擬慢性腸道炎癥誘發癌癥的生理病理過程,近年來被廣泛用于炎癥相關性癌癥形成機制的研究[2]。
結腸癌被認為是一種高免疫相關性疾病,其免疫功能一直受到廣泛的關注。調節性T細胞(Treg細胞)是一類具有免疫抑制功能和免疫無能性的細胞群,可抑制自身免疫反應和機體對外來抗原或病原體的過度免疫反應。轉錄因子Foxp3[3]是Treg細胞最敏感的的特異性標志,對Treg細胞的活化及功能起著重要作用,其表達與Treg細胞密切相關。因此,本研究旨在觀察AOM/DSS誘導小鼠結腸癌組織中Foxp3蛋白表達水平及探討其意義。
1 材料與方法
1.1 實驗動物及分組
6-8周齡雌性SPF級C57BL/6小鼠20只,體質量20-25 g,由北京市海淀興旺動物養殖場提供,動物合格證號:SCXK(軍)2012-0004。小鼠飼養于中國輻射研究院[許可證號:SYXK(晉)2013-0002],12 h晝夜交替的環境,食用標準的顆粒飼料以及飲用水。隨機分為模型組和正常對照組,每組10只小鼠。
1.2 主要試劑與儀器
氧化偶氮甲烷(azoxymethane,AOM)、葡聚糖硫酸鈉(dextran sodium sulfate,DSS)均購自美國Sigma公司,4%多聚甲醛溶液(巴菲兒生物科技有限公司,批號:ASl018,ASl090),抗小鼠Foxp3抗體一抗(美國R&D公司,批號:MAB8214-SP,MAB421-100),兔抗大鼠甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phos-phate dehydrogenase,GADPH),抗體二抗(美國SantaCruz公司,批號:sc437853)。DYY-7C型電泳儀、DYCZ-24DN垂直電泳槽、DYCZ-40電轉儀為北京六一儀器廠產品,邁瑞血細胞分析儀。
1.3 小鼠結腸癌模型的建立
雌性SPF級C57BL/6小鼠單劑量腹腔注射AOM(10 mg/kg),AOM配制成1 mg/ml,注射體積0.1 ml/10 g。注射后1周,給予1% DSS飲用7 d,之后給予正常水飲用14 d,為1個造模周期。共3個造模周期,之后正常飼養2周即實驗11周末實驗結束。
1.4 單核細胞檢測
實驗結束時,腹腔注射1%戊巴比妥鈉溶液(150 mg/kg)麻醉小鼠,行胸腔剖開,暴露小鼠心臟,心腔內取血1 ml,用于檢測單核細胞數。所有實驗小鼠留存新鮮血漿,按照試劑盒說明書(光學法)操作通過血細胞分析儀檢測血細胞分析。
1.5 結直腸病理學觀察
取小鼠距肛門10 cm腸管,觀察其大致形態,取下段5 cm腸管以4%多聚甲醛固定2 d,常規石蠟包埋,切片,HE染色,光鏡觀察病理學變化。
1.6 免疫組織化學檢測結腸組織Foxp3蛋白
結腸組織10%中性甲醛固定,石蠟包埋切片,厚度4 μm,載玻片為防脫片,用PBS按1 ∶1 500稀釋一抗,按試劑盒操作說明進行免疫組化染色。
所有切片的觀察經三名病理科醫師獨立在光鏡下完成。每人均選擇10個具有代表性的高倍視野(×400)倍,計數免疫組化標記定位準確的陽性細胞占腫瘤細胞的比例并記分,其標準為:胞漿陽性細胞數占腫瘤細胞數的10%以下為(±),10%-50%為(+),50%-80%為(++),80%以上為(+++),依次記為1,2,3,4分;染色強度依次以(±)、(+)、(++)表示,記為1,2,3分;計算兩種得分的乘積。
1.7 統計學分析
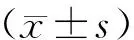
2 結果
2.1 一般情況
模型組小鼠給予AOM/DSS處理第1個造模周期后出現豎毛,少動、食量下降,腹瀉稀便,甚至黑便,肉眼可見暗紅色血便,體質量下降;正常對照組小鼠給予正常飲水后無上述異常反應。
2.2 小鼠結腸組織病理學變化
正常對照組結腸黏膜上皮完整,固有層腺體排列規整,含豐富的杯狀細胞,固有層有少量的淋巴細胞表達,黏膜下層、肌層、漿膜層結構清晰完整(見圖1)。模型組腸黏膜彌漫性充血,黏膜上皮糜爛,黏膜及黏膜下層大量中性粒細胞及淋巴細胞浸潤,固有層杯狀細胞消失,腺體結構破壞,有潰瘍形成,深至固有層,少數甚至出現非局限性透壁性壞死(見圖1)。

圖1 兩組小鼠結腸組織HE染色結果Figure 1 Histological changes of colon tissues in AOD/DSS by HE staining
2.3 小鼠外周血中單核細胞計數
模型組小鼠外周血中單核細胞計數[(5.14±0.25)×109/L]較正常對照組[(5.78±0.17)×109/L]明顯降低,差異有統計學意義(P<0.01)。
2.4 結腸組織Foxp3蛋白表達
正常組小鼠腸黏膜上皮、黏膜間質內淋巴細胞Foxp3蛋白鮮有表達;與正常組相比,模型組小鼠腸黏膜上皮細胞、腺上皮細胞Foxp3蛋白表達明顯增多(見圖2)。半定量分析結果顯示,正常組和模型組間Foxp3蛋白表達差異有統計學意義(1.00±0.71vs3.55±0.88,P<0.05)。

圖2 兩組小鼠結腸組織中Foxp3的表達Figure 2 The expression of Foxp3 in colon tissue of mice by IHC
3 討論
近年來我國結腸癌發病率逐年升高,其發病機制尚未完全闡明。腫瘤局部的免疫微環境.在結腸癌發生發展過程中起著至關重要的作用[4,5]。腫瘤局部的免疫反應一方面可以激活細胞毒性淋巴細胞,從而起到殺滅腫瘤細胞的效果;另一方面,腫瘤局部持續的慢性炎性反應,可加速腫瘤的生長、浸潤甚至遠處轉移[6]。腫瘤相關免疫逃逸已在多項研究中得到證實,調節性T細胞的免疫無能及免疫抑制等特點使其在腫瘤的免疫逃逸機制中起重大作用,肝癌[7]、肺癌[8]、膀胱癌[9]等Treg細胞增高為其提供了一定的理論依據。研究表明Foxp3是Treg細胞特征性表面分子,可通過調控多種基因來調節該細胞的活性[10]。本實驗通過免疫組化染色檢測Foxp3蛋白表達來反應Treg細胞的生物活性,結果表明AOM/DSS誘導小鼠結腸癌組織中Foxp3的表達高于正常對照組結腸組織,推測Treg細胞不但數量增加,而且其功能也可能增強,進而促進腫瘤免疫耐受的形成,對結腸癌患者的機體產生一定的免疫抑制作用,促進腫瘤的發生和發展。
單核細胞是機體防御系統的一個重要組成部分,目前認為它是巨噬細胞的前身,具有吞噬和清除衰老、受傷細胞及碎片的功能。據報道,升高的術前外周血單核細胞計數與結直腸癌肝轉移相關,可能通過使腫瘤患者處于免疫抑制狀態促進了結直腸癌肝轉移[11]。本研究結果提示,結腸癌動物模型外周血中單核細胞計數較正常對照組明顯降低,表明結腸癌發生可能與其免疫功能抑制有關,而單核細胞在其中發揮著一定的作用。
本研究結果提示:Treg細胞免疫及單核細胞在AOM/DSS誘導小鼠結直腸癌發生發展過程中發揮著重要作用。
參考文獻:
[1]Pan Rui, Zhu Meng, Yu Canqing,etal. Cancer incidence and mortality: a cohort study in China, 2008-2013[J]. Int J Cancer, 2017, 141: 1315-1323.
[2]高玉艷,趙琦,鹿曉麟,等.大腸炎促進大腸癌發生發展的實驗研究[J].哈爾濱醫科大學學報,2017,51(2):118-122.
[3]李莎,李巖,梁婧,等.非小細胞肺癌患者外周血Foxp3+調節性T細胞和Th17的檢測與臨床意義[J].中華微生物學和免疫學雜志,2012,32(7):642-646.
[4]陳鈺鋒,吳現瑞,吳小劍,等.免疫微環境在結直腸腫瘤中的臨床預后價值[J].中華實驗外科雜志,2012,29(2):350-351.
[5]de la Cruz-Merino L, Henao Carrasco F, Vicente Baz D,etal. Immune microenvironment in coloreetalcancer: a near hallmarkto change old paradigms[J]. Clin Dev Immunol, 2011, 2011: 174149.
[6]Ferrone C, Dranoff G. Dual roles for immunity ingastrointestinalcancers[J]. J Clin Oncol, 2010, 28: 4045-4051.
[7]李小鳳,徐文貴.轉化生長因子-β1差異性誘導CD4+和CD8+T細胞表達轉錄因子FOXP3的研究[J].中華肝膽外科雜志,2013,19(4):301-306.
[8]Tao H, Mimura Y, Aoe K,etal. Prognostic potential of FOXP3 expression in non-small cell lung cancer cells combined with tumor infiltrating regulatory T cells[J]. Lung Cancer, 2012, 75(1):95-101.
[9]Winerdal ME,Marks P,Winerdal M,etal.FOXP3 and survival in urinary bladder cancer[J].BJU Int,2011,108(10):1672-1678.
[10]Bettelli E,Carrier Y,Gao W,etal.Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells[J].Nature,2006,441(7090):235-238.
[11]胡時棟,鄒振玉,李浩,等.外周血單核細胞計數與結直腸癌肝轉移的關系[J].中國臨床研究,2016,29(1):17-19.

