流式細胞技術檢測酸性飲料中菌落總數的研究
, ,, ,,,,
(1.達能(中國)食品飲料有限公司,廣東中山 528415; 2.廣東出入境檢驗檢疫技術中心,廣東省動植物與食品進出口技術措施研究重點實驗室,廣東廣州 510000)
隨著科技的發展和人們生活水平的不斷提高,食品安全日益受到人們的關注,其中微生物污染是影響食品安全的主要因素,因此作為食品生產企業,對微生物污染的預防和監控顯得尤為重要。傳統微生物檢測方法具有耗時長、工作量大、不易檢出芽孢等缺點[1],嚴重影響了對微生物污染控制的時效性,從而制約了企業的放貨速度和運轉效率,這是所有食品行業所面臨的共同難題。近年來,隨著現代科學技術的不斷發展,各種快速檢測方法如生物熒光法、免疫化學法和流式細胞技術等已廣泛運用于食品、飲料、發酵和環保領域,其中流式細胞技術(Flow Cytometry,FCM)因其可解決傳統微生物檢測手段檢測周期過長、無法大批量檢測樣本等缺點[1]而廣受青睞。FCM法是一種采用流式細胞儀檢測溶液中懸浮細胞或微粒的現代分析技術,通過熒光探針的協助,從分子水平上獲取多種信號,對細胞進行定量分析或純化分選,有研究報道[2-4]比較了流式細胞法與平板法或濾膜法檢測菌落總數,結果發現流式細胞儀檢測時間只需2 h左右,而平板計數法或濾膜法則需要2 d左右,而且在一定濃度范圍內,前者具有更好的符合性,更加靈敏、準確、高通量,對液態食品的貨架期、倉儲、保質期、出口等順利進行提供了高效的技術平臺[1,5]。
FCM法在細菌[6-7]、真菌等微生物檢測方面的應用已非常廣泛[8-9],目前已成為飲料、發酵和環保等微生物質量檢測領域的常用工具和有力手段[10-12],但是關于FCM法直接檢測低含菌量的酸性飲料菌落總數方面的應用研究,國內還鮮有報道。2015年國家食品安全法提倡食品飲料企業運用先進的技術手段來加速產品放行,因此將流式細胞技術應用到含菌量低的酸性飲料菌落總數的檢測,對于飲料行業具有非常重要的現實意義,可以縮短培養時間,加快產品放行,從而提高產品的新鮮度,降低庫存成本。
1 材料與方法
1.1 材料與儀器
酸性飲料(pH<4.6)中山市小欖鎮超市購買;胰蛋白胨大豆瓊脂TSA、平板計數瓊脂PCA、營養肉湯TSB、無菌平皿(50 mm & 90 mm)廣東環凱微生物科技有限公司;0.85%無菌生理鹽水自制;0.45 μm濾膜密理博(中國)有限公司;CS13、ChemSol S 50X、Diluent R、CSR、Isored、Antifoam、Cleaning 5、Cleaning 3、Standard G、ChemChrome V26、CSV、B24梅里埃診斷產品(上海)有限公司;實驗用菌株詳見表1所示。
BactiFlow ALS system流式細胞儀梅里埃診斷產品(上海)有限公司;生物安全柜/超凈工作臺蘇州安泰空氣技術有限公司;生化培養箱美墨爾特(上海)貿易有限公司;三聯過濾裝置密理博(中國)有限公司。

表1 實驗用菌株編號及名稱Table 1 Number and name of the test strains
1.2 實驗方法
1.2.1菌種的保藏和活化實驗菌株在TSA培養基上,(36±1) ℃培養24 h進行復蘇,對復蘇后的菌株純度及生化特性做確認,通過一系列的生化實驗、16S rDNA測序及MODI-TOF分子生物學鑒定實驗確證實驗菌株。將表1所列菌株分別接種于營養肉湯TSB培養基中,(36±1) ℃培養24 h 后,菌懸液備用。
1.2.2濾膜法將含菌飲料手動混勻,在無菌操作環境下,抽濾250 mL含菌飲料,用無菌鑷子將濾膜轉移至平板計數瓊脂(PCA),于(36±1) ℃倒置培養(48±4) h,觀察并計數[13]。
1.2.3FCM法增菌:將含菌飲料手動搖勻,在無菌操作環境下,抽濾250 mL含菌飲料,用無菌鑷子將濾膜轉移至100 mL TSB肉湯,于(36±1) ℃培養箱中正置培養。
檢測:用無菌移液器移取上述增菌后的菌液100 μL加入20 mL無菌試管中,依次加入90 μL CS13,于無菌環境靜置30~60 min。開機清洗校正完成后將含樣品的20 mL試管置于SPU樣品架,試劑Cleaning 5、還原劑(CSR+DR+隔離油)、CSV和B24放置在試劑架,V26放置在冷卻架。編輯程序,運行檢測,其稀釋倍數為30[14]。
1.2.4平板法將菌液手動搖勻,在無菌操作環境下,用無菌移液器移取1 mL含菌溶液至無菌平皿中,傾注溫度為(46±1) ℃的平板計數瓊脂(PCA),搖勻,靜置凝固后倒置于(36±1) ℃培養箱中培養(48±4) h,觀察并計數[15]。
1.2.5FCM法和平板法檢測不同基質中實驗菌株菌濃度的對比研究以生理鹽水為基質,將表1中的新鮮培養物制備成約103~109CFU/mL濃度的菌懸液,分別運用平板法和FCM法對菌懸液的菌濃度進行檢測。
以酸性飲料為基質,將表1中的新鮮培養物制備成約103~109CFU/mL濃度的菌懸液,分別運用平板法和FCM法對菌懸液的菌濃度進行檢測。
1.2.6增菌時間對FCM法和平板法檢測低含菌量樣品菌濃度的影響以酸性飲料為基質,選擇常見實驗菌株13株(A~M),制備濃度為1~10 CFU/250 mL的菌懸液,菌懸液的初始菌濃度由濾膜法確定。另過濾富集250 mL樣品中的微生物,將濾膜置于100 mL TSB肉湯培養基中,(36±1) ℃增菌培養6 h和22 h后,使用FCM法與平板法同時檢測增菌后的微生物水平,對FCM法與平板法的檢測結果與濾膜法的定性檢測結果進行比較分析。
1.2.7增菌時間對FCM法檢測強壯類和愛媛類芽孢桿菌菌濃度的影響以酸性飲料為基質,選擇生長較為緩慢的強壯類和愛媛類芽孢桿菌(A和B),分別制備成濃度為1~10 CFU/250 mL的菌懸液。每個菌株選擇6個樣品(A-1~A-6,B-1~B-6),樣品的菌濃度由濾膜法確定均在1~10 CFU/250 mL的范圍內,分別過濾富集250 mL樣品中的微生物,將濾膜置于100 mL TSB肉湯培養基中(36±1) ℃培養0、6、22 h后,采用FCM法檢測增菌后的微生物水平,每個樣品分別上機檢測2次,并與濾膜法的定性檢測結果進行對比,分析增菌時間對FCM法檢測強壯類和愛媛類芽孢桿菌的影響。
1.2.8濾膜法與增菌22 h后FCM法定性結果的統計學分析以酸性飲料為基質,選擇常見實驗菌株13株(A~M),分別制備成濃度為1~10 CFU/250 mL,10~100 CFU/250 mL和>100 CFU/250 mL的菌懸液。120個陰性樣品(無菌酸性飲料)與936個陽性樣品(每個菌株每個濃度梯度選擇24個樣品),分別過濾富集250 mL樣品中的微生物,將濾膜置于100 mL TSB肉湯培養基中(36±1) ℃增菌培養22 h,采用FCM法檢測增菌后的微生物水平,每個樣品分別上機檢測2次,并與濾膜法的定性檢測結果對比,進行統計學分析。
1.3 數據處理
運用McNemar的Kappa統計分析1.2.8的檢測結果[16]。
2 結果與分析
2.1 蠟樣芽孢桿菌在不同基質中FCM法和平板法檢測結果的一致性研究
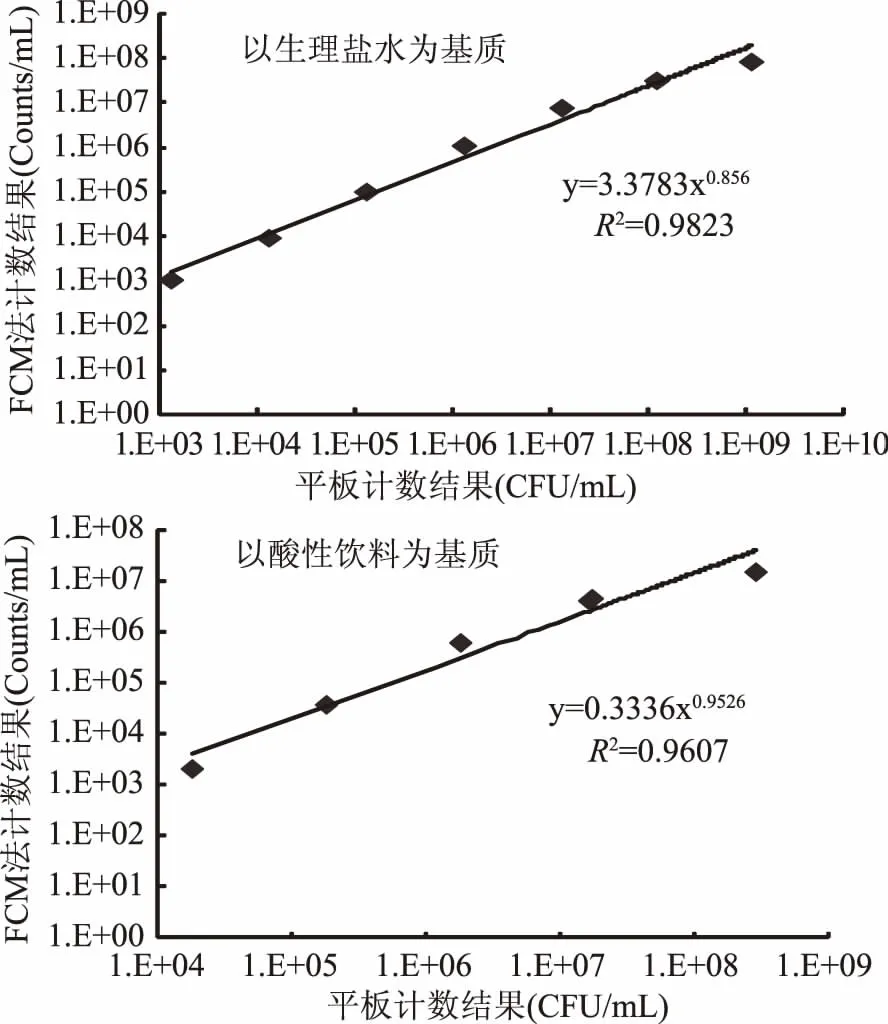
圖1 FCM法和平板法檢測不同基質中蠟樣芽孢桿菌結果的線性關系Fig.1 The linearity of FCM and pour plate methods to test bacillus cereus in different substrates
FCM法與平板法檢測不同基質中蠟樣芽孢桿菌(G)結果的線性關系如圖1所示。以生理鹽水為基質,蠟樣芽孢桿菌有1×103、1×104、1×105、1×106、1×107、1×108和1×109CFU/mL七個濃度梯度,平板法和FCM法檢測結果的線性關系為R2=0.9823>0.95;以酸性飲料基質,蠟樣芽孢桿菌有1×105、1×106、1×107、1×108和1×109CFU/mL五個濃度梯度,平板法和FCM法檢測結果的線性關系為R2=0.9607>0.95。說明在酸性飲料和生理鹽水中兩種方法對于蠟樣芽孢桿菌菌濃度的檢測在一定濃度范圍內均具有較高的相關性,無顯著性差異,采用FCM法可以準確的檢出蠟樣芽孢桿菌。
2.2 不同基質對FCM法與平板法檢測13種實驗菌株菌濃度的影響
不同濃度13種(A~M)實驗菌株在酸性飲料中和生理鹽水中FCM法和平板法的檢測結果如表2所示。以生理鹽水為基質時,FCM法和平板法的計數結果表現出較高的一致性,除菌株E和G外平板法與FCM法檢測結果均在一個數量級上。以酸性飲料為基質時,其中C、D、E、F、H、I、L、M均不能被FCM法檢出,另A、B、G、J、K可以被平板法和FCM法檢出,但差異較大。一方面可能是由于酸性飲料基質成分會特異性的干擾部分菌株;另一方面可能是FCM的檢測限一般在102~103CFU/mL,對于低含菌量的樣品無法檢測出其初始菌濃度[17-18]。故針對含菌量低的酸性飲料可過濾富集后增菌培養,一方面排除基質的干擾[4],另一方面通過增菌培養達到FCM法的最低檢測限,以獲得與濾膜法或平板法更為一致的定性結果。
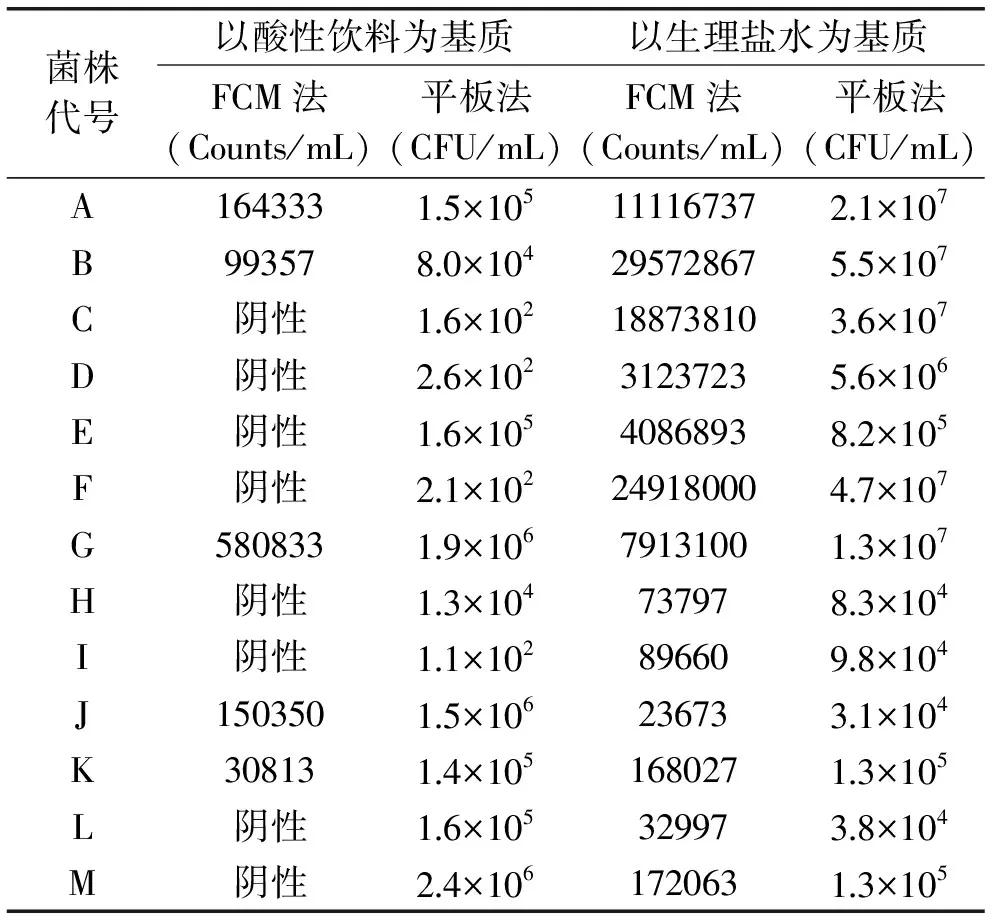
表2 FCM法與平板法檢測不同基質中13種實驗菌株的菌濃度結果對比Table 2 The results comparison of FCM and pour plate methods to detect 13 strains in different substrates
2.3 增菌時間對FCM法和平板法檢測低含菌量樣品菌濃度的影響
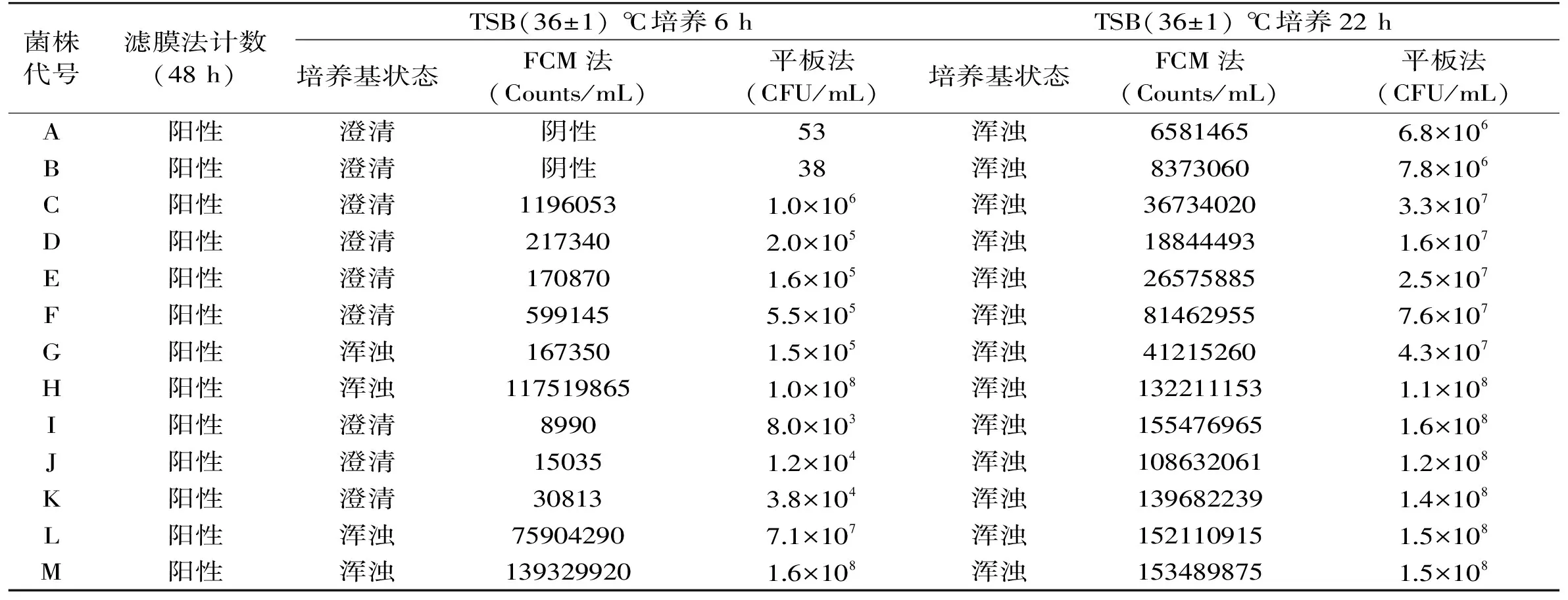
表3 酸性飲料中13種實驗菌株經增菌6 h和22 h后FCM法和平板法的檢測結果Table 3 The results of FCM and pour plate methods to detect 13 strains in acid beverage after proliferation for 6 h and 22 h
增菌時間對FCM法和平板法檢測低含菌量樣品菌濃度的影響如表3所示。初始菌液經濾膜法計數均為陽性,增菌6 h后,強壯類和愛媛類芽孢桿菌(A和B)可以被平板法檢出而不能被FCM法檢出,可能是由于強壯類和愛媛類芽孢桿菌生長分裂緩慢,故在培養6 h后含菌量還不足以達到FCM法的最低檢測限;當增菌時間延長至22 h,13種實驗菌株經FCM法檢測均能獲得與濾膜法一致的定性結果,且FCM法的定量檢測結果與平板法均在一個數量級,說明增菌22 h,可以獲得更為穩定的結果。
2.4 增菌時間對FCM法檢測強壯類和愛媛類芽孢桿菌菌濃度的影響
酸性飲料中不同濃度強壯類和愛媛類芽孢桿菌(A和B),經增菌0、6、22 h后,FCM法的檢測結果如表4所示。0 h時,FCM法檢測結果為陰性,顯示未檢出;增菌時間延長至6 h,部分FCM法檢測結果為陽性,與濾膜法的定性結果是一致的,但仍有部分FCM法檢測結果顯示陰性,說明部分菌株生長稍緩慢,在增菌6 h的情況下,菌株還未能繁殖至FCM法的最低檢測限,從而無法與濾膜法獲得一致的定性結果。當增菌時間延長至22 h,所有樣品的FCM法檢測結果均顯示陽性與濾膜法的定性結果一致,說明增菌時間達到22 h時,FCM法可替代濾膜法進行酸性飲料中強壯類和愛媛類芽孢桿菌的定性檢測。
2.5 濾膜法與增菌22 h后FCM法定性結果的統計學分析
對酸性飲料中低、中和高濃度的13種(A~M)實驗菌株進行濾膜法與FCM法檢測結果的定性對比研究。在增菌22 h的條件下,對于低、中和高濃度的13種實驗菌株FCM法與濾膜法表現出高度一致的定性結果,統計學分析見表5所示。在初始含菌量<1 CFU/250 mL的情況下,卡方值X2=1.5<3.84,FCM法的假陽性率=4.2%<9.6%,特異性=95.8%>90.4%;當初始含菌量在1~10 CFU/250 mL的范圍內時,卡方值X2=1.1<3.84,FCM法的假陰性率=1.9%<2%,靈敏度=98.1%>98%;當初始含菌量>10 CFU/250 mL時,靈敏度=100%>98%,無假陰性的結果。以上統計學分析[16]表明濾膜法與增菌22 h后FCM法的定性結果無顯著差異;在增菌22 h的條件下,FCM法可替代濾膜法進行酸性飲料中菌落總數的定性檢測,從而縮短檢測周期,加速產品放行。
注:a:每250 mL酸性飲料中含有的細菌總數的可能數;b:反應FCM法和達能濾膜法確認性結果相等的數量;c:樣品的數量;d:x2由NcNema定義為(|m-n|-1)2/(m+n),其中m等于FCM法的陽性樣本數和達能濾膜法的陰性樣本數,n等于FCM法的陰性性樣本數和達能濾膜法的陽性樣本數。x2值大于3.84表示顯著性差異為p<0.05。e:假陰性率為100-靈敏度;f:靈敏度定義為100乘以“已知”陽性測試樣品數除以“已知”樣品總數,“已知”指用參考方法確認;g:假陽性率為100-特異性;h:特異性定義為100乘以“已知”陰性測試樣品數除以“已知”樣品總數,“已知”指用參考方法確認。
3 結論
本研究采用FCM法替代濾膜法定性檢測低含菌量酸性飲料的菌落總數,通過添加不同類型的13種(A~M)實驗菌株進行驗證。模擬酸性飲料在不同濃度不同種類微生物污染的情況下,過濾富集菌于TSB肉湯中增菌培養一定時間,經FCM法檢測,并與平板法和濾膜法進行對比分析。結果表明:FCM法可替代濾膜法用于酸性飲料菌落總數的定性檢測從而加速產品放行。FCM法可短時間內出具產品的微生物分析結果,能夠對生產、運輸和庫存環節的微生物污染進行及時有效的控制而產生巨大的經濟效益[19],比濾膜法或平板法節省1 d的檢測時間。FCM法檢測成本高,因此應進一步加強試劑和耗材的研究和開發,降低檢測成本,從而使FCM法檢測菌落總數可以得到更為廣泛的運用;其次進一步縮短培養時間或運用FCM法對低含菌量酸性飲料中霉菌、酵母以及耐酸菌的檢測在食品飲料企業亦具有非常廣大的應用前景。
[1]何方洋,萬宇平,賈芳芳,等. 流式細胞儀在檢測食品中微生物的應用研究[J]. 山東畜牧獸醫,2016,37(8):82-84.
[2]潘洛安,張利華,張經. 應用流式細胞術測定水體異養細菌[J]. 海洋環境科學,2005,24(1):54-58.
[3]劉新星,霍轉轉,云慧,等. 流式細胞術在細菌快速檢測中的應用[J]. 微生物學通報,2014,41(1):161-168.
[4]劉道亮,胡連霞,趙占民. 流式細胞技術快速檢測果汁中的霉菌、酵母菌[J]. 食品工業科技,2011,32(3):387-391.
[5]王寧,劉寧. 流式細胞術快速檢測生乳中細菌總數[J]. 食品工業科技,2007,28(9):197-200.
[6]辛忠濤,薛沿寧,柳川. 流式細胞分選技術在微生物表面展示文庫篩選中的應用進展[J]. 微生物學免疫學進展,2003,31(3):62-65.
[7]董成霞. 流式細胞術在細菌快速檢測中的應用研究[J]. 中國衛生產業,2014(11):194-195.
[8]趙現方,陳林海,李宗義,等. 流式細胞術及其微生物學中的應用[J]. 河南農業科學,2005(6):5-9.
[9]張艷.流式細胞術在微生物檢測中的應用[J]. 醫療裝備,2011,24(5):33-35.
[10]李文華,胡茂志,嚴秋香,等. 流式細胞術在營養和食品衛生評價中的研究進展[J]. 安徽農業科學,2015,43(11):279-281.
[11]Broger T,Odermatt R P,Huber P,et al. Real time on-line flow cytometry for bioprocess monitoring[J].Journal of Biotechnology,2011,154(4):240-247.
[12]鄭海萍,李艷輝. 流式細胞儀的原理及應用[J]. 醫療器械,2003,16(3):286-286.
[13]孫娜,劉海洲,張捷,等. 濾膜法與國標法用于微生物檢驗的比較研究[J]. 化學與生物工程,2008,25(8):70-72.
[14]劉道亮,趙占民,胡連霞,等. 應用流式細胞技術快速檢測液態商品中的細菌總數[J]. 食品科學,2011,32(2):157-163.
[15]GB 4789.2-2016,食品微生物學檢驗菌落總數測定[S]. 北京:中國標準出版社,2016.
[16]李宏,雷質文. 食品微生物檢測方法確認和證實手冊[M].北京:中國標準出版社,2013:5-90.
[17]Gunasekera TS,Attfield PV,Veal DA. A flow cytometry method for rapid detection and enumeration of total bacteria in milk[J]. Applied and Environmental Microbiology,2000,66(3):1228-1232.
[18]李萍,溫平威,許恒毅,等. 流式細胞術在食源致病菌檢測中應用的研究進展[J]. 食品工業科技,2013,34(14):375-379.
[19]孫曉霞,趙占民,劉道亮,等. 應用流式細胞技術快速定量檢測UHT奶產品中的微生物[J]. 食品與發酵工業,2011,37(2):160-164.

