靶向加工番茄elF4E1的CRISPR/Cas9載體有效性驗證
付紫梅,袁 倫,邵冬南,郝小軍,崔百明,向本春
(1.石河子大學生命科學學院/石河子大學農業生物技術重點實驗室,新疆石河子 832003;2.威斯騰生物醫藥科技有限責任公司,重慶 400039;3.新疆綠洲農業病蟲害治理與植保資源利用自治區普通高校重點實驗室/石河子大學農學院,新疆石河子 832003)
0 引 言
【研究意義】新疆是我國最大的加工番茄種植基地,加工番茄作為新疆經濟的支柱性產業之一,對新疆經濟發展有著舉足輕重的影響[1]。然而病毒病害一直以來都是影響加工番茄產量和品質的限制性因素,馬鈴薯Y病毒(PotatoVirusY, PVY)是馬鈴薯 Y病毒屬(Potyviruses)的典型代表,同時也是感染新疆加工番茄的主要病毒種類之一[2]。利用基因工程的手段,從分子水平上培育新的抗病品種,是需要迫切解決的問題。【前人研究進展】CRISPR/Cas9(clustered regularly interspaced short palindromic repeat-associated protein9)作為繼鋅指核酸酶(Zinc-finger nucleases,ZFN)、轉錄激活因子樣效應子核酸酶(transcription activator-like effector nucleases,TALENs)之后的第三代基因組編輯技術,自2013年被報道以來,由于簡便、高效的特點,在動植物基因組編輯中被廣泛的應用[3-4],到目前為止,已在水稻、土豆、玉米、番茄等經濟作物功能基因的編輯中取得顯著成效[5-8]。Mccallum C M等[9]通過TILLING(Targeting Induced Local Lesions IN Genomes)技術靶向番茄eIF4E基因,獲得了抗PVY的eIF4E功能失活突變體。Mazier M等[10]通過RNA干擾的手段下調eIF4E1和eIF4E2基因,使得番茄植株對馬鈴薯Y病毒屬病毒獲得了更廣譜的抗性。然而利用新興的基因組編輯技術CRISPR/Cas9靶向編輯PVY抗病相關基因eIF4E1(eukaryotic translation initiation factors 4E),從分子水平上改良加工番茄品種的研究卻鮮有報道。【本研究切入點】翻譯起始因子是一個小的多基因家族,在功能上具有冗余[11],在番茄當中已鑒定出的3個成員,分別是eIF4E1、eIF4E2和eIF(iso)4E,其中eIF4E1和eIF4E2編碼eIF4E蛋白,eIF(iso)4E編碼eIF(iso)4E蛋白[12]。宿主細胞mRNA既能夠利用eIF4E的同時也能夠利用eIF(iso)4E來起始自身蛋白質的翻譯,在番茄當中,馬鈴薯Y病毒VPg(viral genome-linked protein,VPg)已經演變為特異性結合于eIF4E來幫助病毒蛋白的翻譯[10]。研究利用CRISPR/Cas9系統構建的特異性靶向編輯番茄真核翻譯起始因子elF4E1基因的表達載體,在阻礙了馬鈴薯Y病毒VPg與加工番茄eIF4E相互作用的同時為新疆加工番茄抗病品種的培育提供了新方法。【擬解決的關鍵問題】通過瞬時轉化的方法來快速驗證靶向eIF4E1基因的CRISPR-Cas9載體的有效性,為利用CRISPR-Cas9基因組編輯技術成功敲除eIF4E1基因,獲得抗PVY病毒非轉基因純合體植株提供技術支持。
1 材料與方法
1.1 材 料
1.1.1加工番茄
研究所用的加工番茄(Solanumlycopersicum)品種里格爾(87-5)購自石河子市亞心種業有限公司。
1.1.2菌株和質粒
大腸桿菌(Escherichiacoli)DH5α和根瘤農桿菌(Agrobacteriumtumefaciens)GV3101均為該實驗室-80℃保存菌種。
研究所用的CRISPR/Cas9系統相關載體Px330cas9由石河子大學生命科學學院胡圣偉老師饋贈。sgRNA表達框由上海生工生物工程股份有限公司合成并克隆到pUC19載體上。
1.2 方 法
1.2.1引物設計
根據eIF4E1靶序列設計合成引物sg_4E1_1S/sg_4E1_1A,根據hcas9序列設計合成引物hCas9-S/ hCas9-A,根據eIF4E1基因序列設計檢測引物DT_Sl4E1_F/ DT_Sl4E1_R。根據載體骨架設計引物Colony-F/ Colony-F,用于轉化后單克隆的菌斑PCR鑒定實驗。
表1實驗中所用引物
Table1Sequences of primers used in this study
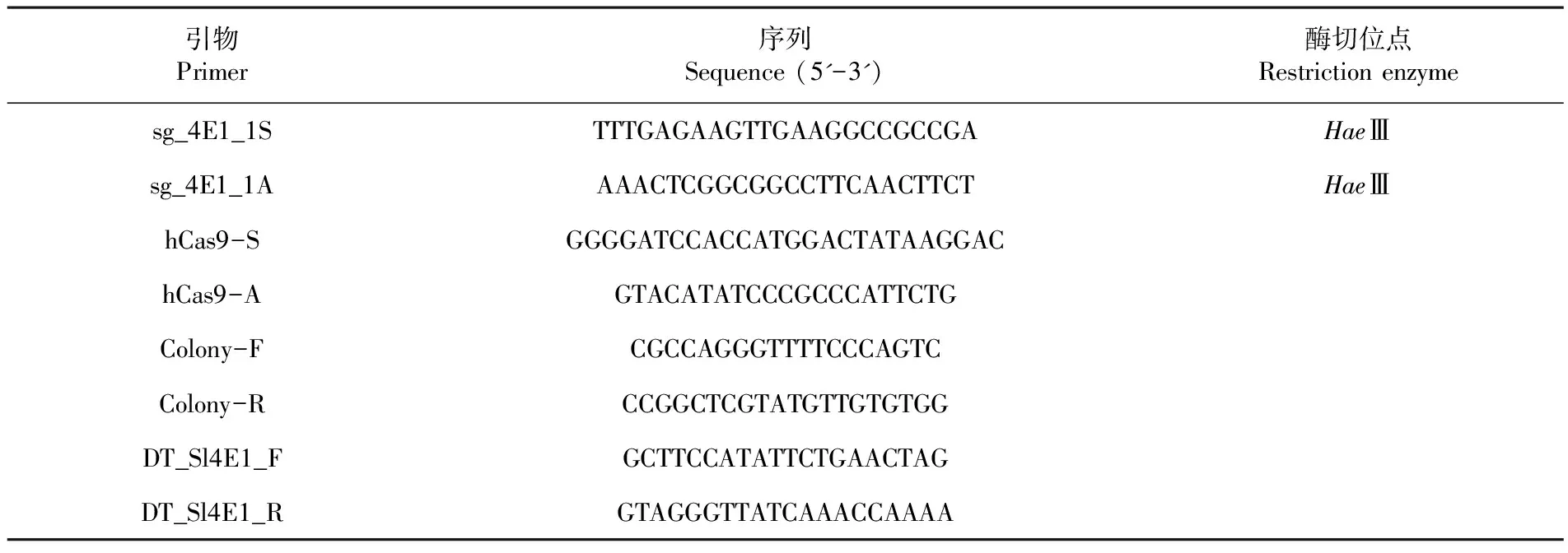
引物Primer序列Sequence(5'-3')酶切位點Restrictionenzymesg_4E1_1STTTGAGAAGTTGAAGGCCGCCGAHaeⅢsg_4E1_1AAAACTCGGCGGCCTTCAACTTCTHaeⅢhCas9-SGGGGATCCACCATGGACTATAAGGAChCas9-AGTACATATCCCGCCCATTCTGColony-FCGCCAGGGTTTTCCCAGTCColony-RCCGGCTCGTATGTTGTGTGGDT_Sl4E1_FGCTTCCATATTCTGAACTAGDT_Sl4E1_RGTAGGGTTATCAAACCAAAA
1.2.2靶序列選取
從NCBI數據庫中下載eIF4E1基因序列 (NC015440),利用Vector軟件在基因編碼區的5'端找到NGG序列,即PAM(protospacer adjacent motifs),研究表明,番茄eIF4E1基因全長 3 340 bp,共含有5個外顯子和4個內含子,根據CRISPR/Cas9系統的特異性切割原則,在綜合考慮靶位點選取過程中的GC含量、鑒定過程中酶切位點的選取以及靶序列最好位于基因序列的5'等因素的情況下。研究的靶序列位于加工番茄eIF4E1基因距轉錄起始位點46 bp的第一個外顯子上(含HaeⅢ酶切位點),并將其命名為sgR-eIF4E1:GAGAAGTTGAAGGCCGCCGA。圖1

圖1加工番茄eIF4E1基因靶序列示意
Fig.1The structural diagram of the Solanum lycopersicum eIF4E1 locus targeted for editing
1.2.3載體構建
將上海生工生物工程股份有限公司合成的sgRNA表達框(含番茄U6啟動子)克隆到pUC19載體上,將其命名為pUC-sgRNA。以Px330為模板,hcas9-S/hcas9-A為引物進行PCR擴增,擴增產物通過NcoⅠ/BstEⅡ克隆到pCAMBIA1302載體上,通過EcoRV酶切驗證后,命名為p1302-Cas9。通過引物退火的方式將sg_4E1_1S/sg_4E1_1A結合成帶粘性末端的雙鏈DNA片段后通過AarI酶克隆到pUC-sgRNA載體上,將其命名為pUC-SgR-eIF4E1。pUC-SgR-eIF4E1和p1302-Cas9載體分別用EcoRⅠ/HindⅢ雙酶切,膠回收預期大小一致的片段,4℃過夜連接并轉化大腸桿菌(DH5α)后,選取陽性克隆送北京華大基因公司測序驗證。并將其命名為p1302-sgR-Cas9-eIF4E1。測序正確的p1302-sgR-Cas9-eIF4E1質粒電擊轉化農桿菌GV3101,選取陽性克隆于 -80℃甘油管中保存備用。表1,圖2

圖2植物表達載體p1302-sgRNA-Cas9-eIF4E1結構示意
Fig.2The structural diagram of the Plant expression vector p1302-sgRNA-Cas9-eIF4E1
1.2.4農桿菌介導番茄瞬時轉化
1.2.4.1無菌苗種植
超凈工作臺中,將番茄種子用 2% 的次氯酸鈉消毒 15 min,期間不停地搖晃,無菌水沖洗7~8次,用無菌鑷子將種子接種于1/2MS培養基,28℃、黑暗條件下培養2 d,待種子發芽后,28℃、長日照下(光照16 h/黑暗8 h)培養至7~8片真葉備用。
1.2.4.2農桿菌侵染液制備
取上述 -80℃甘油管中保存的農桿菌(含重組質粒p1302-sgR-Cas9-eIF4E1),在固體LB培養基(含50 mg/L卡那霉素;50 mg/L慶大霉素;25 mg/L利福平)上劃線,做好標記。28℃、黑暗條件下倒置培養2 d,挑取單斑,接種于液體LB培養基(含50 mg/L卡那霉素;50 mg/L慶大霉素;25 mg/L利福平)中,28℃,220 r/min培養2 d。將活化的菌液以1∶10的比例轉移至液體LB培養基(含50 mg/L卡那霉素;50 mg/L慶大霉素;25 mg/L利福平),28℃擴大培養16~24 h至菌體生長至穩定期,OD600值為1.5。室溫,4 000 g,離心 10 min,收集菌體。用1體積現配的5%蔗糖溶液懸浮菌體至無菌萌發盒中,用前加入10 μL Silwet L-77(終濃度為0.002%)。
1.2.4.3瞬時轉化過程
在工作臺內將無菌苗平放于含有農桿菌浸染液的萌發盒中,蓋上蓋。將含有菌液及番茄植株的萌發盒用隔膜真空泵在0.05 Mpa的壓力下抽真空4 min。用鑷子從萌發盒中取出植株放入另一個無菌萌發盒中,蓋上蓋,抖動,使植株表面過多的菌液滴下并用衛生紙吸干表面殘余的菌液。20~25℃、黑暗條件下過夜培養后轉移至1/2MS(含 300 mg/L羧芐霉素)固體培養基中,28℃、長日照下(光照16 h/黑暗8 h)培養生長。
1.2.5靶序列突變檢測
以CTAB法提取的葉片基因組DNA為模版, DT_Sl4E_F和DT_Sl4E_R為引物, 94℃預變性5 min,94℃變性30 s,53℃退火30 s,72℃延伸45 s,30個循環后,72℃再延伸5 min。PCR擴增加工番茄含靶序列的eIF4E1基因部分片段。將PCR產物用回收試劑盒回收純化后,HaeⅢ進行酶切,膠回收試劑盒回收未切開的片段與pGEM-T進行連接,連接產物轉化DH5α后,用DT_Sl4E_F和DT_Sl4E_R引物(表1)進行菌斑PCR鑒定,隨機挑取陽性克隆穿刺管送至北京華大生物公司測序。根據單克隆測序結果來比對分析靶序列的編輯情況。
2 結果與分析
2.1 載體的構建
利用PstⅠ酶切鑒定已構建的p1302-Cas9載體(圖3A),得到9 512、1 682、1 422、1 212和24 bp大小的6條帶,其特征性條帶1 682、1 422和1 212 bp與預期大小一致。以sg_4E_1S和Colony-R為引物進行菌斑PCR來鑒定中間載體pUC-SgR-eIF4E1重組子,得到預期大小為150 bp的目標條帶。利用特異性引物sg_4E_1A和Colony-R(表1)進行菌斑PCR鑒定植物表達載體p1302-sgR-Cas9-eIF4E1重組子,得到預期大小為374 bp的目標條帶,并對陽性克隆測序驗證,序列比對結果表明,p1302-sgR-Cas9-eIF4E1載體構建成功,其中sgR-eIF4E1靶序列的表達框含有番茄U6啟動子,用以特異性識別和結合靶序列。Cas9表達框含有花椰菜花葉病毒(CaMV)的35S啟動子和終止子,用以對靶序列進行特異性切割。提取p1302-sgR-Cas9-eIF4E1載體質粒,電擊轉化農桿菌GV3101,對轉化的菌斑進行菌斑PCR驗證,得到預期大小為374 bp的電泳條帶(圖3B),說明載體質粒成功轉化農桿菌GV3101,可用于后續的瞬時轉化實驗。表1,圖3

注:A:p1302-Cas9載體的PstⅠ酶切鑒定; M:DL15000;P:p1302-Cas9/PstⅠ; B:菌落PCR鑒定RISPR/Cas9重組載體轉化的農桿菌菌落;M:DL2000;N:空白對照;G:GV3101,陰性對照;1~4:重組載體菌落;P:p1302-sgRNA-Cas9-eIF4E1質粒,陽性對照
Note: A:Restriction enzyme digestion of thep1302-Cas9; B:PCR verification ofAgrobacteriumtumefacienscolonies transformed with CRISPR/Cas9 recombinant vecter; M:DL2000 marker; N: Blank control; G:GV3101, negative control; 1-4: Recombinant vecterAgrobacteriumtumefacienscolony; P:p1302-sgRNA-Cas9-eIF4E1 plasmid, positive control
圖3靶向eIF4E1基因載體構建
Fig.3Construction of CRISPR-Cas9 vectors targeting eIF4E1 gene
2.2 靶序列突變檢測
以瞬時轉化加工番茄植株和野生型加工番茄植株的基因組DNA為模板, DT_Sl4E_F和DT_Sl4E_R為引物,擴增包含靶序列的加工番茄eIF4E1基因部分片段,擴增結果(圖4A),所有擴增樣品均出現了與預期大小一致的408 bp的條帶,PCR產物回收純化后用HaeⅢ進行酶切(圖3B),研究表明,2個瞬時轉化植株相對于野生型對照均出現了HaeⅢ未切開的408 bp的條帶,表明這兩個植株中都有部分細胞被編輯。膠回收未切開的408 bp大小的條帶與pGEM-T進行連接,連接產物轉化DH5α后,隨機挑取11個克隆,用DT_Sl4E_F和DT_Sl4E_R引物(表1)進行菌斑PCR鑒定(圖4C),這11個克隆中有9個為陽性克隆。隨后將這9個陽性克隆穿刺管送至北京華大生物公司測序。表1,圖4

注:A:靶序列處eIF4E1基因片段的PCR擴增;B:HaeⅢ對PCR產物的酶切篩選;C:單克隆菌斑PCR鑒定;M:DL1000 marker;N:空白對照;W:陰性對照;P:陽性對照
Note: A: PCR amplification ofeIF4E1 gene fragment around the target sequence; B: The screening of PCR products byHaeⅢ; C: The PCR identification of Monoclonal plaque; M: DL1000 marker; N: Blank control; W: Negative control; P: Positive control
圖4靶序列突變檢測
Fig.4The mutation detection of target sequence
2.3 測序結果比對
將這9個克隆的靶位點處的核苷酸序列和氨基酸序列分別與野生型進行了比對,核苷酸序列比對結果(圖5A),9個陽性克隆在PAM上游的第6~8個核苷酸處均發生突變,并且所有的突變均為單堿基的替換。相對應的靶位點處的氨基酸序列比對結果(圖5B),研究表明,除6號克隆的氨基酸序列沒有改變外,2、7、8、10、11號克隆靶位點處的丙氨酸被纈氨酸所替換,1和4號克隆靶位點處的丙氨酸被天冬氨酸替換,9號克隆的丙氨酸被蘇氨酸替換。圖5

注:A:核苷酸序列比對結果 (淺灰色為突變堿基位置);B:氨基酸序列比對結果(淺灰色為氨基酸突變區)
Note: A: The comparison results of the nucleotide sequence (Light gray marks the location of base mutation); B: The comparison results of the amino acid sequence (Light gray marks the region of amino acid)
圖5靶位點區域核苷酸序列與氨基酸序列比對結果
Fig.5The comparison results of the nucleotide sequence and amino acid sequence at target region
3 討 論
CRISPR/Cas9基因組編輯系統來源于細菌和古細菌,是自然界普遍存在于原核生物的一種免疫防衛系統,通過激活適應性免疫應答來抵抗質粒DNA或病毒的入侵[13]。經過人工改造后的Ⅱ型RISPR/Cas9系統在編輯過程中,sgRNA通過和靶序列的堿基配對結合到DNA上后引導Cas9核酸內切酶結合并識別靶序列下游的PAM(protospacer adjacent motifs)基序,在PAM上游約3 bp處切割DNA雙鏈,形成平端的DNA雙鏈斷裂(double strand break,DSB),DSB在通過同源重組(homology-directed repair,HDR)和非同源性末端連接(non-homologous end joining,NHEJ)進行修復的過程中。形成靶序列處堿基的替換、插入或刪除,從而形成對DNA靶位點基因編輯[14-16]。 測序結果顯示所獲得的9個陽性單克隆突變情況均為單堿基的替換,這與潘洪杏等[17]利用CRISPR/Cas9 系統定向敲除煙草eIF4E-6 基因后的編輯情況基本一致。推測可能是因為eIF4E1作為翻譯起始因子對植物自身生長比較重要,在Cas9蛋白酶切割DNA雙鏈后,植物出于一種防御反應優先利用同源重組來進行修復,從而出現單堿基替換的突變方式。
為了驗證利用CRISPR/Cas9基因組編輯技術構建的靶向eIF4E1基因載體的有效性,研究采用了真空滲透的瞬時轉化方法來對編輯情況進行評估。HaeⅢ酶切鑒定結果和序列比對結果都表明研究所采取的瞬時轉化方案是可行的,這相對于采用PEG介導的原生質體的瞬時轉化方法更加的方便快捷[18],所以實驗所采用的瞬時轉化方法可應用于CRISPR/Cas9 系統遺傳轉化之前的靶序列評估實驗,為CRISPR/Cas9 系統在后續番茄品種改良過程中更加精準的編輯提供了方便。
4 結 論
研究利用真空滲透的瞬時轉化方法對基于CRISPR/Cas9 系統構建的p1302-sgRNA-Cas9-eIF4E1植物表達載體進行了驗證。從HaeⅢ酶切檢測結果可以看出,未切開的408 bp條帶較亮,說明這兩個植株中被編輯的細胞較多,這表明利用CRISPR/Cas9系統構建的靶向編輯eIF4E1基因的載體的編輯效率較高。所獲得的9個單克隆的序列比對結果表明,所有測序克隆在PAM上游6~8 bp的堿基處發生了單堿基的替換,氨基酸比對結果發現,有8個克隆在相同的位點出現了單個氨基酸的突變,表明研究構建的p1302-sgRNA-Cas9-eIF4E1能夠特異性的靶向加工番茄eIF4E1。這為后續CRISPR/Cas9系統在加工番茄品種改良過程中的成功應用提供了技術支持。
參考文獻(References)
[1] 姚彤,陳豐.新疆成為亞洲最大的番茄生產和加工基地[J].大陸橋視野,2012,(15):74-75.
YAO Tong, CHEN Fen. (2012). Xinjiang becomes Asia's largest Tomato production and processing Base [J].NewSilkRoadHorizon, (15):74-75. (in Chinese)
[2] 都業娟,石寶萍,李成亮,等.加工番茄病毒病田間發生情況及毒原的分子檢測[J].植物保護, 2013, 39(4):110-115.
DU Ye-juan, SHI Bao-ping, LI Cheng-liang, et al. (2013). Incidence and molecular detection of virus on processing tomato in the field [J].PlantProtection, 39(4):110-115. (in Chinese)
[3] 瞿禮嘉,郭冬姝,張金喆,等.CRISPR/Cas系統在植物基因組編輯中的應用[J].生命科學,2015,27(1):64-70.
QU Li-jia, GUO Dong-shu, ZHANG Jin-zhe, et al. (2015). The application of CRISPR/Cas system in plant genome editing [J].ChineseBulletinofLifeSciences, 27(1):64-70. (in Chinese)
[4] 解莉楠,宋鳳艷,張旸.CRISPR/Cas9系統在植物基因組定點編輯中的研究進展[J].中國農業科學,2015,48(9):1 669-1 677.
XIE Li-nan, ZONG Fen-yan, ZHANG Yang. (2015). Progress in Research of CRISPR/Cas9 System in Genome Targeted Editing in Plants [J].ScientiaAgriculturaSinica, 48(9):1,669-1,677. (in Chinese)
[5] Endo, M., Mikami, M., & Toki, S. (2015). Multigene knockout utilizing off-target mutations of the crispr/cas9 system in rice.Plant&CellPhysiology, 56(1): 41.
[6] Andersson, M., Turesson, H., Nicolia, A., F?lt, A. S., Samuelsson, M., & Hofvander, P. (2017). Efficient targeted multiallelic mutagenesis in tetraploid potato (solanum tuberosum) by transient crispr-cas9 expression in protoplasts:.PlantCellReports, 36(1): 1-12.
[7] Qi, W., Zhu, T., Tian, Z., Li, C., Zhang, W., & Song, R. (2016). High-efficiency crispr/cas9 multiplex gene editing using the glycine trna-processing system-based strategy in maize:BMCBiotechnology, 16(1): 58.
[8] Ron, M., Kajala, K., Pauluzzi, G., Wang, D., Reynoso, M. A., & Zumstein, K., et al. (2014). Hairy root transformation using agrobacterium rhizogenes as a tool for exploring cell type-specific gene expression and function using tomato as a model.PlantPhysiology, 166(2): 455.
[9] Mccallum, C. M., Comai, L., Greene, E. A., & Henikoff, S. (2000). Targeting induced local lesions in genomes (tilling) for plant functional genomics.PlantPhysiology, 123(2): 439.
[10] Mazier, M., Flamain, F., Nicoa?, M., Sarnette, V., & Caranta, C. (2011). Knock-down of botheif4e1 andeif4e2 genes confers broad-spectrum resistance against potyviruses in tomato.PlosOne, 6(12): e29595.
[11] Duprat, A., Caranta, C., Revers, F., Menand, B., Browning, K. S., & Robaglia, C. (2002). The arabidopsis eukaryotic initiation factor (iso)4e is dispensable for plant growth but required for susceptibility to potyviruses.PlantJournal, 32(6): 927-934.
[12] Piron, F., Nicola?, M., Mino?a, S., Piednoir, E., Moretti, A., & Salgues, A., et al. (2010). An induced mutation in tomato eif4e leads to immunity to two potyviruses.PlosOne, 5(6): e11313.
[13] Barrangou, R., Fremaux, C., Deveau, H., Richards, M., Boyaval, P., & Moineau, S., et al. (2007). Crispr provides acquired resistance against viruses in prokaryotes.Science, 315(5819): 1,709.
[14] Cong, L., Ran, F. A., Cox, D., Lin, S., Barretto, R., & Habib, N., et al. (2013). Multiplex genome engineering using crispr/cas systems.TrendsinGeneticsTig, 32(12): 815.
[15] Ma, X., Zhu, Q., Chen, Y., & Liu, Y. G. (2016). Crispr/cas9 platforms for genome editing in plants: developments and applications.MolecularPlant, 9(7): 961-974.
[16] Jing, R. C., & Hong, L. U. (2016). The development of crispr/cas9 system and its application in crop genome editing.ScientiaAgriculturaSinica.
[17] 潘洪杏,劉俠,萬秀清,等.利用CRISPR-Cas9基因組編輯技術定向敲除煙草eIF4E-6基因[J].分子植物育種, 2017,(2):538-544.
PAN Hong-xing, LIU Xia, WAN Xiu-qing, et al. (2017). Directional Knockout ofeIF4E-6 Gene Using CRISPR-Cas9 Genome Editing Technique [J].MolecularPlantBreeding, 15(2):538-544. (in Chinese)
[18] Xing, H. L., Dong, L., Wang, Z. P., Zhang, H. Y., Han, C. Y., & Liu, B., et al. (2014). A crispr/cas9 toolkit for multiplex genome editing in plants.BmcPlantBiology, 14(1): 327.

