堿性蛋白酶水解雞血清蛋白制備ACE抑制肽的研究
師小飛,李明生
(西北民族大學生命科學與工程學院,甘肅蘭州 730030)
0 引言
隨著我國家禽養殖業的快速發展,我國每年宰殺肉雞量已超過1×109只,每只雞的血液含量為90 g左右,而這些雞血通常作為廢棄物排放,并未得到有效利用,不僅浪費資源,而且容易污染環境[1-2]。雞血富含蛋白質、氨基酸、脂肪、維生素、無機鹽、微量元素、酶類及其他生物活性物質,具有很高的營養價值,應用前景廣闊[3-5]。近年來,利用動物血液為原料制備抗氧化肽[6-8]、抗菌肽[9-11]、ACE抑制肽[12-13]等生物活性多肽的研究越來越多,為動物血液資源的綜合利用提供了一條新途徑,但利用雞血清制備ACE抑制肽的研究卻鮮有報道。試驗采用堿性蛋白酶水解雞血清蛋白制備ACE抑制肽,通過單因素試驗對其工藝條件進行優化,為雞血資源在功能性食品及醫藥方面的利用提供理論基礎。
1 材料與方法
1.1 材料
1.1.1 試驗材料
雞血清蛋白:新鮮雞血采取于甘肅省蘭州市榆中縣,提取血清蛋白后經真空冷凍干燥,于-20℃條件下保存待用。
1.1.2 試劑
堿性蛋白酶(150 000 U/g),北京中生瑞泰科技有限公司提供;馬尿酰-組氨酰-亮氨酸(HHL),美國Sigma公司提供;血管緊張素轉化酶(ACE),于市售新鮮豬肺中提取;茚三酮、酪氨酸、鹽酸、乙酸乙酯、氫氧化鈉、乙酸酐、吡啶等其他試劑,均為國產分析純。
1.1.3 儀器與設備
PB-10型便攜式臺式酸度計,北京格拉威爾公司產品;JA2003N型電子天平,上海天平儀器廠產品;UV2000型紫外可見分光光度計,龍泥柯儀器有限公司產品;TCL-16M型高速臺式冷凍離心機,湖南湘儀離心機儀器有限公司產品;WS28型電熱恒溫水浴鍋,西安禾普生物科技有限公司產品。
1.2 試驗方法
1.2.1 雞血清蛋白酶解液的制備
稱取適量的雞血清蛋白粉,加入100 mL雙蒸水溶解,配制成一定濃度的雞血清蛋白溶液,調節pH值至一定數值,按照一定的比例加入堿性蛋白酶,在特定溫度下水解一定時間,之后于95℃恒溫下水浴滅酶15 min,冷卻至室溫后,過濾,得到濾液待用。
1.2.2 雞血清蛋白水解度的測定
采用茚三酮比色法[14]測定雞血清蛋白水解度(Degree of Hydrolysis,DH),公式如下:
不過說實話,呼倫對專家并不抱多大希望。他要寫成這篇文章,其實還是虛榮心在做怪。三萬字啊,多大的篇幅!拿給同事們看,他們從此還不得高看他呼倫一眼?——何況還有稿費。——何況還能給單調的日子找些事做。——何況還是國內空白。——何況,還真的有可能成為專家。

式中:A0——水解前雞血清蛋白溶液本身含有的游離氨基酸數,mmol;
A1——雞血清蛋白完全酸水解后含有的游離氨基酸數,mmol;
A2——雞血清蛋白酶解液含有的游離氨基酸數,mmol。
1.2.3 雞血清多肽ACE抑制率的測定
采用高丹丹等人[15]的方法測定雞血清多肽的ACE抑制率。取0.1 mL 5.0 mmol/L的HHL溶液于離心管中,加入0.1 mL雞血清蛋白酶解液,混勻,再加入0.1 mL ACE酶液,于37℃條件下反應1 h,然后立即加入0.25 mL 1.0 mol/L的鹽酸終止反應,振蕩2 min后靜置;之后加入1.5 mL乙酸乙酯,并劇烈振蕩以萃取反應生成的馬尿酸,于5 000 r/min轉速下離心10 min;吸取1.0 mL含有馬尿酸的乙酸乙酯于另一個新離心管中,再往新離心管中加入1.0 mL乙酸酐、2.0 mL 0.5%DAB顯色劑,于40℃條件下顯色30 min,之后測定其在459 nm處的OD值,并根據以下公式計算:

式中:A——用雙蒸水代替雞血清蛋白酶解液所測得的OD值;
S——添加雞血清蛋白酶解液所測得的OD值;
C——添加乙酸乙酯、乙酸酐和顯色劑的參比OD值。
1.2.4 單因素試驗
以雞血清蛋白的水解度及其酶解液的ACE抑制率為指標,在pH值為8.0,底物質量分數6%,酶與底物濃度比6 000 U/g,時間3 h的條件下,研究不同溫度(分別為40,45,50,55,60℃) 對水解效果的影響;在溫度50℃,底物質量分數6%,酶與底物濃度比6 000 U/g,時間3 h的條件下,研究不同pH值(分別為7.0,7.5,8.0,8.5,9.0) 對水解效果的影響;在溫度50℃,pH值8.0,酶與底物濃度比為6 000 U/g,時間3 h的條件下,研究不同底物質量分數(分別為2%,4%,6%,8%,10%)對水解效果的影響;在溫度50℃,pH值8.0,底物質量分數6%,時間3 h的條件下,研究不同酶與底物濃度比 (分別為 4 000,5 000,6 000,7 000,8 000 U/g)對水解效果的影響;在溫度50℃,pH值8.0,底物質量分數6%,酶與底物濃度比為6 000 U/g的條件下,研究不同時間(分別為1,2,3,4,5 h) 對水解效果的影響。
2 結果與分析
2.1 溫度對水解效果的影響
溫度對水解效果的影響見圖1。

圖1 溫度對水解效果的影響
由圖1可知,在40~60℃,隨著溫度升高,其ACE抑制率和水解度均先增大后減小,在50℃達到最大值,分別為57.53%±0.98%和15.07%±0.72%,此時水解效果最好。這是因為溫度對酶促反應效率影響顯著,每種蛋白酶都有最適反應溫度。一方面,當溫度低于最適反應溫度時,隨著溫度的升高,酶活性增強,酶促反應速率加快,水解效果也隨之變好;另一方面,當溫度高于最適反應溫度時,隨著溫度的繼續升高,酶蛋白會慢慢發生變性,酶活性減弱,酶促反應速率減慢,水解效果也隨之變差[16]。因此,50℃為堿性蛋白酶水解雞血清蛋白制備ACE抑制肽的最適反應溫度。
2.2 pH值對水解效果的影響
pH值對水解效果的影響見圖2。
由圖2可知,其ACE抑制率和水解度隨著pH值的升高,呈現出先增大后減小的趨勢,且在pH值為8.0時,具有最好的水解效果,分別達到56.84%±0.80%和15.70%±0.67%,pH值低于或高于8.0,其ACE抑制率和水解度均有不同程度的降低。這是因為每一種蛋白酶根據自身特性的不同,都有最適合的反應pH值,在此條件下,反應底物可以與蛋白酶的催化活性中心充分結合,從而使蛋白酶最大限度地發揮其催化作用,得到更多的目標水解產物,pH值過高或過低,位于蛋白酶催化活性部位的可解離基團都不能得到充分解離,其催化活性都會受到一定程度的抑制[17]。因此,確定8.0為堿性蛋白酶水解雞血清蛋白制備ACE抑制肽的最適pH值。

圖2 pH值對水解效果的影響
2.3 底物質量分數對水解效果的影響
底物質量分數對水解效果的影響見圖3。
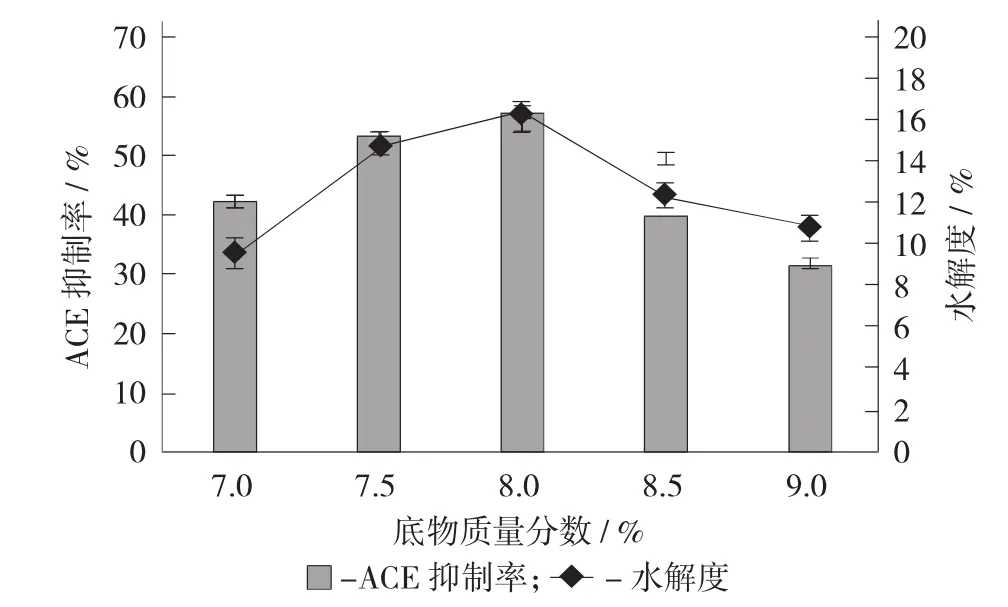
圖3 底物質量分數對水解效果的影響
由圖3可知,在底物質量分數為2%~6%時,其ACE抑制率和水解度隨著底物質量分數的增大逐漸升高,在底物質量分數為6%時,達到最大值,分別為57.86%±0.65%和16.29%±0.41%,之后隨著底物質量分數的繼續增大,其ACE抑制率和水解度則呈現出下降趨勢。這是因為一方面當底物質量分數過低時,過量蛋白酶的存在反而會抑制酶促反應的充分進行,從而導致水解效果變差;另一方面當底物質量分數過高時,溶液過于黏稠,蛋白酶的催化作用受到抑制,從而也會導致水解效果變差。因此,確定堿性蛋白酶水解雞血清蛋白制備ACE抑制肽的最適底物質量分數為6%。
2.4 酶與底物濃度比對水解效果影響
酶與底物濃度比對水解效果的影響見圖4。
由圖4可知,當酶與底物濃度比低于6 000 U/g時,隨著蛋白酶用量的增加,其ACE抑制率和水解度均呈現出增大的趨勢,此后隨著酶與底物濃度比繼續增大,水解度緩慢上升,但增長速率明顯降低,而ACE抑制率則略有下降。這是因為在一定的范圍內,隨著酶用量的增加,酶促反應速率加快,水解效果逐漸變好,而當加酶量超出一定范圍后,蛋白酶的量慢慢趨于飽和,底物的量也逐漸略顯不足,此時繼續增加蛋白酶用量對水解度不會產生顯著影響,而ACE抑制率略有下降,可能是因為目標產物在過量的蛋白酶的作用下發生進一步水解造成的。因此,確定6 000 U/g為堿性蛋白酶水解雞血清蛋白的最適酶與底物濃度比,此時其ACE抑制率和水解度分別為56.08%±0.19%和16.22%±0.86%。

圖4 酶與底物濃度比對水解效果的影響
2.5 時間對水解效果的影響
時間對水解效果的影響見圖5。

圖5 時間對水解效果的影響
由圖5可知,水解度隨著反應時間的延長逐漸增大,但3 h之后增長速率明顯下降,ACE抑制率在4 h之前隨著時間的延長呈現出上升趨勢,之后略有降低。這是因為隨著酶促反應時間的延長,底物濃度逐漸變小,產物濃度逐漸變大,兩者之間的競爭性抑制作用逐漸變強,酶的活性也逐漸降低[6]。因此,考慮到節約時間和能源,確定堿性蛋白酶水解雞血清蛋白制備ACE抑制肽的最佳反應時間為4 h,此時其ACE抑制率和水解度分別為63.07%±0.69%和17.22%±0.31%。
3 結論
采用堿性蛋白酶水解雞血清蛋白制備ACE抑制肽,以ACE抑制率和水解度為評價指標,通過單因素試驗研究了溫度、pH值、底物質量分數、酶與底物濃度比、時間對水解效果的影響,確定了堿性蛋白酶水解雞血清蛋白制備ACE抑制肽最佳工藝條件為溫度50℃,pH值8.0,底物質量分數6%,酶與底物濃度比6 000 U/g,時間4 h,此反應條件下其ACE抑制率和水解度分別為63.07%±0.69%和17.22%±0.31%。通過單因素試驗得到了堿性蛋白酶水解雞血清蛋白制備ACE抑制肽的最佳工藝條件,為雞血資源的綜合利用提供新途徑,為雞血清蛋白ACE抑制肽的開發提供理論基礎。
參考文獻:
[1]曾利平,周紅,李俊田,等.雞血酶解工藝條件的研究 [J].食品與發酵科技,2010,46(2):77-80.
[2]應月,王琴,區子弁,等.雞血清蛋白的提取及其乳化性初探 [J].食品工業科技,2011,32(6):306-308.
[3]Marquez E,Bracho M,Archile A,et al.Proteins,isoleucine,lysine and methionine content of bovine,porcine and poultry blood and their fractions[J].Food Chemistry,2005(3):503-505.
[4]Zheng Z,Si D,Ahmad B,et al.A novel antioxidative peptide derived from chicken blood corpuscle hydrolysate[J].Food Research International,2018 (1):410-419.
[5]Beikot Z, Penczyńska E.Eating value of chicken blood[J].Medycyna weterynaryjna,2002,58 (3):208-210.
[6]高丹丹,蘭家國,趙佩佩,等.中性蛋白酶水解藏羊血清蛋白制備抗氧化肽的研究 [J].食品工業科技,2015(15):229-233,238.
[7]牟雪姣,張強,邢靜.雞血紅蛋白抗氧化肽的制備工藝研究 [J].農產品加工,2009(3):54-56.
[8]Chang C Y,Wu K C,Chiang S H.Antioxidant properties and protein compositionsofporcine haemoglobin hydrolysates[J].Food Chemistry,2007(4):1 537-1 543.
[9]胡鳳姣.雞血源抗菌肽分離鑒定及其生物活性的研究[D].北京:中國農業大學,2017.
[10]Nedjararroume N, Duboisdelval V, Miloudi K, et al.Isolation and characterization of four antibacterial peptides from bovine hemoglobin[J].Peptides,2006,27 (9):2 082-2 089.
[11]Adje E Y,Balti R,Kouach M,et al.Obtaining antimicrobial peptides by controlled peptic hydrolysis of bovine hemoglobin[J].International Journal of Biological Macromolecules,2011,49 (2):143-153.
[12]Guang C,Phillips R D.Purification,activity and sequence of angiotensin I converting enzyme inhibitory peptide from alcalase hydrolysate of peanut flour[J].J Agric Food Chem,2009,57(21):10 102-10 106.
[13]Yu Y,Hu J,Bai X,et al.Preparation and function of oligopeptide-enriched hydrolysate from globin by pepsin[J].Process Biochemistry,2006,41 (7):1 589-1 593.
[14]何照范,張迪清.保健食品化學及其檢測技術 [M].北京:中國輕工業出版社,1997:141-142.
[15]高丹丹,曹郁生,麥曦.改進的分光光度計法測定食源性多肽血管緊張素轉化酶的抑制活性 [J].浙江大學學報(農業與生命科學版),2011,37(2):219-223.
[16]LanX,LiaoD,WuS,etal.Rapidpurificationandcharacterization of angiotensin converting enzyme inhibitory peptides fromlizardfishproteinhydrolysateswithmagneticaffinityseparation[J].FoodChemistry,2015(7):136-142.
[17]Forghani B,Zarei M,Ebrahimpour A,et al.Purification and characterization of angiotensin converting enzyme-inhibitory peptides derived from Stichopus horrens:Stability study against the ACE and inhibition kinetics[J].Journal of Functional Foods,2016 (4):276-290.◇

