甲型肝炎患者黏蛋白域蛋白1和4表達與抗體產生的相關性研究*
胡耀華,陽慧,吳翔,符春苗,邵運祿,鄭才玲,卓書偉
(海南省中醫院 1.檢驗科,2.婦產科,海南 海口 570203)
T細胞免疫球蛋白及黏蛋白域蛋白(T cell immunoglobulin domain and mucin domain,TIM)家族是McIntire等于2001年發現的1個新的基因家族,在人體中包括TIM-1、TIM-3和TIM-4[1]。TIM-1是甲型肝炎病毒受體-1(hepatitis A virus cellular receptor 1,HAVCR-1),TIM-4是TIM-1的天然配體[2]。流行病學發現甲型病毒性肝炎患者痊愈后具有較強的免疫能力[3],且TIM家族參與T細胞的增殖活化調節T細胞的功能,而T細胞在體液免疫抗體產生的過程中起到重要作用,所以筆者猜測TIM-1和TIM-4可能在參與細胞免疫的同時,也參與機體的體液免疫的強化,本研究通過檢測甲型肝炎患者外周血TIM-1和TIM-4 mRNA表達水平以及血清中白介素4(interleukin-4,IL-4),白介素 10(interleukin-10,IL-10)和總 Ig(IgG和IgA),探討TIM-1、TIM-4是否對體驗免疫有強化作用,為將來開發低毒的HAV疫苗從而間接提高體液免疫能力用以抗腫瘤和感染提供理論支持。
1 資料與方法
1.1 一般資料
選取2015年11月-2016年11月本院收治的甲型病毒性肝炎患者60例(研究組)。男性46例,女性14例;年齡28~42歲,平均(33±8.3)歲。所有患者依靠甲型肝炎典型癥狀和血清中抗HAV IgM陽性確診為甲型肝炎,診斷標準參照2000年9月西安中華醫學會傳染病與寄生蟲病學分會和肝病學分會修訂的病毒性肝炎防治方案。選取同期于本院體檢中心健康體檢的志愿者60例為對照組。男性40例,女性20例;年齡26~43歲,平均(31±9.6)歲。入選患者及志愿者均對本研究內容充分知情,且均自愿簽署知情同意書后入組,符合倫理學要求。
1.2 靜脈血標本
于恢復期采集甲型病毒性肝炎患者靜脈血抗凝(EDTA-Na2)全血2 ml及不抗凝血3 ml,分離血清。同時采集健康體檢志愿者靜脈血抗凝(EDTA-Na2)全血2 ml及不抗凝血3 ml,分離血清。
1.3 甲型肝炎患者和正常對照人群外周血單個核細胞TIM-1和TIM-4 mRNA表達水平檢測
1.3.1 引物設計與合成應用生物信息學知識,根據GeneBank中 的TIM-1 mRNA、TIM-4 mRNA和 甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)mRNA全長序列,用Primer Express軟件設計目的基因TIM-1、TIM-4和內參照基因GAPDH引物,并由生工生物工程(上海)股份有限公司合成。
1.3.2 外周血單個核細胞(peripheral blood mononuclear cell,PBMC)的獲取及總RNA的提取與逆轉錄將聚蔗糖-泛影葡胺分離液和預先稀釋的抗凝全血加入離心管中,密度梯度離心法2 000 r/min水平離心20 min后,小心吸取密集在血漿層和分層液界面中呈白色霧狀的單個核細胞,經RPMI 1640細胞培養液調整細胞濃度為1×106個/L。Trizol法抽提外周血單個核細胞總RNA,人TIM-1和TIM-4基因的cDNA文庫按照逆轉錄說明書寶生物工程(大連)有限公司合成。按照pMD18-T Simple載體說明書連接上述人TIM-1和TIM-4加A的片段。并轉化感受態大腸桿菌(Escherichia coli)DH5α,在鏈霉素選擇性培養基上篩選,按藍白斑實驗挑選白斑并用PCR菌液PCR證實。
1.3.3 實時熒光定量聚合酶鏈反應(quantitative realtime polymerase chain reaction,qRT-PCR)檢測外周血單核細胞中TIM-1和TIM-4 mRNA表達根據NCBI GenBank中人GAPDH,TIM-1和TIM-4的基因序列,應用Primer 5.0引物設計軟件設計特異性引物:GAPDH正 向5'-CCAAACTACCTTCAACTCCATC-3',反 向 5'-AGTGATCTCCTTCTGCATCCT-3';TIM-1正向 5'-CGTAATCCGAGGCATAAT-3',反向 5'-AAGCGA CAACCCAAAGGT-3';IM-1正向 5'-GCTAATCCCACG CATAAT-3',反向 5'-ATGGAACAACCCAAATGT-3'。利用Prime-STAR HSDNA聚合酶(TaKaRa)分別擴增人TIM-1和TIM-4全長片段,退火溫度為60℃,純化PCR產物。qRT-PCR儀上進行擴增并進行實時檢測,具體為real-time PCR反應體系:10×PCR緩沖液2 μl,25 mmol/L Mg2+3.5 μl,10 mmol/L dNTPs 0.4 μl,10 μmol/L引物各0.5 μl,普通TaqDNA聚合酶1 u(1 u/μl),質粒 DNA 1 μl,牛血清白蛋白 BSA(1 mg/ml)2 μl,SYBR GreenI 20×1 μl,滅菌 H2O 8.1 μl。空白對照管加1.0 μl滅菌焦碳酸二乙酯(DEPC)水代替質粒DNA,蓋上蓋后瞬間離心,使樣品聚集在毛細管底部,然后上機擴增。擴增條件為:95℃預變性4 min,然后3步反應:95℃變性30 s;60℃退火30 s;72℃延伸30 s,40個循環,再分別進行熒光檢測,并做熔解曲線對PCR產物的特異性進行鑒定,最后反應冷卻至40℃。PCR反應產物在2%瓊脂糖凝膠電泳并測序檢驗其特異性。
1.4 ELISA檢測外周血IL-4、IL-10、腫瘤壞死因子α和總Ig(IgG、IgM和IgA)水平
采用ELISA檢測外周血IL-4、IL-10、腫瘤壞死因子α(tumor necrosis factor,TNF-α)和總 Ig(IgG、IgM和IgA)水平。具體步驟:取抗凝血,采用12 000 r/min離心5 min。吸取上清液100 μl。室溫(18~25℃)溫育30 min,倒掉板內液體,用清洗緩沖液洗板3次拍干,每孔滴加100 μl酶結合物室溫(18~25℃)溫育30 min,洗板3次拍干,滴加顯色液A和B各100 μl,室溫(18~25℃)避光溫育15 min后加終止液100 μl,酶標儀450 nm讀數。
1.5 統計學方法
數據分析采用SPSS 20.0統計軟件,計量資料以均數±標準差(±s)表示,采用t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 兩組TIM-1和TIM-4 mRNA表達水平比較
由qRT-PCR反應曲線得到閾值循環數(threshold cycle number,Ct)值,計算基因相對表達量,采用GAPDH作為內參照。ΔCt=Ct目的基因-Ct GAPDH 基因表達相對量 =2-ΔΔCt×100。其中甲型肝炎患者TIM-1、TIM-4 mRNA閾值循環數為分別為 Ct=39.662~ 2.136logX(r=0.682),Ct=30.279~3.028logX(r=0.748)。測得甲型肝炎患者恢復期以及對照組血清中的TIM-1和TIM-4的mRNA。結果見表1,甲型肝炎恢復期患者血清中TIM-1和TIM-4的mRNA的表達高于對照組(P<0.05)。
2.2 兩組外周血清中IL-4和IL-10水平比較
甲型病毒性肝炎恢復期患者血清中IL-4、IL-10和TNF-α的水平均高于對照組(P<0.01)。其中IL-4水平在2次測量中變異較大,第2次測量中高于對照組。見表2。
2.3 兩組組外周血清中總Ig水平比較
甲型病毒性肝炎恢復期患者血清IgG和IgA水平都高于對照組(P<0.05)。其中IgG的變異性較大,IgA的變異較小;甲型病毒性肝炎患者與對照組IgM比較,差異無統計學意義(P>0.05),見表3。
表1 兩組TIM-1和TIM-4 mRNA水平比較 (±s)
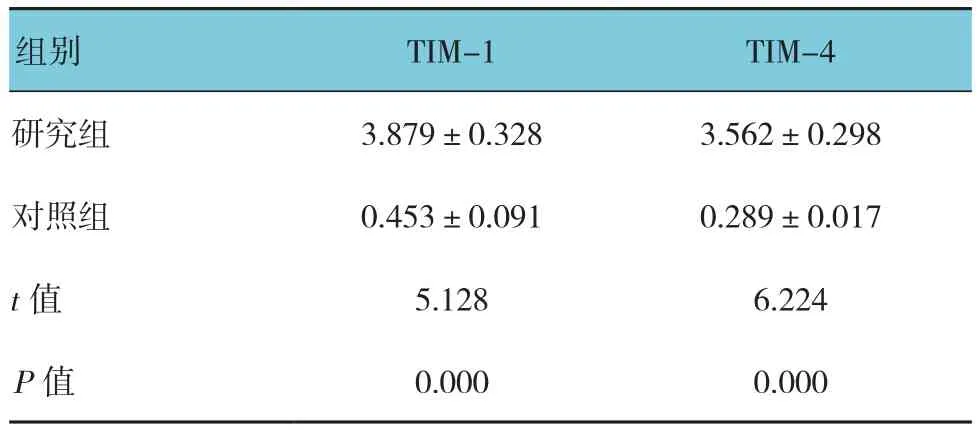
表1 兩組TIM-1和TIM-4 mRNA水平比較 (±s)
組別 TIM-1 TIM-4研究組 3.879±0.328 3.562±0.298對照組 0.453±0.091 0.289±0.017 t值 5.128 6.224 P值 0.000 0.000
表2 兩組外周血清中IL-4、IL-10及TNF-α水平比較(pg/ml,±s)
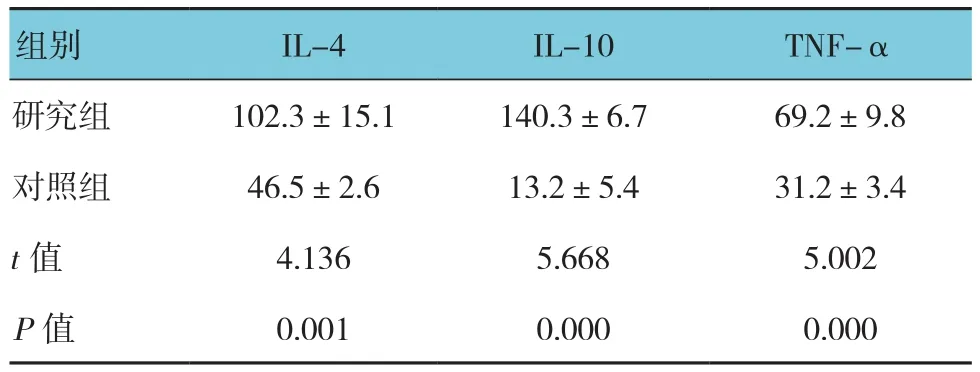
表2 兩組外周血清中IL-4、IL-10及TNF-α水平比較(pg/ml,±s)
組別 IL-4 IL-10 TNF-α研究組 102.3±15.1 140.3±6.7 69.2±9.8對照組 46.5±2.6 13.2±5.4 31.2±3.4 t值 4.136 5.668 5.002 P值 0.001 0.000 0.000
表3 甲型病毒性肝炎患者和對照組外周血清中總 Ig 水平比較 (IU/ml,±s)

表3 甲型病毒性肝炎患者和對照組外周血清中總 Ig 水平比較 (IU/ml,±s)
組別 IgG IgM IgA 總Ig研究組 250±140 15±6 210±60 640±220對照組 150±121 13±5 140±36 470±180 t值 3.668 0.768 2.854 3.275 P值 0.000 0.423 0.000 0.000
3 討論
TIM家族目前在人類中已經發現3個(TIM-1、TIM-3和TIM-4),作為T細胞的免疫調節分子對免疫反應的調節起著重要作用[4]。TIM-1又稱HAVCR-1,是HAV的特異性受體;TIM-4是TIM-1的配體,特異性的表達于抗原提呈細胞(antigen present cell,APC)表面,且更多見于樹突狀細胞細胞(dendritic cell)表面[5]。研究發現,甲型肝炎患者痊愈后血清中的TIM-1和TIM-4的mRNA水平高于對照組,同時總Ig(IgG和IgA)水平也高于對照組。也就是說相比于對照組,HAV感染后患者的體液免疫能力會高于對照組,這與筆者的流行病學觀察結果一致。
IL-4和IL-10主要是由Th2(T help cell)分泌,是血液中重要的抗炎癥因子,具有促進B細胞增值分化以及漿細胞分泌抗體的功能。TNF-α是由單核細胞和巨噬細胞分泌產生的,參與細胞免疫和體液免疫。甲型病毒性肝炎患者愈后血清中IL-4、IL-10和TNF-α表達多于對照組,這可能是由于TIM-1和TIM-4傳遞一種細胞信號刺激Th2使其分泌的IL-4和IL-10增多,同時刺激單核巨噬分泌TNF-α增多。這與國外甲型病毒性肝炎患者恢復期Th2的功能增強的研究結果一致,發現TIM-4可誘導TIM-1胞內尾巴區酪氨酸磷酸化,提供1個共刺激信號,增強IL-4啟動子的轉錄,并激活T細胞核因子(nuclear factor of activated T cells,NFAT)轉錄和活化蛋白1(AP-1)促使T細胞增殖和細胞因子產生[6-8]。最新在斑馬魚上關于TIM-1和TIM-4的研究也證實TIM-1可以增強體液免疫能力而且具有記憶能力,這與甲型肝炎患者長期的自我保護的能力是一致的[9]。國外有研究發現,TIM-1和TIM-4可以相互作用通過影響樹突狀細胞DC來影響體液免疫的能力,且與Th2細胞所分泌的細胞因子IL-4和IL-10相關[11-12]。最近流行病學發現,甲型病毒性肝炎患者預后患哮喘和類風濕等過敏性和自身免疫性疾病的風險會降低,而對于其他病毒感染也會有較強的抵抗能力,研究認為可能是由于TIM-1和TIM-4之間傳遞一種雙向調節信號,可以既提高免疫耐受同時激活免疫防御[10-11]。但是實驗還存在一些不足:TIM-1和TIM-4的具體相互關系以及如何刺激Th2細胞還是不清楚;筆者只是通過IL-4和IL-10間接反映Th2細胞的能力,至于是由于Th2細胞的增值還是活化還不清楚;同時樣本量還是偏小。下一步將通過基因敲除的大鼠同時結合免疫共沉淀技術進一步探討TIM-1和TIM-4與Th2細胞的具體作用機制;利用流式細胞方法進一步檢測Th2細胞的數量來探討Th2細胞的增值和活化;利用基因芯片技術進一步從TIM-1和TIM-4基因多態性角度進一步闡述其對體液免疫調節的復雜機制。
TIM-1和TIM-4是調節T細胞功能的重要分子,對T細胞的影響是很容易理解,但如何調節體液免疫一直不太清楚。通過T細胞影響體液免疫還是直接影響B細胞來實現調節體液免疫也不清楚。本研究發現,TIM-1和TIM-4可能是通過刺激Th2細胞分泌IL-4和IL-10來激活體液免疫。對甲型病毒性肝炎患者而言,HAV病毒會特異性的結合于TIM-1,TIM-1高表達會較持續的激活T細胞進一步影響B細胞。從而達到進一步保護機體的作用。本研究結果認為,可以通過接種低毒性的甲肝疫苗,從而達到刺激TIM-1和TIM-4的表達,從而給機體提供較強的細胞免疫和體液免疫的能力。筆者相信通過對甲型病毒性肝炎患者血清中的TIM-1和TIM-4的進一步研究,可為T細胞和B細胞之間的信號傳遞提供一種新的方式[13]。
參 考 文 獻:
[1] MCINTIRE J J, UMETSU S E, AKBARI O, et al. Identification of Tapr (an airway hyperreactivity regulatory locus) and the linked Tim gene family[J]. Nat Immunol, 2001, 2(12): 1109-1116.
[2] RENNERT P D. Novel roles for TIM-1 in immunity and infection[J]. Immunology Letters, 2011, 141(1): 28-35.
[3] KIM H Y, EYHERAMONHO M B, PICHAVANT M, et al. A polymorphism in TIM1 is associated with susceptibility to severe hepatitis A virus infection in humans[J]. Journal of Clinical Investigation, 2011, 121(3): 1111-1118.
[4] RODRIGUEZ-MANZANET R, DEKRUYFF R, KUCHROO V K,et al. The costimulatory role of TIM molecules[J]. Immunol Rev,2009, 229(1): 259-270.
[5] MEYERS J H, CHAKRAVARTI S, SCHLESINGER D, et al.TIM-4 is the ligand for TIM-1, and the TIM-1–TIM-4 interaction regulates T cell proliferation[J]. Nature Immunology, 2005, 6(5):455-464.
[6] ZHAO C Q, LI T L, HE S H, et al. Specific immunotherapy suppresses Th2 responses via modulating TIM1/TIM4 interaction on dendritic cells[J]. Allergy, 2010, 65(8): 986-995.
[7] YEUNG M Y, DING Q, BROOKS C R, et al. TIM-1 signaling is required for maintenance and induction of regulatory B cells[J].American Journal of Transplantation, 2015, 15(4): 942-953.
[8] SUN H W, WU C, TAN H Y, et al. A new development of FG-CC’siRNA blocking interaction of Tim-1 and Tim-4 can enhance DC vaccine against gastric cancer[J]. Hepatogastroenterology, 2012,59(120): 2677-2682.
[9] XU X G, HU J F, MA J X, et al. Essential roles of TIM-1 and TIM-4 homologs in adaptive humoral immunity in a Zebrafish model[J].J Immunol, 2016, 196(4): 1686-1699.
[10] de SOUZA A J, ORISS T B, O’MALLEY K J, et al. T cell Ig and mucin 1 (TIM-1) is expressed on in vivo-activated T cells and provides a costimulatory signal for T cell activation[J]. Proc Natl Acad Sci U S A, 2005, 102(47): 17113-17118.
[11] CHAKRAVARTI S, SABATOS C A, XIAO S, et al. Tim-2 regulates T helper type 2 responses and autoimmunity[J]. The Journal of Experimental Medicine, 2005, 202(3): 437-444.
[12] XIAO S, ZHU B, JIN H, et al. Tim-1 stimulation of dendritic cells regulates the balance between effector and regulatory T cells[J].Eur J Immunol, 2011, 41(6): 1539-1549.
[13] DU P, XIONG R, LI X, et al. Immune regulation and antitumor effect of TIM-1[J]. Journal of Immunology Research, 2016(2016):1-6.

