老年癡呆模型中人參皂苷Rg1預處理對大鼠腦片中突觸素表達的影響*
李明 李璽 權乾坤 袁海峰 徐陽
(1.西安交通大學第二附屬醫院, 陜西 西安 710004;2. 西安市第五醫院, 陜西 西安 710083)
老年性癡呆是一種常見于老年人的神經退行性變性疾病。有研究表明,老年大鼠海馬突觸數量和突觸素(Synaptophysin,SYN)表達明顯減少[1],在老年癡呆患者早期即可出現突觸的喪失,其認知障礙程度與突觸結構和功能的改變密切相關。因此,突觸的病理性重構是老年性癡呆認識障礙的重要病理基礎[2-4]。研究表明,老年大鼠腦內突觸素丟失程度與記憶缺失程度呈正相關[5]。
人參皂甙Rg1是人參“益智延年”的主要成分, 其主要的靶器官是中樞神經系統。近年來,人參皂苷Rg1對神經保護、增強記憶和抗衰老作用方面的研究已取得了一定進展[6],已成為研究中藥抗癡呆的熱點之一。研究發現,人參皂甙Rg1對多種實驗動物模型的學習記憶障礙均有明顯的改善作用,其作用機制可能與提高膽堿能功能,促進M-膽堿受體數量明顯增加、促進受體蛋白合成有關[7]。人參皂甙Rg1還有抗氧化,清除自由基,抗衰老和抑制細胞凋亡的作用[8-10]。但是目前關于人參皂甙Rg1對SYN表達是否有上調作用并不清楚。因此,本實驗采用岡田酸(okadaic acid,OA)制備老年癡呆大鼠腦片模型,觀察人參皂苷Rg1對老年癡呆模型大鼠腦片中SYN表達的影響,旨在闡明人參皂苷Rg1能否通過影響突觸素的活性表達,發揮抗老年性癡呆神經退行性變的作用。
1 材料與方法
1.1 材料
1.1.1 實驗動物 選擇體重110~130g雄性 SD大鼠,5周齡,清潔級,由西安交通大學醫學院實驗動物中心提供,合格證號為SCXK(陜)2007-001。實驗中對動物的處理方法符合中華人民共和國科學技術部頒發的《關于善待實驗動物的指導意見》。
1.1.2 主要儀器 光學顯微鏡,日本OLYMPUS公司產品,型號:BH22;冰凍切片機,德國MICROM公司產品,型號:HM500;振動切片機,上海之信儀器有限公司產品,型號:ZQP-86;圖像處理與分析系統,德國LEICA公司產品,型號:Qwin550CW。
1.1.3藥物與試劑 人參皂苷Rg1購自吉林宏久生物科技股份有限公司,分子式為C42H72O14,化學結構式見圖1,純度98.99%,使用前溶于分析純甲醇。OA購自美國ALEXIS生物制劑公司,純度98%,使用前溶于10% 二甲基亞砜(dimethy sulphoxide, DMSO),配制成1 mg/mL二甲亞砜溶液待用。SYN蛋白兔抗鼠多克隆抗體、免疫組化試劑盒(SABC)及DAB均為北京博奧森生物技術有限公司產品。Haws’S蘇木素由西安交通大學醫學實驗中心提供。
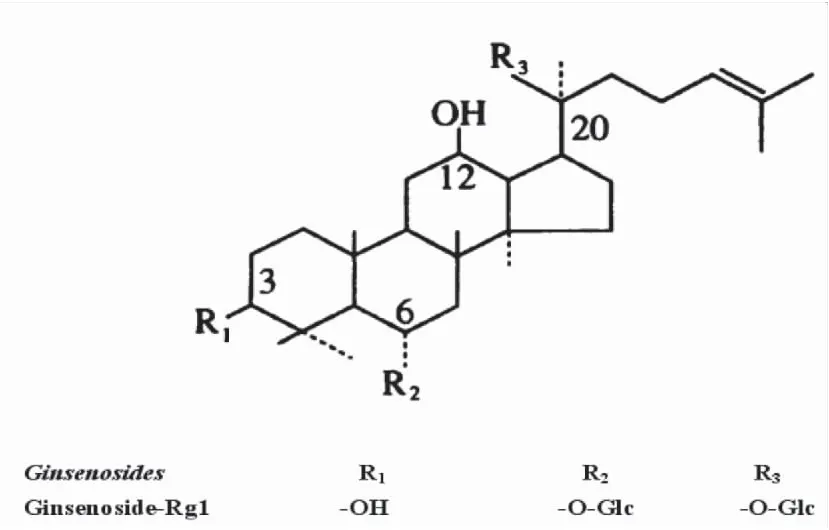
圖1 人參皂苷Rg1分子結構示意圖Figure 1 The chemical structural formula of Gensenoside Rg1
1.2 方法
1.2.1 腦片制備 配置人工腦脊液(成分:mmol·L-1)(150 NaCl,2 CaCl2,1.2 MgSO4,0.5 KH2PO4,1.5 K2HPO4,10 glucose,pH7.4) ,取5周齡SD大鼠,參照文獻方法[11],大鼠經6%水合氯醛麻醉后,斷頭取腦,快速置于0~4 ℃的人工腦脊液冰水混合物中,振動切片機以振幅8檔,速度3檔行冠狀切片所切腦片含皮層和海馬,平均厚度400μm。挑選形態較好(含海馬和皮層)的腦片置入盛有人工腦脊液的6孔板中培養,溫度(32.0±0.5)℃,整個過程人工腦脊液中持續通入混合氧氣(95%O2+5%CO2)。
1.2.2 分組及干預 腦片隨機分為5組:空白組、模型組、人參皂苷Rg1低、中、高濃度組,每組10張腦片。人工腦脊液孵育1小時,人參皂苷Rg1各組分別加入人參皂苷Rg1(60 μmol·L-1、120 μmol·L-1、240 μmol·L-1)培養2 h,模型組和人參皂苷Rg1各濃度組分別加入OA(1 μmol·L-1)培養3 h后,固定處理。
1.2.3 腦片SYN表達檢測 標本經4%多聚甲醛固定4 h,取出,轉入30%蔗糖溶液浸泡至沉底,做冰凍切片,切片10μm厚,每張切片含皮層、海馬、齒狀回。然后進行免疫組織化學染色,組織切片經抗原修復, 3% H2O2阻斷內源性過氧化物酶10 min, 兔抗大鼠SYN濃度為1:600, 4℃過夜,生物素標記的單克隆小鼠抗兔IgG即用型二抗和SABC試劑各在室溫下作用30 min, 鏈酶親和素-過氧化物酶復合物進行抗原修復,最后DAB顯色,蘇木素輕度復染, PBS代替一抗做陰性對照。
1.2.4 圖象分析 采用圖象處理與分析系統,檢測陽性反應物質的平均灰度值,每張切片同一區域中,隨機選取6個視野,檢測面積相同,取其平均值作為該切片目標區域的平均灰度值。灰度值越低,蛋白表達量越高,反之灰度值越高,蛋白表達量越低。
2 結果
SYN的陽性免疫反應物質為棕黃色,主要分布于細胞的突觸、胞膜和胞漿,胞核不著色或著色淡。本實驗中,大鼠腦片經岡田酸孵育后,模型組與空白組比較,SYN的陽性細胞表達量明顯減少(P<0.05)。經人參皂苷Rg1干預后檢測腦片SYN的陽性細胞表達變化發現,與模型組比較,各濃度藥物組SYN的陽性細胞表達量均有增加(P<0.05),其中低劑量組與中劑量組在CA1和Cortex之間比較差異有統計學意義(P<0.05),同時在各腦區人參皂甙Rg1高劑量組SYN的陽性細胞表達明顯優于人參皂甙Rg1中、低劑量組,存在一定的劑量依賴關系,見表1、圖2。
表1 人參皂甙Rg1對老年癡呆模型大鼠腦片SYN的影響(灰度值)Table 1 Expression of SYN protein in rat brain slices in different groups
注:與空白組比較,①P<0.05;與模型組比較,②P<0.05;與高劑量組間比較,③P<0.05;與中劑量組比較,④P<0.05

圖2 免疫組織化學法檢測各組大鼠腦片皮層區SYN蛋白陽性細胞表達(光學顯微鏡,×400)Figure 2 Expression of SYN protein in cortex in different groups observed by immunohistochemical method注:A. 空白組; B. 模型組; C. 人參皂甙Rg1高濃度組
3 討論
突觸素是突觸小泡中含量最多的特異性膜通道蛋白,在所有的神經末梢內幾乎都有分布,是神經元和神經內分泌細胞的一種特異性標記物。它在突觸囊泡的導入、轉運、再循環和神經遞質的釋放及突觸的發生和發育,以及突觸的可塑性中都具有非常重要的作用,是學習記憶過程中的重要蛋白[12-13]。突觸素分布數量和密度可間接反映突觸的數量和密度[14]。突觸喪失將會引起嚴重的認知障礙,學習記憶功能受損[15]。因此,免疫組化圖像采集及數據分析能反映神經元突觸變化狀況。本實驗將岡田酸加入培養大鼠腦片的ACSF中結果發現,與空白組比較,模型組SYN蛋白陽性表達細胞量下降(P<0.05) ,推測可能是岡田酸造成大鼠腦片神經元變性壞死,導致軸突終末變性、丟失,突觸數量及突觸素表達的降低,這與文獻報道一致[16]。
人參皂苷 Rg1 作為人參促智作用的主要有效成份之一,對 AD 具有多種神經保護作用[17-21]。目前還未有研究證實人參皂苷 Rg1 是否可以通過上調腦內SYN表達在突觸的可塑性中起一定的作用。本實驗在ACSF中首先加入人參皂苷Rg1預處理2 h,然后再加入岡田酸,結果發現,人參皂苷Rg1各組腦片SYN蛋白的陽性細胞表達較模型組顯著提高(P<0.05)。這說明人參皂苷Rg1可能通過對抗岡田酸對SYN的抑制作用, 上調SYN的蛋白表達水平,且表達隨劑量的增加而增加,人參皂苷Rg1藥效作用呈一定的劑量依賴關系。
總之,人參皂苷 Rg1對OA所致AD大鼠腦片有明顯的干預作用,這種作用可能與人參皂苷 Rg1提高腦片突觸素的陽性表達、增加神經元保護有關,具體機制還有待進一步探討。
4 結論
本文結果顯示,以OA誘導大鼠腦片tau蛋白發生磷酸化,制備AD樣tau蛋白磷酸化大鼠腦片模型,經人參皂苷Rg1預處理后,SYN的陽性細胞表達明顯增加且呈劑量依賴關系。由此可見,人參皂苷Rg1通過上調腦內SYN的表達,增加神經元保護,以此發揮抗癡呆作用。
【參考文獻】
[1]姚柏春,鄧兆宏,孫天敏,等.AB1-40 誘導大鼠海馬突觸體素和突觸數量的變化[J].中國現代醫學雜志,2007,17(12):153.
[2]Zhong GS, Ruan DY,Ge SY,etal. Effects of lithium on the synaptic plasticity in dentate gyrus region of rat hippocampus[J].Chin J Pharmacol-Toxicol,2002,16(6):432-437.
[3]Arendt T.Alzheimer`s disease as a disorder of dynamic brain self-organization [J].Prog Biain Res,2005,147:355-378.
[4]Spires TL,Hyman BT. Neuronal structure is altered by anryloid plaques[J].Res Neurosci,2004,15(4),267-278.
[5]Head E, Corrada M M,Kahle-Wrohleski K,etal.Synaptic proteins, neuropathology and cognitive status in the oldest-old[J].Neurobiol Aging,2009,30(7):1125-1134.
[6]Zhang JT. Nootropic mechanisms of ginsenoside Rg1 influence on neuronal plasticity and neurogenesis[J]. Yao Xue Xue Bao, 2005; 40(5): 385-388.
[7]Zhang JT,Qu ZW,and Liu Y,etal.Preliminary study on antiamnestic mechanism of ginsenoside Rg1 and Rb1[J].Chin Med J,1990, 103(11):932-938.
[8]Chen XC,Fang F,Zhu YG,etal. Protective effect of ginsenoside Rg1 on MPP+-induced apoptosis in SHSY5Y cells[J].J Neural Transm,2003,110(8):835-845.
[9]金建生,趙朝暉,陳曉春,等.人參皂甙Rg1抗衰老作用可能與改變p21、cyclin E、CDK2的表達有關[M],中國臨床藥理學與治療學,2004,9(1):29-36.
[10] Chen XC,Zhu YG,and Zhu LA,etal.Ginsenoside Rg1 attenuates dopamine-induced apoptosis in PC12 cells by suppressing oxidative stress[J].Eur J Pharmacol,2003,18,473(1):1-7.
[11] Gong CX, Lidsky T, Wegiel J,etal. Metabolically active rat brain slices as a model to study the regulation of protein phosphorylation in mammalian brain[J]. Brain Res Protoc, 2001,6(3): 134-140.
[12] Lippa CF. Synaptophysin immunoreactivity in Pick' s disease: comparison with Alzheimer's disease and dementia with Lewy bodies[J]. Am J Alzheimers Dis Other Demen,2004, 19( 6) : 341-344.
[13] Guevara J,Dilhuydy H,Espinosa B,etal. Coexistence of reactive plasticity and neuron degeneration in Alzheimer diseased brains[J]. Histol Histopathol,2004,19( 4) : 1075-1084.
[14] Boncristiano S, Calhoun ME, Howard V,etal. Neocortical synaptic bouton number is maintained despite robust amyloid deposition in APP23 transgenic mice[J]. Neurobiol Aging, 2005, 26(5): 607-613.
[15] Walsh DM,Selkoe DJ. Deciphering the molecular basis of memory failure in Alzheimer's disease[J]. Neuron,2004, 44( 1) : 181-193.
[16] Tenna,YuanH.The mystery of Alzheimer's disease and its prevention by melatonin[J].Med Hypotheses,2004,12(5):233-244.
[17] Liu QA,Kou JP,Yu BY.Ginsenoside Rg1 protects against hydrogen peroxide-induced cell death in PC12 cells via inhibiting NF-kappa B activation[J].Neurochemistry International,2011,58(1):119-125.
[18] Chen XC,Chen Y,Zhu YG,etal. Protective effect of ginsenoside Rg1 against MPTP-induced apoptosis in mouse substantia nigra neurons[J]. Acta Pharmacologica Sinica,2002,23(9):829-834.
[19] Gong L,Li SL,Li H,etal.Ginsenoside Rg1 protects primary cultured rat hippocampal neurons from cell apoptosis induced by beta beta-amyloid protein [J]. Pharmaceutical Biology,2011,49(5):501-507.
[20] Mook-Jung I,Hong H S,Boo J H,etal. Ginsenoside Rb1 and Rg1 improve spatial learning and increase hippocampal synaptophysin level in mice [J].Journal of Hepatology,2009,49(2):646-657.
[21] Peng XS, Cheng XC, Huang JS,etal. The effect of ginsenoside Rg1 on abnormal phosphorylation of tau in rat shippocampal neurons induced by aggregated Aβ25-35[J]. Zhongguo Yao Li Xue Tong Bao,2005,21(3):299-305.

