鰱魚重組Cystatin及其酶解產物對草魚冷藏肉片優勢腐敗菌的抑制作用
楊娟,鐘海霞,李樹紅,白稚子,林靈,李美良,劉明宇,林昊
(四川農業大學 食品學院,四川 雅安,625014)
半胱氨酸蛋白酶抑制因子(cysteine proteinase inhibitors,CPIs),又稱巰基蛋白酶抑制劑,英文簡稱Cystatins,是一類專門抑制活性中心含有半胱氨酸殘基(CySH)的蛋白酶水解作用的可逆抑制因子[1]。許多學者已從動植物的組織和體液中分離到Cystatins蛋白,并形成了非常龐大的Cystatins超家族。Cystatins超家族根據結構特征主要分為Stefin(家族I)、Cystatin(家族II)和Kininogen(家族III)3個家族。CPIs在生物防預[2]、免疫應答與調節[3-4]、癌癥抑制[5]、細胞凋亡[6]、腫瘤侵襲與轉移[7]以及抑菌[8-10]等生理和病理的過程中發揮著重要的作用。
目前對于陸生哺乳動物來源的Cystatin(家族II)研究得比較透徹,但魚類來源的Cystatin(家族II)很可能具有某些特殊的性質或活性。目前僅從部分魚組織中純化出分子質量在12~14 ku的Cystatin,經鑒定均存在Cystatin的保守活性位點[11-12]或典型抑制活性特征[13-14]。此外,盡管部分魚源Cystatin已得到克隆[15]或表達[16-17],但研究人員尚未對其生物學活性進行深入系統的研究。
關于Cystatin(家族II)的抑菌作用已有報道,某些陸生動物及植物來源的Cystatin(家族II)均對不同種類的細菌[10, 18]或真菌[19-20]表現出明顯的抑制活性,但是關于魚類Cystatin(家族II)的抑菌作用鮮有報道,僅報道鯉魚(Cyprinuscarpio)和香魚(Plecoglossusaltivelis)的受精卵膜提取物(其中含有Cystatin抑制活性)對病原菌表現出抑制作用[21]。此外,本團隊陳海[22]等人通過濾紙片法,證明鰱魚重組Cystatin(家族II)能抑制銅綠假單胞菌(PseudomonasaeruginosaATCC27853)的生長。但該蛋白對其他常見肉類致腐微生物的抑菌活性仍有待進一步開展。有研究表明,動物來源的Cystatin肽鏈結構的內部,可能存在抑菌序列[23-25]。魚類Cystatin(家族II)肽鏈內部是否存在類似機制,尚未見報道。
為此,本實驗擬通過分析鰱魚重組Cystatin(家族II)的Papain酶解物,對草魚冷藏肉片中分離的3種優勢腐敗菌的抑菌效果,同時結合電泳、液相、質譜等分離鑒定方法,以期對Cystatin內部可能含有的有效抑菌片段進行分析和鑒定。
1 材料與方法
1.1 材料與試劑
鰱魚重組Cystatin蛋白凍干粉,參照陳海等[22]的方法由本實驗室制備,純度90.27%,比活性4 130.58 units/mg,分子質量約為20.9 ku。
木瓜蛋白酶(Papain,P4762,10 U/mg),美國Sigma公司,參照鐘海霞[26]的方法,Papain的純度為95.23%,比活性1.28×105units/(g·min)。
草魚冷藏肉片優勢腐敗菌種:草莓假單胞菌(Pseudomonasfragi)、腐敗希瓦氏菌(Shewanellaputrefaciens)和中間氣單胞菌(Aeromonasmedia),參考鐘海霞[26]的方法分離篩選。
藍葡聚糖-2000、Tyr-Gly-Gly-Phe-Met、Asp-Arg-Val-Tyr-Ile-His-Pro-Phe、細胞色素、乳鏈菌肽、牛血清白蛋白、胰蛋白酶、胃蛋白酶原、γ-球蛋白,美國Sigma公司;凝膠制備試劑盒,博士德生物(武漢)有限公司;低分子質量蛋白標準品(4.6~45 ku,9.5~66 ku),美國BBI公司;IPG預制膠條pH 3~10,美國Bio-Rad公司。
1.2 儀器與設備
LC-2010HT高效液相色譜系統,日本島津公司;SW-CJ1F無菌操作臺,佳寶進化工程設備(蘇州)有限公司;LRH-250生化培養箱,一恒科學儀器(上海)有限公司;JY-ECP3000電泳儀,六一(北京)儀器廠;Mini PROTEIN 3垂直電泳槽、PROTEAN i12等電聚焦系統,美國Bio-Rad公司;Orbitrap Fusion Mass Spectrometer質譜分析儀,美國Thermo Fisher公司。
1.3 方法
1.3.1 Papain酶解鰱魚重組Cystatin
Cystatin與Papain按1∶0.25質量比均勻混合,加入到酶解反應管中,并標記為Cystatin與Papain反應0、6、12、18、24 h的反應管,其中0 h反應管以水代替Papain,而對照管加入相對應體積的Cystatin溶液,并用Cystatin代替所有對照管Papain溶液,之后加入超純水使整個反應體系為1mL。混合后37 ℃水浴。取50 μL各時間點反應混合物,加熱滅酶,留作小肽電泳檢測,剩余的混合液微濾除菌后用作濾紙片檢測。
1.3.2 Tricine-SDS-PAGE檢測Papain酶解程度
將Papain酶解后取樣,通過小肽電泳鑒定其酶解程度。同時與Papain和蛋白原樣進行對比,采用Tris-Tricine電泳系統[27],參考SCHGGER等人[28-29]的方法制備電泳膠,利用連續Tricine-SDS-PAGE測定目的蛋白分子質量。根據電泳圖確定Cystatin完成酶解所需的時間。
1.3.3 鰱魚重組Cystatin及其酶解物的抑菌效果比較
采用濾紙片法[30]鑒定Cystatin酶解各時間點的酶解物的抑菌效果,以確定酶解的最佳時間。將草莓假單胞菌、腐敗希瓦氏菌和中間氣單胞菌菌株分別接種于LB液體培養基中培養,當OD600 nm≈0.6時吸取100 μL菌懸液均勻涂布于直徑為60 mm的已加入培養基的平板表面,貼上直徑為6 mm的無菌濾紙,向每片濾紙片上添加15、20、25、30 μL的Cystatin/Cystatin酶解物;同時以無菌水/Papain為對照。將平板于30 ℃恒溫培養16~18 h,觀察測定抑菌圈的大小以判斷鰱魚重組Cystatin的抑菌效果。
1.3.4 凝膠過濾高效液相色譜(TSK-GEL G2000SWXLHPLC)鑒定
參考劉玲[5]的方法鑒定待測樣品的純度和分子質量。以標品藍葡聚糖-2000測定TSK-GEL G2000SWXL的空體積V0,分別以Asp-Arg-Val-Tyr-Ile-His-Pro-Phe(0.573 ku)、Tyr-Gly-Gly-Phe-Met(1.046 ku)、乳鏈菌肽(3.35 ku)、細胞色素C(13.0 ku)、胰蛋白酶(23.3 ku)、胃蛋白酶原(43.0 ku)、牛血清白蛋白(66.0 ku)、γ-球蛋白(150.0 ku)標準蛋白作為標品,相同條件下進行色譜分析,求得各標品的洗脫體積Ve。以Ve/V0值作為縱坐標,標準蛋白分子質量對數為橫坐標,繪制TSK-GEL G2000SWXLHPLC的標準曲線,得到回歸方程為:y=-0.426 9x+3.399 1,R2=0.977 1。
其中色譜條件:色譜柱為TSK-GEL G2000SWXL(300 mm×7.80 mm,5 μm),流動相洗脫液為100 mmol/L磷酸鹽緩沖液(含0.1 mol/L Na2SO4和7.69 mmol/L NaN3),流速為0.5 mL/min,進樣量100 μm,檢測波長280 nm。
1.3.5 雙向電泳鑒定目的抑菌片段的分子質量和等電點
雙向電泳分為第一向等電聚焦和第二向SDS-PAGE電泳2個部分,具體操作步驟參考王任[31]的方法,以測定目的抑菌片段的分子質量和等電點。
1.3.6 RPLC-MS/MS串聯質譜分析
參考劉玲[5]的方法鑒定目的抑菌片段的抑菌序列。將目的蛋白樣品進行酶解,凍干之后的肽段用含5%ACN和0.1%FA的溶液充分溶解,離心(17 000g,15 min)后,取上清以3 μL/min流速自動進樣通過Eksigent 1D plus高效液相色譜系統,進入C18捕捉柱,調至流速為300 μL/min洗脫至C18分析柱(100 mm×75 μm,柱料1.9 μm)。用30%A液(95%ACN和0.1%FA)洗脫20 min后線性梯度洗脫5 min至80%B液,并在80%B液處保持5 min的洗脫。洗脫的肽段通過納升電噴霧離子化進入串聯質譜TripleTOF 5600(Applied Biosystem,USA)中。MS掃描范圍(m/z)350~1 250,累積時間0.25 s,MS/MS掃描范圍(m/z)100~1 500,掃描模式:HS高靈敏度模式,累積時間0.05 s,IDA采集模式,1個MS1圖譜選擇20個最強離子進行串級掃描。
1.3.7 數據分析
采用SPSS 22.0數學軟件進行統計分析,Excel 2010計算各指標的平均值和標準差,采用One-Way ANOVA法進行差異顯著性分析。
2 結果與分析
2.1 Tricine-SDS-PAGE鑒定酶解物
鑒定結果如圖1所示。Cystatin與Papain于37 ℃反應0、6、12、18、24 h時,Papain都能將Cystatin徹底水解成分子質量不同的肽段。但明確該最適酶解時間還需要結合濾紙片實驗,進一步鑒定各時段酶解物的抑菌效果。
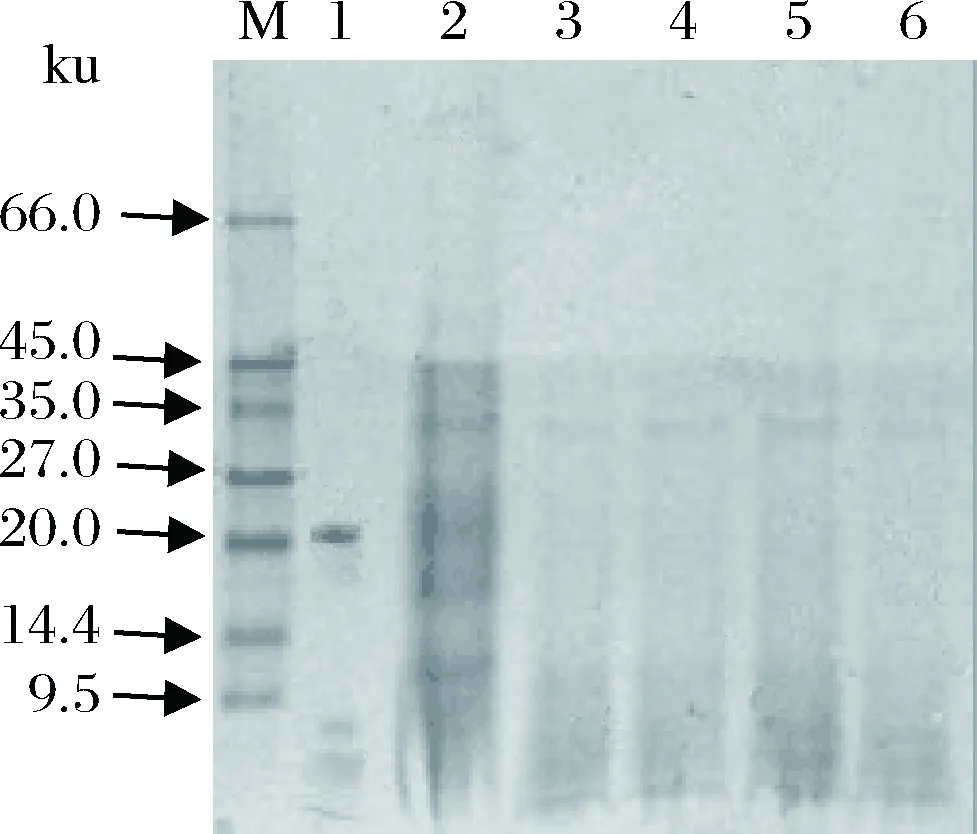
M-Marker標準蛋白(9.5~66.0 ku); 1-Papain;2-Papain酶解鰱魚Cystatin 0 h;3-Papain酶解鰱魚Cystatin 6 h;4-Papain酶解鰱魚Cystatin 12 h; 5-Papain酶解鰱魚Cystatin 18 h;6-Papain酶解鰱魚 Cystatin 24 h
圖1 Tricine-SDS-PAGE電泳鑒定酶解產物
Fig.1 The product was identified by Tricine-SDS-PAGE
2.2 濾紙片法鑒定Cystatin及其酶解產物的抑菌效果
采用濾紙片法鑒定Cystatin酶解各時間點的酶解物對3種優勢腐敗菌(草莓假單胞菌、腐敗希瓦氏菌和中間氣單胞菌)的抑制效果如表1所示。結果表明,Cystatin酶解0、6、12 h的酶解物對其均有抑菌效果,而Cystatin酶解18 h和24 h后的酶解物沒有抑菌活性。綜上實驗結果表明,Cystatin及其酶解物對3種優勢腐敗菌的抑菌圈直徑大小呈現出Cystatin 6 h酶解物>Cystatin 12 h酶解物>Cystatin原樣。結合Tricine-SDS-PAGE電泳鑒定結果,可以確定Papain酶解Cystatin的最適條件為:Cystatin與Papain按m(Cystatin)∶m(Papain)=1∶0.25,均勻混合,37 ℃下反應6 h,其對優勢腐敗菌的抑制作用見圖2。
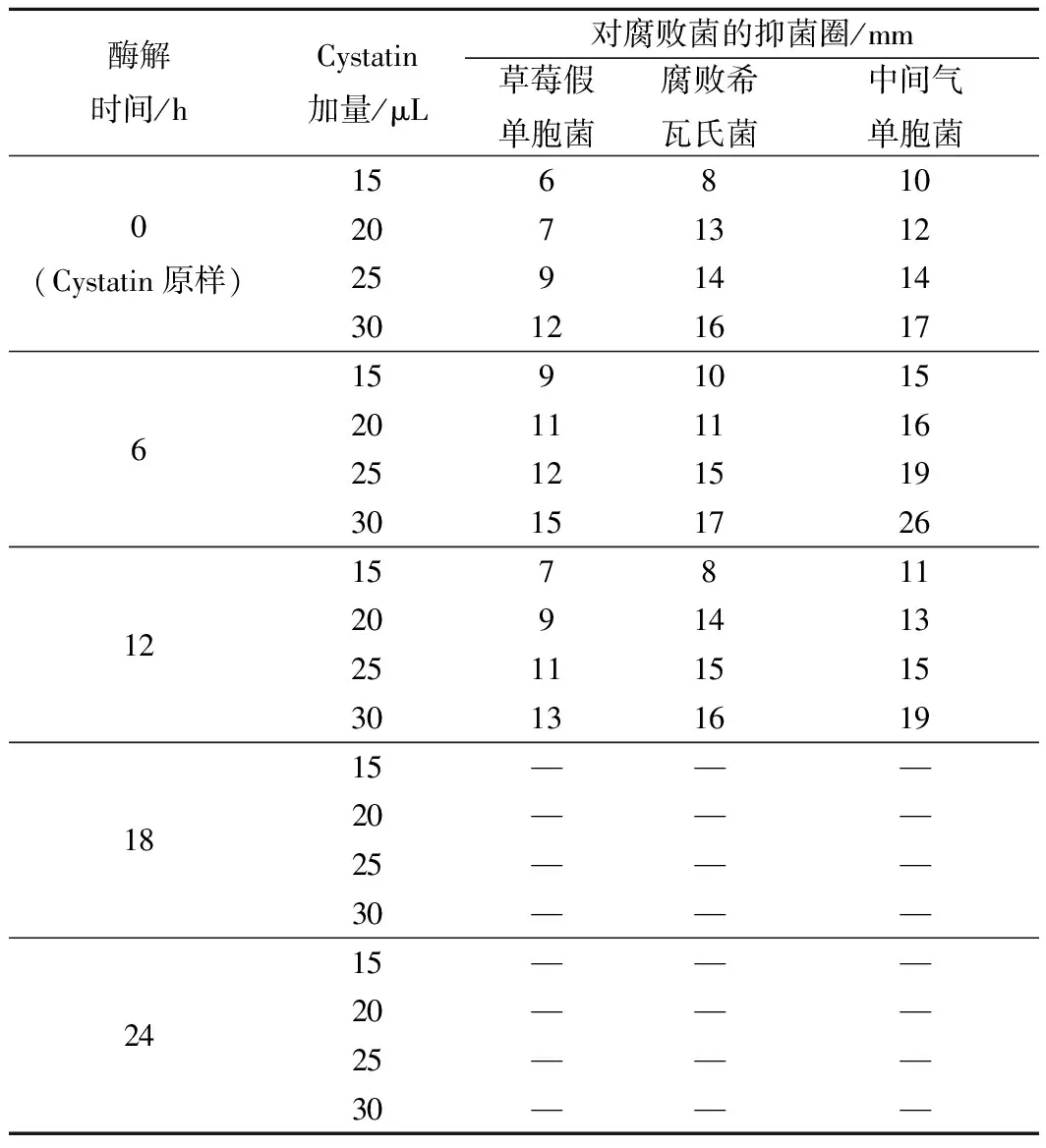
表1 Cystatin不同酶解時間酶解物對腐敗菌的抑菌效果Table 1 Inhibitory effect of cystatin enzyme of differenttime dominant spoilage strains
注:“—”表示沒有出現抑菌圈。

a-草莓假單胞菌; b-腐敗希瓦氏菌; c-中間氣單胞菌;
A-Papain對照; B-Cystatin 15 μL/片; C-Cystatin 20 μL/片; D-Cystatin 25 μL/片; E-Cystatin 30 μL/片
圖2 Cystatin 6 h酶解物對優勢腐敗菌的抑制作用
Fig.2 Inhibitory effect of cystatin 6 h enzyme on dominant spoilage strains
實驗中酶解后的Cystatin較Cystatin原樣對3種優勢腐敗菌的抑菌效果強,可能是由于Cystatin酶解后其內部的抑菌序列暴露出來,增強了抑菌效果。Cystatin酶解6 h的酶解物較Cystatin酶解12 h對3種腐敗菌的抑菌效果好,可能是因為不同酶解時間Papain酶解Cystatin的產物不同。由此,推測實驗所得的具有抑菌活性的片段很可能是來自Cystatin的降解物,有必要對所得的目的抑菌片段做進一步鑒定。
2.3 目的抑菌片段的分離純化及抑菌效果
將酶解6 h后的重組Cystatin小肽片段通過TSK-GEL G2000SWXLHPLC進行分段收集,由圖3可知,水解后的樣在TSK圖上形成了4個不同大小的峰型,其保留時間分別為13.0 min(T-1)、21.5 min(T-2)、25.0 min(T-3)、26.0 min(T-4),分別收集各峰,于-80 ℃冷凍干燥備用。通過濾紙片法鑒定各峰的抑菌活性,發現僅峰T-2對3種腐敗菌具有抑菌效果,其結果如圖4所示,當Cystatin的加量為15、20、25、30 μL/片時,對草莓假單胞菌抑菌圈直徑分別為12、13、15、18 mm;對腐敗希瓦氏菌抑菌圈直徑分別為16、18、20、21 mm;對中間氣單胞菌抑菌圈直徑分別為20、22、29、33 mm。

圖3 Papain酶解重組Cystatin蛋白6 h樣上TSK-GEL G2000SWXLHPLC
Fig.3 Papain enzymatic hydrolysis of recombinant Cystatin for 6 h and identified by TSK-GEL G2000SWXLHPLC

a-草莓假單胞菌; b-腐敗希瓦氏菌; c-中間氣單胞菌;
A-Papain對照;B-Cystatin 15 μL/片;C-Cystatin 20 μL/片;D-Cystatin 25 μL/片;E-Cystatin 30 μL/片
圖4 TSK回收峰2對優勢腐敗菌的抑制作用
Fig.4 Inhibitory effect of TSK peak 2 on dominant spoilage strains
2.4 目的抑菌片段的TSK-GEL G2000SWXLHPLC鑒定
將Cystatin酶解后經TSK-GEL G2000SWXL分離收集的具有抑菌效果的峰T-2的凍干粉復溶后進行檢測,結果如圖5所示,保留時間為21.5 min,根據峰尖處的Ve/V0值,經標準曲線公式計算其分子質量為8.6 ku,且純度較高。

圖5 TSK gel G2000 SWXLHPLC鑒定目的抑菌片段
Fig.5 TSK gel G2000 SWXLHPLC identification bacteriostatic fragments
2.5 雙向電泳鑒定目的抑菌片段
將目的抑菌片段經1 ku超濾杯濃縮后透析除鹽,經雙向電泳檢測,在靠近標準10 ku附近有1條單一條帶(如圖6),可知其分子質量為8.6 ku,pI值為6.5,與Cystatin酶解結果基本一致。

圖6 目的抑菌片段的雙向電泳圖譜
Fig.6 2-DE Patterns of antimicrobial fragments
2.6 質譜鑒定目的抑菌片段
質譜產生的文件通過導入Protein Pilot 5.0 software(AB SCIEX)進行鑒定,結果見表2,其質譜圖見圖7。經質譜分析鑒定到3個肽片段,經UniProt數據庫對比后發現這2個肽片段序列與鰱魚Cystatin氨基酸序列(登記號:KF181446序列)完全相符,分別為31QSNDAFVR38、46VQQQVAAGMKY56以及81NPSIEQVIQ89,并且其中的肽段2肽序列含有Cystatin的特征序列QVAAG,因此,說明其有效抑菌片段來自鰱魚Cystatin本身酶解后的片段。

表2 目的抑菌片段的質譜鑒定結果Table 2 Identification of bacteriostatic fragments of thetarget
注:1)得分:ProteinPilot軟件得分,>1.3即為可信;2)95%覆蓋率:可信度大于95%的肽段占整個蛋白的覆蓋率;3)95%置信區間:置信區間大于95%的肽段數,一般最好取≥2的肽鏈,1個也可接受。

a-序列: QQQVAAGMK; b-序列: QSNDAFVR; c-序列: NPSIEQVIQCK
圖7 Papain酶解Cystatin抑菌肽片段質譜圖
Fig.7 A mass-spectrogram of Bacteriostatic Fragments of Papain enzymatic hydrolysis of recombinant Cystatin
3 討論
目前,已有大量的研究報道了重組Cystatin具有抑菌作用,如人重組Cystatin 9能抑制土拉桿菌(Francisellatulareusis)的生長[8],重組莧菜Cystatin可以抑制多種植物病原真菌[32],以及甘蔗重組Cystatin能抑制里氏木霉(Trichodermareesei)的生長[33]。而關于魚類Cystatin(家族II)的抑菌作用鮮有報道[22, 34]。
Cystatin作為一種半胱氨酸蛋白酶抑制劑,其對細菌的抑制機制,主要涉及以下幾個方面。其一是通過抑制細菌分泌的胞外半胱氨酸蛋白酶(Cysteine Proteinase,CP)而發揮抑菌作用[30]。其二可能是Cystatin可穿透細胞膜進入細胞質,擴散到細胞內部抑制其細胞內蛋白酶的水解活性[2]。其三可能是Cystatin的N端與CP相互作用的保守序列,能與細菌生物膜上的負電荷相結合而發揮抑菌作用[35]。其四,Cystatin內部具有的抑菌氨基酸序列,這些抑菌片段可能干擾了微生物的肽轉運系統[24],而與Cystatin抑制CP無關[36-37]。綜上可見,Cystatin抑菌也可能是多種機制聯合作用的結果。
本實驗中,Cystatin經適宜時間(6 h)酶解后的產物,相對于0、12、24 h組,對3種優勢腐敗菌的抑菌效果最好,因此推測此時具有抑菌活性的片段很可能被完全釋放出來。本實驗鰱魚重組Cystatin酶解后分離得到分子質量約為8.6 ku的目的抑菌肽段,而通常Cystatin(家族II)的分子質量通常約為12~14 ku,因此判斷其為Cystatin的酶解產物。此外,經質譜鑒定到的3個肽序列,分別位于鰱魚Cystatin序列中的31QSNDAFVR38、46VQQQVAAGMKY56以及81NPSIEQVIQ89,再次證明該8.6 ku的目的抑菌肽來自于鰱魚Cystatin的酶解,即鰱魚Cystatin蛋白內部,存在能夠發揮抑菌作用的肽片段。同時,鰱魚Cystatin的N端起始氨基酸殘基至第89個氨基酸殘基(Q89),該片段的分子質量為9.986 ku,這也暗示該8.6 ku片段N端可能遭到了水解破壞,其N端氨基酸并非鰱魚Cystatin的起始氨基酸,故推測其抑菌機制可能不包括通過N端序列結合菌體而發揮作用的可能性,可能是與其內部序列有關。此外,由于該目的抑菌片段為小分子片段(8.6 ku),因此可能更容易穿透細胞膜進入細菌內部從而發揮抑制作用。鑒于Cystatin的多種抑菌機制,鰱魚重組Cystatin及其酶解產物對優勢腐敗菌的具體抑菌機制,還有待進一步深入探究。

