不同濃度環孢菌素A處理對牛肉宰后成熟過程中品質及細胞凋亡因子的影響
馬秀利,王琳琳,韓玲*,余群力,殷元虎,韓廣星,朱躍明
1(甘肅農業大學 食品科學與工程學院,甘肅 蘭州,730070) 2(黑龍江省畜牧研究所,黑龍江 齊齊哈爾,161005) 3(山東綠潤食品有限公司,山東 臨沂,276600) 4(張掖市萬禾草畜產業科技開發有限責任公司,甘肅 張掖,734000)
宰后成熟是肌肉在內環境改變條件下發生的復雜的生理生化反應過程,可提高肌肉品質,尤其能有效改善肌肉的嫩度及風味。目前關于宰后肌肉成熟嫩化的主要理論是肌肉結構變化及肌原纖維骨架蛋白的有限降解而使肌肉嫩化[1]。隨著肉品理論的不斷發展與完善,繼組織蛋白酶和鈣激活酶之后,細胞凋亡酶(Caspases)降解肌原纖維蛋白理論逐漸被認為是改善宰后肌肉嫩度的重要因素。CsA是一種從真菌中提取的含有11個氨基酸的環多肽,具有強烈的特異性作用[2]。大量研究表明CsA對細胞凋亡(apoptosis)的發生具有一定的調節作用,它能夠與線粒體通透性轉運孔(mitochondrial permeability transport pore,MPTP)的結構蛋白親環素D相互作用,通過調節MPTP的開放,間接調節Cyt-c從線粒體釋放到胞漿中,進一步調節apoptosis級聯反應的發生[3-4]。
Apoptosis又稱細胞程序性死亡,其在生物體的進化、內環境穩定以及多個系統的發育中起重要作用[5]。Apoptosis對肌肉的嫩化作用是近年來肉品科學研究的熱點,尤其在apoptosis對肌原纖維蛋白降解方面國內外學者做了大量研究。陳琳[6]研究指出凋亡誘導劑喜樹堿、依托泊苷及Ca2+均能提高肌原纖維的水解;HUANG等[7]利用Caspase-3的選擇性抑制劑DEVE-CHO處理宰后肌肉時發現,DEVE-CHO可以抑制肌肉骨架蛋白的降解,以上研究說明Caspases能夠降解肌細胞骨架蛋白進而改善肌肉嫩度。此外,賈青[8]、孫志昶等[9]、ZHANG等[10]研究發現apoptosis與其他肉品質特征如保水性、色澤顯著相關。有關Caspases對宰后肌肉嫩度改善的相關研究報道較多,但有關MPTP抑制劑CsA對宰后肌肉apoptosis的發生及其對肌肉品質影響機制的相關研究,國內外鮮有報道。
本研究以不同濃度CsA溶液處理的牛背最長肌肉樣為研究對象,通過測定肌肉宰后成熟過程中品質指標(pH值、色澤、保水性及嫩度)和apoptosis因子(胞漿Cyt-c含量、Caspase-9、Caspase-3活性)等指標的變化,研究CsA處理對apoptosis的影響作用,并探究apoptosis的發生對宰后肌肉品質的影響,以期為apoptosis改善肌肉品質提供理論依據。
1 材料與方法
1.1 試驗材料與試劑
試驗材料:肉牛由張掖博峰肥牛開發有限公司提供,選擇在同一牧場,生長發育正常,健康無病,體重均勻,平均年齡2~4 歲的肉牛8頭,公母各半,宰前禁食16~18 h,禁水2 h,屠宰后立即取牛胴體中部背最長肌肉樣,置于0~4 ℃環境下成熟。
試驗試劑:Caspase-9、3活性測定試劑盒,北京普利萊基因技術有限公司;環孢菌素A、細胞色素C、二甲基亞砜、連二亞硫酸鈉、蔗糖、乙基苯基聚乙二醇、2-氨基-2(羥甲基)-l,3-丙二醇(Tris)、酒石酸鉀鈉、KCl、MgCl2、EDTA、K3PO4、NaN3、CuSO4、HCl、NaCl等,以上試劑均為分析純。
1.2 儀器與設備
TGL-16M型離心機,長沙湘儀離心機儀器有限公司;XHF-D-型高速分散器(內切式勻漿機),寧波新芝生物科技股份有限公司;FA2004B型電子天平,上海佑科儀器有限公司;C-LM4 型數顯式肌肉嫩度儀,上海精密科學儀器有限公司;SPectramax M2型酶標儀,美國美谷分子儀器有限公司;DNP-9162型水浴鍋,上海精宏實驗設備有限公司;CR-10型色差計,柯尼美能達有限公司;HI99163型便攜式pH計,意大利哈納HANNA儀器公司。
1.3 試驗方法
1.3.1 樣品采集與處理
宰后立即取牛胴體中部背最長肌肉樣,去除表面脂肪、筋腱及結締組織后,分割為每塊100 g左右的肉樣,按照肉液比10∶1的比例,將4種濃度0.10、0.20、0.25、0.30 mol/L 的CsA溶液均勻注射進肉塊中,不作任何處理的肉樣為對照組;采用托盤包裝,在0~4 ℃環境下成熟。在成熟時間點12、24、48、96及144 h分別測定pH值、肉色、蒸煮損失及剪切力等指標,測定之前用濾紙吸去肉樣滲出的汁液,對于肌原纖維小片化指數(MFI)、胞漿Cyt-c含量及Caspase-9、3活力等不便立即測定的指標,將肉樣在設計時間點采集并用液氮迅速冷卻后置于-80 ℃凍藏待測。
1.3.2 pH值測定
將便攜式pH計的探針插入肉樣中,使pH計的電極與肌肉組織充分接觸,讀數穩定后記錄數據,每個肉樣重復測定3次,取平均值。
1.3.3 肉色測定
測定肉樣表面的L*值、a*值和b*值,將肉樣切開形成新的橫斷面并在室溫下氧合40 min,色差計進行白板校正后,將色差儀探頭垂直放在樣品橫斷面上進行測量,每個肉樣重復測定3次,取平均值作為該肉樣的色差值。
1.3.4 蒸煮損失
將長×寬×高不少于6 cm×3 cm×3 cm的肉樣,修整去除肉塊表面的脂肪和結締組織,稱重記為Ma,80 ℃恒溫水浴加熱,用數顯溫度計記錄加熱過程中肉塊的中心溫度。當中心溫度達到75 ℃時,恒溫保持5 min后取出冷卻至室溫,再次稱重記為Mb,蒸煮損失計算公式為:
蒸煮損失/%=(Ma-Mb)/Mb×100
(1)
式中:Ma為蒸煮前肉樣質量;Mb為蒸煮后肉樣質量。
1.3.5 嫩度
1.3.5.1 剪切力
剪切力肉樣處理方法同蒸煮損失測定方法,用剪切力儀測定剪切力,每組重復3次,取平均值。
1.3.5.2 MFI
參考DELGADO等[11]的方法并稍作修改。測定取2 g肉樣,加20 mL的MFI緩沖液(100 mmol/L KCl、20 mmol/L K3PO4、1 mmol/L EDTA、1 mmol/L MgCl2、1 mmol/L NaN3,pH 7.1),然后勻漿(10 000 r/min,勻漿時間12 s/次,間隙30 s,連續5次,在冰水浴下進行)。勻漿液在4 ℃條件下1 000×g離心15 min,棄去上清液。沉淀用8 mL的MFI緩沖液懸濁、再離心,棄去上清液。沉淀用5 mL的MFI緩沖液,用200目尼龍篩網過濾該懸濁液,另用5 mL MFI緩沖液幫助肌原纖維蛋白通過濾網。過濾所得的肌原纖維蛋白懸濁液用雙縮脲法測定其蛋白含量,然后用MFI緩沖液將其質量濃度稀釋至0.5 mg/mL,然后在540 nm下測定其吸光度,將結果乘以200,即為MFI。
1.3.6 胞漿Cyt-c含量
參考辛國榮等[12](2007)方法并稍作修改。取組織塊在冷水的生理鹽水中漂洗除去血液,濾紙拭干,稱重。加預冷勻漿介質(pH 7.4,0.1 mol/L Tris-HCl,1 mmol/L KCl,1 mmol/L EDTA-2Na,0.25 mol/L蔗糖(均用去離子水配制)的體積總量是組織塊重量的9倍,進行組織勻漿(10 000 r/min,勻漿時間12 s/次,間隙30 s,連續5次,在冰水浴下進行)。勻漿液經離心(2 000 r/min,10 min),棄沉淀。取上清液以18 000 r/min(低溫高速離心機)離心15 min,上清液即為胞漿。取4 mL待測胞漿樣品,加少許連二亞硫酸鈉(0.025 g),振搖后,在520 nm處測定吸光度,由標準曲線計算其濃度。
1.3.7 Caspase活力
1.3.7.1 Caspase-9活力
按照Caspase-9活性檢測試劑盒說明書對Caspase-9的活性進行測定,并稍作修改。取90 mg組織肉樣,剪碎后加入150 μL Caspase-9裂解液,用玻璃勻漿機于4 °C勻漿30次。勻漿液于4 ℃,10 000g離心10 min,離心完畢后取上清液待測。取85 μL Caspase-3反應緩沖液,10 μL待測上清液,5 μL 2 mm Caspase-9反應底物Ac-LEHD-AMC,依次加入96孔酶標板中,對照孔加入95 μL反應緩沖液,5 μL Caspase-9反應底物DEVD-pNA,用封口膜封住,置于37 ℃恒溫箱中反應1~2 h,取下封口膜,用酶標儀在405 nm處測定吸光度值。
1.3.7.2 Caspase-3活力
按照Caspase-3活性檢測試劑盒說明書對Caspase-3的活性進行測定,并稍作修改。樣品處理及操作同Caspase-9活性檢測方法,用酶標儀在405 nm處測定吸光度值。
1.4 統計分析
試驗結果均采用平均值 ± 標準差表示,用SPSS 19.0統計分析軟件進行數據處理,多重比較分析采用Duncan法(p<0.05),用Origin 8.5作圖軟件進行圖形制作。
2 結果與分析
2.1 不同濃度CsA處理對肌肉pH值的影響
由圖1可知,隨著成熟時間的延長,對照組及處理組pH值均呈先下降后上升的變化趨勢。對照組pH值在宰后96 h下降到最小值為5.56,隨后緩慢上升(p<0.05);處理組pH值在96 h下降到最小值,隨后緩慢上升(p<0.05)。12~48 h,處理組pH值均高于對照組,且pH值隨CsA濃度的增加而升高,但0.25 mol/L處理組pH值均高于其他處理組,且0.10和0.20 mol/L處理組、0.25和0.30 mol/L處理組的pH值無顯著差異(p>0.05)。
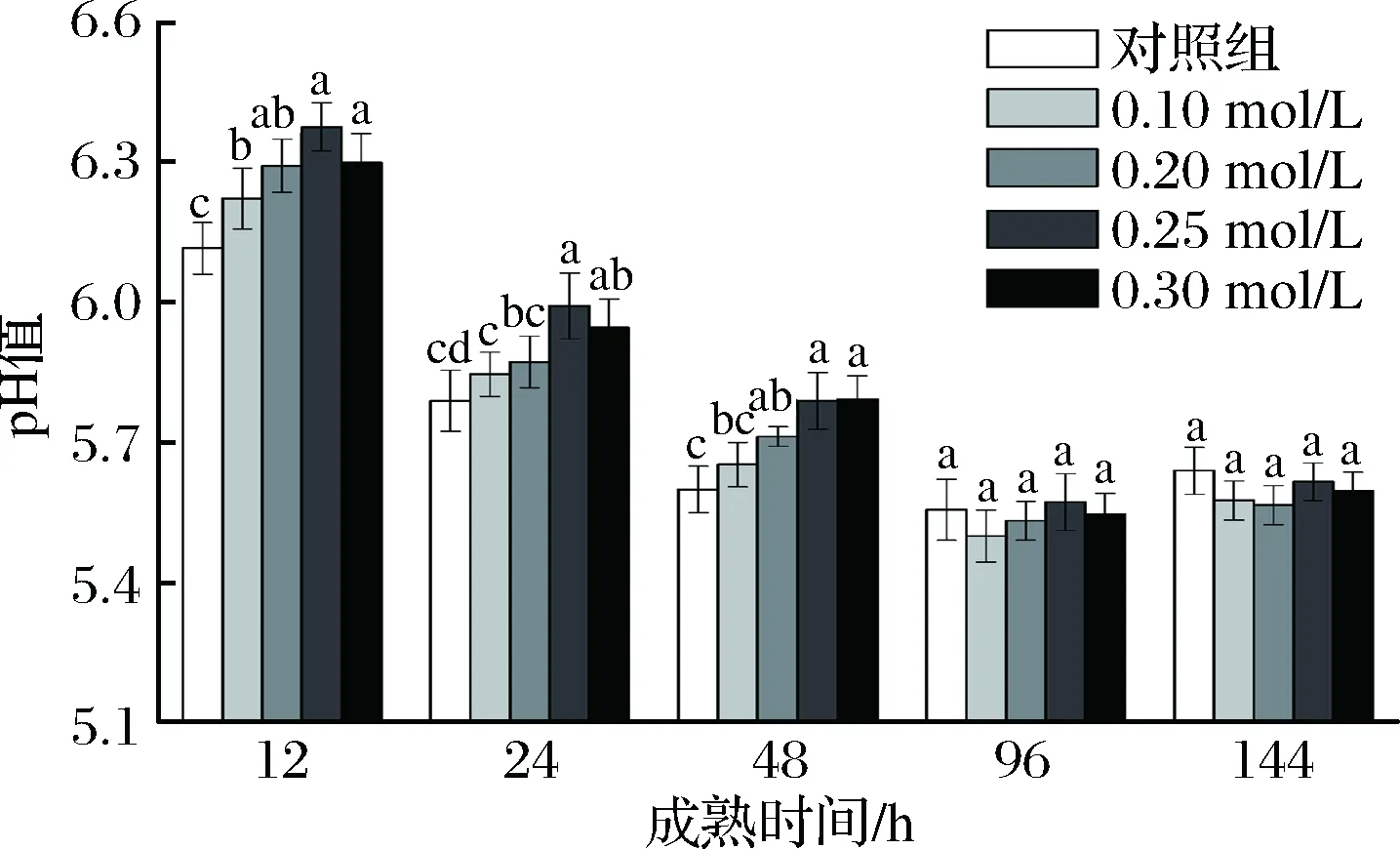
圖1 不同濃度CsA處理對肌肉pH值的影響
Fig.1 Effect of different concentrations of CsA treatment on pH value of muscle
注:圖中不同字母表示同一時間點不同處理濃度的差異顯著(p<0.05),下同。
2.2 不同濃度CsA處理對肌肉色度的影響
肉色是消費者評定肌肉外觀的重要指標,其與肌紅蛋白含量、肌纖維類型和狀態及水分分布有很大關系[13]。由圖2可知,隨著宰后成熟時間的延長,對照組及處理組L*值、a*值、b*值均呈先上升后下降的變化趨勢。對照組L*值、b*值均在96 h達到最大值,隨后L*值顯著下降(p<0.05);對照組a*值在宰后24 h達到最大值19.77,隨后呈下降趨勢,但差異不顯著(p>0.05)。處理組L*值均在宰后48 h達到最大值,按濃度遞增順序L*值峰值分別為37.01、38.87、39.80、39.37,隨后顯著下降(p<0.05);12~48 h,處理組的L*值均高于對照組,且0.25 mol/L處理組L*值均高于其他處理組,但各處理組L*值差異不顯著(p>0.05)。處理組b*值變化情況與L*值變化情況類似,在宰后48 h達到最大值,隨后顯著下降(p<0.05);12~48 h內,處理組b*值均高于對照組,且b*值的上升呈溶液濃度依賴變化,但0.25 mol/L處理組b*值均高于其他處理組。處理組a*值在宰后24 h達到最大值,隨后顯著下降(p<0.05)。12~96 h,對照組a*值均高于各處理組,且隨處理濃度的增加a*值呈下降趨勢,0.10 mol/L處理組a*值在12~96 h內均高于其他處理組,0.30 mol/L處理組a*值在12~48 h均低于其他處理組a*值,但差異不顯著。

圖2 不同濃度CsA處理對肌肉L*(A)、a*(B)、b*(C)值的影響
Fig.2 Effects of different concentrations of CsA treatment on L*(A), a*(B), b*(C) value of muscle
2.3 不同濃度CsA處理對肌肉蒸煮損失的影響
由圖3可以看出,對照組及處理組蒸煮損失呈先上升后下降的變化趨勢。12~96 h內,對照組蒸煮損失顯著上升,并達到最大值為34.21%,隨后顯著下降(p<0.05);0.10和0.30 mol/L 處理組蒸煮損失在96 h顯著上升并達到最大值分別為35.65%、38.31%,隨后顯著下降(p<0.05),0.25 mol/L和0.25 mol/L處理組蒸煮損失在48 h達到最大值分別為36.34%、38.87%,隨后顯著下降(p<0.05)。在12~144 h,處理組蒸煮損失均顯著高于對照組,除0.30 mol/L處理組外,12~48 h,0.25 mol/L處理組蒸煮損失均高于其他處理組,且各處理組之間蒸煮損失無顯著差異(p>0.05)。

圖3 不同濃度CsA處理對肌肉蒸煮損失的影響
Fig.3 Effects of different concentrations of CsA treatment on the cooking loss of muscle
2.4 不同濃度CsA處理對肌肉嫩度的影響
剪切力是肉嫩度最直接的反映,肌肉越嫩其剪切力越低。MFI代表肌原纖維蛋白被降解及肌原纖維結構破壞的程度,能夠反映出肌肉成熟進行的程度[14]。由表1可以看出,隨著宰后成熟時間的延長,對照組及處理組剪切力均呈先上升后下降的變化。對照組剪切力在96 h達到最大值8.39 kgf,隨后顯著下降(p<0.05);各處理組剪切力在宰后96 h也均達到最大值,按濃度遞增順序,依次為8.66、9.19、9.90和10.00 kgf,隨后顯著下降(p<0.05)。12~144 h,0.3 mol/L處理組剪切力均高于其他處理組,0.10 mol/L處理組剪切力在各時間點均顯著低于其他處理組(p<0.05),且隨CsA處理濃度增加剪切力增大。

表1 不同濃度CsA處理對肌肉剪切力和MFI的影響Table 1 Effects of different concentrations of CsA treatment on the shear force and MFI of muscle
注:同列不同字母表示差異顯著(p<0.05),下同。
說明剪切力的變化呈CsA處理濃度依賴變化。由表1可知,在整個成熟過程中,對照組及處理組MFI均呈顯著上升趨勢(p<0.05)。宰后144 h,對照組MFI顯著上升到最大值72.30(p<0.05);處理組MFI均達到最大值,按濃度遞增的順序分別為65.07、63.00、62.13、60.32(p<0.05),說明MFI的變化呈濃度依賴變化。12~144 h,處理組MFI均低于對照組MFI,且隨CsA處理濃度增加MFI呈下降趨勢,12~96 h,0.30 mol/L處理組MFI均低于其他處理組,0.10 mol/L處理組MFI均高于其他處理組。
2.5 不同濃度CsA處理對肌肉胞漿Cyt-c含量的影響
Cyt-c是細胞凋亡途徑中的凋亡誘導因子,在細胞發生凋亡過程中起重要作用[15]。由表2可以看出,隨著成熟時間的延長,對照組胞漿Cyt-c含量呈先顯著下降后顯著上升的趨勢(p<0.05),CsA處理組胞漿Cyt-c含量呈逐漸增加的趨勢(p<0.05)。宰后12~24 h,對照組胞漿Cyt-c含量顯著下降并達到最小值0.48 mmol/L,隨后顯著上升(p<0.05);宰后12~144 h,處理組胞漿Cyt-c含量均達到最大值,按濃度遞增的順序胞漿Cyt-c含量分別為0.58、0.56、0.55、0.51 mmol/L。宰后12~144 h,除24 h外,處理組胞漿Cyt-c含量均低于對照組,且隨CsA處理濃度增加而降低;48~144 h,0.30 mol/L處理組胞漿Cyt-c含量均低于其他處理組,且0.10 mol/L處理組Cyt-c含量變化與之相反;除0.10 mol/L處理組外,各處理組胞漿Cyt-c含量在成熟期間無顯著差異(p>0.05)。

表2 不同濃度CsA處理對肌肉胞漿Cyt-c含量的影響Table 2 Effects of different concentrations of CsA treatment on cytoplasm Cyt-c content in muscle
2.6 不同濃度CsA處理對肌肉Caspase活力的影響
在細胞凋亡的線粒體途徑中,Caspase-9作為凋亡的啟動因子,它可召集并激活凋亡效應酶Caspase-3[5]。由圖4-A可以看出,隨著成熟時間的延長,對照組Caspase-9活性呈顯著下降的趨勢,CsA處理組Caspase-9活性均呈先顯著上升后顯著下降的趨勢(p<0.05)。0.10和0.20 mol/L處理組Caspase-9活性在24 h顯著上升并達到最大值分別為1.414、1.302,0.25和0.30 mol/L處理組Caspase-9活性在48 h達到最大值分別為1.239、1.220,隨后顯著下降(p<0.05)。12~24 h,處理組Caspase-9活性均低于對照組,且隨CsA處理濃度增加而降低,在48 h,處理組Caspase-9活性顯著高于對照組(p<0.05);48~144 h,0.20 mol/L處理組Caspase-9活性降低速率均高于其他處理組,處理組Caspase-9活性降低速率隨CsA處理濃度增加而降低。在整個成熟過程中,對照組及處理組Caspase-3活性均呈先顯著上升后顯著下降的趨勢(p<0.05)(圖4-B)。宰后12~24 h,對照組Caspase-3活性顯著上升并達到最大值3.051,隨后顯著下降(p<0.05);宰后12~48 h,處理組Caspase-3活性均達到最大值,按濃度遞增的順序Caspase-3活性分別為2.815、2.637、2.530、2.628,隨后顯著下降(p<0.05)。12~24 h,處理組Caspase-3活性均低于對照組,且隨CsA處理濃度增加而降低,在48 h,處理組Caspase-3活性顯著高于對照組;48~96 h,0.10 mol/L處理組Caspase-3活性降低速率均高于其他處理組,處理組Caspase-3活性降低速率隨CsA處理濃度增加而降低,12~48 h,0.30 mol/L處理組Caspase-3活性均低于其他處理組,且0.10 mol/L處理組Caspase-3活性變化與之相反;12~144 h,0.25及0.30 mol/L處理組Caspase-3活性無顯著差異。

圖4 不同濃度CsA處理對肌肉Caspase-9(A)和 Caspase-3(B)活力的影響
Fig.4 Effects of different concentrations of CsA treatment on Caspase-9 (A) and Caspase-3 (B) activity in muscle
3 討論
在成熟過程中,肌肉pH值呈先下降后緩慢上升的變化,原因可能是宰后缺血、缺氧環境,導致肌糖原無氧酵解產生乳酸及ATP分解產生磷酸根離子而使肌肉內酸性環境變化[16]。肌肉成熟過程中,因pH值、活性氧等變化導致線粒體Ca2+超載等的作用可引起線粒體外膜通透性增大,進一步使線粒體Cyt-c釋放至胞漿[17-18];注射不同濃度的CsA溶液使宰后肌肉MPTP關閉,維持了滲透壓及H+濃度的變化,限制了Cyt-c的釋放,并在一定程度上維持了有氧呼吸鏈完整,使得pH值下降緩慢,且濃度越高pH值下降越緩慢,但是當處理濃度達到0.30 mol/L時,pH值下降加快,這可能與CsA濃度增高促進非依賴性apoptosis途徑有關。
在宰后成熟過程中,對照組L*值、a*值和b*值均呈先上升后下降的變化趨勢。L*值增大可能是由于肌肉內部水分滲出,堆積于肌肉的表面,增加了肌肉對光的反射能力[19];脫氧肌紅蛋白暴露在空氣中迅速氧合,進而氧合肌紅蛋白的比例逐漸升高,肉色變得亮紅而導致a*值、b*值上升[20];隨著貯藏時間延長,氧合肌紅蛋白自動氧化,產生灰褐色的高鐵肌紅蛋白使肉色變暗導致L*值、a*值及b*值均呈下降趨勢,這與田甲春等[21]研究的宰后牛肉成熟過程中色澤變化情況類似。注射不同濃度的CsA溶液使宰后牛肉表面水分滲出嚴重、色素流失增加,導致牛肉變暗變黃,且濃度越高此現象越明顯。注射CsA溶液使肌肉的L*值高于對照組,a*值較對照組低、b*值較對照組高,這是注射CsA溶液后,肉樣中氧氣含量變化以及蛋白變性使得a*值降低、b*值增加。這與賈青[8]研究的向宰后牦牛肉中注射Caspase-3專一抑制劑DEVE后L*值和b*值升高、a*值降低結果一致。
宰后牛肉的蒸煮損失呈先上升后下降的趨勢。注射不同濃度CsA溶液使pH值下降減緩,極限值升高,同時部分蛋白質變性,外源溶液注入而使蒸煮損失增加,且濃度越高蒸煮損失越嚴重。OFFER等[22]研究發現在宰后成熟過程中,乳酸積累導致肉中的pH值下降并達到等電點時,能被蛋白質吸附和保持的水分減少,肌原纖維內部結構的排斥力減少,肌原纖維內部空間減小,導致水分流失嚴重,這與本研究對照組的研究結果相一致。
宰后牛肉成熟過程中剪切力呈先上升后下降的趨勢,這是宰后成熟過程中會發生尸僵導致肌肉收縮和內源酶作用解僵共同作用的結果[23]。MFI是肌原纖維降解情況的直接反映,隨著成熟時間的延長,蛋白質不斷降解產生小片段使得MFI不斷增加[24]。本研究中對照組剪切力和MFI變化情況與王莉[25]、TAN等[14]研究結果相類似。注射不同濃度CsA溶液后,剪切力高于對照組,MFI低于對照組,可能是由于CsA使蛋白降解速度變慢、解僵時間增加以及部分蛋白發生變性,故剪切力較高、MFI較低;隨著成熟時間增加,在內源酶的作用下,使成熟后期剪切力下降、MFI繼續上升。
宰后牛肉成熟過程中,胞漿中Cyt-c含量呈先下降后上升變化趨勢、Caspase-9活性呈逐漸下降的趨勢、Caspase-3活性呈先上升后下降變化趨勢。這是由于宰后早期肌肉缺氧使得線粒體通透性增加,Cyt-c釋放到胞漿使得胞漿Cyt-c含量增加,然后胞漿中Cyt-c與Apaf-1、Caspase-9前體、ATP/dATP結合成凋亡小體復合物,活化Caspase-9,進而活化Caspase-3[26-28];由于本實驗測定時間起始點是牛肉宰后12 h,肌纖維缺氧,胞漿Cyt-c含量較高,Caspase-9被活化而活性較高,而Caspase-3被Caspase-9激活時間短活性較低,隨著成熟時間延長,線粒體結構遭到破壞、膜通透性進一步增加,CsA抑制作用也減弱,ATP大量消耗,胞漿中Cyt-c含量大量增加,Caspase-9,Caspase-3活性均降低[29];對照組與曹錦軒[30]、王琳琳等[31]研究結果類似,同時也能反映出Caspase-9,Caspase-3被激活的先后順序。本研究中注射不同濃度CsA溶液后,胞漿中Cyt-c含量逐漸增加,但含量低于對照組,Caspase-9、Caspase-3活性先上升后下降,這是由于CsA致使肌肉線粒體MPTP開放程度不同,限制了Cyt-c釋放入胞漿,同時胞漿中Cyt-c與Apaf-1結合成復合物的時間和數量不同,Caspase-9、3活化程度不同,使得Caspase-9、3活性升高緩慢并低于對照組,apoptosis發生進程不同,進而對肌肉品質的影響存在一定差異。
4 結論
宰后成熟過程中,肌肉pH值隨CsA溶液濃度增加而升高;隨CsA溶液處理濃度增加,L*值、a*值及b*值均呈先升高后降低的趨勢,L*值和b*值的升高及a*值的降低均呈濃度依賴變化;處理組蒸煮損失均高于對照組,各組肉樣蒸煮損失均在96 h達到最大值。
宰后成熟過程中,處理組剪切力高于對照組,MFI及低于對照組,且上述指標的變化均隨CsA處理濃度的增加呈遞增或遞減的趨勢變化。
在成熟初期,處理組在12~48 h胞漿Cyt-c含量均低于對照組,且隨CsA處理濃度增加胞漿Cyt-c含量下降,處理組在12~24 h Caspase-9、3活性均低于對照組,且隨CsA處理濃度增加Caspase-9、3活性呈下降趨勢;CsA處理能夠影響宰后肌肉的品質變化,且各品質指標的變化均呈濃度依賴趨勢變化,同時CsA能夠抑制宰后肌肉apoptosis的發生進程。

