紅景天提取物對西藏缺氧地區肉仔雞早期免疫功能的影響
李 龍,劉鎖珠,張振倉
(1.楊凌職業技術學院動物工程分院,陜西楊凌 712100;2.西藏農牧學院動物科學學院,西藏林芝 860000)
近幾年,西藏商品肉雞的飼養量不斷增加。但在高海拔缺氧條件下,外來商品肉雞表現出死亡率高的特點,這也是造成高海拔地區肉雞飼養經濟損失的主要原因之一。Li等(2014)研究發現,在西藏林芝地區(平均海拔2900 m)飼養AA肉雞死亡率高達30%,其中飼養前期(1~14 d)死亡率占總死亡率的一半,缺氧引起的腹水死亡主要發生在中期(15~28 d)和后期(29~42 d),飼養前期的死亡率主要是非腹水引起的死亡。高海拔地區的缺氧環境使肉仔雞孵化率很低(田發益等,2001),西藏地區飼養的肉雞都是從內地購買并空運進藏,因此,降低早期過高的雛雞死亡率對西藏和其他高海拔地區養禽業的發展至關重要。
飼養前期肉仔雞免疫系統未發育成熟,更易受到病原菌感染,造成前期死亡率高,因此,飼養前期的免疫系統發育對肉雛雞來說非常重要(Bar-Shira等,2003)。已有大量研究表明,缺氧環境會影響動物機體的體液免疫和細胞免疫(McNamee等,2013;Clambey等,2012),本課題組前期研究也表明,缺氧會抑制肉雞免疫機能的發育,并與高海拔肉雞早期非腹水死亡率高有關(待發表)。多年生草本植物紅景天在歐洲和亞洲以其抗缺氧、抗抑郁和抗炎等作用已在臨床上得到廣泛應用,在體外、動物和臨床試驗中已證實,紅景天能增強機體免疫機能和調節機體的免疫反應(Recio等,2016;Chou等,2011)。但目前對紅景天提取物對肉雞早期免疫機能的影響還未見報道,因此,本試驗的目的是研究不同紅景天提取物添加水平對肉雞早期(0~14 d)死亡率和免疫機能的影響。
1 材料與方法
1.1 紅景天提取物制備 本試驗中紅景天來自西藏農牧學院校內人工種植,經本校相關專家鑒定為大花紅景天。取紅景天干燥根部用蒸餾水清洗,在陰涼處風干,用粉碎機將紅景天制成粉末,按質量體積比1:5(m/V)蒸餾水,室溫放置24 h(冷滲法)獲得紅景天水提物,將上層液體轉入另一容器中,殘渣重復上述操作4次。將所有紅景天水提物混合并用紗布過濾,8000 g離心2 min轉移上清棄去殘渣。上清利用旋轉蒸發儀進行干燥處理,結果顯示,1 g大花紅景天根部可以生產約0.18 g紅景天水提物粉末。通過液相色譜檢測提取物中紅景天苷、絡塞維和酪醇的含量分別為25.21、10.44 mg/g和 0.03 mg/g。
1.2 試驗動物與飼養管理 本試驗中所用的450只1日齡健康雄性AA肉仔雞從成都購買,出殼當天空運至西藏大學農牧學院實習牧場(平均海拔2986 m)。肉仔雞全程自由采食和飲水。飼養密度為15只/m3,第一周室溫保持在33 ℃,第二周室溫保持在28 ℃。光照制度為23 h光照,1 h熄燈。
1.3 試驗設計 450只1日齡雄性AA肉仔雞按體重隨機分為5組,每組6個重復,每個重復15只雞,試驗期為14 d。仔雞飼喂玉米為基礎的商品前期日糧。5個處理組分別在基礎日糧中添加0(對照組)、0.1%、0.15%、0.2% 和 0.4% 的紅景天水提物干粉。
1.4 樣品采集與測定 每天觀察雞群,統計死亡雞只數。在14日齡,利用抗凝采血管頸靜脈采血,血樣3000 g離心10 min,血漿保存于-80 ℃,用于測定血漿免疫球蛋白IgA,IgG和IgM。血漿免疫球蛋白水平通過ELISA試劑盒(武漢伊萊瑞特)測定,操作步驟按照說明書進行。免疫球蛋白的濃度通過標準品構建的標準曲線計算。
為測定肉雞特異性抗體免疫應答,本試驗選擇給雛雞口服抗原牛血清白蛋白(BSA)。Bar-Shira(2003)曾報道雞仔7日齡后才會出現特異性抗體應答,因此,本試驗從每個重復選取2只雞免疫BSA(每只雞每天5 mg),從8日齡到12日齡連續免疫5 d。最后一次免疫10 d后頸靜脈采血,3000 g離心10 min,收集血漿,通過ELISA方法檢測抗-BSA抗體的水平。通過連續稀釋免疫過BSA的雞血清繪制標準曲線,未稀釋的血清定為1000。
1.5 數據統計分析 試驗數據采用SPSS 17.0 one-way ANOVA進行單因素方差分析,差異顯著時用LSD法進行多重比較,P<0.05表示差異顯著,死亡率通過卡方檢驗進行統計,結果以“平均值±標準差”表示。
2 結果
2.1 死亡率 由圖1可知,與對照組相比,0.1%和0.15%紅景天提取物組對肉雞早期死亡率無顯著影響(P>0.05),但0.2%和0.4%紅景天提取物組顯著降低了肉雞早期死亡率(P<0.05)。
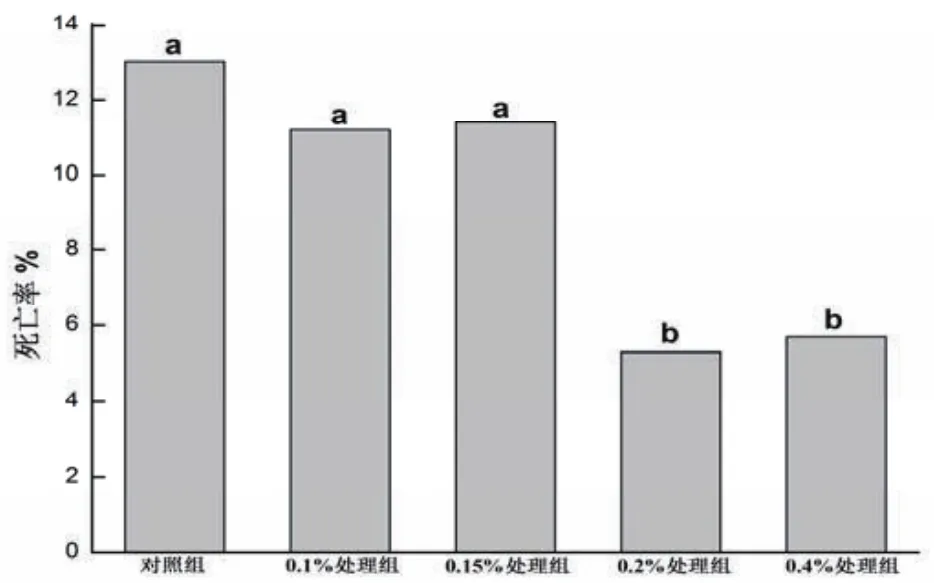
圖1 不同紅景天提取物添加水平對飼養早期肉雞死亡率的影響
2.2 血漿免疫球蛋白 由表1可知,在飼養期14 d,與對照組相比,0.2%和0.4%紅景天提取物組血漿中IgA和IgG水平顯著提高(P<0.05),0.1%和0.15%紅景天提取物組與對照組間無顯著差異(P>0.05)。所有處理組對血漿中IgM水平無顯著影響(P>0.05)。
2.3 BSA抗體滴度 由圖2可知,與對照組相比,0.2%和0.4%紅景天提取物組血漿中BSA抗體水平顯著提高(P<0.05),但0.1%和0.15%紅景天提取物組與對照組無顯著差異(P>0.05)。

表1 不同紅景天提取物添加水平對早期肉雞免疫球蛋白水平的影響????????????ng/mL
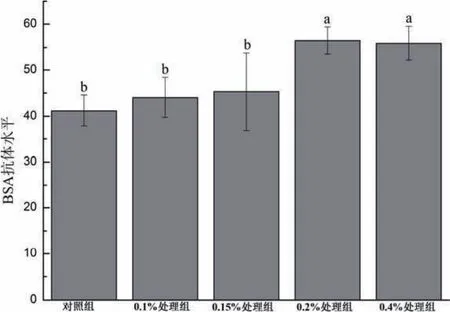
圖2 不同紅景天提取物添加水平對飼養早期肉雞BSA抗體水平的影響
3 討論
高原缺氧條件下,肉雞飼養早期死亡率偏高是制約高原地區肉雞飼養的一個重要問題。本研究發現,飼料中添加0.2%和0.4%紅景天提取物顯著降低高原缺氧條件下肉雞飼養早期(0~14 d)死亡率。高海拔地區肉雞飼養前期高的死亡率與缺氧引起的免疫機能發育受阻密切相關。缺氧應激會影響機體免疫應答反應,削弱免疫細胞的分化和功能,如T細胞和B細胞,進而影響免疫球蛋白和細胞因子的水平。Kleessen等(2005)研究發現,德國登山者在攀登過程中,血清中的IgA和IgM水平有降低趨勢。Chohan等(1975)發現,高海拔地區居民血清中的IgA和IgG水平顯著高于生活在海平面的居民,而且生活在海平面的居民達到高海拔地區兩年后,血清IgA和IgG水平也顯著高于海平面居民。本研究發現,與對照組相比,0.2%和04%紅景天提取物組顯著提高肉雞血液IgA和IgG水平。Mishra等(2010,2006)在體外和體內試驗中發現,紅景天提取物能改善不良狀態下的免疫抑制作用,但在正常情況下紅景天提取物對免疫的改善作用不明顯。本課題組通過對比高氧組(氧氣百分比25.8%~26.5%)和低氧組(氧氣百分比20.7%~21.4%)肉雞前期免疫機能發現,缺氧會削弱肉雞前期非特異性免疫應答,降低血液中免疫球蛋白IgA和IgG水平(數據待發表),證實了缺氧條件造成肉雞的免疫抑制。綜合以上結果說明,紅景天提取物能改善缺氧引起的肉雞免疫抑制。
除了改善肉雞的非特異性免疫應答,紅景天提取物還會改善肉雞特異性免疫應答。本試驗發現,飼料中添加0.2%和04%紅景天提取物能顯著提高血漿中特異抗原BSA的抗體水平。徐業芬等(2005)也發現,飲水或肌注紅景天提取物能顯著提高藏雞新城疫抗體水平,并且存在計量依懶性。在體外細胞模型和哺乳動物試驗中發現,缺氧影響免疫應答的原因可能是因缺氧會抑制TCR信號通路或誘導細胞凋亡,從而影響T細胞的功能(Sitkovsky等,2005)。此外,缺氧還會引起細胞氧化損傷。免疫細胞對氧化應激特別敏感,免疫細胞表面存在大量多不飽和脂肪酸膠,并且缺乏維生素E、鋅等抗氧化物質,這可能是缺氧影響免疫的另一個原因(Meydani等,1995)。但在家禽上,缺氧對免疫機能影響的機理可能會有不同,還需進一步研究。
4 結論
在本試驗中,日糧添加0.2%和0.4%紅景天提取物能顯著降低肉雞高原缺氧條件下飼養前期的死亡率,這與其能改善雛雞免疫機能有關,結合實際生產成本,以0.2%紅景天提取物添加量為最佳。
參考文獻
[1]田發益,朱洪云,趙曉玲,等.提高西藏地區蛋種雞孵化效果的綜合研究—氣體交換和濕度對蛋種雞孵化效果的影響[J].畜牧與獸醫,2001,33(5):6~ 17.
[2]徐業芬,牛加強.藏藥紅景天對藏雞 ND-HI 抗體水平的影響[J].畜牧與獸醫,2005,37(5):45 ~ 46.
[3]Bar-Shira E,Sklan D,Friedman A. Establishment of immune competence in the avian GALT during the immediate post-hatch period[J].Developmental & Comparative Immunology,2003,27(2):147~157.
[4]Clambey E T,McNamee E N,Westrich J A,et al. Hypoxiainducible factor-1 alpha-dependent induction of FoxP3 drives regulatory T-cell abundance and function during inflammatory hypoxia of the mucosa[J].Proceedings of the National Academy of Sciences,2012,109(41):E2784 ~ E2793.
[5]Chohan I S,Singh I,Balakrishnan K,et al. Immune response in human subjects at high altitude[J]. International journal of biometeorology,1975,19(3):137 ~ 143.
[6]Chou Lin S S,Chin L W,Chao P C,et al. In vivo Th1 and Th2 cytokine modulation effects of Rhodiola rosea standardised solution and its major constituent,salidroside[J].Phytotherapy research,2011,25(11):1604~1611.
[7]Kleessen B,Schroedl W,Stueck M,et al. Microbial and immunological responses relative to high-altitude exposure in mountaineers[J].Medicine & Science in Sports & Exercise,2005,37(8):1313~1318.
[8]Li L,Wang H,Zhao X. Effects of Rhodiola on production,health and gut development of broilers reared at high altitude in Tibet[J].Scientific reports,2014,4.
[9]McNamee E N,Johnson D K,Homann D,et al. Hypoxia and hypoxia-inducible factors as regulators of T cell development,differentiation,and function[J].Immunologic research,2013,55(1-3):58~70.
[10]Meydani S N,Wu D,Santos M S,et al. Antioxidants and immune response in aged persons:overview of present evidence[J].The American journal of clinical nutrition,1995,62(6):1462S~1476S.
[11]Mishra K P,Padwad Y S,Jain M,et al. Aqueous extract of Rhodiola imbricata rhizome stimulates proinflammatory mediators via phosphorylated IκB and transcription factor nuclear factor-κB[J].Immunopharmacology and immunotoxicology,2006,28(2):201~212.
[12]Mishra K P,Chanda S,Shukla K,et al. Adjuvant effect of aqueous extract of Rhodiola imbricata rhizome on the immune responses to tetanus toxoid and ovalbumin in rats[J].Immunopharmacology and immunotoxicology,2010,32(1):141~146.
[13]Recio M C,Giner R M,Má?ez S. Immunmodulatory and antiproliferative properties of Rhodiola species[J]. Planta medica,2016,82(11/12):952~ 960.
[14]Sitkovsky M,Lukashev D. Regulation of immune cells by localtissue oxygen tension:HIF1α and adenosine receptors[J]. Nature Reviews Immunology,2005,5(9):712 ~ 721.

