紅花清肝十三味對CCl4 誘導大鼠肝損傷纖維化的作用
楊宏昕,白音夫,常 亮,金 輝,魏艷沛,董珉翔,米裕青,劉 靜
(1.內蒙古自治區人民醫院,呼和浩特 010065;2.內蒙古自治區中醫藥研究所,呼和浩特 010020;3.內蒙古自治區國際蒙醫醫院,呼和浩特 010065;4.內蒙古自治區監獄管理局第一醫院,呼和浩特 010050)
紅花清肝十三味(國藥準字Z15020395,蒙藥名為古日古木-13)是治療肝病的蒙成藥,在中華人民共和國衛生部藥品標準蒙醫分冊中收錄[1],由紅花、丁香、蓮子、麥冬、木香、訶子、川楝子、梔子、紫檀香、人工麝香、水牛角濃縮粉、人工牛黃和銀朱組成,為肝熱癥[2]主要方劑,具有清肝熱、解毒作用,主治肝功衰退和腰腎損傷。臨床報道,紅花清肝十三味治療淤膽型肝炎有效率為86.6%[3],治療酒精性肝病有效率為96%[4],治療乙型肝炎有效率為93%[5],治療脂肪肝有效率為91%[6],對藥物性肝炎、病毒性肝炎也有較好的療效[7]。但紅花清肝十三味(HHQG)對實驗性肝損傷的作用報道較少。本文采用CCl4制備大鼠肝損傷模型,考察不同劑量HHQG對CCl4引起大鼠肝損傷及纖維化的防治作用,探討其可能的機制,為蒙藥抗肝損傷藥物的應用開發提供依據。
1 儀器與材料
1.1儀器 TGL-16型高速離心機(上海醫用分析儀器廠);BA210型光學顯微鏡(麥克奧迪有限公司);210紫外分光光度計(日本島津公司);DNM-9602酶聯免疫檢測儀(北京普朗新技術有限公司);42型半自動生化儀(英國BECKMAN公司)。
1.2試藥 紅花清肝十三味(HHQG,內蒙古蒙藥有限公司,批號1606028);聯苯雙酯滴丸(浙江萬邦藥業有限公司,批號20151113);天冬氨酸氨基轉移酶(AST)、丙氨酸氨基轉移酶(ALT)、乳酸脫氫酶(LDH)檢測試劑盒 (中生北控生物科技股份有限公司);丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽酶(GSH) (南京建成生物工程研究所);基質金屬蛋白酶原-1(MMP-1),基質金屬蛋白酶抑制因子-1(TIMP-1)試劑盒(上海海研醫學生物技術有限公司)。
1.3動物 Wistar大鼠,國家二級標準動物,SCXK(蒙字)2002-0001,雌雄各半,3周齡,體質量為90~110 g,由內蒙古大學實驗動物中心提供。
2 方法
2.1模型的制備與分組 取大鼠50只,室溫20~24 ℃、濕度70%的環境下飼養,標準飼料和自由飲水,喂養1周,記錄體質量。將大鼠分為對照組、模型組、陽性對照組(LBSZ 0.1 g·kg-1)和實驗藥物高、低劑量組(HHQG 2和0.2 g·kg-1),每組10只,按照每100 g體質量2 mL 灌胃給藥,對照組和模型組用等體積蒸餾水灌胃。除對照組外,其他各組動物按照文獻方法[8],以體積分數為25%四氯化碳(CCl4)玉米油溶液1 mL·kg-1,每隔4 d 皮下注射1次,共計20次。所有大鼠在整個實驗期間均喂標準飼料,自由飲水。第1次注射后開始灌胃給藥,對照組、HHQG高劑量組和低劑量組,每日1次;實驗結束后,動物禁食12 h,乙醚麻醉,腹主動脈收集血液,切取肝臟。
2.2肝體指數測定 取完整肝臟稱定質量,計算肝臟與體質量的比值。
2.3肝組織病理學觀察 從肝大葉處切下0.5 cm×0.5 cm×0.5 cm 的肝組織,用100 mL·L-1的甲醛固定。將固定好的肝組織做組織切片,HE染色,光鏡觀察肝臟組織病理學變化。
2.4血清酶測定 取血液,以4 000 r·min-1離心10 min,取上清,測定AST、ALT和LDH含量,按照試劑盒說明書操作。
2.5肝組織勻漿檢測 剪取一塊肝組織于預冷生理鹽水中漂洗,除去血液,濾紙吸干,分別稱取0.1 g 放入勻漿管,加入9 倍預冷生理鹽水,采用勻漿器研磨后,以4 000 r·min-1離心10 min,取上清液,制備成質量濃度為10 g·L-1的組織勻漿,用分光計測定SOD、GSH和MDA,酶聯免疫檢測儀測定MMP-1和TIMP-1,按照試劑盒說明書操作。

3 結果
3.1肝體指數測定 對照組大鼠肝體指數與模型組比較差異有統計學意義(P<0.05),LBSZ組與HHQG高劑量組肝體指數明顯低于模型組(P<0.05),HHQG低劑量組與模型組比較差異無統計學意義(P>0.05)。見表1。
表1各組大鼠體質量和肝體指數的變化
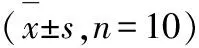

組別體質量/g肝體指數/mg·g-1對照組296.34±34.230.23±0.07模型組274.76±35.270.31±0.08?LBSZ組285.23±38.270.26±0.07??HHQG高劑量組289.47±33.260.27±0.07??HHQG低劑量組281.58±37.230.29±0.09
注:與對照組比較*P<0.05;與模型組比較**P<0.05。
3.2對肝損傷病理變化的觀察 見圖1。由圖1A可知,對照組肝組織形態、結構正常,肝小葉結構完整,肝細胞排列整齊,形態大小一致,肝索呈明顯的放射狀,匯管區無腫脹、脂變壞死和血管周圍無炎細胞浸潤與纖維化等病變;由圖1B可知,模型組肝組織呈多發性變性和壞死,肝細胞索排列紊亂,細胞混濁腫脹,空泡樣變性,枯否氏細胞增多,血竇擴張、瘀血,部分細胞核消失,細胞膜不完整,結構混亂,纖維化增生;由圖1C可知,LBSZ組肝小葉較完整,匯管區比較清晰,血管周圍見炎細胞浸潤,肝細胞變性、壞死,與模型組相比較,肝損傷明顯減輕;由圖1D可知,HHQG高劑量組肝小葉較完整,肝細胞濁腫變性輕于模型組,纖維增生不明顯,匯管區見炎細胞浸潤,與模型組比較,肝損傷明顯減輕;由圖1E可知,HHQG低劑量組肝細胞索排列紊亂,細胞混濁腫脹,細胞水腫和脂肪樣變,炎細胞浸潤,程度與模型組接近。結果表明,HHQG組對CCl4所引起的肝損傷具有改善作用。
3.3對血清酶的影響 對血清酶測定表明,模型組中ALT和AST和LDH含量與對照組比較均明顯升高(P<0.05),LBSZ組中ALT、AST含量均明顯低于模型組(P<0.05),HHQG高劑量組中ALT、AST和LDH含量均明顯低于模型組(P<0.05),HHQG低劑量組對ALT、AST和LDH含量無明顯影響(P>0.05)。見表2。

圖1大鼠肝損傷病理變化(HE×40)
A.對照組;B.模型組;C.LBSZ組;D.HHQG高劑量組;E.HHQG低劑量組。
Fig.1 Rat liver injury pathological changes (HE×40)
A.control group;B.model group;C.LBSZ group;D.HHQG high dose group;E.HHQG low dose group.
表2各組大鼠血清酶的比較
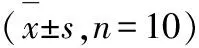

組別ALT/U·L-1AST/U·L-1LDH/U·L-1對照組68.26±15.72221.15±32.3134.33±8.63模型組156.77±22.49?325.11±47.28?59.21±12.31?LBSZ組98.45±20.70??285.53±38.18??47.78±11.22HHQG高劑量組112.31±21.31?274.31±35.41??43.76±10.73??HHQG低劑量組145.21±25.86298.65±43.2054.33±13.39
注:與對照組比較*P<0.05;與模型組比較**P<0.05。
3.4對肝組織勻漿中脂質過氧化的影響 結果表明,對照組大鼠肝勻漿組織中SOD和GSH水平明顯高于模型組(P<0.05),MDA明顯低于模型組(P<0.05);LBSZ組中MDA水平明顯低于模型組(P<0.05);HHQG高劑量組中SOD和GSH水平明顯高于模型組 (P<0.05),MDA 水平明顯低于模型組(P<0.05);HHQG低劑量組中SOD、GSH和MDA 水平與模型組比較無明顯變化(P>0.05)。見表3。
表3各組大鼠肝組織勻漿脂質過氧化作用的的比較
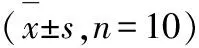

組別SOD/U·mg-1MDA/nmol·mg-1GSH/ng·mg-1對照組121.2±34.6?12.4±1.3?238.4±45.2?模型組194.7±42.517.8±2.4211.3±51.9LBSZ組146.2±45.6?14.3±2.3?228.7±51.7?HHQG高劑量組133.1±55.3?15.6±2.5?221.8±46.1?HHQG低劑量組169.1±58.718.5±3.6210.4±51.2
注:與對照組比較*P<0.05;與模型組比較**P<0.05。
3.5對肝組織勻漿中基質金屬蛋白酶的影響 模型組與對照組比較,MMP-1水平明顯降低(P<0.05),TIMP-1水平明顯升高(P<0.05),MMP-1/TIMP-1比值明顯降低(P<0.05);LBSZ組與模型組比較,TIMP-1水平明顯降低(P<0.05),MMP-1水平無明顯變化(P>0.05);HHQG高劑量組與模型組比較,MMP-1水平明顯升高(P<0.05),TIMP-1水平明顯降低(P<0.05),MMP-1/TIMP-1比值明顯升高(P<0.05);HHQG低劑量組與模型組比較,MMP-1、TIMP-1水平與MMP-1/TIMP-1比值無明顯變化(P>0.05)。見表4。
表4各組大鼠肝勻漿中MMP-1與TIMP-1的變化


組別MMP?1(A)TIMP?1(A)MMP?1/TIMP?1對照組0.150±0.0250.055±0.0112.73模型組0.104±0.021?0.067±0.015?1.20LBSZ組0.119±0.0280.062±0.013??1.92HHQG高劑量組0.120±0.023??0.060±0.011??2.00HHQG低劑量組0.112±0.0210.079±0.0161.26
注:與對照組比較*P<0.05,與模型組比較**P<0.05。A表示吸光度、光密度。
4 討論
CCl4中毒大鼠肝細胞變性和后期纖維化[9],脂質過氧化是其主要的肝損傷形成機制[10]。CCl4進入肝細胞后,被肝微粒體酶和細胞色素P450 激活生成三氯甲基自由基和氯自由基,通過氫鍵的吸附作用攻擊細胞膜磷脂質上的不飽和脂肪酸,使蛋白質變性交聯,引起膜結構的破壞,引起肝細胞病理性損傷[11],細胞外基質的增生與降解失去平衡,導致肝臟內纖維結締組織異常沉積形成纖維化。
研究表明,實驗性大鼠在CCl4作用下肝細胞出現病理性改變,血清酶升高,肝組織勻漿中SOD、GSH與MDA氧化與抗氧化平衡系統破壞;同時伴有細胞外基質蓄積,并伴有TIMP-1表達增加,MMP-1表達下降,表明細胞外基質合成增加分解下降,肝纖維化啟動[12]。
MDA是脂質過氧化的終產物,不僅能反映機體內氧化反應水平,也能作為損害因子對機體進行攻擊[13]。SOD廣泛存在于生物細胞中的重要金屬結合酶,能清除氧自由基而起到保護細胞的作用,其含量與體內活性氧負相關[14-15],GSH是以半胱氨酸、谷氨酸與甘氨酸為原料的三肽酶,參與體內氧化還原過程,對脂自由基及脂質過氧化自由基等基團具有較強的清除作用,保護細胞膜中含巰基的蛋白質和含巰基酶不被破壞[16];MMP-1與TIMP-1等細胞因子對肝損傷后的細胞外基質分解與合成起到調節作用,對肝纖維化發生具有重要作用[17-18]。高劑量HHQG可提高大鼠肝組織SOD與GSH水平,抑制MDA生成,通過降低肝組織的脂質過氧化,保護肝組織、降低肝細胞損傷程度及壞死程度,減少ALT、AST和LDH釋放;肝損傷MMP-1的作用減弱,TIMP-1的作用增強,細胞外基質分泌增強,分解減弱。HHQG調控MMP-1與TIMP-1平衡,從而減少細胞外基質合成分泌,達到調控肝纖維化的作用。
此外,HHQG主治蒙醫的肝熱證[2]。肝熱證包括肝損傷及纖維化的動態病理過程,肝熱證早期(損傷期)毒黏外襲、肝氣郁結,肝熱證晚期(纖維化期)肝郁血瘀,兼肝腎不足。由此清熱解毒、活血化瘀兼補肝腎是HHQG的治療原則。HHQG從臨床實踐中可知,清熱藥、解毒藥和活血化瘀藥可以抗病毒與抗脂質過氧化,終止氧化應激的鏈式反應,抑制膠原蛋白合成、促進分解[19-20];HHQG以不同性味配伍通過多靶點途徑達到抗肝損傷,調節肝纖維化的作用;上述為HHQG對肝熱證的蒙醫藥辨證論治的理論和臨床依據,另外,在蒙醫藥理論指導的處方配伍,藥物之間的相互作用,降低了毒性藥材的毒性,臨床使用未見不良反應的報道。
綜上所述,HHQG抗肝損傷是通過抗脂質過氧化實現的,同時通過對MMP-1與TIMP-1細胞因子平衡達到調節肝纖維化作用。
參考文獻:
[1] 中華人民共和國衛生部藥典委員會.中華人民共和國衛生部藥品標準:蒙藥分冊[S].1998:99.
[2] 白清云.中國醫學百科全書蒙醫學[M].上海:上海科學技術出版社,1992:204.
[3] 郝新芳.紅花清肝十三味丸治療瘀膽型肝炎60例[J].醫藥論壇雜志,2005,26(3):52,54.
[4] 娜仁花.蒙醫蒙藥十三味紅花散治療酒精性肝炎40例[J].中國中醫藥現代遠程教育,2013,11(8):30-31.
[5] 秦學,王銀虎.蒙藥古日古木13味丸治療急性黃疸型肝炎的療效觀察[J].中國民間療法,2015,23(3):68-69.
[6] 寶玉,郭永勝.蒙藥古日古木-13味治療脂肪肝32例[J].中國民族醫藥雜志,2006,13(3):16.
[7] 曹·其木格.蒙藥古日古木-13治療藥物性肝損害[J].中國民族醫藥雜志,2008,14(9):3.
[8] 楊宏昕,白音夫,米裕青,等.蒙古山蘿卜酸對實驗性肝纖維化大鼠MMP-1、TIMP-1、TGF-β1和PDGF表達的影響[J].西北藥學雜志,2017,32(4):477-480.
[9] 劉赴平,師玲玲.四氯化碳造成急性肝損傷大鼠模型的實驗研究[J].中國輸血雜志,2012,25(5):446-448.
[10]Lin X,Huang R,Zhang S,et al.Methyl helicterate protects against CCl4-induced liver injury in rats by inhibiting oxidative stress,NF-κB activation,Fas/FasL pathway and cytochrome P4502E1 level[J].Food Chem Toxicol,2012,50(10):3413-3420.
[11]Pinto C,Duque A L,Rodríguez-Galdón B,et al.Xanthohumol prevents carbon tetrachloride-induced acute liver injury in rats[J].Food Chem Toxicol,2012,50(10):3405-3412.
[12]姜憲輝,葉華,孫雷.MMP-1、TIMP-1 在肝纖維化組織中的表達及其病理意義[J].醫學信息,2008,21(12):2291-2293.
[13]郭又嘉,文坎,張士軍,等.玉郎傘皂苷對四氯化碳誘導大鼠肝纖維化的影響[J].中國藥理學通報,2012,28(4):554-558.
[14]莫簡.醫用自由基生物學導論[M].北京:人民衛生出版社,1989:204-213.
[15]王君明,崔瑛,王崢濤,等.超氧化物歧化酶參與肝損傷的研究進展[J].中國實驗方劑學雜志,2011,17(7):265-267.
[16]Anand K V,Anandhi R,Pakkiyaraj M,et al.Protective effect of chrysin on carbon tetrachloride (CCl4)-induced tissue injury in male Wistar rats[J].Toxicol Ind Health,2011,27(10):923-933.
[17]艾迎春,遲男男.肝硬化大鼠血清MMP-3、TIMP-1的表達水平與肝硬化進程的研究[J].黑龍江醫藥科學,2013,36(3):53-54.
[[18]聶青和,周永興,謝玉梅.肝硬化病人血清、肝組織中金屬蛋白酶組織抑制因子的表達及意義[J].中華醫學雜志,2001,81(13):805-807.
[19]劉亞鋒.氧化應激與肝臟保護[J].胃腸病學和肝病學雜志,2011,20(7):594-596.
[20]曉紅,白音夫.植物藥有效成分抗肝纖維化研究[J].中國民族醫藥雜志,2009,15(8);38-39.

