褪黑素受體Mel 1b基因mRNA和蛋白在鴨不同組織中的表達與分布
劉文舉,王淑娟,*,劉曉麗,龐訓勝,王立克
(1.安徽科技學院 動物科學學院,安徽 鳳陽 233100;2. 華中農業大學 動物醫學院,湖北 武漢 430070)
幾乎所有生物體都表現出生理和行為的日常節律,這些節律不僅受外界環境刺激的影響,如日光/黑暗周期,也受內源性生物鐘的影響。褪黑素的生產和分泌就表現出晝夜節律,且其可調節人和動物的節律性生理功能。褪黑激素是一種吲哚類神經激素,化學名稱為N-乙酰-5-甲氧基色胺,是神經內分泌系統的核心。20 世紀中期,Lerner 等[1]首次從牛的松果體中發現、分離并鑒定了該激素。在人和動物體內,褪黑激素主要由腦部的松果體分泌,其他周邊組織和細胞中也有部分的分泌。褪黑激素不僅存在于脊椎動物體內,在細菌、單細胞真核生物和植物等生物中也存在,這一發現表明了褪黑激素在生物進化過程中具有多樣性。褪黑激素是光照信息同動物日常行為和神經內分泌調節系統協調關系中的重要激素信號,其合成分泌與光照周期同步,呈現極顯著的晝夜節律和季節節律。大量臨床和實驗結果證明,褪黑激素作為內源性神經內分泌激素,對中樞神經系統有直接和間接的生理調節作用,在其他組織中褪黑激素也起到廣泛的作用,如調節睡眠和晝夜節律性[2-3],對免疫系統的調節[4]、抗氧化[5-6]、抗衰老[7],及對生殖系統的調節作用[8]。褪黑素對動物的生殖調控作用方式主要有間接作用和直接作用。褪黑激素分泌受光照的影響,其通過下丘腦-垂體-性腺軸(hypothalamus-pituitary-genital axis,HPG)的信號傳導調節季節性繁殖動物的生殖功能,且在下丘腦促性腺激素釋放激素(gonadotropin-releasing hormone,GnRH)釋放神經元、垂體前葉結節部、遠端促性腺細胞和泌乳細胞、睪丸和卵巢等部位的褪黑激素受體作用下完成[9-12]。研究表明,卵泡中褪黑素的濃度是松果體釋放血液中的褪黑素的3倍[13],進一步說明高濃度褪黑素對卵泡發育有著重要的作用,其可改善卵泡質量,促進卵泡成熟,對胚胎也起到保護作用[14]。褪黑激素生物學作用如此廣泛,提示機體中許多組織細胞是其作用的靶位點,褪黑激素發揮作用的第一步是與靶組織上的特異性受體結合,然后通過信號傳導系統而產生生物效應,因此研究褪黑激素受體在體內的分布及生物學特性對于闡明褪黑激素的作用機制十分重要。基于此,本實驗分析了褪黑素受體Mel 1b在鴨不同組織的表達分布,為研究褪黑素及其受體對鴨生殖功能的影響奠定基礎。
1 材料與方法
1.1 實驗對象
產蛋期母鴨6只,購于蚌埠種鴨場。頸靜脈放血屠宰,30 min內取心臟、肝臟、脾臟、肺臟、腎臟、大腦、胰臟、胸肌、卵巢組織,于液氮中保存備用。同時取大腦、肺臟、肝臟、胸肌、腎臟、心臟、胰臟組織于4%多聚甲醛固定備用。
1.2 主要試劑
總RNA提取試劑盒、dNTP MixTaqDNA聚合酶等均購自天根生化科技(北京)有限公司(中國);反轉錄試劑盒購自MBI Fermentas(立陶宛);免疫組化試劑盒購自武漢博士德生物工程有限公司(中國);褪黑素受體Mel 1b多克隆抗體購自北京博奧森生物技術有限公司(中國);熒光定量試劑盒購自Roche(瑞士)。
1.3 總RNA提取與RT-PCR
取冷凍于液氮中的組織樣本各約50 mg,在研缽中研磨成粉末狀,然后放入含有裂解液的試管中,充分混合均勻,按照RNA提取試劑盒說明提取總RNA,-80 ℃保存備用。
利用反轉錄試劑盒將所提取的各組織的總RNA反轉錄成cDNA。反轉錄程序和條件依照試劑盒說明進行,所得到的各組織的cDNA置于-20 ℃保存備用。
1.4 引物設計
參照GenBank中原雞(ID:396338)、斑馬魚(ID:30669)、非洲爪蛙(ID:100493509)的Mel1b基因序列的保守區域,利用Primer 5.0軟件優化設計1對引物。將GAPDH基因作為內參基因,其引物序列參照Duckett等[15]設計的引物序列,由上海生物工程有限公司合成,見表1。
1.5 PCR擴增
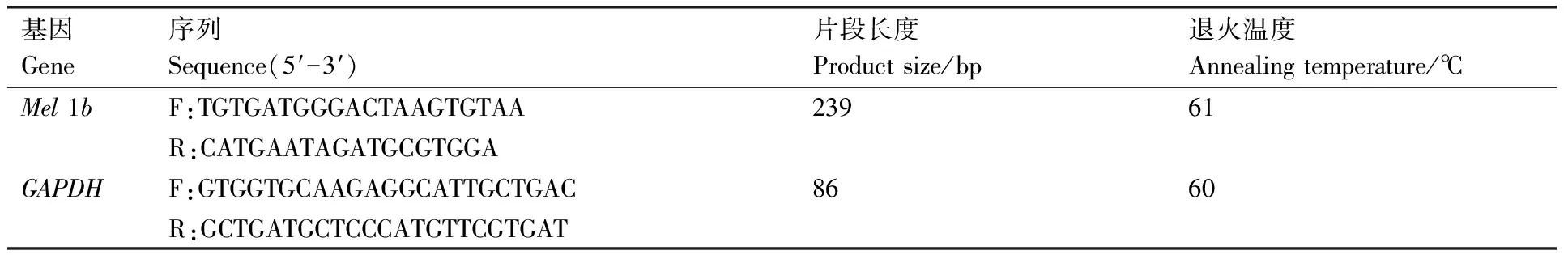
表1 鴨Mel 1b基因PCR擴增引物序列Table 1 Primers used in Mel 1b gene of duck for PCR
以反轉錄獲得的cDNA鏈為模板,利用PCR技術進行鴨Mel1b基因和內參基因的擴增,檢測不同組織中是否存在Mel1bmRNA的表達。PCR反應體系為:cDNA 1.0 μL,10 mmol·L-1正、反向引物各0.5 μL,10 mmol·L-1dNTP 0.5 μL,10×Buffer 2.5 μL,5 U·μL-1Taq酶0.5 μL,加ddH2O補至25.0 μL。PCR反應程序:94 ℃預變性5 min;94 ℃變性30 s,61 ℃退火30 s,72 ℃延伸45 s,35個循環;最后72 ℃延伸10 min。PCR產物保存在4 ℃。
得到的PCR產物用1.2%瓊脂糖凝膠電泳,在凝膠成像系統中觀察目的片段。如存在目的片段,用DNA凝膠回收試劑盒回收目的片段,送上海生物工程有限公司進行測序,鑒定基因序列。若回收的DNA片段經測序符合鴨Mel1b基因序列,則按照PCR反應體系和程序檢測鴨各組織中Mel1bmRNA的表達水平。
1.6 免疫組化
將4%多聚甲醛固定好的各組織樣品用常規石蠟包埋,4 μm厚連續切片,60 ℃恒溫箱中烘烤120 min,常規脫蠟至水。按照武漢博士德SABC法免疫組化試劑盒操作步驟,依次滴加抗原修復液、3% H2O2、5%脫脂奶粉封閉液和兔抗Mel 1b多抗,再滴加生物素化山羊抗兔二抗,DAB顯色,蘇木精復染細胞核1 min,鹽酸乙醇分化、脫水、透明、封片。顯微鏡下觀察Mel 1b蛋白的表達情況。
1.7 Real-time PCR
以反轉錄獲得的cDNA為模板,引物見表1,每個樣本重復3次。10 μL反應體系中加入5.0 μL含綠色熒光的2×Mix Buffer,2.0 μL cDNA模板,各0.5 μL 10 mmol·L-1的正、反引物,以ddH2O補至10 μL。反應程序見表2所示。
1.8 數據統計分析
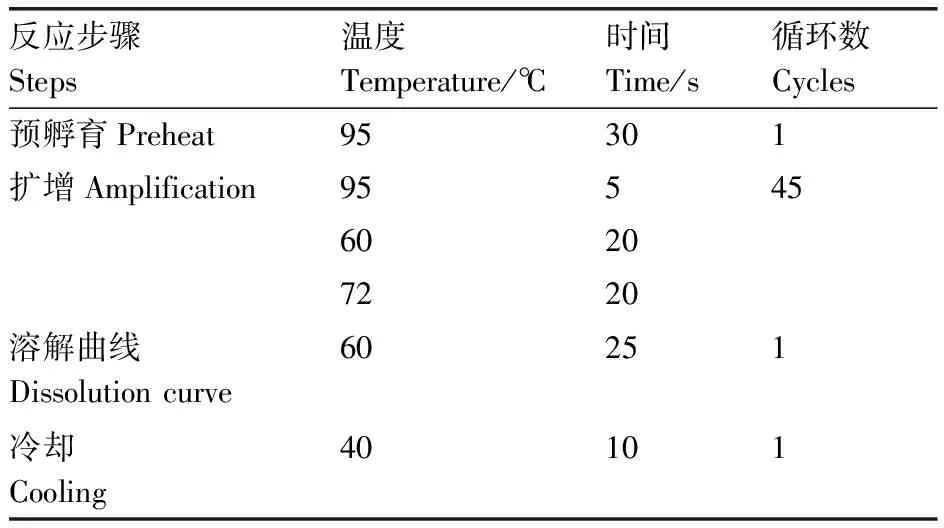
表2 Real time PCR 反應程序Table 2 Real time PCR experimental procedure
利用LightCycler 480系統軟件分析Real time PCR數據,以大腦組織中Mel1bmRNA表達量為參照,應用 2-ΔΔCt方法分析其他組織中的相對表達量。采用SPSS 11.0軟件作統計學分析,數據以平均值±標準差表示,P<0.05為差異顯著。
2 結果與分析
2.1 鴨各組織總RNA的提取
利用瓊脂糖凝膠電泳檢測提取的鴨各組織總RNA,結果表明,有兩條清晰的條帶,分別為28S和18S,且28S條帶比18S亮度高,表明提取的RNA質量較好,無降解,可保證后續實驗(圖1)。
2.2 Mel 1b mRNA組織表達譜
經PCR擴增獲得的鴨Mel1b基因,用1.2%瓊脂糖凝膠電泳檢測。PCR產物大小和預期大小相符,為216 bp(圖2)。經測序,其基因序列與GenBank中其他物種的Mel1b同源性很高,屬于鴨Mel1b基因。基于此,檢測鴨脾臟、心臟、腎臟、大腦、胸肌、卵巢、肺臟、肝臟、胰臟中Mel1bmRNA。結果表明,鴨的各組織中均存在Mel1bmRNA表達,且不同組織中的表達量存在差異性(圖2)。
2.3 Mel 1b蛋白組織分布
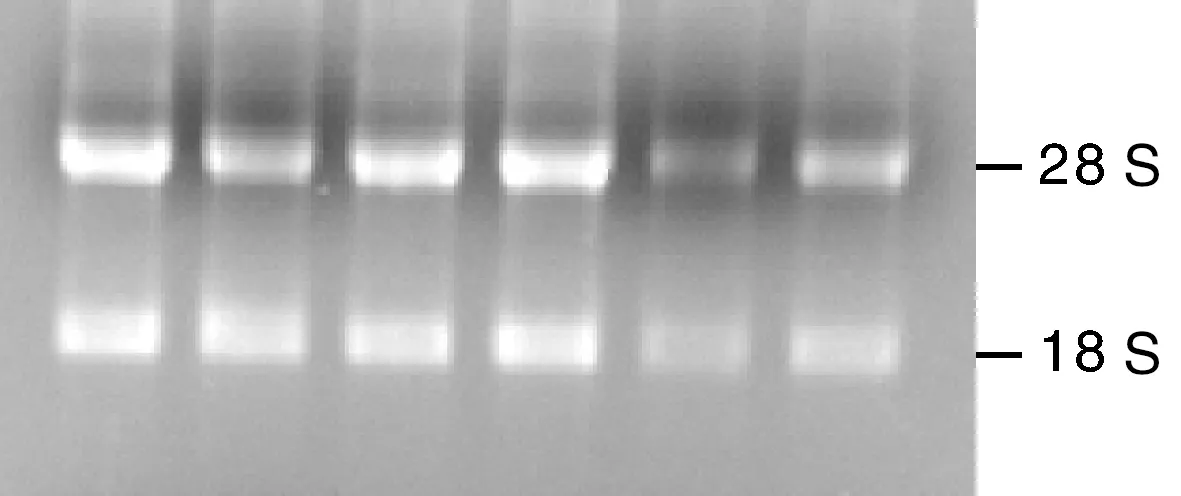
圖1 鴨各組織總RNA瓊脂糖凝膠電泳Fig.1 Agarose gel electrophoresis map of total RNA in duck tissues
利用免疫組化方法檢測鴨Mel 1b蛋白在不同組織中的表達,結果表明,在鴨大腦、肺臟、肝臟、胸肌、腎臟、心臟、胰臟中均有分布,其信號在細胞膜、細胞質和細胞核內均存在,但蛋白信號強度存在差異(圖3)。

M,Marker;1-9,脾臟、心臟、腎臟、大腦、卵巢、胸肌、肺臟、肝臟、胰腺。M,Marker;1-9,Spleen,heart,kidney,brain,ovary,breast muscle,lung,liver and pancreas, respectively.圖2 Mel 1b基因和內參基因GAPDH在鴨各組織中的表達Fig.2 Expression of Mel 1b and GAPDH gene in duck tissues

A, 大腦;B,肺臟;C,肝臟;D,胸肌;E,腎臟;F,心臟;G,胰臟。A,Brain; B, Lung; C, Liver; D, Breast muscle; E, Kidney; F, Heart; G, Pancreas.圖3 Mel 1b受體蛋白在鴨各組織中的分布Fig.3 Distribution of Mel 1b protein in duck tissues
2.4 Mel 1b mRNA組織中的相對表達量
利用Real time PCR方法檢測鴨Mel1bmRNA在鴨脾臟、心臟、腎臟、大腦、胸肌、卵巢、肺臟、肝臟和胰臟組織的相對表達量,以GAPDH基因作為內參基因,以大腦內表達量為對照。結果表明,Mel1bmRNA在卵巢中的表達量最多,其次為肺臟,在脾臟、心臟、腎臟和肝臟中的表達量也明顯高于大腦中的表達,但在胸肌和胰臟中的表達量稍低于大腦中的表達量(圖4)。
3 討論
褪黑素具有廣泛的生物學功能,除具有抗氧化作用外,還可通過與膜受體結合調節晝夜節律和生理功能,如免疫調節、內分泌調節、生殖功能、生物鐘等。這些膜受體表達較廣泛,在神經中樞系統和外周組織中均有表達,但每個受體亞型的靶組織不同,所以不同部位的功能反應亦不同[16]。對動物而言,更多地關注其對生殖的調控。研究表明,褪黑素可通過下丘腦-垂體-性腺軸調控動物生殖功能,主要是褪黑素可調節下丘腦神經元分泌GnRH,而GnRH控制LH和FSH的生成,同時褪黑素還刺激顆粒細胞分泌黃體酮[17],抑制雌激素受體表達和雌激素活性[18]。另外,褪黑素亦可直接作用于卵巢功能。研究表明,卵巢內可直接分泌褪黑素,其可調節卵母細胞成熟、胚胎發育[14]和顆粒細胞增殖凋亡[19-20]等。本研究探索了鴨的Mel 1b在不同組織中的表達分布,為進一步研究褪黑素對鴨的生理功能調節作用奠定了良好的基礎。采用Real time PCR技術和免疫組化技術研究了Mel1bmRNA和蛋白質在鴨不同組織中的表達分布,表明鴨Mel1bmRNA在脾臟、心臟、腎臟、大腦、胸肌、卵巢、肺臟、肝臟、胰臟中均有表達,且Mel 1b受體蛋白均存在于大腦、肺臟、肝臟、胸肌、腎臟、心臟、胰臟中。本研究未能成功檢測Mel 1b受體蛋白在卵巢和脾臟組織中的分布,但有研究表明在其他動物的卵巢和脾臟中存在褪黑素受體蛋白的表達分布[19,21],推測鴨的卵巢和脾臟中可能亦有褪黑素受體蛋白的分布,有待進一步證實。Real-time PCR結果表明,各組織中Mel1bmRNA表達量存在差異,在卵巢中的表達量最多,其次為肺臟,在脾臟、心臟、腎臟和肝臟中的表達量明顯高于大腦中的表達量,但在胸肌和胰臟中的表達量稍低于大腦中的表達量。進一步證實了褪黑素受體參與調節廣泛的生物學功能,特別是對生殖功能的調節作用。
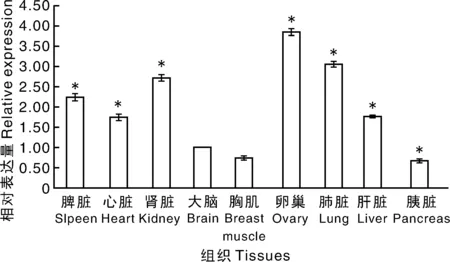
*代表與大腦中的表達量相比差異顯著(P<0.05)。Symbol * represented a significant difference between the expression level in this tissue and the expression level in the brain (P<0.05).圖4 Mel 1b基因mRNA在鴨各組織中的定量表達Fig.4 Quantitative expression of Mel 1b mRNA in duck tissues
本研究成功克隆了鴨Mel1b基因的部分片段,經過NCBI數據庫比對分析發現,與其他非哺乳物種Mel1b基因的同源性較高。Mel1bmRNA 在鴨神經組織和周邊組織具有廣泛的表達,同時Mel 1a受體蛋白在鴨多個組織中也具有廣泛表達,并且Mel1amRNA在各組織的表達量也存在差異性。由于Mel 1b和Mel 1a在鴨各組織中的表達分布規律具有相似性[22],推測該兩種受體可能同時介導褪黑素對鴨的廣泛的生理功能,但這一推理有待進一步證實。
參考文獻(References):
[1] LERNER A B,CASE J D,TAKAHASHI Y,et al. Isolation of melatonin,a pineal factor that lightens melanocytes[J].JournaloftheAmericanChemicalSociety,1958,80(10):2587.
[2] SCHEER F A,CZEISLER C A. Melatonin,sleep,and circadian rhythms[J].SleepMedicineReviews,2005,9(1):5-9.
[3] REVELL L,BURGESS H J,GAZDA C J,et al. Advancing human circadian rhythms with afternoon melatonin and morning intermittent bright light[J].JournalofClinicalEndocrinology&Metabolism,2006,91(1):54-59.
[4] SRINIVASAN V,MAESTRONI G J M,CARDINALI D P,et al. Melatonin,immune function and aging[J].Immunity&Ageing,2005,2:17.
[5] TAN D X,REITER R J,MANCHESTER L C,et al. Chemical and physical properties and potential mechanisms: melatonin as a broad spectrum antioxidant and free radical scavenger[J].CurrentTopicsinMedicinalChemistry,2002,2(2):181-197.
[6] HARDELAND R. Antioxidative protection by melatonin: multiplicity of mechanisms from radical detoxification to radical avoidance[J].Endocrine,2005,27(2):119-130.
[7] 李經才,張揚. 褪黑激素與衰老[J]. 生理科學進展,1997,28(1):76-78.
LI J C,ZHANG Y. Melatonin and aging[J].ProgressinPhysiologicalSciences, 1997,28(1):76-78.(in Chinese)
[8] TAMURA H,NAKAMURA Y,KORKMAZ A,et al.. Melatonin and the ovary: physiological and pathophysiological implications[J].FertilityandSterility,2009,92(1):328-343.
[9] VANECEK J. Cellular mechanisms of melatonin action[J].PhysiologicalReviews,1998,78(3):687-721.
[10] SOARES J M JR,MASANA M I,ERSAHIN C,et al. Functional melatonin receptors in rat ovaries at various stages of the estrous cycle[J].JournalofPharmacologyandExperimentalTherapeutics,2003,306(2):694-702.
[11] ROY D,ANGELINI N L,FUJIEDA H,et al. Cyclical regulation of GnRH gene expression in GT1-7 GnRH-secreting neurons by melatonin[J].Endocrinology,2001,142 (11):4711-4720.
[12] FRUNGIERI M B,MAYERHOFER A,ZITTA K,et al. Direct effect of melatonin on Syrian hamster testes: melatonin subtype 1a receptors,inhibition of androgen production,and interaction with the local corticotropin-releasing hormone system[J].Endocrinology,2005,146 (3):1541-1552.
[13] REITER J R,TAN D X. What constitutes a physiological concentration of melatonin?[J].JournalofPinealResearch,2003,34(1):79-80.
[14] WANG S,LIU W,XIAO Y,et al. The effects of melatonin on bovine uniparental embryos development and the hormone secretion of COCs[J].PeerJ,2017,5:e3485
[15] DUCKETT S K,PRATT S L,PAVAN E. Corn oil or corn grain supplementation to steers grazing endophyte-free tall fescue. II. Effects on subcutaneous fatty acid content and lipogenic gene expression[J].JournalofAnimalScience,2009,87(3):1120-1128.
[16] CHAN K H,WONG Y H. A molecular and chemical perspective in defining melatonin receptor subtype selectivity[J].InternationalJournalofMolecularSciences, 2013,14(9):18385-18406.
[17] DUBOCOVICH M L,RIVERA-BERMUDEZ M A,GERDIN M J,et al. Molecular pharmacology,regulation and function of mam malian melatonin receptors[J].FrontiersinBioscience,2003,8: d1093-1108.
[18] CARLBERG C. Gene regulation by melatonin[J].AnnalsoftheNewYorkAcademyofSciences,2000,917: 387-396.
[19] WANG S J,LIU W J,WU C J,et al. Melatonin suppresses apoptosis and stimulates progesterone production by bovine granulosa cells via its receptors (MT1 and MT2)[J].Theriogenology,2012,78(7):1517-1526.
[20] WANG S,LIU W,PANG X, et al. The role of melatonin receptor MTNR1A in the action of melatonin on bovine granulosa cells[J].MolecularReproduction&Development,2017,84(1): 1140-1154.
[21] GUO Q,DONG Y,CAO J, et al. Developmental changes of melatonin receptor expression in the spleen of the chicken,Gallusdomesticus[J].ActaHistochem, 2015, 117(6):559-565.
[22] 王淑娟,劉文舉,劉曉麗,等. 褪黑素受體Mel 1a在鴨不同組織中的表達研究[J]. 浙江農業學報,2016,28(6):928-934.
WANG S J,LIU W J,LIU X L, et al. Study on expression of melatonin receptor Mel 1a in several duck tissues[J].ActaAgricultureZhejiangensis,2016,28(6):928-934.(in Chinese with English abstract)

