新疆部分地區致犢牛腹瀉輪狀病毒病的調查*
(石河子大學動物科技學院,新疆 石河子 832003)
牛輪狀病毒是引起犢牛腹瀉的主要病原之一,感染輪狀病毒的犢牛表現為消瘦、脫水、排蛋花狀水樣糞便,病情嚴重者常并發或繼發其他病毒、細菌、寄生蟲等感染[1],導致規模化牛場犢牛死亡率升高[2],目前輪狀病毒的檢測方法主要是病毒的分離鑒定[3-4]、RT-PCR[5-6]、半巢氏 RT-CR[7]、ELISA[8]等。張坤[9]等通過RT-PCR等方法對新疆北疆地區致犢牛腹瀉輪狀病毒病的調查發現,規模化牛場中犢牛存在感染。輪狀病毒結構蛋白中VP6蛋白構成輪狀病毒內衣殼[10],具有良好的免疫原性和抗原性[11]。本研究利用VP6設計引物,運用RT-PCR和ELISA方法對新疆規模化牛場致犢牛腹瀉病原輪狀病毒病進行調查研究,以便為犢牛腹瀉采取防控措施提供依據。
1 材料與方法
1.1 試驗材料
1.1.1 主要試劑與儀器
ELISA雙抗體夾心檢測試劑盒購自上海潤裕生物技術有限公司,pMD19-T克隆載體、T4 DNA連接酶、DNA Marker均購自寶生物工程大連公司(Takara),RNA提取試劑盒、瓊脂糖凝膠DNA回收試劑盒均購自康為世紀生物科技有限公司,2×Taq PCR MAsterMix溶液、DH5a菌株制備的感受態細胞均購自北京天根生物科技有限公司。試驗儀器主要有酶標儀、微量震蕩儀器和離心機(Costar公司)。
1.1.2 樣本采集
采集石河子地區奶牛場、石河子地區某肉牛場、昌吉奶牛場、奎屯地區奶牛場等地區腹瀉犢牛糞便共172份,于-80℃冰箱保存待檢。
1.2 試驗方法
1.2.1 樣品處理
將腹瀉犢牛糞便樣品與等體積的PBS于冰上充分研磨,進行超聲破碎,反復凍融,最后12 000 r離心30 min,取上清液用于PCR模板檢測和牛輪狀病毒ELISA試劑盒檢測。
1.2.2 牛輪狀病毒VP6基因的引物設計
根據GenBank公布的BRV基因序列VP6設計引物(見表1)。
1.2.3 總RNA的提取
按照說明書Trizol法,處理后的樣品加入適量的Trizol后,用無RNA酶槍頭反復吹打混勻,使樣品充分裂解,分離蛋白核酸復合物,靜置10 min后加入1/5 Trizol量的氯仿,震蕩混勻后靜置5 min,在預冷的4℃離心機中12 000 r離心15 min,EP管中的液體分為3層,提取的RNA主要在上層的無色液體中,利用特制的帶收集管的吸附柱,將無色液體和等量的無水乙醇全部加入吸附柱中,進行離心,用無RNA酶水進行洗脫收集得到的RNA,提取RNA后,進行反轉錄,具體反應體系如表2。
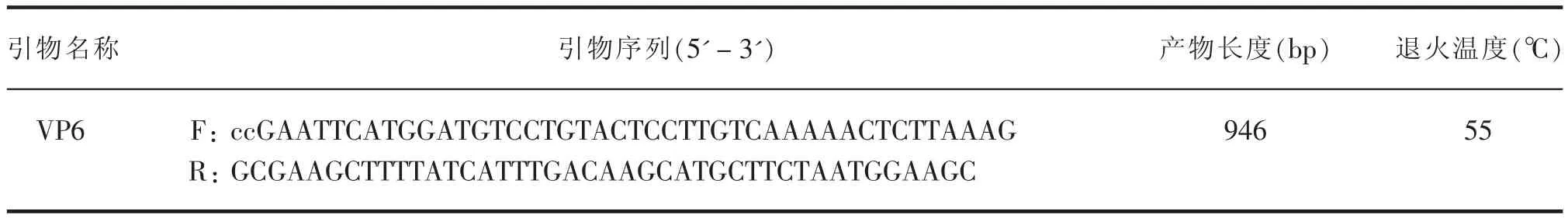
表1 牛輪狀病毒VP6基因PCR擴增引物信息

表2 反轉錄反應體系
1.2.4 PCR反應
PCR 反應體系 (20 μL):2 × Es Taq Master mix 10.0 μL,上、下游引物各 0.4 μL,模板 2.0 μL,ddH2O 7.2 μL。PCR 反應條件:95℃預變性 5 min,94℃變性 30 s,55℃退火 30 s,72℃延伸 30 s,35 個循環后,72℃延伸10 min。擴增反應結束后,將PCR產物在2%的瓊脂糖凝膠上進行電泳檢測,同時瓊脂糖凝膠試劑盒回收目的片段。
1.2.5 瓊脂糖凝膠電泳和目的條帶回收
稱取瓊脂糖1.2 g、1×TBE電泳緩沖液60 mL,配置成2%的瓊脂糖凝膠溶液,經微波爐加熱,完全溶解,室溫靜置,滴加EB染液后充分混勻,將其倒入制膠槽中,約30 min后凝固,20 uL點樣,180 V、120 mA進行電泳,結束后將膠放入凝膠成像儀器中,進行拍照保存。
目的條帶的回收:用切膠刀將目的條帶在紫外燈下切除,置于無RNA酶的EP中加入適量的溶膠液,進行50℃水浴溶解,充分溶解后加入特制的吸附柱中,離心后,加入無水乙醇進行洗脫,最后用無RNA酶水進行洗脫,收集得到的洗脫液。
1.2.6 目的基因的連接(表3)

表3 目的基因的連接反應體系
1.2.7 轉化及菌液PCR鑒定
轉化按照說明書進行操作,采用經特殊工藝制作的DH5α感受態細胞進行DNA的熱激轉化,將連接產物加入置于冰上緩慢融化的DH5α感受態細胞中,用移液器吹打混勻后,置于冰上30 min,進行42℃水浴熱激90 s后迅速置于冰上,加入適量的LB液體后,37℃、170 r搖床上搖4 h,離心取沉淀涂于固體LB平板上。
菌液PCR的鑒定及測序:從轉化平皿中挑取單菌落加入氨芐抗性的LB液體培養基,37℃、180 r搖床培養4 h,進行菌液PCR鑒定。將鑒定為陽性的菌,擴大培養后提取質粒送上海生工測序。
1.2.8 牛輪狀病毒抗原ELISA檢測
按照牛輪狀病毒抗原ELISA說明書進行。試劑盒原理是雙抗體夾心法,將處理好的樣品上清液吸取200 μL加入已經預先包被牛輪狀病毒捕獲抗體的微孔中,同時設置陰、陽性對照孔和空白孔,除空白孔外,樣品孔中加入辣根過氧化物酶(HRP)標記的檢測抗體100 μL,微量震蕩儀器上震蕩混勻,用封板膜封好后置于37℃恒溫培養箱中作用1 h,取出棄掉微孔中的液體,每孔用洗滌液洗板5次,每次2 min,加入底物后避光孵育15 min,用終止液進行終止,在450 nm的酶標儀上進行讀數。
2 結果與分析
2.1 PCR檢測的牛輪狀病毒感染情況
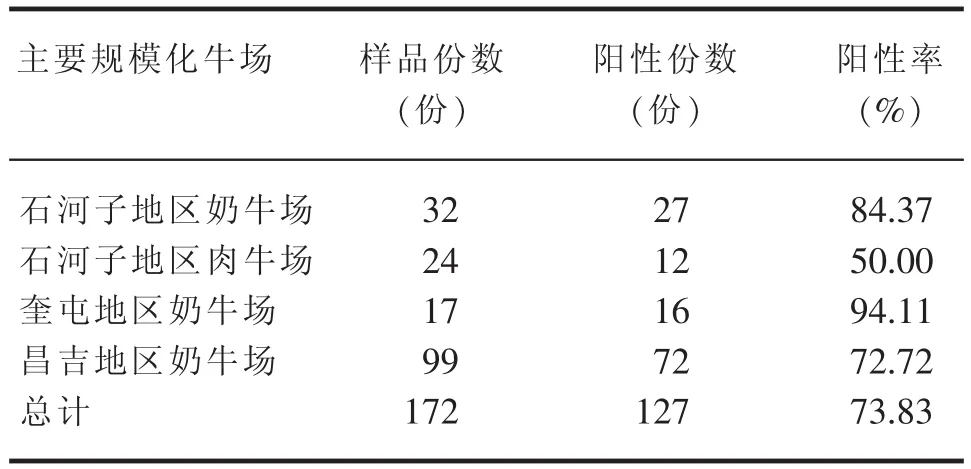
表4 新疆部分地區規模化牛場牛輪狀病毒檢測結果
經PCR方法對新疆部分地區規模化牛場172份腹瀉犢牛糞便樣品進行檢測,檢出陽性份數127份,陽性率73.83%(表4)。犢牛糞便中VP6基因檢測的結果(圖1、圖2)運用DNAMAN軟件將牛輪狀病毒VP6基因測序結果與標準序列進行在線比對,發現兩者同源性達到100%(部分圖)。
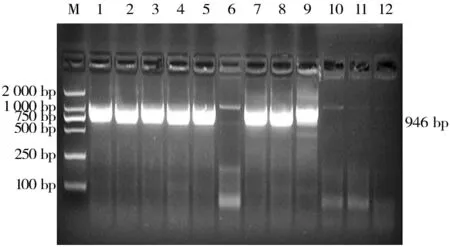
圖1 某規模化牛場腹瀉犢牛糞便輪狀病毒VP6基因檢測結果
2.2 ELISA檢測結果
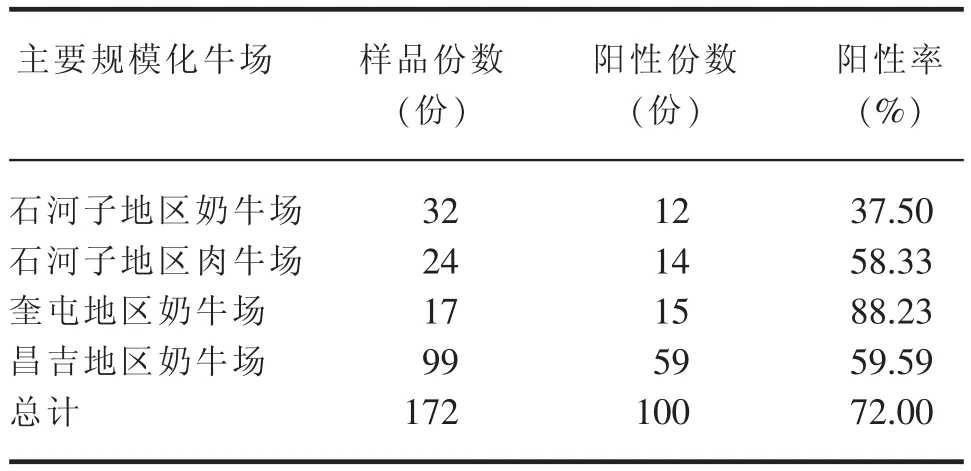
表5 ELISA方法檢測結果
經ELISA方法對新疆部分地區規模化牛場172份腹瀉犢牛糞便樣品進行檢測,陽性份數100份,陽性率 72%(表5)。
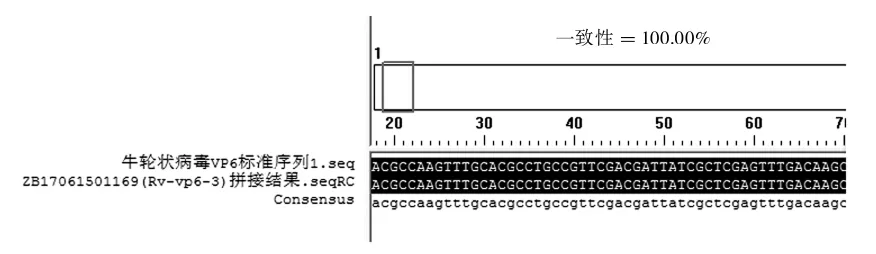
圖2 牛輪狀病毒VP6基因與標準序列比對結果
3 討論
牛輪狀病毒VP6基因,是診斷牛輪狀病毒感染的常用基因,本研究通過設計牛輪狀病毒VP6基因引物,通過測序,將測序結果分別與牛輪狀病毒VP6基因標準序列通過DNAMAN軟件進行在線比對,發現擴增出的牛輪狀病毒VP6基因與標準序列的同源性為100%,可以判定被調查牛場犢牛遭受輪狀病毒病感染。
ELISA方法是進行大量樣本檢測的首選,本調查經ELISA方法對新疆部分地區規模化牛場腹瀉犢牛糞便樣品進行檢測,陽性率72%(100/172),經RT-PCR方法檢測犢牛糞便樣品,陽性率73.83%(127/172),這比張坤[9,12]等應用 RT-PCR 和 ELISA方法檢測報道的調查結果略高。綜合PCR和ELISA方法各自的優點,可對腹瀉犢牛的輪狀病毒感染提供較為準確的診斷。
參考文獻
[1]李艷婷,孫光野,張露,等.犢牛輪狀病毒和大腸桿菌混合感染檢測[J].中國畜牧獸醫,2017,44(1):248-253.
[2]常繼濤,于力.牛輪狀病毒引起的犢牛腹瀉研究進展[J].中國奶牛,2016(2):22-25.
[3]李凡,周芳,岳華,等.A群牛輪狀病毒的分子生物學研究進展[J].動物醫學進展,2017,38(6):82-85.
[4]侯美如,高俊峰,周慶民,等.牛輪狀病毒診斷方法研究進展[J].中國草食動物科學,2013,33(2):63-66.
[5]李成元,姚美玲,王廣偉,等.應用RT-PCR方法檢測牛輪狀病毒的研究[J].中國動物保健,2015,17(4):65-68.
[6]姜向陽,鄧小敏,王晶鈺,等.牛輪狀病毒的分離及其RTPCR 鑒定[J].西北農業學報,2007(4):191-194.
[7]欒婧婧,楊少華,張維軍,等.半巢式RT-PCR快速檢測犢牛輪狀病毒方法的建立 [J].中國人獸共患病學報,2006(7):671-673.
[8]田風林,魏鎖成.應用ELISA法、RT-PCR法檢測固原市部分地區肉牛輪狀病毒的研究[J].黑龍江畜牧獸醫,2017(20):126-128.
[9]張坤,剡根強,王靜梅,等.新疆部分地區致犢牛腹瀉輪狀病毒的檢測及VP6基因序列分析 [J].黑龍江畜牧獸醫,2016(13):160-162.
[10]Mc Clain B,Settembre E,Temple BRS,et al.X-ray crystal struc-ture of the rotavirus inner capsid particle at 3.8 Aresolution[J].JMol Biol,2010,397(1):587-599.
[11]Kohli E,Muurice L,Bourgeois C,et al.Epitopemapping of themajor inner capaid protein of group A rotavirus using peptide synthesis[J].Virology,1993,194 (1):110-116.
[12]張坤.新疆北疆地區規模化奶牛場犢牛病毒性腹瀉相關病原的調查研究[D].石河子:石河子大學,2016.

