蜜環菌發酵生產胞外漆酶的工藝優化
(天津天獅學院生物與食品工程學院,天津 301700)
蜜環菌(Amillariella mellea)是一種藥食兩用真菌,多作為藥材天麻的伴生菌。工業化生產多采用液體深層發酵技術[1],發酵液中富含多種活性成分,以蜜環菌液態發酵產物開發出的眾多商品[2]。漆酶(EC 1.10.3.2)是蜜環菌發酵液中積累的一種綠色環保型多酚氧化酶,其活性中心含有金屬離銅,可以催化酚類及芳胺類物質的聚合、降解及轉化,近年來在在工業、農業、食品[3]、廢水處理[4-5]和醫藥[6]等領域市場前景廣闊[7]。
以深層液態發酵培養可以提高漆酶的產率,許多學者致力于研究漆酶生產的發酵條件。司靜等[8]分別以麥芽糖和蛋白胨作為碳源和氮源,篩選出漆酶高產菌株為東方栓孔菌Trametes orientalis Cui. 6300,一定程度上縮短漆酶生產周期。徐雪霏等[9]對黃多孔菌發酵產漆酶的條件進行優化,提高酶活2.5倍,發現影響該菌產生漆酶的主要營養因素為碳氮比。實驗證明漆酶發酵較適pH多集中在4.0~6.0,不同的真菌有它們各自的最佳pH,且底物不同,最適發酵pH也差異明顯[10-12]。目前,漆酶的研究還在探索,很多方面需要完善,對漆酶發酵的研究暫時還主要在實驗室中進行,產漆酶培養基的優化和大規模生產是將來發展的趨勢,漆酶的價值會緊跟著科技時代的步伐,慢慢地被世人所熟知。
本研究利用實驗室培養保存的蜜環菌進行發酵培養,改變培養條件,測定發酵液中漆酶的活性,對蜜環菌產漆酶的發酵工藝進行優化,旨在找出適宜大批生產的操作方案,為企業提供一定的理論依據。
1 材料與方法
1.1 試驗材料
1.1.1 供試菌株
蜜環菌A9,購于華中農業大學菌種實驗中心,經天津天獅學院生物工程實驗中心擴大培養用于試驗。
1.1.2 試驗試劑
葡萄糖、可溶性淀粉、2,2′-聯氨-雙(3-乙基苯并噻唑啉-6-磺酸)二胺鹽(簡稱ABTS,Sigma-Alorich生產)等,購于上海藍季科技發展有限公司;七水硫酸鎂、氯化鈣、氯化銨、硝酸銨、牛肉膏、蛋白胨等,購于天津市風船化學試劑科技有限公司;玉米粉、麥麩,購于農貿市場。
1.1.3 儀器設備
恒溫培養搖床HNY-200B,天津歐諾產;臺式高速離心機TG16K-II,長沙東旺產;賽多利斯天平BSA124S,德國產;高壓蒸汽滅菌鍋MJ-78A,上海施都凱產;紫外可見分光光度計UV1000,上海天美產;超凈工作臺SW-CJ-2G,蘇州凈化產。
1.2 試驗方法
1.2.1 試驗培養基的制備
將1 L去離子水倒入電磁爐中,分別加入80 g麥麩,200 g馬鈴薯小塊,大火煮沸后溫火煮20 min,8層紗布過濾,用去離子水補足溶液至1 L。分別添加1.5 g MgSO4·7H2O、2 g KH2PO4、0.1 g CaCl2,0.01 g 維生素B1,用氫氧化鈉和檸檬酸調整培養液的pH至6.0作為基本培養基。
公式中Kjaccard和Ksorensen為科、屬、種相似性系數,A、B分別為兩地區植物科、屬、種數,C為兩地區共有植物科、屬、種數。
根據研究目的不同,在基本培養基中添加不同葡萄糖和蛋白胨分別作為碳源和氮源,添加一定量的微量元素,微量元素溶液見表1。
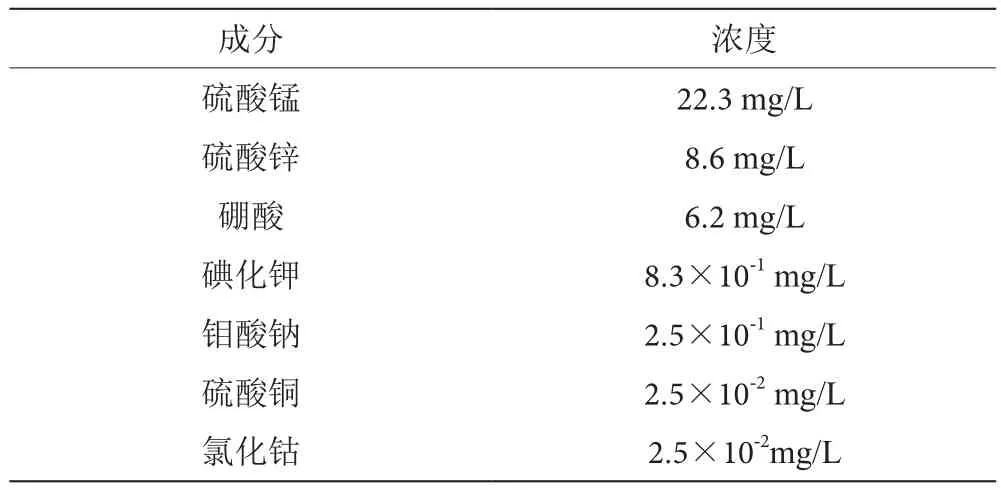
表1 微量元素溶液成分表
1.2.2 液體菌種制備及接種培養
將蜜環菌斜面菌種接種到綜合PDA平板上25 ℃黑暗培養活化14 d。在超凈臺下,用打孔器取長勢一致的菌絲,接種于液體培養基中,25 ℃、180 r/min搖瓶培養7 d,收集菌絲體懸液作為液體菌種。接種時,在超凈臺下用取液器精確吸取2 mL加入到不同試驗組,在25 ℃、180 r/min搖床中培養。
1.2.3 酶活力測定
搖床培養15 d后,取出一定量的發酵液,經5 000 r/min離心20 min后,取上清液測試酶活力[13-14],酶活力單位定義為1 min轉化1 μmol ABTS,使ABTS自由基濃度增加量。每個處理做3次重復取平均值作為酶活力。
1.2.4 單因素試驗研究
(1)葡萄糖添加量對漆酶酶活的影響。在基礎培養基中分別加入葡萄糖15、20、25、30 g和35 g,蛋白胨4 g,加入10 mL微量元素溶液,每個水平分別做3次重復,接種培養15 d后,測定酶活力,記錄結果(下同)。
(3)初始pH對漆酶酶活的影響。在基本培養基中添加20 g葡萄糖,C/N為5,添加10 mL微量元素溶液pH為分別調節到5.0、5.5、6.0、6.5和7.0,培養后測定并記錄結果。
(4)微量元素添加量對漆酶酶活的影響 在基本培養基中添加20 g葡萄糖,C/N為5,溶液pH調節6.0,添加微量元素溶液量分別為5、10、15、20 mL和25 mL,培養后測定并記錄結果。
1.2.5 正交試驗研究
通過單因素優選的四個不同因素的三個水平,采用L9(34)正交實驗設計,進一步確定因素的主次及發酵產漆酶的最佳工藝。
2 結果與分析
2.1 葡萄糖添加量對漆酶酶活的影響
在基礎培養基中分別按1.5%~3.5%的量添加葡萄糖,其他培養條件不變,研究葡萄糖的添加量對產漆酶的酶活的影響,發酵至15 d后取上清液進行測定酶活力,結果如圖1所示。
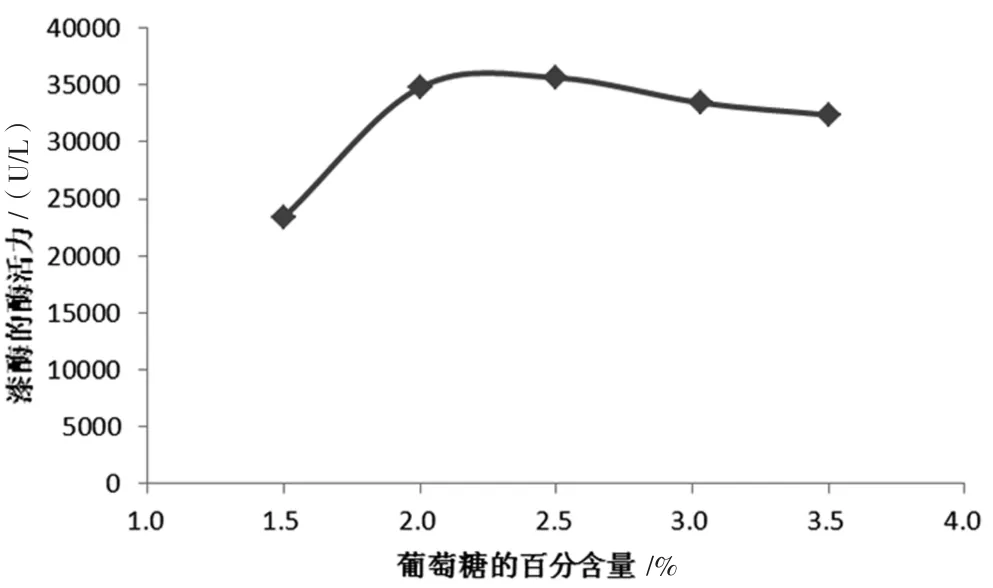
圖1 不同葡萄糖添加量對蜜環菌胞外漆酶酶活的影響圖
由圖1可見,葡萄糖添加量對發酵產漆酶的酶活力隨著葡萄糖的增加,漆酶的酶活先升高后緩慢下降的趨勢。當1 L培養基中添加2.5%葡萄糖時產漆酶量最多。繼續增加含糖量可能對蜜環菌的生長產生部分抑制作用,分泌的胞外漆酶量略微下降。可見,在培養時過高的葡萄糖濃度既不經濟,又不利于蜜環菌的生長。
2.2 不同碳氮比對漆酶酶活的影響
保持碳源氮源總量不變的前提下,以葡萄糖作為碳源,蛋白胨做氮源,設置5個不同水平的C/N,研究其對蜜環菌發酵產漆酶酶活的影響,結果如圖2所示。
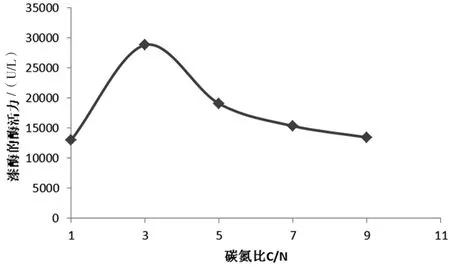
圖2 不同碳氮比對蜜環菌胞外漆酶酶活的影響圖
由圖2可見,在碳氮源總量不變的前提下,隨碳源增加,蜜環菌分泌的胞外漆酶酶活力呈現先增高后降低的趨勢,反映出同葡萄糖效應同樣的影響效果。當1 L培養基中添加22.5 g葡萄糖和7.5 g蛋白胨(即C/N=3)時產漆酶量最多。
2.3 不同初始pH對漆酶酶活的影響
調整配制完畢的培養基的pH在5~7共5個水平,分別測定發酵后的漆酶產量,結果如圖3所示。
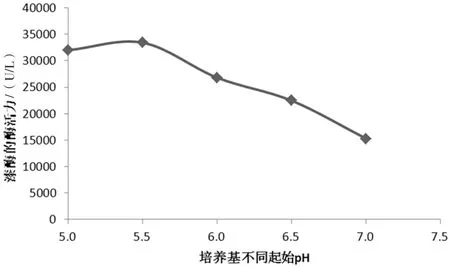
圖3 不同初始pH對蜜環菌胞外漆酶酶活的影響圖
由圖3可見,發酵培養基初始pH維持在5~6時,蜜環菌生產的胞外漆酶活性較高。此范圍的pH跟基本培養基配制完后的pH接近,在生產漆酶時,可以考慮不用調整pH,保持自然的pH即可。pH繼續升高,漆酶產量明顯降低,主要是由于較高pH對蜜環菌的生長有一定地抑制作用。
2.4 不同微量元素添加量對漆酶活力的影響
通過只改變微量元素的添加量,分別加入5~25 mL微量元素溶液,其他培養條件一致的情況下,培養完成后測定酶活力如圖4所示。
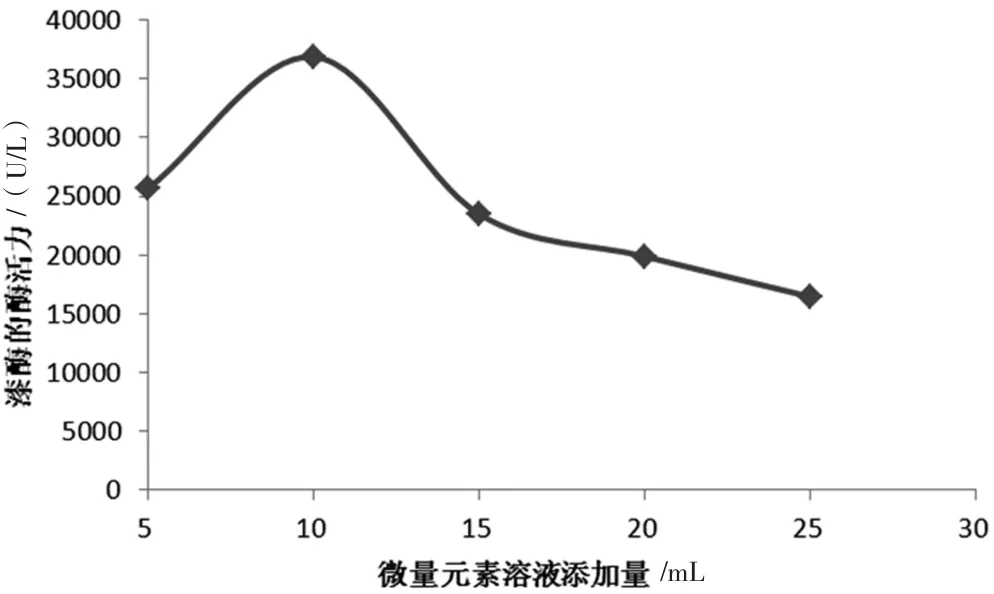
圖4 不同微量元素溶液添加量對蜜環菌胞外漆酶酶活的影響圖
由圖4可見,添加適量微量元素對蜜環菌發酵生產漆酶有益,可以促進菌體的生長,進而增加發酵液中漆酶的酶活。當1 L培養基中添加10 mL微量元素溶液時,發酵完成后漆酶活力達到峰值。加入過多的微量元素,漆酶的產量明顯下降,可推斷其對蜜環菌的生長存在抑制作用。
2.5 正交實驗結果及分析
根據單因素的實驗結果,從4個因素中各自選取3個水平進行L9(34)正交實驗設計。因素水平表設計見表2,正交實驗的結果見表3。

表2 因素水平表
由表3可知,影響蜜環菌發酵生產漆酶的因素主次順序依次為葡萄糖添加量、C/N、微量元素添加量和初始pH。可見在培養基中的碳源對蜜環菌產漆酶影響較大,需要對添加碳源的種類進一步研究,確定最佳碳氮比以提高漆酶的生產效率。pH對產漆酶的影響相對較小,因而可以考慮配制基本培養基后,按照自然的pH進行發酵。

表3 正交實驗的結果表
2.6 驗證結果及分析
按照以上結果中最優方案,進行3次重復實驗,測得1 L發酵液中漆酶活力為51202.0U,相對標準偏差小于5%。高于正交表格中實驗數值,說明此工藝的優越性。
3 結論與討論
確定蜜環菌發酵培養生產漆酶的最佳方案為添加葡萄糖2.5%,碳源氮源比為3,基本培養基中附加15 mL/L微量元素,pH5.0為最有利于漆酶的積累。可作為工業生產漆酶的參考方案。在實際生產過程中,由于pH的影響較小,可以直接利用配制完成的培養基進行發酵生產,無需調整pH。
發酵生產胞外漆酶的最適培養時間出現在14 d左右,此時酶活力最高,本次研究統一在15 d采集樣品測定活力。比蜜環菌達到最大生長量的時間(10 d左右)有所滯后,說明當蜜環菌達到最大生長量后,胞外積累的漆酶數量才可達到峰值,從動力學角度分析,這種胞外漆酶的合成模型可能屬于滯后合成型,需要進一步的研究確定,此時是分離純化漆酶的最佳時間段。培養時間再長漆酶可能發生部分降解,影響產量。
參考文獻:
[1]楊海龍.藥用真菌深層發酵生產技術[M].北京:化學工業出版社,2009.
[2]劉 宇,龔思慧,彭 楠,等.蜜環菌液態發酵培養基及補料分批發酵工藝的優化[J].食品與發酵工業,2016,42(5):187-191.
[3]范文霞,蔡友華,劉學銘,等.毛云芝菌產漆酶液體培養條件的優化[J].食品與生物技術學報,2008,27(3):88-93.
[4]吳香波,謝益民,馮曉靜.白腐菌漆酶催化聚合造紙廢水中木素的研究[J].環境科學與技術,2010,33(1):23-26.
[5]張學才,徐美紅,李 麗,等.王劍波白腐真菌漆酶處理幾種有毒環境污染物的研究[J].化學與生物工程,2006,23(9):40-42.
[6]郭 梅,白東清,蒲 軍,等.雜色云芝漆酶用于提取人參總皂甙的研究[J].食品科學,2006,27(2):166-168.
[7]劉家揚,焦國寶,有小娟,等.真菌漆酶的性質、生產及應用研究進展[J].生物技術通報,2016,32(4):24-33.
[8]司 靜,崔寶凱,戴玉成.栓孔菌屬漆酶高產菌株的初步篩選及其產酶條件的優化[J].微生物學通報,2011,38(3):405-416.
[9]徐雪霏,畢云楓,蔣海芹,等.黃多孔菌產漆酶最佳培養條件的優化[J].紡織學報,2012,33(2):63-67.
[10]萬善霞,滑 靜,王文平,等.杏鮑菇漆酶部分酶學性質的研究[J].中國農學通報,2009,25(21):107-109.
[11]Hakulinen N,Kiiskinen L L, Kruus K, et al. Crystal structure of alaccase from Melano copper site[J]. Nature Structural Biology,2002,9(8):601-605.
[12]J Jordaan,WD Leukes. Isolation of a thermostable laccase with DMAB and MBTH oxidative coupling activity from a mesophilic white rot fungus[J]. Enzyme and Microbial Technology,2003,33(2):212-219.
[13]吳 涓,李清彪,肖亞中,等.蜜環菌胞外漆酶酶活力的分光光度法測定[J].廈門大學學報(自然科學版),2001,40(4):893-897.
[14]張 鵬.以ABTS為底物測定漆酶活力的方法[J].印染助劑,2007,24(1):43-45.

