不同紅藍(lán)光比例對(duì)番茄幼苗葉片結(jié)構(gòu)及光合特性的影響
楊俊偉,鮑恩財(cái),張珂嘉,潘銅華,曹晏飛,張 靜,鄒志榮(1.西北農(nóng)林科技大學(xué) 園藝學(xué)院,陜西楊凌 712100;2.農(nóng)業(yè)部西北設(shè)施園藝工程重點(diǎn)實(shí)驗(yàn)室,陜西楊凌 712100)
番茄因其獨(dú)特風(fēng)味成為世界上最受歡迎的蔬菜之一[1]。在設(shè)施番茄栽培中,幼苗質(zhì)量直接影響番茄后期的生長(zhǎng)發(fā)育及產(chǎn)量形成。在生產(chǎn)中,人們通常通過(guò)噴施激素類物質(zhì)[2-3]如矮壯素、多效唑等植物生長(zhǎng)調(diào)節(jié)劑來(lái)促進(jìn)幼苗的健壯生長(zhǎng)。而這些激素大多在自然狀態(tài)下難以降解[4],攝入過(guò)多后可能會(huì)危害人體健康[5]。在栽培學(xué)上,調(diào)控栽培環(huán)境(如光照)是培育壯苗的一種生態(tài)環(huán)保的可行方法。光是植物生長(zhǎng)最重要的環(huán)境因子之一,光質(zhì)對(duì)番茄幼苗品質(zhì)有顯著影響[6]。新型半導(dǎo)體發(fā)光二極管(light emitting diode,LED)光源具有體積小、能耗低、堅(jiān)固耐用、使用壽命長(zhǎng)、工作電壓低、冷光源和環(huán)保等特點(diǎn)[7]。同時(shí),LED可以根據(jù)不同植物對(duì)光強(qiáng)和光質(zhì)的需求不同進(jìn)行精準(zhǔn)調(diào)制,最大限度滿足作物對(duì)光的需求[8]。因此,在設(shè)施番茄幼苗培育過(guò)程中,研究光質(zhì)精準(zhǔn)調(diào)控對(duì)人工光環(huán)境下工廠化育苗具有一定的實(shí)際應(yīng)用價(jià)值。關(guān)于光質(zhì)對(duì)蔬菜生長(zhǎng)和發(fā)育的影響,前人在生菜[9]、黃瓜[10]、烏塌菜[11]和芽苗菜[12]等蔬菜中已有廣泛研究。不同光信號(hào)通過(guò)影響光敏色素和隱花色素的形成進(jìn)而影響植物的光形態(tài)建成[13]、莖的伸長(zhǎng)[14]、葉綠素的合成[15]、氣孔運(yùn)動(dòng)[16]和葉片結(jié)構(gòu)[17]。Poudel等[13]發(fā)現(xiàn)紅光處理可促進(jìn)葡萄幼苗莖和節(jié)間的伸長(zhǎng),藍(lán)光可增加葡萄葉片數(shù)和氣孔數(shù)量。王麗偉等[18]用不同比例紅藍(lán)光處理番茄幼苗發(fā)現(xiàn)紅光∶藍(lán)光=3可以顯著增加葉綠素總濃度,紅光∶藍(lán)光=9可以提高Chla/b。Mizuno 等[19]發(fā)現(xiàn)植株在黑暗期給予適當(dāng)?shù)倪h(yuǎn)紅光照射可使植物體內(nèi)的光敏色素轉(zhuǎn)變成Pfr構(gòu)型,從而促進(jìn)植株下胚軸的伸長(zhǎng)。Li 等[20]研究發(fā)現(xiàn)陸地棉在藍(lán)光處理下葉片最厚,柵欄組織最長(zhǎng)。前人關(guān)于光質(zhì)對(duì)作物生長(zhǎng)發(fā)育的影響主要集中在單色光或復(fù)合光(多種光)對(duì)植株光合及干物質(zhì)積累的影響上[21]。葉片結(jié)構(gòu)和植物的光合特性存在緊密聯(lián)系,而不同比例紅藍(lán)光對(duì)植株葉片內(nèi)部結(jié)構(gòu)影響的研究較少,針對(duì)西北地區(qū)設(shè)施生產(chǎn)實(shí)踐,缺乏與光質(zhì)調(diào)控對(duì)番茄的生理生化性狀相應(yīng)的技術(shù)。研究不同紅藍(lán)比例LED 對(duì)番茄幼苗光合特性,葉片結(jié)構(gòu)和葉綠體超微結(jié)構(gòu)的影響,篩選適合番茄幼苗生長(zhǎng)的紅藍(lán)光配比,從而為番茄的工廠化育苗和LED光源在設(shè)施番茄中高效利用提供理論基礎(chǔ)。
1 材料與方法
1.1 試驗(yàn)材料
試驗(yàn)于2016年9月-2017年5月在西北農(nóng)林科技大學(xué)科研溫室12號(hào)植物生長(zhǎng)箱(陜西旭田光電農(nóng)業(yè)科技有限公司)中進(jìn)行。供試溫室番茄品種為‘金棚朝冠’,種子購(gòu)于陜西楊陵金棚種業(yè)有限公司。
1.2 試驗(yàn)處理
番茄種子經(jīng)溫湯浸種后,在溫度28 ℃,空氣濕度90%的人工氣候箱(RDN-1000D-4,寧波東南儀器有限公司)中催芽72 h后播種于72孔穴盤(pán)中,穴盤(pán)放置于人工氣候箱中。設(shè)置光周期12 h/12 h,溫度25 ℃/20 ℃,濕度65%~75%,光照強(qiáng)度為100 μmol·m-2·s-1。當(dāng)番茄幼苗長(zhǎng)至兩葉一心時(shí),挑選長(zhǎng)勢(shì)一致的植株移栽到植物生長(zhǎng)箱(西北農(nóng)林科技大學(xué)科研溫室,陜西旭田光電農(nóng)業(yè)科技有限公司提供)中。以草炭∶珍珠巖∶蛭石=3∶1∶1(體積比)為栽培基質(zhì),采取潮汐式營(yíng)養(yǎng)液灌溉模式,營(yíng)養(yǎng)液采取1/2倍山崎番茄營(yíng)養(yǎng)液配方。使用時(shí)控開(kāi)關(guān)(KG316T,浙江正泰電器股份有限公司)精確控制光周期(晝∶夜=14 h∶10 h),控制LED燈打開(kāi)個(gè)數(shù)使番茄葉冠層光照強(qiáng)度達(dá)到200 μmol·m-2·s-1±10 μmol·m-2·s-1,溫度25 ℃/20 ℃(晝/夜),濕度65%~75%。試驗(yàn)重復(fù)3次,每次從定植到當(dāng)次試驗(yàn)結(jié)束持續(xù)30 d。試驗(yàn)采用不同比例的紅(400~500 nm)、藍(lán)(600 ~700 nm)單色LED(西安麟字半導(dǎo)體照明有限公司)燈珠數(shù)量的組合,構(gòu)成5個(gè)不同光質(zhì)處理,分別為紅光(R)、 藍(lán)光(B)、紅∶藍(lán)=1∶2 (1R2B)、紅∶藍(lán)=1∶1 (1R1B)、紅∶藍(lán)=2∶1 (2R1B),以白光(W)為對(duì)照,光照強(qiáng)度均200 μmol·m-2·s-1±10 μmol·m-2·s-1。不同處理的波譜分布如圖1所示,不同波譜為在距離燈正下方20 cm處測(cè)定。

圖1 不同處理的光譜分布
1.3 測(cè)定項(xiàng)目及方法
光照強(qiáng)度和光譜的測(cè)定:試驗(yàn)進(jìn)行之前,在暗室內(nèi)采用光譜儀(PAR-NIR,Apogee Instruments Inc,Logan,UT)于燈正下方20 cm處測(cè)定不同處理的光譜,根據(jù)設(shè)定的光強(qiáng)調(diào)整LED燈管數(shù)量。
番茄幼苗生長(zhǎng)指標(biāo)的測(cè)定:番茄植株生長(zhǎng)15 d 后,每個(gè)處理隨機(jī)選取10株,重復(fù)3次,用精度為0.1 cm的直尺測(cè)量番茄幼苗的株高;用精度為0.01 mm的電子數(shù)顯卡尺(605A-05,哈爾濱量具刃具集團(tuán)有限責(zé)任公司)測(cè)量第1節(jié)位上方的莖粗。
葉綠素質(zhì)量分?jǐn)?shù)測(cè)定:將待測(cè)葉片洗凈擦干后用打孔器取樣,加φ=96%的乙醇,室溫下置于暗處浸提過(guò)夜(8 h),期間搖動(dòng)2~3次,直至葉片完全變白為止。取1mL的提取液于離心管,以φ=96%乙醇定容至5 mL,用島津紫外可見(jiàn)光分光光度計(jì)(UV-1800)測(cè)定其在 665、649、470 nm 波長(zhǎng)下的吸光值,并依據(jù)下列式(1)、(2)分別計(jì)算葉綠素a和b的質(zhì)量分?jǐn)?shù)[22]。
葉綠素a(Ca)=13.95×A665-6.88×A649
(1)
葉綠素b(Cb)=24.96×A649-7.32×A665
(2)
番茄葉片比葉重(LMA)的測(cè)定根據(jù)公式(3)[6]計(jì)算:
比葉重(g·cm-2)= 葉片干質(zhì)量/葉面積
(3)
番茄葉片結(jié)構(gòu)的觀察:用不同比例的紅藍(lán)光處理番茄幼苗15 d后,參考吳濤等[23]的方法處理樣品。用正置熒光顯微鏡(OlympusBX51,日本奧林巴斯株式會(huì)社,日本)觀察葉片結(jié)構(gòu),柵欄組織內(nèi)含葉綠體多,進(jìn)行同化作用,而海綿組織空隙多,也較大,組織疏松,內(nèi)含葉綠體少。每張切片選取5個(gè)視野,用Cell Sens軟件在每個(gè)視野分別測(cè)定柵欄和海綿組織3次,求平均值,即為柵欄(海綿)組織厚度。
葉綠體超微結(jié)構(gòu)觀察:不同比例的紅藍(lán)光處理番茄幼苗15 d后,參考He等[24]的方法稍作調(diào)整處理樣品。先用φ=4%的戊二醛固定植物葉片6 h,接著用pH6.8的磷酸緩沖液沖洗6次,然后用10 g/L的鋨酸在4 ℃下固定2 h,在不同梯度乙醇梯度脫水之前再多次漂洗,EPON812樹(shù)脂包埋,聚合8 h后超薄切片,用透射電子顯微鏡(JEM-1230,日本電子,日本)觀察葉綠體超微結(jié)構(gòu)。
光合速率的測(cè)定:不同比例的紅藍(lán)光處理番茄幼苗15 d后,用便攜式光合-熒光聯(lián)用系統(tǒng)(LI-6400XT,LI-COR Inc,USA)測(cè)定不同紅藍(lán)光配比處理下番茄幼苗最新完全展開(kāi)葉片的凈光合速率(Pn)、氣孔導(dǎo)度(Gs)、胞間CO2濃度(Ci)和氣孔限制值(Ls),每個(gè)處理選擇5株,每株選擇3個(gè)葉片進(jìn)行測(cè)定。
葉綠素?zé)晒鈪?shù)測(cè)定:采用PAM-II 便攜調(diào)制式熒光儀(PAM Photosynthesis Yield Aanalyser,Walz,Effeltrich,Germany)測(cè)定葉綠素?zé)晒鈪?shù):穩(wěn)態(tài)熒光水平(Fs)、飽和光脈沖激發(fā)的熒光水平(Fm′)、PSII實(shí)際光化學(xué)效率(ΦPSⅡ)和光適應(yīng)下PSII 最大光化學(xué)效率(Fv′/Fm′)。
番茄幼苗干物質(zhì)積累的測(cè)定:用蒸餾水沖洗番茄植株表面基質(zhì)及灰層后,用吸水紙吸干植株表面的水分,然后用精度為0.001 g的電子天平(FA2004C,上海越平科學(xué)儀器有限公司)分別測(cè)量番茄幼苗葉片、莖和根的鮮質(zhì)量,將鮮樣在105 ℃殺青15 min后,于電熱鼓風(fēng)干燥箱(101-2型,北京科偉永興儀器有限公司)中70 ℃烘干48 h 至恒量后,采用精度為0.000 1 g的電子天平(AL204,梅特勒-托利多儀器有限公司,上海)稱量各部分干質(zhì)量。
壯苗指數(shù)的計(jì)算[18]:壯苗指數(shù) = (莖粗 /株高+地下部干質(zhì)量 /地上部干質(zhì)量) ×全株干質(zhì)量。
1.4 數(shù)據(jù)處理
采用SPSS 20.0對(duì)試驗(yàn)數(shù)據(jù)進(jìn)行方差分析及顯著性分析(α=0.05),用OriginPro 8.0進(jìn)行圖表制作。
2 結(jié)果與分析
2.1 不同比例紅藍(lán)光處理對(duì)番茄植株生長(zhǎng)的影響
由圖2和表1可知,不同比例的紅藍(lán)光處理對(duì)番茄形態(tài)生長(zhǎng)影響顯著。R處理番茄株高和第1節(jié)間長(zhǎng)度顯著高于其他處理。R、2R1B和1R1B處理番茄的莖粗和真葉數(shù)間無(wú)顯著性差異,但均顯著高于對(duì)照及其他處理番茄的莖粗。R、2R1B、1R1B和1R2B處理下的番茄莖粗分別較對(duì)照增加47.84%、46.86%、46.08%和14.71%,而B(niǎo)處理和W處理無(wú)顯著性差異。

圖2 不同比例紅藍(lán)光處理下番茄植株幼苗的生長(zhǎng)
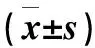
表1 不同紅藍(lán)光比例處理下番茄的幼苗形態(tài)指標(biāo)
注:同列不同小寫(xiě)字母表示處理間差異顯著(P<0.05),下同。
Note: Different lowercase letters in the same column means significant difference (P<0.05), the same below.
2.2 不同比例紅藍(lán)光處理對(duì)番茄植株葉片葉綠素質(zhì)量分?jǐn)?shù)、葉面積及比葉重的影響
不同比例的紅藍(lán)光對(duì)番茄幼苗葉片的葉綠素質(zhì)量分?jǐn)?shù)、葉面積及比葉重具有顯著影響(圖3)。由圖3-A可知,R和B處理番茄幼苗葉綠素質(zhì)量分?jǐn)?shù)最高,葉綠素質(zhì)量分?jǐn)?shù)隨藍(lán)光比例的增加而增加。由圖3-B可知,1R1B處理番茄幼苗的葉綠素a/ b的比值最高,顯著高于R、B和W處理。由圖3-C可知2R1B和1R1B處理番茄幼苗的葉面積無(wú)顯著差異,且顯著高于W及其他處理,R與1R2B次之,且兩者無(wú)顯著差異,而W與B最低。由圖3-D可知,R處理下葉片比葉重最大,1R1B次之,并且顯著高于其他處理,W處理下比葉重最低。

不同小寫(xiě)字母表示處理間差異顯著(P<0.05),下同
2.3 不同比例紅藍(lán)光處理對(duì)番茄葉片結(jié)構(gòu)和葉綠體超微結(jié)構(gòu)的影響
由表2可知,不同比例紅藍(lán)光處理對(duì)番茄葉片結(jié)構(gòu)影響顯著。2R1B處理葉片最厚,W次之,1R2B與B無(wú)顯著差異,而R的葉片厚度最低,顯著低于其他處理。2R1B處理番茄葉片的柵欄組織最長(zhǎng),1R2B和1R1B次之,且二者之間無(wú)顯著性差異; R和B處理番茄葉片的柵欄組織和海綿組織最短,顯著低于其他處理。由圖4可以看出,1R1B、 1R2B和W處理番茄葉片的柵欄組織排列整齊,并且和海綿組織有明顯的界線,而R處理番茄葉片的柵欄組織排列雜亂且和海綿組織之間無(wú)明顯界線。B、R和W處理的柵欄組織長(zhǎng)度顯著低于紅藍(lán)光處理。
由圖5可知,不同比例紅藍(lán)光處理對(duì)番茄葉綠體超微結(jié)構(gòu)影響顯著。R處理番茄葉片的淀粉粒體積膨大,占據(jù)葉綠體主要結(jié)構(gòu)空間,葉綠體基粒片層整齊,基粒類囊體垛疊較少; B 處理淀粉粒少,葉綠體基粒數(shù)少,基粒類囊體結(jié)構(gòu)不明顯。2R1B和1R1B 處理,淀粉粒體積相對(duì)R處理縮小,葉綠體基質(zhì)和基粒片層清晰,基粒類囊體垛疊較多且排列整齊致密,1R2B 處理,淀粉粒質(zhì)量分?jǐn)?shù)少;CK 處理,淀粉粒體積較小基粒數(shù)較少,基質(zhì)片層清晰,片層較薄。

表2 不同比例紅藍(lán)光處理番茄幼苗葉片結(jié)構(gòu)

PT.柵欄組織細(xì)胞 Palisade tissue cells;ST.海綿組織細(xì)胞 Sponge tissue cells;UE.上表皮 Upper epidermis;LE.下表皮 Lower epidermis;S.氣孔 Stomata.下同 The same below
圖4不同比例紅藍(lán)光處理下番茄植株幼苗葉片結(jié)構(gòu)
Fig.4Anatomicalstructureoftomatoleavesunderdifferentredandbluelightratios
2.4 不同比例紅藍(lán)光處理對(duì)番茄植株光合特性的影響
番茄幼苗處理15 d后,不同比例紅藍(lán)光處理對(duì)各光合特性指標(biāo)產(chǎn)生了不同程度的影響(圖6)。2R1B處理Pn與1R1B及W無(wú)顯著性差異,且均顯著高于其他處理(比R、B和1R2B分別高22.30%、21.11%和10.95%)。番茄幼苗Gs隨藍(lán)光比例的增加,先升后降,B處理幼苗Gs顯著低于1R2B(11.64%),2R1B、1R1B、1R2B和B處理番茄幼苗顯著高于W(P<0.05),R處理番茄幼苗和W無(wú)顯著性差異。處理組的Ci顯著高于CK,1R2B和B處理的Ci顯著高于其他處理(W除外)。Ls的變化趨勢(shì)與Ci的變化趨勢(shì)恰好相反。

MC.葉肉細(xì)胞 Mesophyll cells;CW.細(xì)胞壁 Cell wall;CP.葉綠體 Chloroplast;SG.淀粉顆粒 Starch grain;G.基粒類囊體 Granathylakoid; ST.基質(zhì)類囊體 Stromathylakoid; P.質(zhì)體小球 Plastoglobulus
圖5不同比例紅藍(lán)光處理下葉綠體超微結(jié)構(gòu)
Fig.5Structureofchloroplastsunderdifferentredandbluelightratios
2.5 不同比例紅藍(lán)光處理對(duì)番茄植株Fv′/Fm′ 和ΦPSⅡ的影響
番茄幼苗處理15 d后,不同比例紅藍(lán)光處理對(duì)Fv′/Fm′和ΦPSⅡ產(chǎn)生了不同程度的影響(表3)。1R1B處理下番茄幼苗的Fv′/Fm′最高,顯著高于其他處理,但和B處理下的幼苗無(wú)顯著差異,R處理下的Fv′/Fm′最低。2R1B、1R1B和1R2B處理下幼苗的ΦPSⅡ無(wú)顯著性差異,但顯著高于其他處理,B處理下的ΦPSⅡ最低。
2.6 不同比例紅藍(lán)光處理對(duì)番茄植株干、鮮質(zhì)量的影響
由表4可以看出,不同比例的紅藍(lán)光處理對(duì)番茄植株地上部和地下部干、鮮質(zhì)量影響顯著。2R1B和1R1B處理植株地下部的鮮質(zhì)量顯著高于其他處理,R、2R1B和1R1B處理間的番茄幼苗地上部鮮質(zhì)量和總干質(zhì)量無(wú)顯著差異,但顯著高于其他處理。R、2R1B和1R1B處理番茄不同光質(zhì)對(duì)地上部干質(zhì)量與總干質(zhì)量影響趨勢(shì)一致,2R1B處理地下部干質(zhì)量和1R1B處理無(wú)顯著差異,但顯著高于其他處理。
由表4和圖2可知,2R1B和1R1B處理番茄幼苗植株的壯苗指數(shù)無(wú)顯著差異,但顯著高于其他處理。

圖6 不同比例紅藍(lán)光處理下番茄植株的光合特性

表3 不同比例紅藍(lán)光質(zhì)處理下番茄幼苗葉片葉綠素的熒光參數(shù)
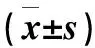
表4 不同比例紅藍(lán)光處理下番茄植株地上部和地下部干、鮮質(zhì)量
3 討 論
光在植物生長(zhǎng)發(fā)育中具有重要作用,既可作為能量供植物生長(zhǎng),也可作為光信號(hào)調(diào)控其形態(tài)建成[25]。大量研究表明,植物的生長(zhǎng)發(fā)育、葉片形態(tài)及干物質(zhì)積累受光質(zhì)尤其是紅藍(lán)光[9,26]的顯著影響。本研究發(fā)現(xiàn)R處理下的番茄幼苗株高最高,B處理下最矮,2R1B和1R1B處理下幼苗壯苗指數(shù)顯著高于其他處理,這與徐文棟等[27]在黃瓜上的研究一致。說(shuō)明藍(lán)光可以抑制莖的生長(zhǎng),而紅光促進(jìn)莖的伸長(zhǎng)。徐文棟等[27]研究發(fā)現(xiàn)紅光下黃瓜的葉面積最大,而本試驗(yàn)2R1B處理下幼苗的葉面積最大,可能是因?yàn)椴煌N類的蔬菜對(duì)光質(zhì)的響應(yīng)具有差異性[28],選擇合適的光質(zhì)可以促進(jìn)作物的生長(zhǎng)發(fā)育。葉片中的葉綠素是衡量植物生長(zhǎng)發(fā)育的一個(gè)重要指標(biāo)。Nhutd等[29]發(fā)現(xiàn)紅光促進(jìn)草莓試管苗的生長(zhǎng)但是降低了葉綠素質(zhì)量分?jǐn)?shù),30%藍(lán)光顯著提高了草莓試管苗的葉片葉綠素質(zhì)量分?jǐn)?shù),這與本試驗(yàn)在紅光處理下葉綠素質(zhì)量分?jǐn)?shù)最高不一致,可能是由不同作物之間的差異性導(dǎo)致。Sander 等[30]報(bào)道了50%的藍(lán)光可以提高黃瓜葉片的葉綠素a/b,這與本研究結(jié)果相一致。Chla/Chlb反映捕光色素復(fù)合體II (LHCII)在所有含葉綠素的結(jié)構(gòu)中所占比例,該比值與植物光能利用率呈正相關(guān)[31]。
葉片是植物進(jìn)行光合作用,將光能轉(zhuǎn)化為化學(xué)能的重要組織器官[32]。葉片結(jié)構(gòu)與光合作用存在緊密聯(lián)系[33]。不同光質(zhì)處理通過(guò)改變植物葉面積、葉片數(shù)量、傾斜角度、葉片厚度和葉片結(jié)構(gòu)[33-35],從而最大程度利用光能。本試驗(yàn)發(fā)現(xiàn),1R1B和1R2B處理下番茄葉片的柵欄組織排列整齊、致密。Macedo等[36]研究發(fā)現(xiàn)藍(lán)光處理可以顯著增加蓮子草葉片的上表皮和柵欄組織的厚度,這與本研究發(fā)現(xiàn)2R1B處理下可以顯著增加?xùn)艡诮M織、海綿組織和葉片厚度不太一致,這可能與作物的品種有關(guān),需要進(jìn)一步研究。此外,本試驗(yàn)發(fā)現(xiàn),2R1B處理下葉片柵欄組織厚度顯著高于W處理, 這與Liu等[37]報(bào)道的紅藍(lán)光處理顯著增加了番茄葉片的厚度和柵欄組織細(xì)胞的長(zhǎng)度相一致。以往研究表明,紅藍(lán)光處理下的葉肉細(xì)胞中含有更多的淀粉粒,基質(zhì)類囊體和基粒類囊體之間的界線更清晰[38],這與本研究發(fā)現(xiàn)的2R1B和1R1B處理下基質(zhì)、基粒片層清晰,基粒類囊體垛疊較多且排列整齊致密,葉綠體中適當(dāng)比例的淀粉粒結(jié)果相一致;表明適宜比例的紅藍(lán)光處理有利于促進(jìn)葉綠體內(nèi)部結(jié)構(gòu)整齊,從而促進(jìn)光合速率的提高。
葉片的光合和熒光特性是衡量作物對(duì)光能的吸收、利用與分配的兩個(gè)重要指標(biāo)。其中Fv′/Fm′是PSII有效光化學(xué)量子產(chǎn)量,反映開(kāi)放的PSII反應(yīng)中心原初光能捕獲效率,可以表示光合功能的相對(duì)限制。本試驗(yàn)中,W和2R1B下葉片Pn均較高,這可能是由于該處理下Chla/b較高、柵欄組織排列更加緊密和葉綠體中類囊體垛疊較多且排列整齊致密,從而增加了葉片對(duì)光能的利用率,但是W處理下番茄幼苗的干物質(zhì)積累和壯苗指數(shù)較低,這與王麗偉等[18]研究相似,白光處理下淀粉顆粒體積較小不利于干物質(zhì)的積累。總之,植物光合作用受到很多因素的影響,而干物質(zhì)積累和壯苗指數(shù)的高低并不能完全反映光合作用的強(qiáng)弱。本試驗(yàn)表明,1R1B處理下Fv′/Fm′和ΦPSⅡ最高,這與蘇娜娜等[10]在黃瓜上發(fā)現(xiàn)的50%的藍(lán)光可以顯著提高光合速率和ΦPSⅡ結(jié)果相一致。周成波等[39]發(fā)現(xiàn)以白光為背景,紅光∶藍(lán)光=1∶1處理下的小白菜的光合作用、Fv′/Fm′和ΦPSⅡ最高,這與本研究結(jié)果相一致,表明1R1B處理在一定程度上可以提高植株P(guān)S II反應(yīng)中心活性、原初光能轉(zhuǎn)換效率及光能利用率。
健康強(qiáng)壯的幼苗有利于增加作物的產(chǎn)量和提高蔬菜的品質(zhì)。Kai等[40]發(fā)現(xiàn)增加夜間紅光打斷次數(shù)可以使番茄幼苗更健壯,并增加早期產(chǎn)量。本研究發(fā)現(xiàn)R、2R1B和1R1B處理可以顯著增加番茄幼苗的地上部和全株的干鮮質(zhì)量,2R1B和1R1B處理顯著增加地下部干鮮質(zhì)量,可能是該配比可以顯著提高碳水化合物的積累,這與Nhutd等[29]發(fā)現(xiàn)的30%藍(lán)光+70%紅光可以明顯提高草莓幼苗地下部和地上部的干質(zhì)量相符,表明不同光質(zhì)配比可以顯著影響光合同化產(chǎn)物的運(yùn)輸與積累。綜上,2R1B和1R1B處理可以明顯促進(jìn)番茄幼苗的干物質(zhì)積累,為植株后期的生殖生長(zhǎng)奠定良好的基礎(chǔ)。
4 結(jié) 論
本研究結(jié)果表明,合適的紅藍(lán)光比例有利于改善葉肉細(xì)胞結(jié)構(gòu)與葉綠體超微結(jié)構(gòu),提高植株葉片的光合色素及光合速率,從而促進(jìn)植株的干物質(zhì)積累、分配與植株健壯成長(zhǎng)。本試驗(yàn)中,2R1B和1R1B下葉綠體基粒、基質(zhì)片層發(fā)育更良好,葉片柵欄組織和海綿組織的厚度較厚,柵欄組織排列比其他處理更整齊、致密,且其葉面積、Pn、Fv′/Fm′和ΦPSⅡ較高,幼苗的壯苗指數(shù)最高,株型更緊湊。R、2R1B和1R1B處理下番茄幼苗的干質(zhì)量顯著高于其他處理。綜上所述,2R1B和1R1B處理植株生長(zhǎng)最好,可做為番茄育苗的合適光質(zhì)比例。
參考文獻(xiàn)Reference:
[1] KRUMBEIN A,PETERS P,BRüCKNER B.Flavour compounds and a quantitative descriptive analysis of tomatoes(LycopersiconesculentumMill.) of different cultivars in short-term storage[J].PostharvestBiologyandTechnology,2004,32(1):15-28.
[2] 牛 玉,戚志強(qiáng),韓 旭,等.矮壯素和乙烯利對(duì)櫻桃番茄幼苗生長(zhǎng)的影響[J].熱帶作物學(xué)報(bào),2013,34(12):2353-2357.
NIU Y,QI ZH Q,HAN X,etal.Effect of plant chlormequat and ethephon on growth of cherry tomato seedlings [J].ChineseJournalofTropicalCrops,2013,34(12):2353-2357.
[3] BEROVA M,ZLATEV Z.Physiological response and yield of paclobutrazol treated tomato plants(LycopersiconesculentumMill.)[J].PlantGrowthRegulation,2000,30(2):117-123.
[4 ] 佘佳榮,楊仁斌,王海萍,等.多效唑在油菜植株、油菜籽和土壤中的殘留[J].農(nóng)藥學(xué)學(xué)報(bào),2008,10(1):113-116.
SHE J R,YANG R B,WANG H P,etal.Paclobutrazol residue in rapeseed plant,rapeseed and soil[J].ChineseJournalofPesticideScience,2008,10(1):113-116.
[5] 包媛媛,張新永,邵金良,等.多效唑在番茄和土壤中的殘留與降解動(dòng)態(tài)研究[J].生態(tài)環(huán)境學(xué)報(bào),2014,23(5):864-869.
BAO Y Y,ZHANG X Y,SHAO J L,etal.Dynamics of the residue and degradation of paclobutrazol in tomato and soil[J].EcologyandEnvironmentSciences,2014,23(5):864-869.
[6] HERNNDEZ R,KUBOTA C.Physiological responses of cucumber seedlings under different blue and red photon flux ratios using LEDs [J].EnvironmentalandExperimentalBotany,2016,121(1):66-74.
[7] 徐圓圓,覃 儀,呂蔓芳,等.LED光源在植物工廠中的應(yīng)用[J].現(xiàn)代農(nóng)業(yè)科技,2016(6):161-162,170.
XU Y Y,QIN Y,Lü M F,etal.Current status and developmental trends of LED light source utilization in plant factory [J].ModernAgriculturalScienceandTechnology,2016(6):161-162,170.
[8] 崔 瑾,徐志剛,邸秀茹.LED在植物設(shè)施栽培中的應(yīng)用和前景[J].農(nóng)業(yè)工程學(xué)報(bào),2008,24(8):249-253.
CUI J,XU ZH G,DI X R.Applications and prospects of light emitting diode in plant protected culture [J].TransactionsoftheChineseSocietyofAgriculturalEngineering,2008,24(8):249-253.
[9] WANG J,LU W,TONG Y,etal.Leaf morphology,photosynthetic performance,chlorophyll fluorescence,stomatal development of lettuce(LactucasativaL.) exposed to different ratios of red light to blue light[J].FrontiersinPlantScience,2016,7:1-9.
[10] 蘇娜娜,鄔 奇,崔 瑾.LED光質(zhì)補(bǔ)光對(duì)黃瓜幼苗生長(zhǎng)和光合特性的影響[J].中國(guó)蔬菜,2012(24):48-54.
SU N N,WU Q,CUI J.Effects of supplemental lighting with LED light quality on growth and photosynthetic characteristics of cucumber seedlings [J].ChinaVegetables,2012(24):48-54.
[11] 陳祥偉,劉世琦,王 越,等.不同LED光源對(duì)烏塌菜生長(zhǎng)、光合特性及營(yíng)養(yǎng)品質(zhì)的影響[J].應(yīng)用生態(tài)學(xué)報(bào),2014,25(7):1955-1962.
CHEN X W,LIU SH Q,WANG Y,etal.Effects of different LED light qualities on growth,photosynthetic characteristics and nutritional quality of savoy [J].ChineseJournalofAppliedEcology,2014,25(7):1955-1962.
[12] 邢澤南,張 丹,李 薇,等.光質(zhì)對(duì)油葵芽苗菜生長(zhǎng)和品質(zhì)的影響[J].南京農(nóng)業(yè)大學(xué)學(xué)報(bào),2012,35(3):47-51.
XING Z N,ZHANG D,LI W,etal.Effects of light quality on the growth and quality ofHelianthusannuussprouts [J].JournalofNanjingAgriculturalUniversity,2012,35(3):47-51.
[13] POUDEL P R,KATAOKA I,MOCHIOKA R.Effect of red-and blue-light-emitting diodes on growth and morphogenesis of grapes [J].PlantCell,TissueandOrganCulture,2008,92(2):147-153.
[14] REED J W,NAGPAL P,POOLE D S,etal.Mutations in the gene for the red/ far-red light receptor phytochrome B alter cell elongation and physiological responses throughoutArabidopsisdevelopment[J].PlantCell,1993,5(2):147-157.
[15] GUPTA V,TRIPATHY B C.Effect of light quality on chlorophyll accumulation and protein expression in wheat(TriticumaestivumL.) seedlings [J].InternationalJournalofBiotechnology&Biochemistry,2010,6(4):521-536.
[16] TALBOTT L D,SHMAYEVICH I J,CHUNG Y,etal.Blue light and phytochrome-mediated stomatal opening in the npq1 and phot1 phot2 mutants ofArabidopsis[J].PlantPhysiology,2003,133(4):1522-1529.
[17] SBA,KREKLING T,APPELGREN M.Light quality affects photosynthesis and leaf anatomy of birch plantlets in vitro [J].PlantCellTissue&OrganCulture,1995,41(2):177-185.
[18] 王麗偉,李 巖,辛國(guó)鳳,等.不同比例紅藍(lán)光對(duì)番茄幼苗生長(zhǎng)和光合作用的影響[J].應(yīng)用生態(tài)學(xué)報(bào),2017,28(5):1595-1602.
WANG L W,LI Y,XIN G F,etal.Effects of different proportions of red and blue light on the growth and photosynthesis of tomato seedlings[J].ChineseJournalofAppliedEcology,2017,28(5):1595-1602.
[19] MIZUNO T,OKA H,YOSHIMURA F,etal.Insight into the mechanism of end-of-day far-red light(EODFR)-induced shade avoidance responses inArabidopsisthaliana[J].JournaloftheAgriculturalChemicalSocietyofJapan,2015,79(12):1987-1994.
[20] LI H M,XU ZH G,TANG C M.Effect of light-emitting diodes on growth and morphogenesis of upland cotton(GossypiumhirsutumL.) plantlets in vitro[J].PlantCellTissueandOrganCulture,2010,103(2):155-163.
[21] LIN K H,HUANG M Y,HUANG W D,etal.The effects of red,blue,and white light-emitting diodes on the growth,development,and edible quality of hydroponically grown lettuce(LactucasativaL.var.capitata)[J].ScientiaHorticulturae,2013,150:86-91.
[22] 高俊鳳.植物生理學(xué)實(shí)驗(yàn)指導(dǎo)[M].北京:高等教育出版社,2006:74-77.
GAO J F.Plant Physiology Experiment Guide[M].Beijing:Higher Education Press,2006:74-77.
[23] 吳 濤,耿云芬,柴 勇,等.三葉爬山虎葉片解剖結(jié)構(gòu)和光合生理特性對(duì)3種生境的響應(yīng)[J].生態(tài)環(huán)境學(xué)報(bào),2014,23(10):1586-1592.
WU T,GENG Y F,CHAI Y,etal.Response of leaf anatomical structure and photosynthesis characteristics ofParthenocissushimalayanato three habitat types[J].EcologyandEnvironmentalSciences,2014,23(10):1586-1592.
[24] HE X,LIU B.Oolong tea extract as a substitute for uranyl acetate in staining of ultrathin sections based on examples of animal tissues for transmission electron microscopy[J].JournalofMicroscopy,2017,267(1):27-33.
[25] SHIMAZAKI K,DOI M,ASSMANN S M,etal.Light regulation of stomatal movement [J].AnnualReviewofPlantBiology,2007,58(1):219-247.
[26] YORIO N C,GOINS G D,KAGIE H R,etal.Improving spinach,radish,and lettuce growth under red light-emitting diodes(LEDs) with blue light supplementation[J].HortscienceAPubicationoftheAmericanSocietyforHorticulturalScience,2001,36(2):380-383.
[27] 徐文棟,劉曉英,焦學(xué)磊,等.不同紅藍(lán)配比的LED光調(diào)控黃瓜幼苗的生長(zhǎng)[J].植物生理學(xué)報(bào),2015,51(8):1273-1279.
XU W D,LIU X Y,JIAO X L,etal.Different ratio of red and blue LED regulation growth and development of cucumber seedlings[J].PlantPhysiologyJournal,2015,51(8):1273-1279.
[28] KEIKO O K,TAKASE M,MON N,etal.Effect of light quality on growth and vegetable quality in leaf lettuce,spinach and komatsuna [J].EnvironmentControlinBiology,2007,45(3):189-198.
[29] NHUTD T,TAKAMURA T,WATANABE H,etal.Responses of strawberry plantlets cultured in vitro under superbright red and blue light-emitting diodes(LEDs) [J].PlantCellTissue&OrganCulture,2003,73(1):43-52.
[30] SANDER W,HOGEWONING,GOVERT TROUWBO- RST,etal.Blue light dose-responses of leaf photosynthesis,morphology,and chemical composition of Cucumis sativus grown under different combinations of red and blue light [J].JournalofExperimentalBotany,2010,61(11):3107-3117.
[32] TERASHIMA I,HANBA Y T,THOLEN D,etal.Leaf functional anatomy in relation to photosynthesis [J].PlantPhysiology,2011,155(1):108-116.
[33] MEIER I C,LEUSCHNER C.Leaf size and leaf area index in Fagus sylvatica forests:competing effects of precipitation,temperature,and nitrogen availability[J].Ecosystems,2008,11(5):655-669.
[34] 張 超,楊曉盆,王文梅,等.不同光質(zhì)對(duì)美國(guó)紅櫨葉片結(jié)構(gòu)的影響[J].山西林業(yè)科技,2008(1):4-6.
ZHANG CH,YANG X P,WANG W M,etal.Effect of light quality on tissue of leaf ofCotinuscoggygria‘Royal purple’[J].ShanxiForestryScienceandTechnology,2008(1):4-6.
[35] LEE D W,OBERBAUER S F,JOHNSON P,etal.Effects of irradiance and spectral quality on leaf structure and function in seedlings of two Southeast Asian Hopea(Dipterocarpaceae) species[J].AmericanJournalofBotany,2000,87(4):447-455.
[36] MACEDO A F,LEAL-COSTA M V,TAVARES E S,etal.The effect of light quality on leaf production and development of in vitro-cultured plants ofAlternantherabrasilianaKuntze[J].Environmental&ExperimentalBotany,2011,70(1):43-50.
[37] LIU X Y,GUO SH R,XU ZH G,etal.Regulation of chloroplast ultrastructure,cross-section anatomy of leaves,and morphology of stomata of cherry tomato by different light irradiations of light-emitting diodes[J].JournalofBiotechnology,2011,24(2):129-139.
[38] SCHREIBER U,BILGER W,NEUBAUER C.Chlorophyll Fluorescence as a Nonintrusive Indicator for Rapid Assessment of in vivo Photosynthesis[M]//Ecophysiology of Photosynthesis.Springer Berlin Heidelberg,1995:49-70.
[39] 周成波,張 旭,崔青青,等.LED補(bǔ)光光質(zhì)對(duì)小白菜生長(zhǎng)及光合作用的影響[J].植物生理學(xué)報(bào),2017,53(6):1030-1038.
ZHOU CH B,ZHANG X,CUI Q Q,etal.Effects of supplementary light quality on growth and photosynthesis of pakchoi(Brassicacampestris)[J].PlantPhysiologyJournal,2017,53(6):1030-1038.
[40] KAI C,CUI L,LIN Y,etal.Effects of red light night break treatment on growth and flowering of tomato plants [J].FrontiersinPlantScience,2016(7):527.

