基于氮摻雜碳量子點/DNA自組裝納米探針檢測魚精蛋白
武建露,閆桂琴
(山西師范大學 生命科學院,山西 臨汾 041004)
1 引 言
魚精蛋白(Protamine)是一種從魚類精巢組織中分離獲得的多聚陽離子堿性蛋白。在醫學領域里,它可延遲或阻止胰島素釋放,或作為肝素解毒劑等[1]。魚精蛋白作為一種新型的食品資源,具有高效抑菌活性[2]。同時,魚精蛋白也是近年發展起來的又一新型的天然高分子非病毒載體,鑒于魚精蛋白豐富的生物活性和重要的藥用價值,如何實現魚精蛋白快速、簡單的測定引起了廣大學者的關注。
目前,關于魚精蛋白的測定方法報道的甚少,僅見于液相色譜法、傳統熒光法、電位滴定法等。這些方法中,液相色譜法需要復雜的樣品預處理,電化學法需要復雜的電極修飾過程,傳統熒光法雖然靈敏,但難以避免干擾物質。因此,建立一種靈敏、準確的魚精蛋白分析方法十分有必要。
碳量子點作為一種新興的納米材料,因其易于合成、定制的功能化及優異的化學和膠體穩定性對跨學科研究給予了巨大的希望[3],它們內在的光致發光性質被稱為“納米亮點”[4],特別是由于碳點的多色發射性能和生物相容性對發展生物成像和生物傳感非常重要[5],碳量子點作為一種新型熒光探針,已廣泛應用于化學分析[6-7]和生物傳感[8]等研究領域。本文將氮原子摻入到碳點中。由于氮原子具有孤對電子,其進入碳骨架后將有效調節碳點的本身性質,如電子特征、表面或者局部的化學特性[9]。碳點的發射特性及其優點已被用于生物傳感器開發,現已被應用到臨床重要蛋白質的檢測。因此本文參考Hu[10]的方法由下至上地快速、簡單、大規模合成氮摻雜熒光碳點(NCDs)。這種方法是將檸檬酸置于單乙醇胺中,通過簡單加熱實現的。其中單乙醇胺扮演了修飾劑和溶劑的雙重角色,而檸檬酸是碳源。該方法不需要特殊的儀器,在相對溫和的條件下(170℃,空氣環境),能夠快速(10min)地一鍋合成大量(39.96g)的高質量氮摻雜碳點。
本文的研究目的是通過表面修飾或自組裝(氫鍵、酸/堿質子轉移、靜電作用)等功能化過程,使量子點與DNA通過靜電作用構建一種納米復合物,并探索將該復合物作為熒光納米探針對魚精蛋白進行檢測的可行性。雙鏈DNA的磷酸骨架(ds-DNA)通過負的靜電引力與帶有正電的NCDs相互吸引結合,形成了NCDs/DNA雜交物,使得NCDs的熒光明顯增強。有趣的是,當將魚精蛋白加入到NCDs/DNA混合物中時,魚精蛋白能夠競爭結合DNA,于是雙鏈DNA和魚精蛋白由于強烈的親和力結合,使得DNA從NCDs表面脫落從而解除了NCDs熒光信號,NCDs的熒光恢復,因此,可以通過監測熒光增強和恢復檢測魚精蛋白。
2 實 驗
圖1為氮摻雜碳量子點/DNA納米探針測定魚精蛋白的原理示意圖。

圖1 氮摻雜碳量子點/DNA納米探針測定魚精蛋白的原理示意圖Fig.1 Principle of determination of protamine with NCDs/DNA nano probe
2.1 試劑和材料
單乙醇胺、鮭魚精子DNA(hsDNA)、魚精蛋白(Protamine)均購與美國Sigma公司。檸檬酸購于上海愛為科研公司。其他試劑都為分析純并按原樣使用。實驗用水為超純水。
2.2 儀器
通過JEM-2100透射電子顯微鏡(日本電子,日本)觀察量子點形貌和微觀結構,通過Cary Eclipse熒光分光光度計(瓦里安有限公司,美國)對熒光和共振光散射(Resnnanee Light Seattering,RLS)進行信號測定(掃描波長200~800nm),通過pH酸度劑(上海雷磁,中國)對pH值進行測定。
2.3 氮摻雜碳點的合成
用檸檬酸作碳源大規模合成氮摻雜碳點。首先,將30g檸檬酸與230mL單乙醇胺混合,劇烈攪拌使其分散均勻。之后在冷凝回流的條件下,以大約20℃·min-1的速度加熱上述混合物至170℃并持續反應10min。在上述過程中,混合物溶液由無色慢慢變為黃色且顏色逐漸加深至棕黃色,這表明生成了氮摻雜碳點。10min后撤去熱源,將溶液自然冷卻至室溫。用旋轉蒸發儀蒸去未反應的單乙醇胺(蒸出的液體大約204mL)并真空干燥樣品,得到39.96g氮摻雜碳點粉末。
2.4 碳點的表征

熒光光譜(圖4)表明氮摻雜碳點具有激發波長依賴的熒光特性。當激發波長從360nm調至440nm時,氮摻雜碳點的熒光發射峰峰位從451nm紅移至518nm。這種依賴于激發波長的熒光變化特性很可能與粒子尺寸不均一和表面發射缺陷點過多有關[12]。當激發波長為370nm時,氮摻雜碳點具有最強的熒光發射,其峰位為365.085nm,半峰寬為75nm。以硫酸奎寧為參比,氮摻雜碳點的熒光量子產率為40.3%,高于絕大多數文獻報道的碳納米材料的熒光量子產率。氮摻雜碳點的光學穩定性好,在室溫下經近一年的儲存后,其熒光強度仍基本保持不變,在350nm的紫外燈照射下仍能發射明亮的藍色熒光。

圖2 NCDs的透射電鏡圖Fig.2 TEM image of NCDs
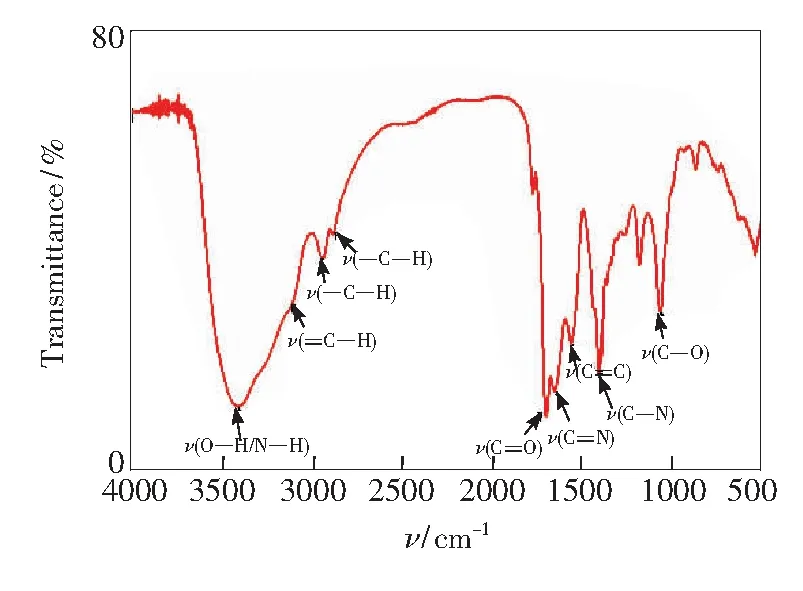
圖3 NCDs的紅外光譜圖Fig.3 FTIR spectra of NCDs
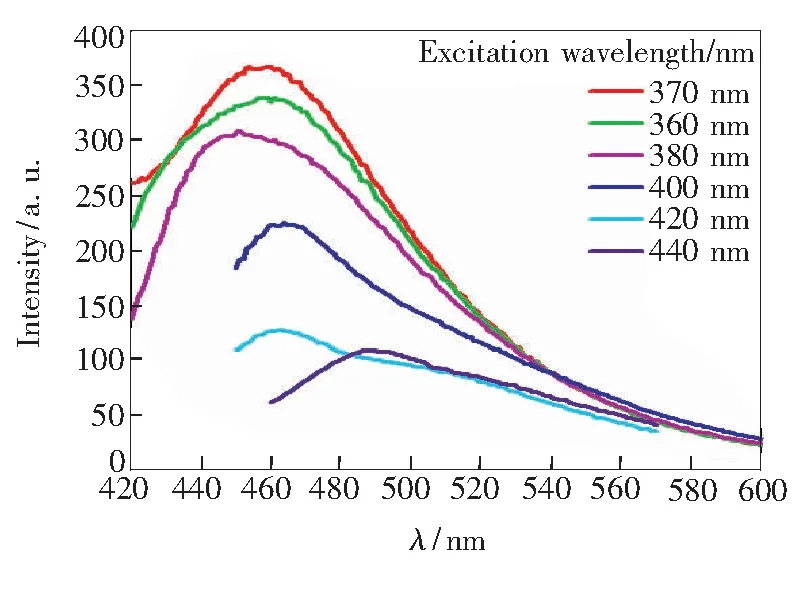
圖4 不同激發波長下NCDs的熒光光譜Fig.4 Normalized FL spectra of NCDs under different excitation wavelengths
2.5 測定方法
為研究DNA對NCDs熒光強度的影響,將DNA溶于超純水中,濃度為400μg·mL-1(經多次試驗后找到的最佳濃度),在一系列比色管中分別加入100~1000μL上述溶液,再分別加入(PBS10mol/mL,pH=7.4)0.5mL以及50μL濃度為1μg·mL-1的NCDs溶液于各比色管中。超純水定容至5mL,此時,DNA的濃度為8~88μg·mL-1。10min后進行熒光光譜測定分析。對于魚精蛋白的檢測,先將一定量的魚精蛋白溶于水,制得1mg·mL-1溶液,接著在一系列比色管中依次加入(PBS10mol/mL pH=7.4)0.5mL,和50μL濃度為1μg·mL-1的NCDs溶液以及1000μL濃度為400μg·mL-1的DNA溶液以及5~50μL濃度為1mg·mL-1不同量的魚精蛋白溶液(定容后濃度為1~10μg·mL-1),用高純水定容至5mL,靜止30min,進行熒光檢測。激發波長為370nm,掃描范圍為400~600nm,取激發光譜的最大吸收峰值作為定量分析值。
3 結果與討論
3.1 熒光納米探針構建原理

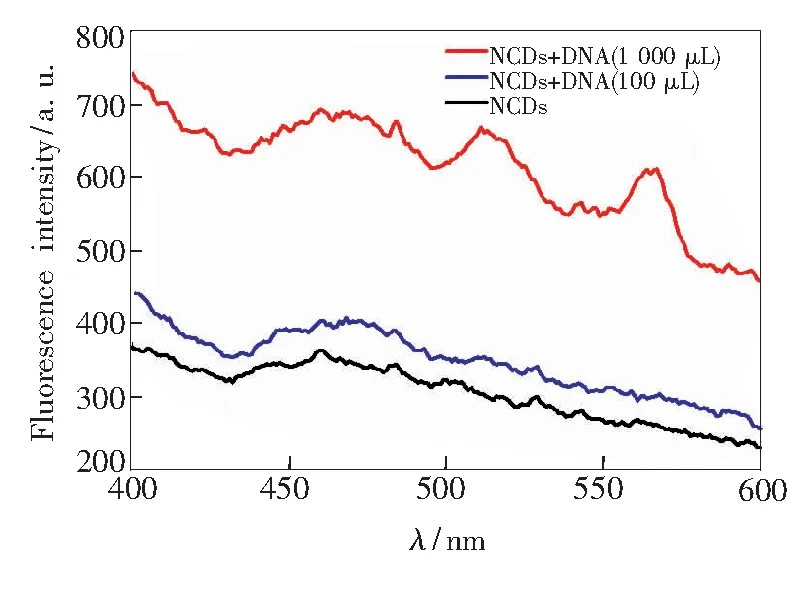
圖5 不同濃度的DNA與NCDs的RLS光譜Fig.5 RLS spectra of DNA and NCDs with different concentrations
通過Zeta電位進一步分析可得,在pH=7.4時,該體系的Zeta電位值(Z)從+24.68mV下降到+17.23mV也證實,NCDs與DNA通過靜電作用使得DNA周圍的負電荷減少,與NCDs的正電荷結合。
此外,還合成了陰離子型碳點(ACD)來驗證靜電吸引是否是形成混合物NCDs/DNA的驅動力,并進行了凝膠確認。NCDs/DNA混合形成一個典型的瓊脂糖凝膠電泳(質量分數3%,stained with ethidium bromide(EB)),電泳是由ACD/DNA、NCDs 和NCDs/DNA 進行的(NCDs和ACD為50μL,濃度為1μg·mL-1;DNA 為200μL,濃度為400μg·mL-1)。觀察比較發現EB染色的瓊脂糖凝膠電泳,ACD/DNA、NCDs/DNA 這兩條帶顏色顯著(圖6)。然而,在單純的含有NCDs條帶上,看不到任何熒光遷移現象。而在NCDs/DNA上,由于大多數自由的DNA和NCDs結合,NCDs/DNA的DNA帶也很微弱,但幾乎沒有DNA可以跟復雜的ACD結合,因此該條帶較亮。此外,密度分析該凝膠的發光區顯示,70%的DNA在和NCDs結合后不在凝膠中遷移。
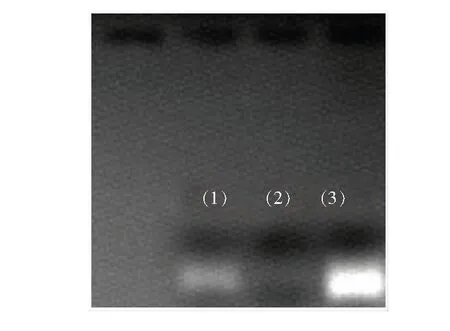
圖6瓊脂糖凝膠電泳。(1)NCDs/DNA;(2)NCDs;(3)ACD/DNA。
Fig.6Agarose gel electrophoresis.(1)NCDs/DNA.(2)NCDs.(3)ACD/DNA.
3.2 NCDs對DNA的熒光響應
DNA對NCDs的熒光強度有明顯的增強作用。我們在NCDs/DNA形成后測量每個溶液的發射光譜。通過增加DNA的量發現,NCDs的發射波長逐漸增大且發射最小值從310nm急劇增大到334nm,表明形成了納米混合物,如圖7所示。 隨著加入的 DNA濃度的增加,熒光強度逐漸增大,且增大效應明顯(圖7)。隨著DNA濃度從8μg·mL-1增加到88μg·mL-1,熒光強度呈線性增大,嵌入圖表示濃度與熒光強度之間的線性關系,其線性方程為I/I0=0.0875CDNA+0.9416(R=0.995)。實驗證明兩者之間發生了相互作用,可以通過熒光增強效應來測定DNA的含量。
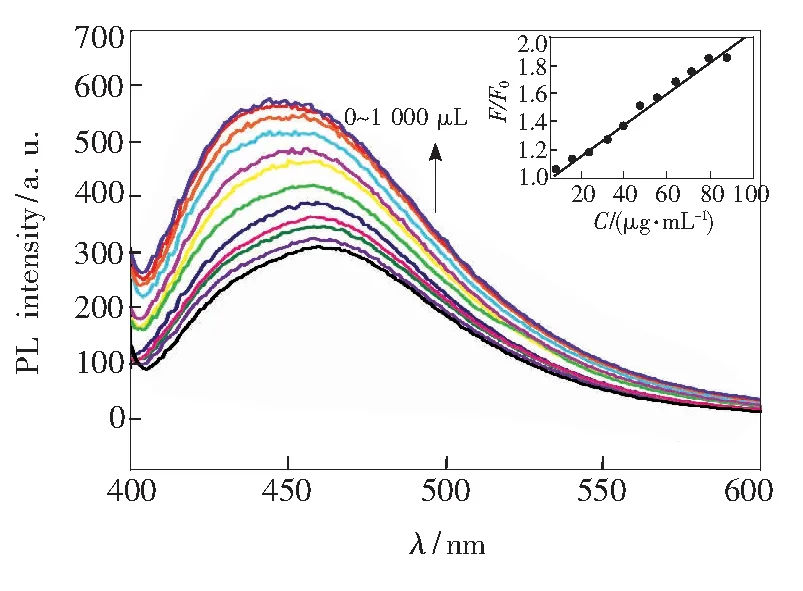
圖7 不同濃度的DNA熒光響應Fig.7 Relationship between different concentrations of DNA and fluorescence intensity
3.3 實驗條件的優化
圖8分別表示了溶液pH值和時間對DNA增強NCDs熒光強度的影響。如圖8(a)所示,pH值在4.0~9.0之間時,體系熒光較強,隨后開始逐漸降低。當下降到pH值為6.5后又開始增強。直到pH值到8.3之后,熒光強度又有了較明顯的下降,但在6.5~7.4之間基本保持不變。因此,我們選擇pH值為7.4作為后續測定最佳pH條件,之后對該體系反應時間進行了測定,如圖8(b)所示。在加試劑后立即測定,在最初反應時間之后每隔10min進行一次測定,一直到90min后,反應熒光強度基本都保持不變,說明該體系比較穩定,時間對其影響不大。
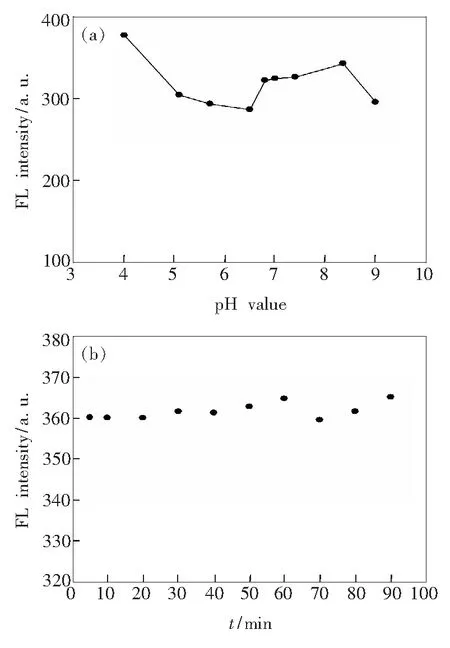
圖8(a)pH值對氮摻雜碳量子點/肝素熒光強度的影響;(b)時間對氮摻雜碳量子點/肝素熒光強度的影響。
Fig.8(a) Effect of pH value on fluorescence intensity of NCDs/DNA.(b) Effect of time on fluorescence intensity of NCDs/DNA.
3.4 NCDs/DNA自組裝納米探針對魚精蛋白的檢測
如圖9所示,在NCDs/DNA復合體系中加入魚精蛋白后,體系熒光強度隨著魚精蛋白的加入逐漸降低。而在單純的NCDs溶液中加入魚精蛋白,NCDs室溫熒光強度基本保持不變,這歸因于NCDs與魚精蛋白在溶液中均呈現正電,二者不會發生相互作用。
圖10顯示在加入DNA與魚精蛋白后,紫外光照射下NCDs熒光視覺變化的順序。從左到右依次為NCDs、NCDs+DNA、NCDs+DNA+魚精蛋白。該圖直觀地表明,加入DNA后NCDs熒光顯著增強,但繼續加入魚精蛋白后,熒光有所降低,基本恢復到了原有熒光亮度,說明魚精蛋白能競爭結合DNA并使DNA從NCDs表面脫落,使得NCDs的熒光恢復。
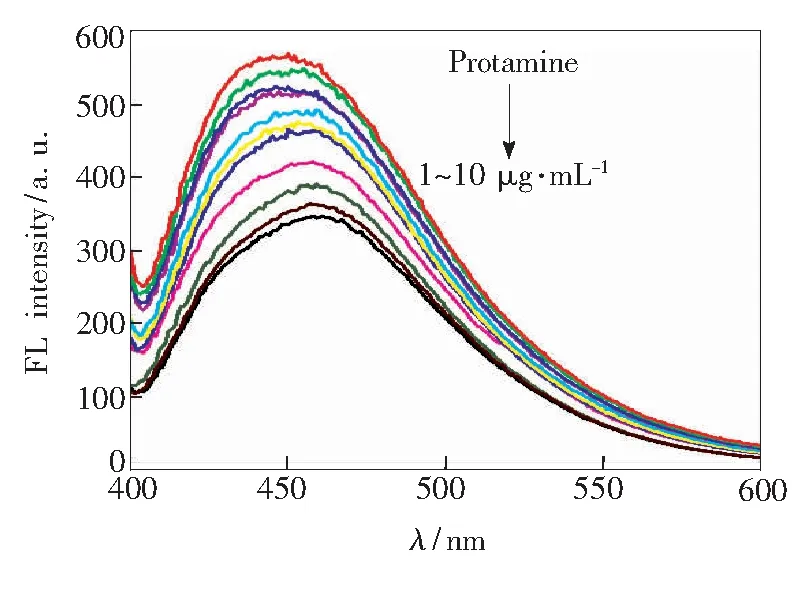
圖9不同濃度的魚精蛋白對NCDs/DNA納米探針熒光強度的影響
Fig.9Effect of different concentrations of protamine on fluorescence intensity of NCDs/DNA nano probe

圖10 紫外光照射下NCDs熒光視覺變化Fig.10 Visual changes of NCDs fluorescence under UV irradiation
通過Zeta電位進一步分析發現,在PH為7.4時,單獨的NCDs溶液的Zeta電位為+24.68mV,加DNA使Zeta電位降為+17.23mV。在二者體系中繼續加入魚精蛋白后,Zeta電位又升至+24.62mV。這些結果也說明DNA能與NCDs通過靜電作用形成基態復合物使NCDs周圍的電荷減少,魚精蛋白會中和DNA本身的負電荷,由于魚精蛋白與DNA形成了穩定的復合物,從而減弱了DNA與NCDs之間的靜電作用,使DNA從NCDs表面脫離,Zeta電位也隨之恢復,NCDs的熒光得到恢復。
基于以上結果分析,在最佳實驗條件下,我們建立了NCDs/DNA復合物熒光強度變化與魚精蛋白之間的線性響應關系,如圖11所示,線性方程為I/I0=0.0396Cprotamine+0.5789(R=0.991),線性范圍為1~10μg·mL-1。連續測定11次不含魚精蛋白和含1μg·mL-1體系熒光強度差值的相對偏差為6.8%,該方法檢出限(3σ/k)為0.61μg·mL-1。
就檢出限與檢出范圍與其他檢測方法相比較(表1),該方法的檢出限明顯低于液相色譜法。此外,與相似的量子點熒光法比較,雖然檢出限高,但范圍更寬。且NCDs熒光法中,量子點的合成更簡單,原料更便宜環保,操作更簡單。
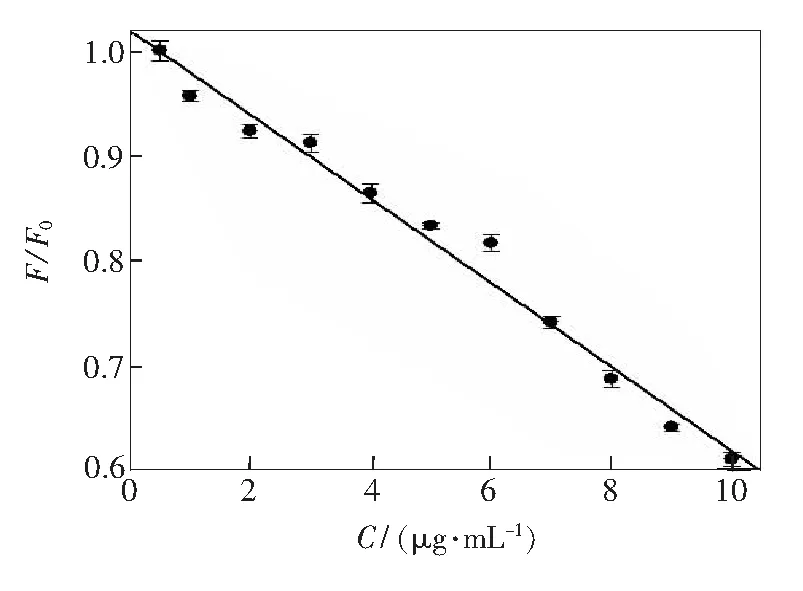
圖11NCDs/DNA復合物熒光強度變化與魚精蛋白之間的線性響應關系曲線
Fig.11Linear response curve between fluorescence intensity of NCDs/DNA complex and protamine

表1 魚精蛋白測定中不同分析方法的比較Tab.1 Comparison of the proposed method with different analytical techniques reported for determination of protamine
3.5 外源物質的干擾
為探究NCDs對肝素選擇的靈敏性及生物體液中常見小分子、離子對該檢測體系的干擾,我們做了以下干擾實驗(表2)。在5 μg·mL-1魚精蛋白存在的環境下,1 000倍的Na+、1 000倍的K+、150倍的Mg2+、200倍的Ca2+、500倍的Glucose、500倍的Lysozyme、140倍的Arginine、80倍的BSA、50倍的HA、50倍的KS對魚精蛋白的檢測造成的影響不明顯,其中Lysozyme影響稍高,可能和其帶有正電與一小部分DNA發生了靜電作用有關,但影響并不大可以忽略。因此,在實際檢測中外源物質對該檢測方法干擾較小,以上結果證明,該方法具有良好的選擇性。
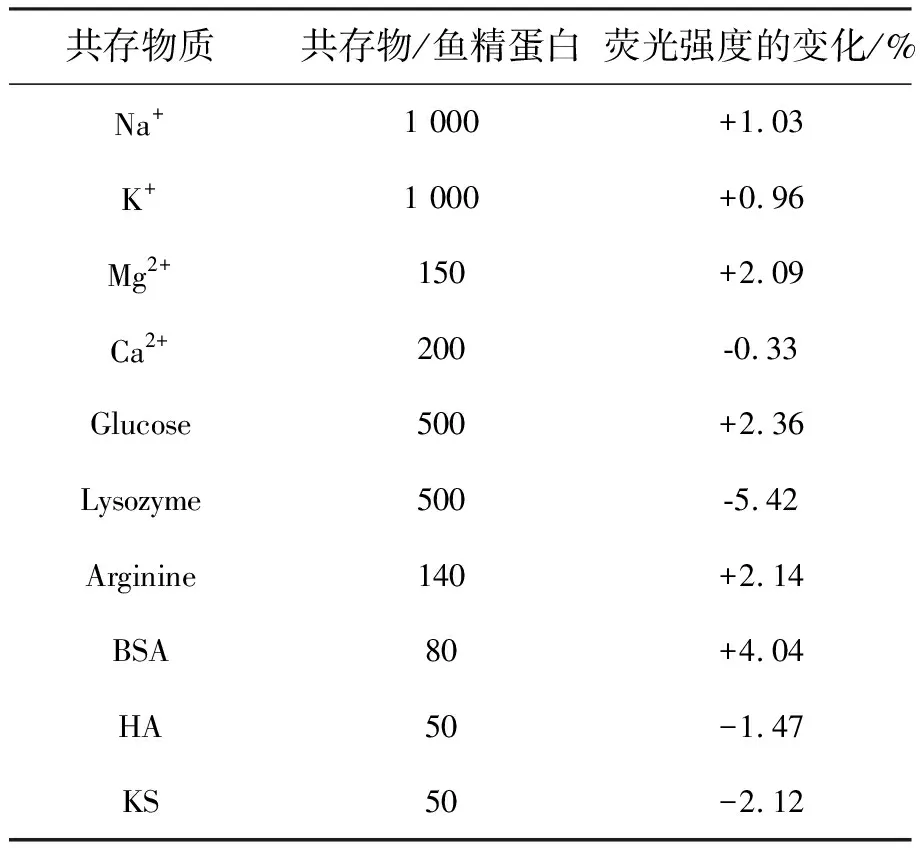
表2 外源物質的干擾Tab.2 Tolorance of foreign substances
4 結 論
基于氮摻雜碳量子點和DNA之間強烈的靜電作用,構建了一種快速、簡單、靈敏的自組裝納米探針檢測魚精蛋白。該方法有效地利用NCDs量子點特有的熒光性質,使DNA通過靜電作用與NCDs量子點結合并將量子點的熒光增強。隨后加入魚精蛋白,魚精蛋白與DNA相互作用并結合,將DNA從NCDs量子點表面解吸,進而使得NCDs量子點的熒光得到恢復。基于NCDs量子點熒光性質的檢測方法與傳統的方法相比較,不需要添加任何誘導劑及除氧。該納米探針可在濃度范圍1~10 μg·mL-1內有效檢測魚精蛋白,檢出限為0.61 μg·mL-1。此外,該檢測法具有成本低、無毒、環保、容易操作等優點,具有較強的實際意義。
參 考 文 獻:
[1] JAQUES L B.Protamine-antagonist to heparin [J].Can.Med.Assoc.J., 1973, 108:1291-1297.
[2] POTTER R, HANSEN L T, GILL T A.Inhibition of foodborne bacteria by native and modified protamine:importance of electrostatic interactions [J].Int.J.Pharm., 2012, 425:35-43.
[3] JOAQUIM C G, DA SILVA E, HELENA M R,etal..Analytical and bioanalytical applications of carbon dots [J].Anal.Chem., 2011, 30(8):1327-1336.
[4] BAKER S N, BAKER G A.Luminescent carbon nanodots:emergent nanolights [J].Angew.Chem.Int.Ed., 2010, 49:6726-6744.
[5] LIU J H, LI J S, JIANG Y,etal..Combination of p-p stacking and electrostatic repulsion between carboxylic carbon nanoparticles and fluorescent oligonucleotides for rapid and sensitive detection of thrombin [J].Chem.Commun., 2011, 47:11321-11323.
[6] HAMISHEHKAR H, GHASEMZADEH B, NASERI A,etal..Carbon dots preparation as a fluorescent sensing platform for highly efficient detection of Fe(Ⅲ) ions in biological systems [J].Spectrochim.ActaA, 2015, 150:934-939.
[7] ZHAO J J , ZHAO L M, LAN C Q,etal..Graphene quantum dots as effective probes for label-free fluorescence detection of dopamine [J].Sens.ActuatorsB-Chem., 2016, 223:246-251.
[8] WANG G L, FANG X, WU X M,etal..Label-free and ratiometric detection of nuclei acids based on grapheme quantum dots utilizing cascade amplification by nicking endonuclease and catalytic G-quadruplex DNAzyme [J].Biosens.Bioelectron., 2016, 81:214-220.
[9] WU X, TIAN F, WANG W X,etal..Fabrication of highly fluorescent graphene quantum dots using L-glutamic acid forinvitro/invivoimaging and sensing [J].Mater.Chem.C, 2013, 1:4676-4684.
[10] HU Y P, YANG J, TIAN J W,etal..How do nitrogen-doped carbon dots generate from molecular precursors? An investigation of the formation mechanism and a solution-based large-scale synthesis [J].Mater.Chem.B, 2015, 3:5608-5614.
[11] LIU S, TIAN J Q , WANG L,etal..Hydrothermal treatment of grass:a low-cost, green route to nitrogen-doped, carbon-rich, photoluminescent polymer nanodots as an effective fluorescent sensing platform for label-free detection of Cu(Ⅱ) ions [J].Adv.Mater., 2012, 24:2037-2041.
[12] SHVAREV A, BAKKER E.Reversible electrochemical detection of nonelectroactive polyions [J].J.Am.Chem.Soc., 2003, 125:11192-11193.
[13] ZHAO J N, YI Y H, MI N X,etal..Gold nanoparticle coupled with fluorophore for ultrasensitive detection of protamine and heparin [J].Talanta, 2013, 116:951-957.
[14] SNYCERSKI A, DUDKIEWICZ-WILCZYNSKA J, TAUTT J.Determination of protamine sulphate in drug formulations using high performance liquid chromatography [J].J.Pharmaceut.Biomed.Anal., 1998, 18(4-5):907-910.
[15] AWOTEW-OTOO D, AGARABI C, FAUSTINO P J,etal..Application of quality by design elements for the development and optimization of an analytical method for protamine sulfate [J].J.Pharmaceut.Biomed., 2012, 62:61-67.

