醫學
腹主動脈瘤發病機制方面的研究取得重要進展
北京大學醫學部基礎醫學院孔煒教授研究團隊開展同型半胱氨酸直接結合并激活血管緊張素2受體1從而加重血管損傷的研究,研究論文發表于《自然—通訊》。該研究從臨床問題出發,揭示高同型半胱氨酸作為新的危險因素,促發腹主動脈瘤新機制,即同型半胱氨酸可作為血管緊張素I型受體(AngiotensinⅡType 1,AT1)新的配體,以不依賴于血管緊張素Ⅱ(AngII)作用,激活AT1受體,從而加重血管損害。腹主動脈瘤是與高血壓相關的高度致死心血管疾病,目前尚無有效藥物治療方法。同型半胱氨酸(Homocysteine, Hcy)為蛋氨酸代謝中間產物,高同型半胱氨酸血癥是多種心血管疾病的危險因素。
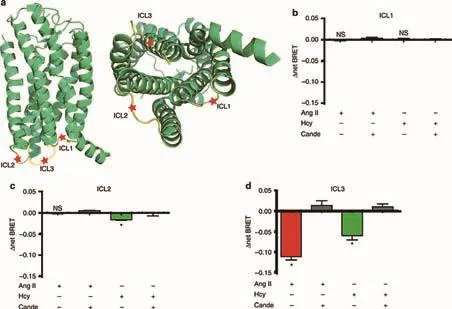
Hcy和Ang II誘導AT1受體的構象變化
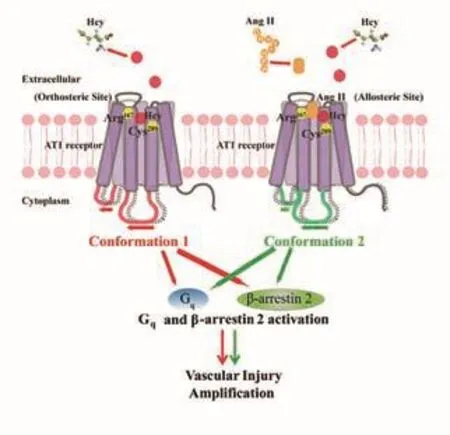
同型半胱氨酸直接結合AT1受體激活下游Gq及β-arrestin 2信號
耐藥鮑曼不動桿菌感染誘導宿主細胞死亡
中科院昆明動物研究所齊曉朋課題組研究I型干擾素信號途徑在鮑曼不動桿菌感染誘導宿主細胞死亡調控中的作用機理,研究論文發表于Cell Death & Differentiation。鮑曼不動桿菌是一種廣泛存在于環境中的革蘭氏陰性細菌。耐藥性鮑曼不動桿菌已成為醫院內主要流行病原菌,對免疫力低下人群感染性和致病性極強。鮑曼不動桿菌能引起肺炎、尿路感染、血行性感染,也是引起燒傷感染的主要病原。鮑曼不動桿菌在全球范圍內對包括碳青霉烯類及粘菌素類在內的多種抗生素具有廣譜耐藥性,對其針對性治療日益困難。鮑曼不動桿菌感染通過TRIF依賴的信號通路誘發I型干擾素的產生。
中國人群甲狀腺乳頭狀癌的遺傳圖譜
中科院北京生命科學研究院孫中生研究團隊與北京大學腫瘤醫院頭頸外科劉寶國課題組合作,收集了355對甲狀腺乳頭狀癌的癌組織和癌旁組織樣本,繪制了中國人群甲狀腺乳頭狀癌的遺傳圖譜,研究論文發表于The Journal of Pathology。甲狀腺乳頭狀癌是內分泌系統中發病率最高的惡性腫瘤,發病率在近30年的時間里上升了3倍。目前,國際上大規模的全基因組重測序和轉錄組測序已經鑒定出多個甲狀腺乳頭狀癌驅動變異,但研究對象主要是西方人群。由于癌癥的驅動遺傳變異具有地域和人群的特異性,故而研究中國人群甲狀腺乳頭狀癌的遺傳學極為重要。
新型革蘭氏陽性菌藥物外排泵
中科大合肥微尺度物質科學國家研究中心和生命科學學院教授周叢照、陳宇星課題組,解析了肺炎鏈球菌中一種新型ABC轉運蛋白(Spr0693和Spr0694-0695)的原子分辨率結構,揭示了革蘭氏陽性菌抗藥的一種新機制,相關論文發表于《自然—通訊》。藥物外排泵是細菌抵御外界有毒物質的主要方式,而ABC轉運蛋白是藥物外排泵中的一種重要類型,它依靠ATP水解的能量將這些有毒物質排出。在大腸桿菌等革蘭氏陰性菌中已發現一種ABC類型的藥物外排泵MacAB-TolC,可將抗生素從胞內依次跨過內膜、周質腔、外膜轉運到細菌外。該研究工作發現了一類全新的革蘭氏陽性菌ABC轉運蛋白的組織形式。
NLRP3炎癥小體調控進展
南京大學生命科學學院、醫藥生物技術國家重點實驗室徐強教授、孫洋教授研究團隊開展磷酸酶SHP2通過與ANT1互作維持線粒體穩態從而負調控NLRP3炎癥小體活化研究,相關研究論文發表于《自然—通訊》。NLRP3炎癥小體作為天然免疫的重要組成部分,在機體免疫反應和疾病發生發展過程中發揮著重要作用,其過度活化可導致多種人類重大疾病如阿爾茨海默病、炎癥性腸病、糖尿病以及惡性腫瘤等的發生。蛋白酪氨酸磷酸酶SHP2可在NLRP3激活劑ATP、尿酸鹽結晶以及尼日利亞菌素等刺激下,穩定線粒體膜電位、抑制線粒體DNA以及活性氧的釋放、下調由此引發的NLRP3炎癥小體的過度活化。
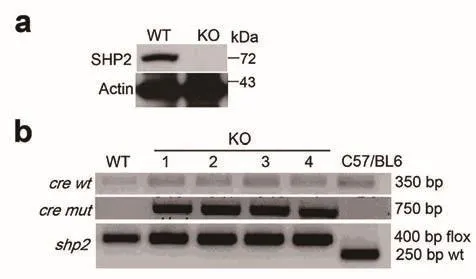
SHP2基因敲除小鼠巨噬細胞識別研究
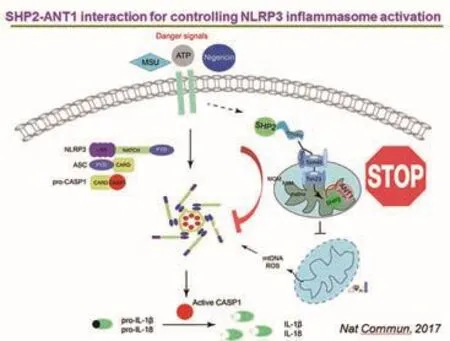
SHP2維持線粒體穩態、精細調控NLRP3炎癥小體活化的機制示意圖。
應激性心臟損傷方面的研究進展
北京大學第三醫院心內科張幼怡研究員團隊開展白介素18剪切活化啟動b-腎上腺素受體過度激活所致心臟炎癥及纖維化研究,相關論文發表于《歐洲心臟雜志》。圍繞交感神經系統過度激活所致心臟損傷機制開展研究,從臨床問題出發,分析在急性b-腎上腺素受體激活后,心臟炎癥因子表達和心臟組織結構和功能的動態變化過程。發現急性b-腎上腺素受體激活后,心肌細胞特異的炎性小體快速活化,引起IL-18剪切激活,后者是促發心臟細胞因子瀑布反應和巨噬細胞浸潤,并導致心肌損傷和功能減低的關鍵因子。交感過度激活的急性胸痛患者也伴隨著外周血IL-18水平的升高。
髓系抑制性細胞(MDSC)在新生個體免疫穩態建立過程中的作用
中山大學中山醫學院人類病毒學研究所周潔教授和Dmitry Gabrilovich教授團隊合作,揭示了髓系抑制性細胞(myeloidderived suppressor cells, MDSC)在新生個體免疫穩態建立過程中的重要作用,相關成果發表于《自然—醫學》。MDSCs是一類非成熟的髓系細胞,具有廣譜的免疫抑制功能。目前普遍認為,MDSC的擴增主要存在于腫瘤,感染等病理狀態,通過抑制免疫應答,誘導機體對腫瘤或病原體的免疫耐受,促進腫瘤或感染性疾病的進展;而在正常健康機體中,MDSC被認為不存在或水平極低。該項研究發現了MDSC在新生兒期的重要生理性免疫調節作用。
成纖維細胞亞群調控腫瘤干細胞新機制
中山大學孫逸仙紀念醫院宋爾衛、蘇士成團隊運用細胞膜蛋白CD10和GPR77為化療耐受相關的成纖維細胞亞群貼上“身份標簽”,發現了一種新型表達CD10+與GPR77+細胞表面標記分子的癌癥相關成纖維細胞,此種成纖維細胞可顯著促進乳腺癌與肺癌病人對化療的耐藥性,并為腫瘤干細胞的干性維持提供了環境,研究論文發表于《細胞》。既往研究提示腫瘤相關成纖維細胞具有高度的異質性。該研究采用術前化療作為研究腫瘤微環境異質性的臨床模型,通過臨床標本高通量篩選發現的膜蛋白鑒定成纖維細胞亞群,闡述了補體分子對炎癥轉錄因子轉錄后修飾的調控作用,為靶向腫瘤干細胞微環境的治療提供了新思路。

