硅酸鈉溶液與酸反應的實驗探究
徐小健

摘要: 通過對硅酸鈉溶液與鹽酸反應的最佳實驗操作方法以及硅酸鈉溶液和二氧化碳反應生成硅酸凝膠實驗的探究,得出制備硅酸凝膠的幾種可行的實驗方法,以及硅酸鈉溶液與二氧化碳反應所生成的鈉鹽種類。
關鍵詞: 硅酸鈉溶液; 二氧化碳; 硅酸凝膠; 實驗探究
文章編號: 1005-6629(2018)4-0072-03 中圖分類號: G633.8 文獻標識碼: B
人教版教材《化學1》第四章第一節中設計了硅酸鈉溶液與鹽酸反應制取硅酸膠體的實驗,其內容為:“在試管中加入3~5mL Na2SiO3溶液(飽和Na2SiO3溶液按1∶2或1∶3的體積比用水稀釋),滴入1~2滴酚酞溶液,再用膠頭滴管逐滴加入稀鹽酸,邊加邊振蕩,至溶液紅色變淺并接近消失時停止,靜置。[1]”教材中的實驗并未提到鹽酸的濃度,如果溫度較低時按照教材中的實驗方案進行實驗需等待較長時間,甚至還需要水浴加熱。此外,由于硅酸的酸性比碳酸還弱,那么Na2SiO3溶液能不能與CO2反應?能不能也產生凝膠狀的硅酸?反應生成什么鈉鹽?為弄清楚這些問題,特對Na2SiO3溶液與酸反應的情況做如下探究。
1 硅酸鈉溶液與鹽酸反應生成硅酸凝膠的實驗研究
硅酸在不同的濃度、溫度和pH下,以不同的程度縮水聚合成各式硅酸,其結構有開鏈的,有環狀的,也有立體網狀的。其通式是xSiO2·yH2O。通常將硅酸寫成H2SiO3只是籠統地代表所有硅酸而已。形成硅酸凝膠不僅與溶膠的聚合度有關,也與其交聯度有關,一般來說在各種硅酸中H2O與SiO2的比值越小,其交聯度和聚合度就越大,即越容易凝聚[2]。選用什么濃度的溶液進行實驗比較合適呢?考慮到無論是演示實驗還是學生分組實驗,實驗現象應盡可能快速、明顯,所以選用飽和Na2SiO3溶液和6~7mol/L鹽酸進行實驗,達到了預期的實驗效果。
1.1 向飽和Na2SiO3溶液中加入鹽酸
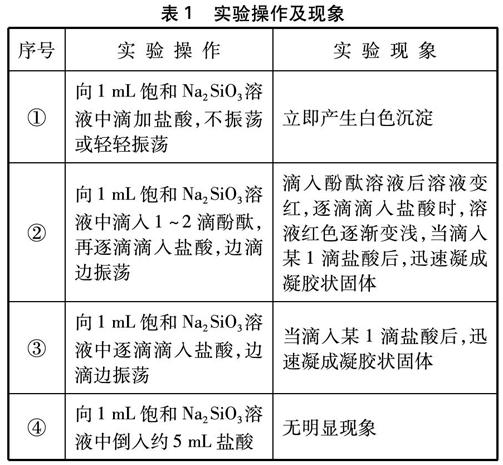
實驗操作及現象如表1所示。
表1 實驗操作及現象
1.2 向鹽酸中加入飽和Na2SiO3溶液
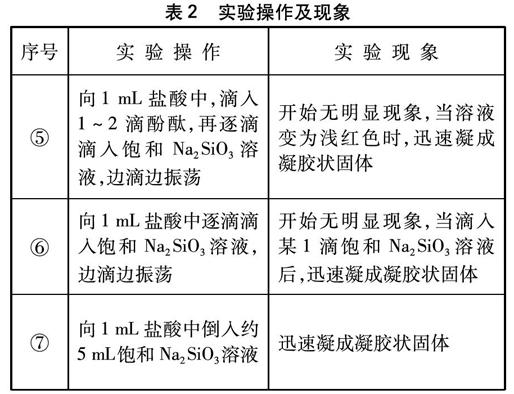
實驗操作及現象如表2所示。
表2 實驗操作及現象
所以,如果只想讓學生了解Na2SiO3溶液與鹽酸反應產生沉淀,只需采用實驗①的做法;如果想觀察到凝膠狀固體,可以采用實驗③、⑥或⑦的做法;如果想讓學生了解Na2SiO3溶液呈堿性,可以向其中滴入1~2酚酞,采用實驗②或⑤的做法。
2 硅酸鈉溶液與碳酸反應生成硅酸凝膠的實驗研究
由于碳酸的酸性強于硅酸,所以從理論上說,Na2SiO3溶液可以與CO2反應生成硅酸。向久置的硅酸鈉溶液中滴加鹽酸,有氣泡生成[3],亦可說明Na2SiO3溶液能與CO2反應。
2.1 用組合裝置進行實驗
2.1.1 實驗裝置
實驗裝置如圖1所示。
圖1 Na2SiO3溶液與CO2反應的組合裝置
2.1.2 實驗處理
如果用大理石與鹽酸反應制取CO2氣體,由于CO2氣體中混有的HCl氣體能與Na2SiO3溶液反應,所以須將其通過飽和NaHCO3溶液除去,再通入Na2SiO3溶液中,如圖1所示。這樣實驗裝置較為復雜,建議采用NaHCO3固體與稀硫酸反應或加熱NaHCO3固體制取CO2,從而簡化實驗裝置。
2.1.3 操作與現象
向試管內加入約2mL飽和Na2SiO3溶液,通入CO2氣體。幾分鐘后溶液上方試管內壁有白色固體產生,停止通氣,靜置片刻,可觀察到試管內液體凝成凝膠狀固體。值得注意的是,如果長時間持續通入CO2氣體,反而難以形成凝膠狀固體。
2.2 用軟飲料瓶進行實驗
由于飽和Na2SiO3溶液中通入CO2氣體產生硅酸凝膠耗時較長,不適合課堂演示,所以對該實驗進行改進。取一個350mL軟飲料瓶,洗凈后晾干,用向上排空氣法收集滿CO2氣體備用。擰開瓶蓋,向瓶內加入1~2mL飽和Na2SiO3溶液,迅速擰緊瓶蓋,充分振蕩,可以觀察到飲料瓶逐漸變癟,并能感知到瓶壁微熱,說明該反應放熱。振蕩1分鐘左右,將瓶子倒置在桌上約1分鐘,擰開瓶蓋,可以觀察到瓶蓋內產生白色透明、軟而有彈性的凝膠狀固體。墊一薄層保鮮膜,即可用手進行觸摸(也是一次感悟化學、與化學親密接觸的機會)。顯然,用軟飲料瓶進行實驗,速度更快、效果更好、趣味性更強。
3 硅酸鈉溶液與碳酸反應生成鈉鹽的實驗研究
3.1 理論分析
查得H2CO3的電離常數Ka1=4.3×10-7、 Ka2=5.61×10-11, H2SiO3的電離常數Ka1=2.2×10-10、 Ka2=2×10-12[4]。由于電離H+的能力H2CO3>H2SiO3>HCO -3,所以向Na2SiO3溶液中通入CO2氣體時,應該生成H2SiO3和HCO -3,而不生成CO2-3。
然而,目前仍有部分教師根據經驗認為,向Na2SiO3溶液中通入CO2氣體除了生成硅酸外,生成的鈉鹽與CO2的用量有關,通入少量CO2氣體時,生成Na2CO3,通入足量CO2氣體時,生成NaHCO3。實際情況如何呢?
3.2 實驗探究
3.2.1 思路分析
由于Na2SiO3溶液中通入少量CO2氣體時,溶液中還有大量過量的Na2SiO3,難以直接檢驗出生成的是NaHCO3還是Na2CO3。那么換個角度,可以探究H2SiO3能不能與Na2CO3反應。目前普遍認為酸與鹽發生復分解反應時一般要求酸可溶,鹽可以不溶。那么H2SiO3能不能與Na2CO3反應呢?當然也可以探究Na2SiO3能不能與NaHCO3反應。
3.2.2 實驗步驟與現象
(1) 用飽和Na2SiO3溶液與鹽酸或CO2制取硅酸凝膠。
(2) 將凝膠用玻璃棒攪碎后,加入蒸餾水,振蕩,棄去上層液體,重復2~3次。
(3) 向洗凈后的硅酸中加入蒸餾水,振蕩,分為兩等份,一份加入足量的飽和Na2CO3溶液,另一份加入等量的水做對比實驗。將兩份混合物充分振蕩,為了加快反應速率,可以在酒精燈火焰上適當微熱,觀察到加有飽和Na2CO3溶液的硅酸逐漸溶解。
(4) 取3mL飽和的Na2SiO3溶液于試管中,向試管中加入2mL飽和的NaHCO3溶液,振蕩試管[5],放置一段時間或水浴加熱一段時間,均未見明顯現象。
3.2.3 實驗結論與延伸
(1) 實驗結論
實驗現象表明,H2SiO3能與Na2CO3溶液反應,Na2SiO3與NaHCO3溶液無明顯現象,可說明Na2SiO3溶液中通入少量CO2氣體時,應該生成H2SiO3與NaHCO3。
(2) 拓展延伸
① 既然H2SiO3能與Na2CO3溶液反應,而相同條件下,Na2SiO3溶液的堿性強于Na2CO3溶液,那么H2SiO3能與Na2SiO3溶液反應嗎?鑒于此,將3.2.2實驗中的“飽和Na2CO3溶液”換成“飽和Na2SiO3溶液”進行探究,實驗現象與之相似,說明H2SiO3能與Na2SiO3溶液反應生成酸式鹽。
② 受Na2CO3+CO2+H2O2NaHCO3知識的影響,有人理所當然地認為向酸性弱于碳酸的酸所對應的鹽溶液中通入CO2氣體,都應該先生成碳酸鹽,后生成碳酸氫鹽。其實不然,能不能生成碳酸鹽,取決于酸的酸性是否比HCO-3還弱。常見酸性弱于碳酸的酸除了硅酸外,還有HClO、 OH和Al(OH)3等,HClO、 OH
和Al(OH)3的酸電離平衡常數分別為2.98×10-8、 1.1×10-10、 6.3×10-13,可以看出,其中酸性弱于HCO -3的只有Al(OH)3,所以向NaAlO2溶液中通入CO2氣體時,生成的鈉鹽才與CO2量有關,而向Na2SiO3、 NaClO或ONa
溶液中通入CO2氣體時,生成的鈉鹽與CO2量無關,應該生成NaHCO3。
在當前提倡以核心素養為導向的化學教學中,教師在備課時需進一步加強批判性思維和發散性思維,敏銳地捕捉教學中的疑點,精心設計教學方案。教學時應引導學生參與其中,發揮學生的主體作用,讓設計的教學方案更加完善,然后再通過實驗進行研究,進而得出結論。相信只要持之以恒,教師和學生的思維品質和研究水平一定會得到較大程度的提升。
參考文獻:
[1]宋心琦主編.普通高中課程標準實驗教科書·化學1[M].北京:人民教育出版社, 2007: 76.
[2]陽智純.“硅酸鈉與鹽酸反應”最佳實驗條件的探究[J].化學教學, 2008,(7): 11~13.
[3]張道年.久置硅酸鈉溶液的“另類”現象[J].化學教學, 2011,(2): 43.
[4]北京大學等.無機化學(下)(第4版)[M].北京: 高等教育出版社, 2003: 567, 578.
[5]朱正德.從制備硅酸凝膠的實驗探究談“強酸制弱酸”規律[J].化學教學, 2013,(5): 49~50.

