豬血蛋白酶解物對小鼠急性酒精性肝損傷的保護作用
胡 濱,李康林,吳 橋,柯 琴,鄧玉嬋,陳一資
(四川農(nóng)業(yè)大學食品學院,四川 雅安 625014)
隨著現(xiàn)代社會交往需求增加,酒精消費量快速增加,酒精性肝損傷的發(fā)病率也呈逐年上升趨勢,在我國已成為繼病毒性肝炎后的第二大肝病,嚴重危害著大眾身體健康。由于酒精性肝損傷是進行性疾病,發(fā)展到晚期為肝硬化難以治愈。因此,研究預防和早期遏制酒精性肝損傷的有效方法顯得尤為重要[1-2]。目前,現(xiàn)代醫(yī)學治療酒精性肝損傷除了戒酒、對癥治療外,臨床多采用激素類藥物進行治療,但療效有限,而且藥物也存在潛在的毒副作用。因此,從食物中尋找具有保肝作用的活性成分,已成為國內(nèi)外學者的研究熱點之一[3-5]。
豬血是一種價格低廉,又可大量獲取的食品工業(yè)副產(chǎn)品,含有蛋白質(zhì)、礦物質(zhì)、酶和一些生理活性物質(zhì);其蛋白質(zhì)含量達到18%左右,蛋白質(zhì)中含有人體所需的8 種必需氨基酸,是極具開發(fā)利用價值的優(yōu)質(zhì)蛋白資源。如今優(yōu)質(zhì)蛋白資源短缺,而我國作為世界養(yǎng)豬大國,有豐富的血資源,并且生豬定點屠宰的貫徹實施和屠宰加工企業(yè)向大型化的發(fā)展,使血液的大規(guī)模收集成為可能。因此,開發(fā)利用豬血蛋白資源受到了廣泛重視[6-7]。近年來,由于生物酶解技術的發(fā)展,利用蛋白酶水解豬血以提高其利用率已逐漸成為熱點。目前對豬血蛋白酶解產(chǎn)物的功能研究多集中在抗氧化[8]、降血脂[9]、輔助調(diào)節(jié)血壓[10]等方面,而有關其對酒精性肝損傷的保護作用研究鮮見報道。為此,本實驗以雄性昆明種小鼠為實驗動物,通過建立急性酒精性肝損傷動物模型,研究豬血蛋白酶解物對酒精性肝損傷的保護作用,為更廣泛利用豬血蛋白資源和開發(fā)抗酒精性肝損傷的功能食品提供參考。
1 材料與方法
1.1 實驗動物、材料與試劑
實驗專用雄性昆明種小鼠60 只,體質(zhì)量(20±2)g,小鼠專用生長維持飼料,均由四川大學華西實驗動物中心提供,動物合格證號為SCXK(川)-2013-026。
豬血蛋白酶解物(porcine blood hydrolysate,PBH)的制備:將新鮮豬血于40 ℃水浴條件下,加胰酶進行攪拌酶解。酶解5 h后,將酶解液置沸水浴滅酶,冷卻后將酶解液離心,取上清液于試管中,經(jīng)過濾、濃縮、干燥后得到粉末狀產(chǎn)品。
超氧化物歧化酶(superoxide dismutase,SOD)測試盒、谷胱甘肽-過氧化物酶(glutathione peroxidase,GSH-Px)測試盒、甘油三酯(triglyceride,TG)測試盒、還原型谷胱甘肽(glutathione,GSH)、丙二醛(malonic dialdehyde,MDA)、腫瘤壞死因子(tumor necrosis factor,TNF)-α、白細胞介素-6(nterleukin-6,IL-6)測試盒 南京建成生物工程研究所;GSH原料藥(純度98%) 北京澳康生物科技有限公司。
1.2 儀器與設備
TE412-L電子天平 德國Sartorius公司;MicrOTOF-QⅡ型高分辨質(zhì)譜儀 德國Bruker公司;S-433D型全自動氨基酸分析儀 德國賽卡姆公司;XHF-D型高速分散器 寧波新芝生物科技有限公司;UV-3200型紫外-可見分光光度計 上海美譜達儀器有限公司;St16r型冷凍離心機和Multiskan MK3型全自動酶標儀 賽默飛世爾科技(中國)有限公司;7020型全自動生化分析儀 日本Hitachi株式會社;RM2135型半自動切片機 德國Leica公司;NIS-Elements BR顯微攝像儀 日本Nikon株式會社。
1.3 方法
1.3.1 PBH分子質(zhì)量的測定
將一定質(zhì)量的PBH溶于甲醇后,采用電噴霧質(zhì)譜法方式自動進樣,以3 μL/min的流速檢測分子質(zhì)量。
1.3.2 小分子肽得率的測定
蛋白質(zhì)含量測定:按照GB 5009.5—2016《食品安全國家標準 食品中蛋白質(zhì)的測定》,采用凱氏定氮法測定。游離氨基酸含量和氨基酸組成的測定:按照GB 5009.124—2016《食品安全國家標準 食品中氨基酸的測定》,采用全自動氨基酸分析儀測定,色氨酸的測定采用堿水解法進行。三氯乙酸(trichloroacetic acid,TCA)可溶性蛋白含量測定:按照GB/T 22492—2008《大豆肽粉》和GB/T 22729—2008《海洋魚低聚肽粉》進行,取PBH 2 g,加入10 mL質(zhì)量分數(shù)15%的TCA溶液,混合均勻,靜置10 min,將樣品溶液4 000 r/min離心10 min,取全部上清液,采用凱氏定氮法測定上清液蛋白質(zhì)含量。小分子肽含量測定:按照GB/T 22492—2008和GB/T 22729—2008進行,PBH經(jīng)過TCA溶液溶解處理后,離心分離出沉淀物,收集離心上清液;按照GB 5009.5—2016方法測定離心清液中TCA可溶性蛋白含量,離心清液中TCA可溶性蛋白含量減去游離氨基酸含量可得到樣品中小分子肽的含量,即小分子肽含量/(g/100 g)=TCA可溶性蛋白質(zhì)含量/(g/100 g)-游離氨基酸含量/(g/100 g)。
1.3.3 動物分組和給藥方法
按照《保健食品檢驗與評價技術規(guī)范(2003年版)》中“對化學性肝損傷有輔助保護作用”檢驗方法要求,采用造酒精性肝損傷模型進行實驗。將60 只小鼠適應性喂養(yǎng)3 d后隨機分為6 組,每組10 只,分別為空白對照組、模型對照組、藥物對照組和PBH低、中、高劑量組。通常蛋白質(zhì)類補充劑的人體推薦劑量為10 g/d,按成人體質(zhì)量平均為60 kg設計灌胃劑量。以人體推薦劑量5、10、20 倍作為受試劑量,即3 個實驗組以0.83(Ⅰ組)、1.70(Ⅱ組)、3.33 g/kg mb(Ⅲ組)劑量每日灌胃PBH,藥物對照組用GSH以20 mg/kg mb灌胃,空白對照組、模型對照組給予等體積蒸餾水,實驗期30 d。實驗至第31天,模型對照組、藥物對照組及PBH各劑量組一次灌胃給予50%的無水乙醇12 mL/kg mb,空白對照組給予蒸餾水,禁食16 h后各組小鼠摘除眼球取血,再采用頸椎脫臼法處死,取出肝臟,測定各項指標。
1.3.4 血清和肝臟生化指標的檢測
血清谷丙轉(zhuǎn)氨酶(alanine aminotransferase,ALT)、谷草轉(zhuǎn)氨酶(aspartate transaminase,AST)活力采用全自動生化分析儀進行檢測。肝臟MDA、GSH-Px、GSH、TG、TNF-α、IL-6水平按試劑盒說明書進行測定。
1.3.5 肝組織病理組織學觀察
取部分肝組織,用體積分數(shù)10%甲醛溶液固定,常規(guī)石蠟包埋,切片,蘇木精-伊紅(hematoxylin-eosin,HE)染色,光學顯微鏡下觀察肝組織形態(tài)學變化。
1.4 數(shù)據(jù)統(tǒng)計
實驗數(shù)據(jù)采用SPSS 19.0軟件進行統(tǒng)計分析,采用Duncan’s法進行單因素多重比較分析,數(shù)據(jù)以表示。
2 結果與分析
2.1 PBH中氨基酸組成、游離氨基酸含量和分子質(zhì)量

表1 PBH中氨基酸組成和游離氨基酸含量Table 1 Compositions of amino acid and free amino acid in PBH g/100 g
由表1可知,PBH中必需氨基酸含量豐富,總量為34.6 g/100 g,而且還含有11.45 g/100 g的游離氨基酸。
由圖1可知,PBH是分子質(zhì)量集中在1 000 Da以下的多種小肽和氨基酸的混合物。由凱氏定氮法測得PBH中蛋白質(zhì)含量為91.25 g/100 g,TCA可溶性蛋白質(zhì)含量為89.85 g/100 g。由于高分子質(zhì)量蛋白質(zhì)在酸性條件容易被沉淀,低分子質(zhì)量蛋白質(zhì)水解物(包含小分子肽和游離氨基酸)可溶于TCA溶液。樣品經(jīng)過TCA溶液溶解處理后,離心分離出沉淀物,上清液中TCA可溶性蛋白含量減去游離氨基酸含量即可得到樣品中小分子肽的含量。因此,PBH中小肽含量占70%以上,各組分含量所占比例如圖2所示。

圖1 PBH分子質(zhì)量范圍Fig. 1 Molecular mass distribution of PBH

圖2 PBH中小分子肽、游離氨基酸、高分子質(zhì)量蛋白質(zhì)等含量比例Fig. 2 Proportions of small peptide, free amino acid and high-molecular-mass protein in PBH
2.2 PBH對小鼠體質(zhì)量的影響
整個實驗期間,各組小鼠精力充沛,活潑好動,食欲旺盛;皮膚富有彈性,被毛光滑明亮,個體增質(zhì)量迅速,體質(zhì)量測定結果見表2。實驗至第31天灌胃酒精后,模型對照組首先表現(xiàn)出興奮狀態(tài),然后出現(xiàn)反應遲緩、嗜睡、四肢癱軟,此狀態(tài)持續(xù)1 h左右。PBH各劑量組與模型對照組相比較,精神狀態(tài)明顯優(yōu)于模型對照組,中、高劑量組尤為明顯。

表2 各組小鼠平均體質(zhì)量的測定結果(n= 10)Table 2 Average body weight of mice (n= 10)g
由表2可知,在整個實驗期間,各組小鼠的體質(zhì)量差異不顯著(P>0.05),表明在本實驗條件下PBH對小鼠的生長發(fā)育和健康狀況無不良影響。
2.3 PBH對小鼠血清ALT、AST活力的影響

表3 PBH對小鼠血清 ALT和AST活力的影響(n=8)Table 3 Effect of PBH on ALT and AST activity in serum from mice (n= 8)
ALT和AST是主要存在于肝臟的轉(zhuǎn)氨酶,當肝細胞發(fā)生損傷如變性或壞死時,ALT和AST會逸出肝細胞使血中ALT、AST活力升高。因此,在臨床醫(yī)學上常用血中ALT、AST活力作為判斷肝臟是否受到損傷的重要指標。由表3可知,模型對照組血清AST和ALT活力與藥物對照組、Ⅰ組、Ⅱ組、Ⅲ組、空白對照組差異極顯著(P<0.01),表明模型組肝細胞受到損傷,肝功能出現(xiàn)異常。Ⅰ組、Ⅱ組、Ⅲ組AST和ALT活力與藥物對照組、空白對照組差異顯著(P<0.05,P<0.01),Ⅰ組與Ⅱ組、Ⅲ組差異顯著(P<0.05),Ⅱ組與Ⅲ組差異不顯著(P>0.05);這表明PHB各劑量組ALT和AST活力雖然高于藥物對照組,但顯著低于模型對照組,說明豬血經(jīng)過酶解后產(chǎn)生的PHB對維持肝細胞的完整性起到重要作用。而且隨著PHB灌胃劑量增加,小鼠血中ALT和AST活力逐漸下降,呈現(xiàn)一定的劑量-效應關系。劉睿等[11]在研究人參低聚肽對急性酒精性肝損傷的作用時證實,通過人參低聚肽干預可以顯著降低大鼠血清ALT、AST活力;何慧等[12]研究靈芝肽對乙醇誘導肝損傷小鼠的保護作用時,也得出了類似結論。因此,本實驗結果與同類研究結果類似。
2.4 PBH對小鼠肝臟SOD、GSH-Px活力,MDA、GSH
和TG水平的影響
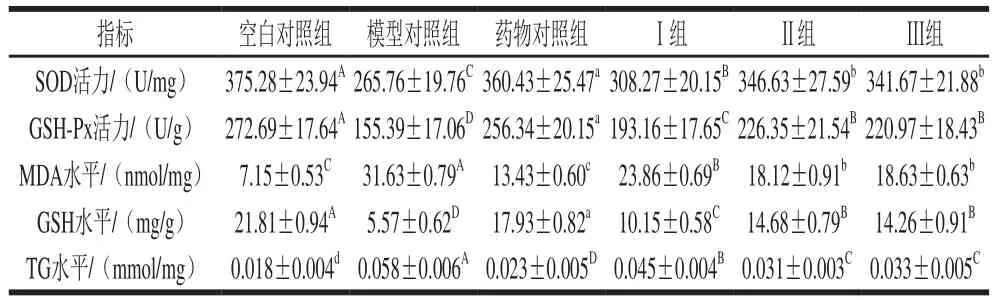
表4 PBH對小鼠肝臟SOD、GSH-Px活力,MDA、GSH和TG水平的影響(n=8)Table 4 Effect of PBH on SOD and GSH-Px activities, MDA, GSH and TG level in liver from mice (n= 8)
肝臟是酒精代謝的重要器官,飲酒過量可使肝臟受到損傷,尤其對肝臟的抗氧化能力和脂肪代謝影響較大。SOD和GSH-Px是體內(nèi)重要是抗氧化酶,GSH能夠清除體內(nèi)自由基,MDA是體內(nèi)脂質(zhì)過氧化產(chǎn)物,它們的變化均可反映組織細胞過氧化損傷的程度。由表4可知,模型對照組肝臟SOD、GSH-Px活力,MDA、GSH和TG水平與藥物對照組、Ⅰ組、Ⅱ組、Ⅲ組、空白對照組差異顯著(P<0.05,P<0.01),這進一步表明模型對照組小鼠肝臟受到損傷,導致SOD、GSH-Px活力,GSH水平下降,MDA和TG水平上升,提示本實驗造模成功;Ⅰ組、Ⅱ組、Ⅲ組SOD、GSH-Px活力,MDA、GSH和TG水平與藥物對照組、空白對照組差異顯著(P<0.05,P<0.01),Ⅰ組與Ⅱ組、Ⅲ組差異顯著(P<0.05,P<0.01),表明在本實驗條件下,灌胃不同劑量PHB能夠提高肝臟的抗氧化能力,改善肝臟的脂肪代謝。王雙玉等[13]在研究玉米肽對小鼠急性酒精性肝損傷的保護作用時發(fā)現(xiàn),灌胃不同劑量玉米肽均能顯著提高肝臟GSH-Px活力,降低MDA、TG水平。本實驗中Ⅱ組與Ⅲ組差異不顯著(P>0.05),表明蛋白質(zhì)類補充劑過量攝入不會增加機體的抗氧化能力。徐士勛等[14]在研究鱉甲寡肽抗小鼠急性酒精性肝損傷時也證實,鱉甲寡肽能夠使得肝組織SOD活力升高、MDA含量下降,但是高劑量組和低劑量組差異不顯著。因此,本實驗結果與同類研究類似。
2.5 PBH對小鼠肝臟TNF-α、IL-6水平的影響

表5 PBH對小鼠肝臟TNF-α和IL-6水平的影響(n=8)Table 5 Effect of PBH on TNF-αand IL-6 level in liver from mice (n= 8)
TNF-α和IL-6作為重要的炎癥反應調(diào)節(jié)因子,在酒精性肝病的發(fā)生過程中被認為是反映炎癥嚴重程度的重要指標。由表5可知,模型對照組肝臟TNF-α和IL-6水平極顯著(P<0.01)高于藥物對照組、Ⅰ組、Ⅱ組、Ⅲ組、空白對照組,表明模型組肝細胞發(fā)生嚴重的炎癥反應。Ⅰ組、Ⅱ組、Ⅲ組TNF-α和IL-6水平與藥物對照組、空白對照組差異顯著(P<0.05,P<0.01),Ⅰ組與Ⅱ組、Ⅲ組差異顯著(P<0.05,P<0.01),Ⅱ組與Ⅲ組差異不顯著(P>0.05);這表明PHB對改善肝臟的炎癥反應有明顯效果。孫夢雯等[15]在研究腦腸肽對酒精性肝損傷的保護作用時證實,腦腸肽通過降低肝臟中TNF-α和IL-6水平,發(fā)揮抗炎抗氧化作用對酒精性肝損傷起保護作用。劉晨晨等[16]也認為,鱈魚皮膠原蛋白肽通過降低肝臟中TNF-α水平對小鼠急性肝損傷起保護作用。因此,本實驗結果與同類研究類似。
2.6 PBH對小鼠肝臟的組織病理學影響


圖3 小鼠肝臟切片HE染色Fig. 3 HE staining of liver sections from mice
由圖3A可知,空白對照組肝小葉清晰,肝細胞索排列整齊,在中央靜脈周圍呈放射狀分布;中央靜脈無擴張,胞漿內(nèi)無脂滴,無異常改變。由圖3B可知,模型對照組肝小葉界限不清,肝細胞結構紊亂,胞漿內(nèi)有大量脂滴出現(xiàn),嚴重者脂滴互相融合,將細胞核擠向細胞一側(cè),出現(xiàn)明顯的脂肪變性。
由圖3C可知,藥物對照組肝細胞結構和肝索排列基本接近正常,肝細胞內(nèi)脂滴基本消失,偶見散在脂滴。由圖3D可知,實驗Ⅰ組肝細胞結構基本完整,胞漿內(nèi)有部分脂滴出現(xiàn),但脂滴排列稀疏,脂肪變性程度明顯輕于模型對照組。
由圖3E可知,實驗Ⅱ組肝細胞結構較完整,胞漿內(nèi)有散在脂滴出現(xiàn),但脂肪變性程度明顯輕于實驗Ⅰ組。由圖3F可知,實驗Ⅲ組肝細胞結構較完整,胞漿內(nèi)有少量脂滴出現(xiàn),脂肪變性程度輕于實驗Ⅰ組。因此,PBH對小鼠急性酒精性肝損傷有顯著的改善作用。蔡琦等[17]在研究蛹蟲草多肽對大鼠急性酒精性肝損傷的作用時發(fā)現(xiàn),灌胃蟲草多肽可以明顯減輕肝細胞脂肪變性及壞死。李林格等[18]通過研究大鯢皮膠原蛋白肽對乙醇肝損傷時證實,小鼠灌胃大鯢皮膠原蛋白肽后肝細胞損傷得到改善。因此,本實驗結果與同類研究類似。
3 討 論
酒精性肝病已成為全球面臨的重要公共衛(wèi)生問題之一,多個國家都在致力于降低酒精的過量使用,以減少酒精性肝病的發(fā)病率。目前認為酒精性肝病的發(fā)病機制與酒精及其代謝產(chǎn)物對肝臟的損傷密切相關,包括氧化應激與脂質(zhì)過氧化反應、內(nèi)毒素作用、免疫學、營養(yǎng)和遺傳等因素,而氧化應激與脂質(zhì)過氧化反應在酒精性肝損傷中的作用日益受到重視[19-20]。大量研究表明,急性酒精中毒會導致肝細胞中的酶和細胞器受到損傷,使脂肪酸在線粒體內(nèi)的β-氧化產(chǎn)生障礙,產(chǎn)生脂質(zhì)過氧化反應。而脂質(zhì)過氧化會不僅會使肝細胞膜產(chǎn)生損傷,使血中AST、ALT活力升高,還會使甘油三酯在肝細胞中的代謝發(fā)生障礙,導致甘油三酯在肝臟聚集。肝臟在發(fā)生脂質(zhì)過氧化反應時,TNF-α可通過直接細胞毒作用,引起肝細胞變性或壞死,也可與IL-6相互激發(fā),引起級聯(lián)放大反應而加重肝損傷[21-22]。本實驗結果顯示模型組小鼠肝組織SOD、GSH-Px活力和GSH水平顯著下降,MDA、TNF-α、IL-6水平顯著升高,表明小鼠在灌胃酒精后機體氧化應激水平發(fā)生改變,引起了肝細胞損傷。而灌胃PBH劑量組顯著升高肝組織SOD、GSH-Px活力和GSH水平,降低MDA、TNF-α、IL-6水平,表明PBH能夠?qū)构辔妇凭笠鸬母渭毎|(zhì)過氧化反應,保護肝細胞免受損傷。此外,模型組小鼠肝臟TG水平顯著上升,病理組織切片也顯示肝細胞胞漿有大量脂滴出現(xiàn),發(fā)生明顯脂肪變性;且肝細胞形態(tài)結構發(fā)生破壞,使得血中ALT、AST活力顯著上升。而PBH劑量組肝細胞結構相對完整,脂肪變性程度減輕,而且肝臟TG水平、血中ALT、AST活力明顯下降,表明PBH能夠調(diào)節(jié)肝脂代謝,降低肝臟的脂質(zhì)過氧化損傷,通過修復和維持肝細胞膜的完整性以降低血中ALT、AST活力。Wu Yuhong等[23]在研究玉米肽對酒精性肝損傷的保護作用時證實,玉米肽通過提高肝內(nèi)SOD、GSH-Px活力和GSH水平,降低TNF-α濃度,減輕肝臟過氧化損傷,以促進肝細胞修復而降低血中ALT、AST活力。Lin Bing等[24]在研究海洋膠原蛋白肽對酒精性肝損傷的作用時也認為,海洋膠原蛋白肽能夠通過抗炎抗氧化途徑緩解酒精性肝損傷。
豬血蛋白具有一定空間結構,當酶對其水解時,肽鍵發(fā)生斷裂,蛋白質(zhì)結構發(fā)生變化。一些被包埋的氨基酸殘基和氨基酸的側(cè)鏈基團暴露出來,其中具有提供氫原子和金屬鰲合能力的基團能直接參與自由基的淬滅,抑制脂質(zhì)過氧化發(fā)生,保護肝細胞[25]。因此PBH的氨基酸組成可能決定其對肝細胞損傷有保護作用。Wei等[26]認為所有氨基酸都含有—NH2基團,可以在不同體系中表現(xiàn)出抗氧化活性,對肝細胞損傷有輔助保護作用;Ramos等[25]研究發(fā)現(xiàn)組氨酸、苯丙氨酸、色氨酸等抗氧化活性較強,這些氨基酸能夠作為潛在的護肝補充劑使用。但還有研究認為,蛋白質(zhì)酶解產(chǎn)物的功能是由其含有的小肽和氨基酸共同體現(xiàn)。Zhang Feng等[27]在研究玉米肽的功能時發(fā)現(xiàn),玉米蛋白水解物中的多種小肽能夠直接發(fā)揮保肝作用,而且在水解物中其他氨基酸的協(xié)同作用下,其保肝活性得到增強。通常對酒精性肝損傷具有保護作用的肽都具有抗氧化活性,而且其中富含亮氨酸、賴氨酸、組氨酸、苯丙氨酸等氨基酸[28-29]。PBH的氨基酸組成中含有一定量的組氨酸、賴氨酸、蛋氨酸、苯丙氨酸等氨基酸,這些氨基酸不僅在游離狀態(tài)就具有抗氧化保肝作用,而且由其所組成的肽還能發(fā)揮保肝作用,這樣使得PBH的保肝效果還可能進一步提高。此外,PBH作為蛋白質(zhì)類補充劑,在參與肝組織的更新與修復方面也起了重要作用。
因此,可以認為PBH對急性酒精性肝損傷的保護作用是由組成它的許多小肽和游離氨基酸共同形成。其機制可能是PBH能夠有效拮抗急性酒精性肝損傷所導致的抗氧化酶活性下降、GSH耗竭以及炎癥因子的產(chǎn)生,抑制自由基介導的脂質(zhì)過氧化反應,增強機體自由基清除防御體系及脂肪酸在細胞內(nèi)的代謝能力,促進肝細胞的修復和再生。
4 結 論
本實驗以小鼠為實驗動物,研究PBH對急性酒精性肝損傷的保護作用,實驗按照我國衛(wèi)生部頒布的《保健食品檢驗與評價技術規(guī)范(2003版)》中“對化學性肝損傷有輔助保護作用檢驗方法”評定標準,結果顯示PBH能夠減輕小鼠急性酒精性肝損傷程度,降低血清中ALT、AST活力,提高小鼠肝臟SOD、GSH-Px水平及GSH水平,增強肝臟脂質(zhì)代謝能力,降低受損肝組織中MDA、TNF-α、IL-6水平,減輕肝組織病變程度,說明PBH作為對酒精性肝損傷有保護作用的保健食品的開發(fā)具有很大前景。
[1] 邢佳, 陸文娟, 趙云霞, 等. 石榴葉多酚對小鼠急性酒精性肝損傷的保護作用[J]. 食品科學, 2015, 36(21): 253-257. DOI:10.7506/spkx1002-6630-201521047.
[2] 王麗娟, 仇菊, 李再貴. 蘆薈白酒毒性評價及對酒精性肝損傷小鼠的保護作用研究[J]. 現(xiàn)代食品科技, 2016, 32(6): 281-287.
[3] SONTHALIA N, PAWAR S V, MOHITE A R, et al. metronidazoleinduced encephalopathy in alcoholic liver disease: a diagnostic and therapeutic challenge[J]. The Journal of Emergency Medicine, 2016,51(4): 79-83. DOI:10.1016/j.jemermed.2016.05.038.
[4] ADDOLORATO G, MIRIJELLO A, BARRIO P, et al. Treatment of alcohol use disorders in patients with alcoholic liver disease[J].Journal of Hepatology, 2016, 65(3): 618-630. DOI:10.1016/j.jhep.2016.04.029.
[5] GON?ALVES J L, LACERDA-QUEIROZ N, SABINO J F L, et al.Evaluating the effects of refined carbohydrate and fat diets with acute ethanol consumption using a mouse model of alcoholic liver injury[J]. The Journal of Nutritional Biochemistry, 2017, 39: 93-100.DOI:10.1016/j.jnutbio.2016.08.011.
[6] 周毅, 楊萍, 肖前程. 降解豬血蛋白的優(yōu)良菌株篩選鑒定及產(chǎn)酶條件研究[J]. 食品與發(fā)酵工業(yè), 2015, 41(3): 58-63. DOI:10.13995/j.cnki.11-1802/ts.201503010.
[7] 張敏, 閆曉明, 王敏, 等. 高鐵含量豬血紅蛋白的提取純化及特性研究[J]. 食品工業(yè)科技, 2016, 37(8): 268-271. DOI:10.13386/j.issn1002-0306.2016.08.047.
[8] 孫騫, 胡鑫, 羅永康, 等. 豬血紅蛋白抗氧化肽的酶法制備及其體外抗氧化活力觀察[J]. 中國農(nóng)業(yè)大學學報, 2008, 13(4): 77-81.DOI:10.3321/j.issn:1007-4333.2008.04.014.
[9] 方俊, 田云, 盧向陽, 等. 豬血多肽輔助降血脂功能研究[J]. 中國食品學報, 2010, 10(4): 147-151. DOI:10.3969/j.issn.1009-7848.2010.04.023.
[10] 鄭炯, 鄧惠玲, 闞建全. 響應面法優(yōu)化豬血紅蛋白制備ACE抑制肽的酶解工藝條件[J]. 食品科學, 2012, 33(23): 209-214.
[11] 劉睿, 任金威, 陳啟賀, 等. 人參低聚肽對急性酒精性肝損傷大鼠的保護作用[J]. 現(xiàn)代預防醫(yī)學, 2016, 43(15): 2820-2824.
[12] 何慧, 石燕玲, 徐淑芬, 等. 靈芝肽對乙醇誘導肝損傷小鼠的保護作用[J]. 食品科學, 2010, 31(3): 213-216.
[13] 王雙玉, 李坤, 闞國仕, 等. 玉米抗氧化肽的制備及其對小鼠急性酒精性肝損傷的保護作用[J]. 食品研究與開發(fā), 2007, 28(3): 29-33.DOI:10.3969/j.issn.1005-6521.2007.03.009.
[14] 徐士勛, 王咪娜, 林錦旋, 等. 鱉甲寡肽I-C-F-6抗酒精誘導小鼠急性肝損傷活性研究[J]. 環(huán)球中醫(yī)藥, 2013, 6(10): 721-724.DOI:10.3969/j.issn.1674-1749.2013.10.001.
[15] 孫夢雯, 胡世蓮, 殷實, 等. 腦腸肽通過抗炎抗氧化作用發(fā)揮酒精性肝損傷的保護作用[J]. 中國藥理學通報, 2014, 30(10): 1452-1456.DOI:10.3969/j.issn.1001-1978.2014.10.025.
[16] 劉晨晨, 趙玉勤, 楊最素, 等. 鱈魚皮膠原蛋白肽對小鼠急性肝損傷的保護作用研究[J]. 現(xiàn)代食品科技, 2015, 31(7): 18-24.
[17] 蔡琦, 閆魏魏, 王少坤, 等. 蛹蟲草多肽對大鼠急性酒精性肝損傷的保護作用[J]. 臨床肝膽病雜志, 2016, 32(4): 669-672. DOI:10.3969/j.issn.1001-5256.2016.04.011.
[18] 李林格, 曲敏. 大鯢皮膠原蛋白肽的結構特性及其對乙醇誘導肝損傷小鼠的保護作用[J]. 食品工業(yè)科技, 2014, 35(8): 340-343.DOI:10.13386/j.issn1002-0306.2014.08.069.
[19] WANG M, ZHANG X J, LIU F, et al. Saponins isolated from the leaves of Panax notoginseng protect against alcoholic liver injury via inhibiting ethanol-induced oxidative stress and gut-derived endotoxinmediated inflammation[J]. Journal of Functional Foods, 2015, 19:214-224. DOI:10.1016/j.jff.2015.09.029.
[20] LíVERO F A, MARTINS G G, TELLES J E Q, et al. Hydroethanolic extract of Baccharis trimera ameliorates alcoholic fatty liver disease in mice[J]. Chemico-Biological Interactions, 2016, 260: 22-32.DOI:10.1016/j.cbi.2016.10.003.
[21] CUI Y, YE Q, WANG H Y A, et al. Aloin protects against chronic alcoholic liver injury via attenuating lipid accumulation, oxidative stress and inflammation in mice[J]. Archives of Pharmacal Research,2014, 37: 1624-1633. DOI:10.1007/s12272-014-0370-0.
[22] ALBANO E. Oxidative mechanisms in the pathogenesis of alcoholic liver disease[J]. Molecular Aspects of Medicine, 2008, 29: 9-16.DOI:10.1016/j.mam.2007.09.004.
[23] WU Yuhong, PAN Xingchang C, ZHANG Shixiu, et al. Protective effect of corn peptides against alcoholic liver injury in men with chronic alcohol consumption: a randomized double-blind placebocontrolled study[J]. Lipids in Health and Disease, 2014, 13: 192-200.DOI:10.1186/1476-511X-13-192.
[24] LIN Bing, ZHANG Feng, YU Yongchao, et al. Marine collagen peptides protect against early alcoholic liver injury in rats[J]. British Journal of Nutrition, 2012, 107(6): 1160-1166. DOI:10.1017/S0007114511004211.
[25] RAMOS G, FERNáNDEZ S, CARRILLO L, et al. Functional properties of protein fractions isolated from porcine blood[J]. Journal of Food Science, 2003, 68(4): 1196-1200. DOI:10.1111/j.1365-2621.2003.tb09624.x.
[26] WEI J T, CHIANG B H. Bioactive peptide production by hydrolysis of porcin blood proteins in a continuous enzymatic membrane reactor[J].Journal of the Science of Food and Agricultural, 2009, 89(3): 372-378.DOI:10.1002/jsfa.3451.
[27] ZHANG Feng, ZHANG Jiali, LI Yong. Corn oligopeptides protect against early alcoholic liver injury in rats[J]. Food and Chemical Toxicology, 2012, 50(6): 2149-2154. DOI:10.1016/j.fct.2012.03.083.
[28] LU Y K, WU D F. Role of oxidative stress in alcohol-induced liver injury[J]. Archives of Toxicology, 2009, 83(6): 519-548. DOI:10.1007/s00204-009-0432-0.
[29] GUO H, KOUZUMA Y, YONEKURA M. Structures and properties of antioxidative peptides derived from royal jelly protein[J]. Food Chemistry, 2009, 113(1): 238-245. DOI:10.1016/j.foodchem.2008.06.081.

